9 класс. Химия. Ковалентная связь. Ковалентная полярная связь — Ковалентная полярная связь
Комментарии преподавателяКовалентная полярная связь в молекуле хлороводорода
Рис. 1. Образование молекулы хлороводорода
Зная, что ковалентная связь образуется за счет общих электронных пар, изобразим модель молекулы хлороводорода. Атом водорода имеет на внешнем электронном слое всего один электрон. Атом хлора – семь электронов. Эти атомы приобретут энергетически выгодное состояние, если атому водорода будет принадлежать два электрона, а атому хлора – восемь. Такое возможно при образовании одной общей электронной пары.
Связь, образующаяся между водородом и хлором, в молекуле хлороводорода отличается от той химической связи, которая реализуется в молекулах простых веществ водорода и хлора. Это подтверждают экспериментальные данные. Например: атом водорода в молекуле HCl, может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток.
2HCl + Zn = ZnCl2 + H2↑
Электроотрицательность
Атомы разных химических элементов обладают различной способностью притягивать к себе электроны.
Шкала электроотрицательности
Способность атома оттягивать к себе электроны, участвующие в образовании связи, называется электроотрицательностью.
Рис. 2. Шкала относительной электроотрицательности элементов
Лайнус Полинг предложил шкалу значений относительной электроотрицательности, приняв электроотрицательность лития за единицу.
При этом он сравнивал электроотрицательность остальных атомов в химических элементах с электроотрицательностью лития. Максимальную электроотрицательность имеет атом фтора, ее значение равно 4.
В соответствии с этой шкалой, относительная электроотрицательность водорода меньше, чем значение относительной электроотрицательности хлора.
Рис. 3. Частичные заряды атомов в молекуле хлороводорода
Значит, общая электронная пара, и электронная плотность будут смещены к атому хлора. Обратите внимание на то, что нет полного перехода электрона от атома водорода к атому хлора, а лишь смещается электронная плотность в сторону более электроотрицательного элемента.
Таким образом, на атомах этих элементов образуются частичные заряды, которые обозначаются греческой буквой «δ». На атоме водорода δ+, на атоме хлора δ-.Рис.3.
Ковалентная полярная связь в молекулах
Химическую связь, образованную элементами-неметаллами с разной электроотрицательностью, называют ковалентной полярной связью.
Теперь, зная модель химической связи в молекуле хлороводорода, мы можем объяснить, почему раствор хлороводорода в воде становится электропроводным. Откуда там берутся заряженные частицы? Дело в том, что под действием молекул воды образуются не частичные, а целочисленные заряды на атомах H и Cl.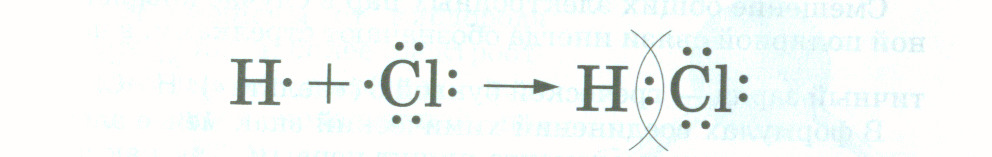 Таким образом, в раствор переходят заряженные частицы – ионы, и такой раствор способен проводить электрический ток.
Таким образом, в раствор переходят заряженные частицы – ионы, и такой раствор способен проводить электрический ток.
Между атомами неметаллов образуется ковалентная связь. Ковалентная неполярная связь образуется между атомами одного химического элемента. Ковалентная полярная связь образуется между различными атомами неметаллов. При образовании ковалентной полярной связи общие электронной пары смещаются в сторону наиболее электроотрицательного элемента.
Источники
http://www.youtube.com/watch?v=K8Fvy0vDLt8
источник презентации — http://ppt4web.ru/khimija/kovalentnaja-poljarnaja-i-nepoljarnaja-svjaz.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
ГДЗ химия 11 класс Радецкий, дидактический материал, тема 3, раб 1, вариант 3, 1 задание.
 В чём сходство и различие? – Рамблер/класс ГДЗ химия 11 класс Радецкий, дидактический материал, тема 3, раб 1, вариант 3, 1 задание. В чём сходство и различие? – Рамблер/класс
В чём сходство и различие? – Рамблер/класс ГДЗ химия 11 класс Радецкий, дидактический материал, тема 3, раб 1, вариант 3, 1 задание. В чём сходство и различие? – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
В чём сходство и различие природы химической связи в молекулах хлора и хлороводорода?
ответы
Cl-Cl H-Cl
Связи в обоих соединениях простые ковалентные, но в молекуле Cl2
связь неполярная, а в молекуле HCl связь полярная.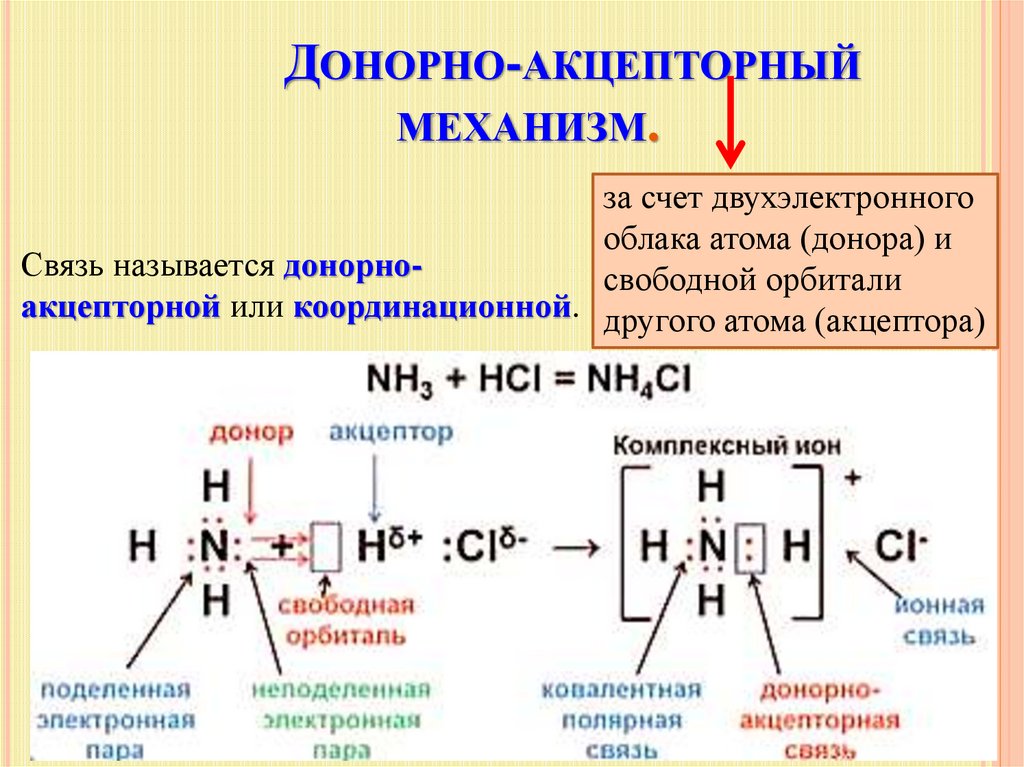
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Найдите корень уравнения
(Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Вкаким из вариантов только простые вещества А)вода угл. водарод Б) вода повар. Соль, мет, натрий В) вода, угл, газ, соль. Г) медь,озот фостов
Химия
Приветики! Поможете мне с прогрессией? Раздел II. № 6.21. ГДЗ Алгебра 9 класс ОГЭ Кузнецова.
1) Найдите сумму первых десяти членов арифмети-
нов равна нулю, а сумма (Подробнее…)
ГДЗАлгебра9 классКузнецова Л. В.
Задача 4. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Помогите найти решение вот на такую задачу:
Какая масса сажи образуется при термическом разложении этана массой 90 г, если (Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
ГДЗ по информатике, 1 класс Горячев, ч. 2, 43 упр. Нужна схема
Нарисуй по картинке схему. (Подробнее…)
ГДЗИнформатика1 классГорячев А.В.
лучшие подарки предлагают последнюю версию видеоигры,
лучшие подарки лучшие предложения в магазинах распродажи последние релизы поп-музыки,
лучшие предложения по продажам скачать бесплатную музыку, последние выпуски фильмов, лучшие подарки
для подростков последняя высокая уличная мода в одежде, модные тенденции в
одежда, лучшие подарки лучшие скидки в магазине продавщицы покупают
одежду, тратить много денег на одежду, лучшие предложения обуви,
сладости и шоколад, журналы и косметика лучшие подарки для подростков Мальчики покупают еду и напитки, компьютерные игры лучшие подарки выгодные предложения
в магазине кроссовок по продаже DVD и компакт-дисков девочки и мальчики тратят много денег на
кредит на мобильные телефоны лучшие предложения лучшие скидки в магазинах
автобусы и поезда для их перевозки лучшие подарки для подростков
лучшие скидки на распродажах в обувном магазине Девушки тратят много денег на
одежда лучший подарок имеет дело цвет цветовые предпочтения в одежде,
классные солнцезащитные очки лучшие предложения мальчики покупают дорогие вещи как лучшие подарки для подростков дизайнерская спортивная одежда и кроссовки, подростки экономят на
праздники, лучшие предложения одежды, мобильных телефонов, подарков на день рождения
и электроники, подростковые аксессуары, Любимый фасон джинсов. |
Является ли HCl ионным или ковалентным?
HCl известен как соляная кислота или соляная кислота. Это один из членов галогеноводородов (HX). Галогениды водорода представляют собой неорганические двухатомные молекулы и действуют как кислоты Аррениуса из-за их тенденции терять протон в растворе. X является членом семейства галогенов (группа 17) и, следовательно, может быть фтором, хлором, бромом и йодом.
Это один из членов галогеноводородов (HX). Галогениды водорода представляют собой неорганические двухатомные молекулы и действуют как кислоты Аррениуса из-за их тенденции терять протон в растворе. X является членом семейства галогенов (группа 17) и, следовательно, может быть фтором, хлором, бромом и йодом.
Соляная кислота представляет собой бесцветный и прозрачный раствор хлороводорода в воде. Это сильная кислота с резким запахом.
Температуры плавления и кипения раствора хлороводорода не фиксированы, так как зависят от концентрации его водного раствора. Точно так же значения pH и плотности раствора хлороводорода не фиксированы.
Если мы откроем бутылку с концентрированным раствором HCl, то сможем наблюдать пары в воздухе с резким запахом.
Соляная кислота присутствует в нашем желудке и помогает перевариванию пищи. Высокая концентрация этой кислоты в желудке приводит к проблемам с кислотностью.
HCl используется в синтезе различных органических и неорганических соединений, а также для регенерации ионообменников, которые используются для очистки воды.
Итак, HCl ионная или ковалентная? HCl является ковалентным соединением, поскольку разница электроотрицательностей между водородом и хлоридом составляет менее 2,0. Однако это не настоящее ковалентное соединение, поскольку хлор более электроотрицательный, чем водород, и, следовательно, он будет притягивать к себе общую пару электронов. Следовательно, молекула HCl представляет собой ковалентное соединение с 17 % ионным характером.
Связь H-Cl будет действовать как диполь с частичным положительным зарядом и частичным отрицательным зарядом на атоме водорода и атоме хлора соответственно в молекуле HCl.
Значение частичного заряда в HCl составляет ±0. 027 х 10-18 С .
Рассмотрим подробно ковалентную природу хлороводорода.
Для этого нам нужно начать с основ химической связи, то есть с того, что такое химическая связь и как она образуется.
Химическая связь
Прежде всего, давайте взглянем на современную периодическую таблицу.
Как мы все знаем, атомы современной таблицы Менделеева не существуют свободно в природе, за исключением членов группы 18. Следовательно, они соединяются либо с одним и тем же атомом, либо с другим атомом, что приводит к образованию элементов и соединений соответственно.
Эта сила притяжения между двумя одинаковыми или разными атомами, помогающая сблизить их, известна как химическая связь.
Как образуются химические связи?
Атом состоит из субатомных частиц, т. е. протонов, электронов и нейтронов. Из этих трех частиц в образовании связи участвуют только электроны.
Мы знаем, что атомный номер атома соответствует количеству электронов в атоме.
Теперь возникает вопрос: все ли электроны, присутствующие в атоме, участвуют в образовании связи?
Нет, не все электроны участвуют в образовании связи. Единственные электроны, которые присутствуют на самой внешней оболочке атома, способствуют образованию связи. Эти электроны известны как валентные электроны.
Электроны, присутствующие во внутренней оболочке атома, известны как основные электроны и не участвуют в образовании связи.
Следовательно, химическая связь образуется при разделении электронной плотности между двумя атомами. Это распределение электронной плотности может быть равным или неравным между атомами.
Типы химических связей
Существует два типа химических связей, присутствующих в молекулах, т. е. ионные и ковалентные связи.
Ионные связи : Ионные связи образуются путем переноса электрона(ов) от одного атома к другому атому. Между катионами и анионами в ионной связи существует электростатическая сила притяжения.
Ковалентные связи : Ковалентные связи образуются путем совместного использования электронной пары (пар) между двумя атомами. Ковалентные связи далее классифицируются как одинарные, двойные и тройные связи в зависимости от количества электронных пар, общих для двух атомов.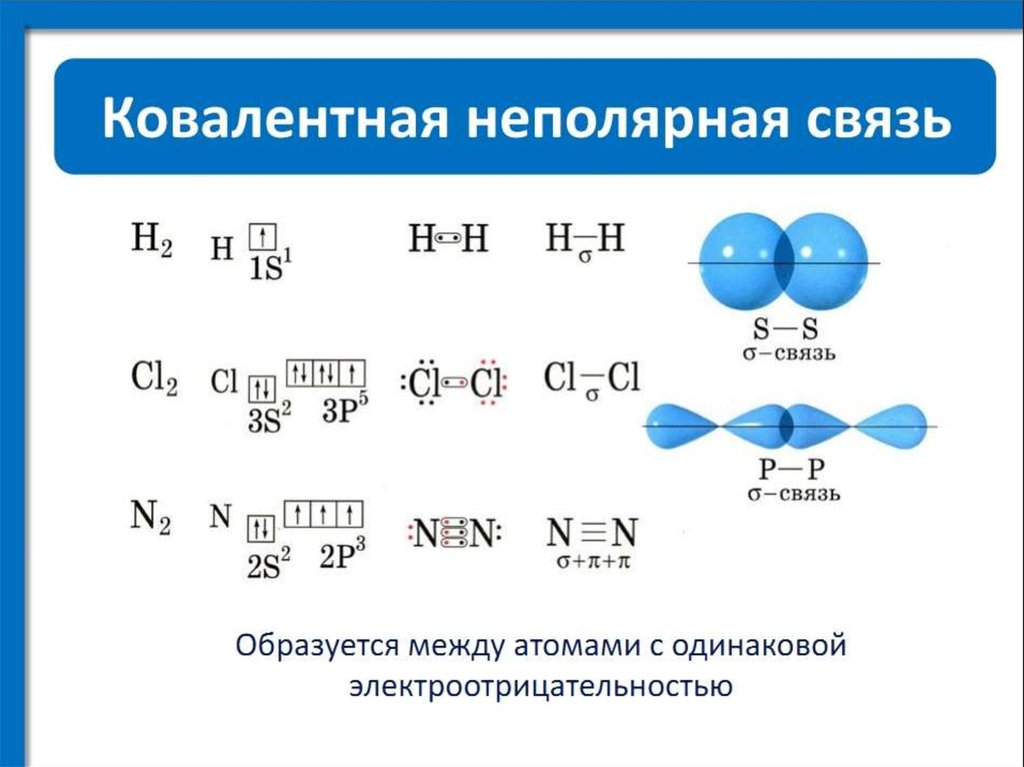
Теперь, как отличить, является ли конкретная химическая связь ионной связью или ковалентной связью?
Очевидно, что мы не можем ответить на этот вопрос, рассматривая атомы, участвующие в образовании связи. Нам нужен количественный параметр, чтобы различать ионные и ковалентные связи. Этот параметр — значения электроотрицательности.
Расскажите нам, что такое электроотрицательность?
Электроотрицательность
Это свойство атома, благодаря которому атом притягивает к себе общую электронную пару. Значения электроотрицательности атомов взяты из шкалы Полинга.
Если разница электроотрицательностей между двумя атомами в химической связи больше 2,0, то химическая связь считается ионной связью. Однако если эта разница меньше 2,0 по шкале Полинга, то связь ковалентная.
Почему HCl ковалентна по своей природе?
В случае хлористого водорода (HCl)
Значение электроотрицательности атома водорода = 2,20
Значение электроотрицательности атома хлора = 3,16
Разность электроотрицательностей связи H-Cl = 0,96
Разность электроотрицательностей связи H-Cl составляет всего 0,96 по шкале Полинга, что указывает на ковалентную природу связи H-Cl.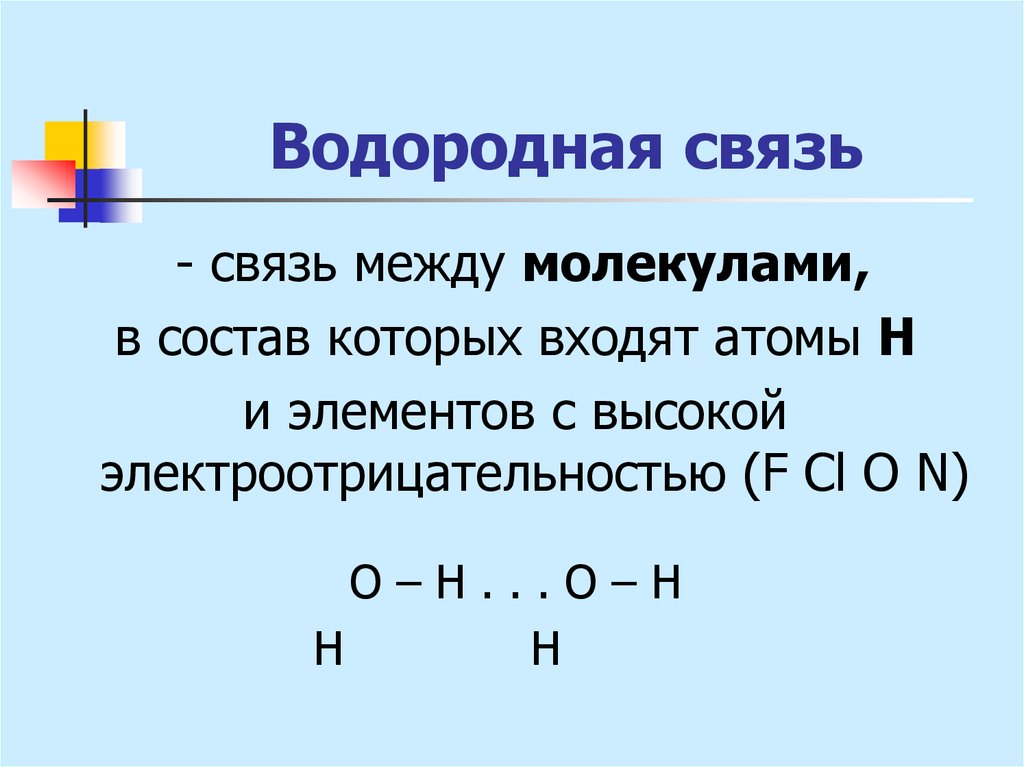
Следовательно, хлористый водород является ковалентным соединением.
Однако хлористый водород не является настоящим ковалентным соединением. Почему это так и что такое истинные ковалентные соединения?
Почему HCl не является настоящим ковалентным соединением?
Истинная ковалентная связь образуется при равном распределении электрона от каждого атома в молекуле, такой как гомоядерные молекулы, т. е. H-H, FF, Cl-Cl и т. д.
Однако ковалентность или, можно сказать, чистота ковалентности снижается при наличии гетероядерных молекул. Например, H-Cl, H-Br и H-I. В гетероядерных молекулах атомы не делят электрон (электроны) поровну из-за разницы в значении электроотрицательности.
Следовательно, HCl не является истинно ковалентным соединением, поскольку атом хлора будет притягивать к себе общую пару электронов из-за своей более высокой электроотрицательности (3.16), чем атом водорода (2.20).
Или мы можем сказать, что связь H-Cl в соединении хлористого водорода является полярной ковалентной связью. Это означает, что связь H-Cl действует как диполь с частичным положительным зарядом на атоме водорода и частичным отрицательным зарядом на атоме хлора.
Это означает, что связь H-Cl действует как диполь с частичным положительным зарядом на атоме водорода и частичным отрицательным зарядом на атоме хлора.
Было бы очень интересно, если бы мы могли вычислить частичный заряд атома. Итак, рассчитаем парциальные заряды на атомах водорода и хлора в хлороводороде.
Заряд определяется как отношение дипольного момента молекулы (µ) к расстоянию между двумя атомами (d) в полярной ковалентной связи. Формула для измерения заряда выглядит следующим образом:
Q = мк/д
Дипольный момент измеряется в Д (Дебай), а единицей измерения расстояния является м, следовательно, заряд измеряется в Д/м или Кл (Кулон).
Дипольный момент хлороводорода равен 1,05 Д, а расстояние между атомом водорода и хлора в хлороводороде равно 127,4*10-12 м.
1 D = 3,33 × 10–30 Кл м
Если подставить значения в приведенное выше уравнение, то парциальный заряд атома водорода получится равным 0,027 × 10–18 Кл.
На атоме хлора будет одинаковый, но противоположный заряд, т. е. – 0,027 x 10-18 Кл. Следовательно, значение частичного заряда в соединении хлороводорода равно ±0. 027 x 10−18 C.
Следующим нашим шагом будет оценка процента электронов, перешедших от атома водорода к атому хлора в хлороводороде, известном ионном характере ковалентной связи.
Как мы знаем, заряд одного электрона равен 1,6022 × 10−19 Кл.
Процент ионного характера = (Частичный заряд атома * 100) / Заряд одного электрона
= (0,027 х 10-18 ∗ 100)/1. 6022 × 10−19 C
= 17 %
Следовательно, только 17 % электронной плотности перешло от атома водорода к атому хлора в хлороводороде.
Это подтверждает, что связь H-Cl в хлористом водороде является полярной ковалентной связью, а не ионной связью. Это еще один критерий различия между ионными и ковалентными связями.
Следовательно, молекула хлористого водорода представляет собой ковалентное соединение с 17 % ионным характером.


Leave A Comment