Правописание приставок роз- (рос-), раз- (рас-) | План-конспект урока по русскому языку (5 класс) на тему:
Урок по теме “Правописание приставок роз- (рос-), раз- (рас-)”.
Урок усвоения новых знаний.
Цели и задачи:
- Узнать, от каких условий зависит написание букв о и а в этих приставках;
- Научиться использовать полученные знания на практике;
- Отличать приставки роз- (рос-), раз- (рас-) от омонимичных корней.
Ход урока
- Организационный момент.
- Актуализация знаний.
— От каких морфем нужно уметь отличать приставки? Как это сделать?
— От каких условий зависит написание приставок на з-с?
— Какой диалог помогает нам вспомнить все глухие согласные?
— Какую приставку нельзя относить к этой группе? Почему?
- Определение темы урока. Постановка цели и задач урока.
— Задание: спишите, вставив пропущенные буквы, объясните выбор графически. (слова на доске)
Ро_вальни, ро_пись, ра_задорить, ро_сыпь, ра_считать, ра_влечься, ро_сказни, ра_дать.
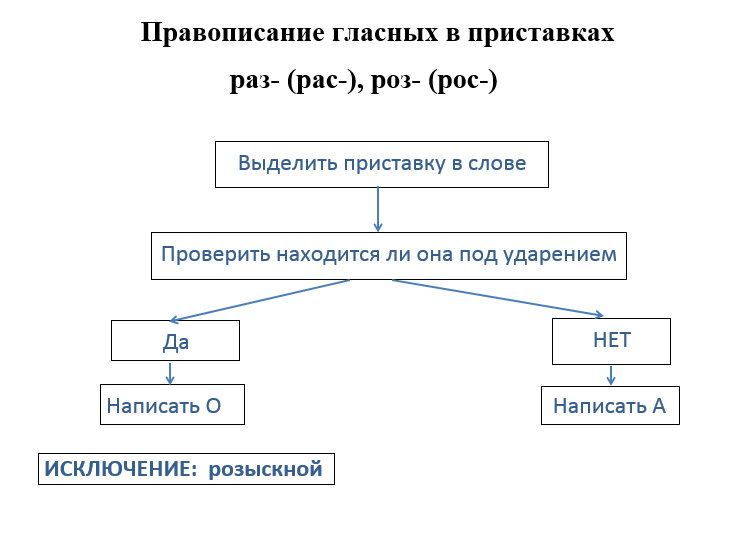
— Посмотрите внимательно на написание этих приставок. Всё ли здесь понятно? Что необычного вы видите? (в каких-то приставках пишется буква а, а в каких-то — о)
Дети формулируют тему и цели урока.
- Первичное усвоение новых знаний.
— Давайте с вами проследим тенденцию и постараемся сделать вывод. Посмотрите, что общего у всех слов с приставками, в которых пишется буква О. Теперь — что общего у всех слов с приставками, в которых пишется буква А. Как вы думаете, от чего может зависеть написание букв а и о в этих приставках?
Дети высказывают предположения. Если никто не догадывается, учитель предлагает детям во всех словах проставить ударения.
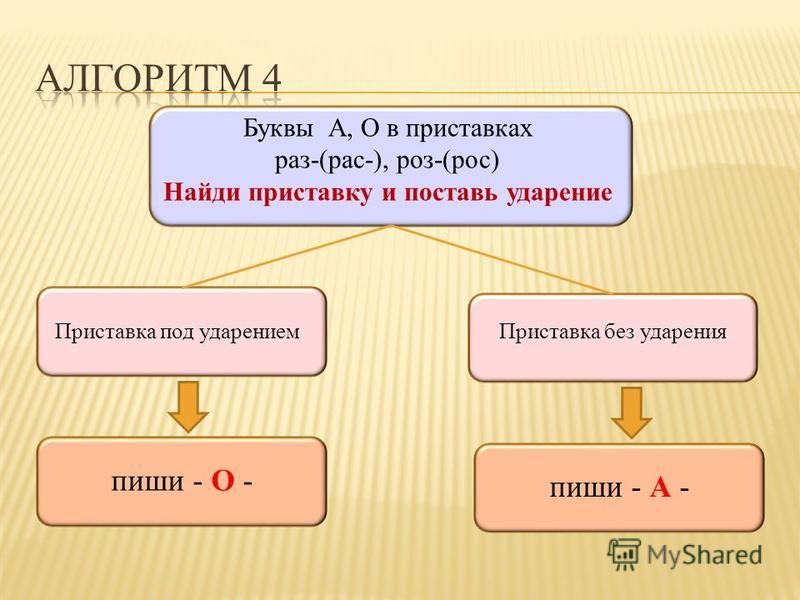
Дети формулируют правило: В ПРИСТАВКАХ РОЗ- (РОС-), РАЗ- (РАС-) ПОД УДАРЕНИЕМ ПИШЕТСЯ БУКВА О, БЕЗ УДАРЕНИЯ — А.
*правило для более лёгкого запоминания оформляется в виде схемки:
- Первичная проверка понимания
— На что очень похожи эти приставки?
— Как их отличить друг от друга?
— Давайте потренируемся в разграничении приставок и омонимичных корней.
Распределительный диктант: в левый столбик дети записывают слова с приставками роз- (рос-), раз- (рас-), в правый — с корнями раст-ращ-рос.
Роспуск, расти, растение, росчерк, разжигать, ростовщик, расклад, рассечь, росток, растительность.
*взаимопроверка (0 ош. = 5; 1 ош. = 4; 2 ош. = 3; >2 ош. = 2)
слова с приставками роз- (рос-), раз- (рас-) | слова с корнями раст-ращ-рос |
Роспуск, росчерк, разжигать, расклад, рассечь. | Расти, растение, ростовщик, росток, растительность. |
- Первичное закрепление.
— Задание на раздаточном материале: списать, вставить пропущенные буквы, обозначить орфограмму.
Р_здать, р_списание, р_списка, р_спись, р_склад, р_зливать, р_слый, р_зыскивать, р_зыск, р_зжиг, р_спуск, р_зыграть, р_зыгрыш, р_схаживать, р_счёсывать.
— Все ли слова необходимо было записать? Какое слово было лишнее? Почему?
- Д/З
- Рефлексия (подведение итогов занятия)
Презентация «Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС»
ОПОРНЫЙ ОРФОГРАФИЧЕСКИЙ КОМПАКТ ОРФОГРАММЫ И ПРАВИЛА В.М.Шаталов, Ю.С.Меженко
ОПОРНЫЙ ОРФОГРАФИЧЕСКИЙ КОМПАКТ ПРАВОПИСАНИЕ ПРИСТАВОК В.М.Шаталов, Ю.С.Меженко
ОПОРНЫЙ ОРФОГРАФИЧЕСКИЙ КОМПАКТ БУКВЫ О, А В ПРИСТАВКАХ
РОЗ-, РОС-, РАЗ-, РАС-
В.М.Шаталов, Ю.С.Меженко
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
Р ` о звальни, р ` о спись, р ` о ссыпь, р ` о ссказни, р ` о зыгрыш, р ` о зданный, р ` о здых,
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О
р ` о зливень, р ` о зыск, р ` о спашь,
р ` о сплеск, р ` о спуск, р ` о счерк.
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
р а
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
р а зжир ` еть, р а змельч ` ить, р а зм ` ен, р а знаряжённый, р а скалённый, р а скл ` ад,
Правописание приставок (№ 1-5)
3. Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
Буквы О, А в приставках РОЗ-, РОС-, РАЗ-, РАС-
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
р а ск ` опанный, р а ск ` ормленный, р а скр ` ашивать, р а спев ` ать песни,
р а сс ` еянный,
Правописание приставок (№ 1-5)
3. Буквы О, А
В приставках РОЗ-, РОС-, РАЗ-, РАС-
под ударением пишется — О , без ударения — А.
р а сск ` азчик, р а ст ` ерянный, р а сцелов ` ать, р а сх ` аживать, р а счёсывать,
р а сшиб ` иться .
Взаимодействие между ROS и Ras GTPases: физиологические и патологические последствия
1. Wennerberg K, Rossman KL, Der CJ. Краткий обзор суперсемейства Ras. Журнал клеточной науки . 2005;118(5):843–846. [PubMed] [Google Scholar]
Wennerberg K, Rossman KL, Der CJ. Краткий обзор суперсемейства Ras. Журнал клеточной науки . 2005;118(5):843–846. [PubMed] [Google Scholar]
2. Nobes CD, Hall A. Rho, Rac и Cdc42 GTPases регулируют сборку мультимолекулярных фокальных комплексов, связанных с актиновыми стрессовыми волокнами, ламеллоподиями и филоподиями.
3. Ridley AJ, Hall A. Небольшой GTP-связывающий белок rho регулирует сборку фокальных спаек и актиновых стрессовых волокон в ответ на факторы роста. Сотовый . 1992;70(3):389–399. [PubMed] [Google Scholar]
4. Ridley AJ, Paterson HF, Johnston CL, Diekmann D, Hall A. Небольшой GTP-связывающий белок rac регулирует взъерошивание мембраны, вызванное фактором роста. Сотовый . 1992;70(3):401–410. [PubMed] [Google Scholar]
5. Биоу В., Черфилс Дж. Структурные принципы мультиспецифичности малых GTP-связывающих белков.  [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
6. Herrmann C. Рас-эффекторные взаимодействия: спустя одно десятилетие. Текущее мнение по структурной биологии . 2003;13(1):122–129. [PubMed] [Google Scholar]
7. Хео Дж. Окислительно-восстановительный контроль ГТФаз: от молекулярных механизмов до функционального значения для здоровья и болезней. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала . 2011;15(4):689–724. [PubMed] [Google Scholar]
8. Sundaresan M, Yu ZX, Ferrans VJ, Irani K, Finkel T. Требование для генерации H
9. Bae YS, Kang SW, Seo MS, et al. Индуцированное эпидермальным фактором роста (EGF) образование перекиси водорода. Роль в опосредованном рецептором EGF фосфорилировании тирозина. Журнал биологической химии . 1997;272(1):217–221. [PubMed] [Google Scholar]
10. Лето Т.Л., Гейст М. Роль НАДФН-оксидаз семейства Nox в защите хозяина. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала
Лето Т.Л., Гейст М. Роль НАДФН-оксидаз семейства Nox в защите хозяина. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала
11. Kheradmand F, Werner E, Tremble P, Symons M, Werb Z. Роль rac1 и кислородных радикалов в экспрессии коллагеназы-1, вызванной изменением формы клеток. Наука . 1998; 280(5365):898–902. [PubMed] [Google Scholar]
12. Werner E, Werb Z. Интегрины задействуют митохондриальную функцию для передачи сигнала с помощью механизма, зависящего от Rho GTPases. Журнал клеточной биологии . 2002;158(2):357–368. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Chiarugi P, Pani G, Giannoni E, et al. Активные формы кислорода как важные медиаторы клеточной адгезии: окислительное ингибирование тирозинфосфатазы FAK необходимо для клеточной адгезии.
14. Финкель Т. Внутриклеточная окислительно-восстановительная регуляция семейства малых ГТФаз. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала . 2006; 8 (9-10): 1857–1863. [PubMed] [Google Scholar]
Финкель Т. Внутриклеточная окислительно-восстановительная регуляция семейства малых ГТФаз. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала . 2006; 8 (9-10): 1857–1863. [PubMed] [Google Scholar]
15. Ушио-Фукаи М. Компартментализация окислительно-восстановительной передачи сигналов через rOS, полученную из NaDPH-оксидазы. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала
16. Gregg D, de Carvalho DD, Kovacic H. Интегрины и коагуляция: роль для передачи сигналов ROS/Redox? Антиоксиданты и передача сигналов окислительно-восстановительного потенциала . 2004;6(4):757–764. [PubMed] [Google Scholar]
17. Бабиор Б.М. НАДФН-оксидаза. Текущее мнение по иммунологии . 2004;16(1):42–47. [PubMed] [Google Scholar]
18. Бабиор Б.М. Кислородозависимый киллинг микробов фагоцитами. (Первая из двух частей) The New England Journal of Medicine .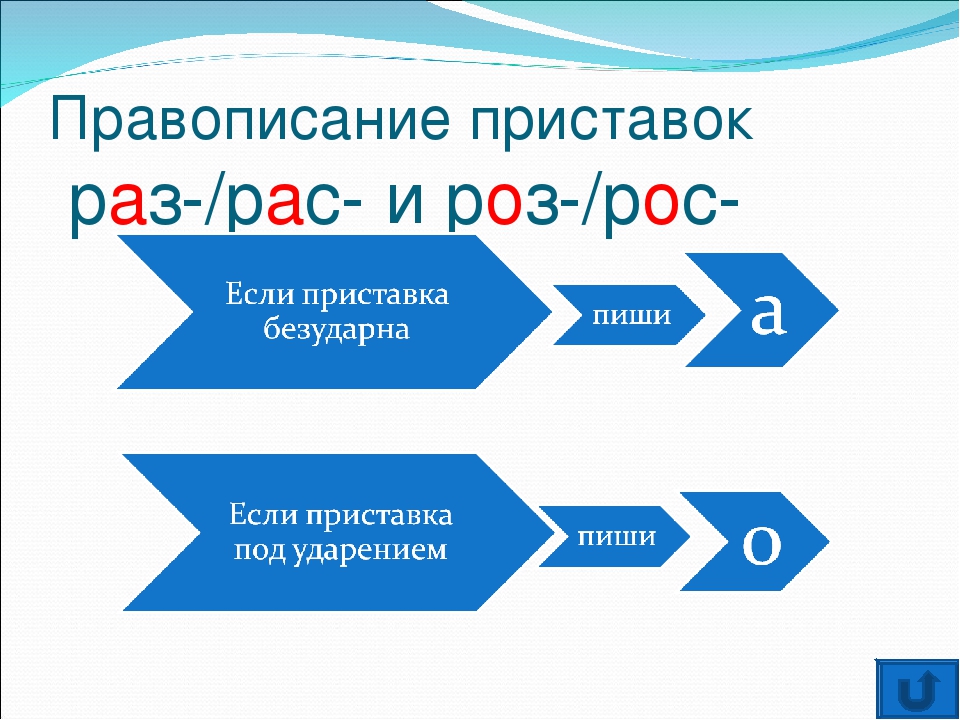
19. Бабиор Б.М. Кислородзависимый киллинг микробов фагоцитами. (Вторая из двух частей) The New England Journal of Medicine . 1978;298(13):721–725. [PubMed] [Google Scholar]
20. Groemping Y, Rittinger K. Активация и сборка NADPH-оксидазы: структурная перспектива. Биохимический журнал . 2005;386(3):401–416. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Молдован Л., Митрей К., Гольдшмидт-Клермон П.Дж., Саттервайт Л.Л. Активные формы кислорода в подвижности эндотелиальных клеток сосудов. Роли НАД(Ф)Н-оксидазы и Rac1. Сердечно-сосудистые исследования
22. Sundaresan M, Yu ZX, Ferrans VJ, et al. Регуляция образования активных форм кислорода в фибробластах с помощью Rac1. Биохимический журнал . 1996;318(2):379–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Sulciner DJ, Irani K, Yu ZX, Ferrans VJ, Goldschmidt-Clermont P, Finkel T. Rac1 регулирует цитокин-стимулируемый окислительно-восстановительный путь, необходимый для NF. — κ B активация. Молекулярная и клеточная биология . 1996;16(12):7115–7121. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Rac1 регулирует цитокин-стимулируемый окислительно-восстановительный путь, необходимый для NF. — κ B активация. Молекулярная и клеточная биология . 1996;16(12):7115–7121. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Hye SP, Seung HL, Park D, et al. Последовательная активация фосфатидилинозитол-3-киназы, β Pix, Rac1 и Nox1 в продукции H, индуцированной фактором роста 2 O 2 . Молекулярная и клеточная биология . 2004;24(10):4384–4394. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Cho HJ, Jeong HG, Lee JS, et al. Онкогенный H-ras усиливает репарацию ДНК посредством пути Ras/фосфатидилинозитол-3-киназа/Rac1 в клетках NIh4T3. Доказательства связи с активными формами кислорода. Журнал биологической химии . 2002;277(22):19358–19366. [PubMed] [Академия Google]
26. Pelletier S, Duhamel F, Coulombe P, Popoff MR, Meloche S. ГТФазы семейства Rho необходимы для активации передачи сигналов Jak/STAT с помощью рецепторов, связанных с G-белком. Молекулярная и клеточная биология . 2003;23(4):1316–1333. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Молекулярная и клеточная биология . 2003;23(4):1316–1333. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Taddei ML, Parri M, Mello T, et al. Опосредованная интегрином клеточная адгезия и распространение задействуют различные источники активных форм кислорода. Антиоксиданты и передача сигналов окислительно-восстановительного потенциала . 2007;9(4):469–481. [PubMed] [Google Scholar]
28. van Wetering S, van Buul JD, Quik S, et al. Активные формы кислорода опосредуют индуцированную Rac потерю межклеточной адгезии в первичных эндотелиальных клетках человека. Журнал клеточной науки . 2002; 115 (9): 1837–1846. [PubMed] [Google Scholar]
29. Abid MR, Kachra Z, Spokes KC, Aird WC. Активность НАДФН-оксидазы необходима для пролиферации и миграции эндотелиальных клеток. Письма FEBS . 2000;486(3):252–256. [PubMed] [Академия Google]
30. Абид М.Р., Цай Дж.К., Спокс К.С., Дешпанде С.С., Ирани К., Эйрд В.К. Сосудистый эндотелиальный фактор роста индуцирует экспрессию марганцево-супероксиддисмутазы в эндотелиальных клетках с помощью Rac1-регулируемого NADPH-оксидазозависимого механизма. Журнал FASEB . 2001;15(13):2548–2550. [PubMed] [Google Scholar]
Журнал FASEB . 2001;15(13):2548–2550. [PubMed] [Google Scholar]
31. Yeh LH, Park YJ, Hansalia RJ, et al. Индуцированное сдвигом фосфорилирование тирозина в эндотелиальных клетках требует Rac1-зависимой продукции АФК. Американский журнал физиологии — клеточная физиология . 1999; 276(4):C838–C847. [PubMed] [Google Scholar]
32. Sohn HY, Keller M, Gloe T, Morawietz H, Rueckschloss U, Pohl U. Небольшой G-белок Rac опосредует индуцированное деполяризацией образование супероксида в эндотелиальных клетках человека. Журнал биологической химии . 2000;275(25):18745–18750. [PubMed] [Google Scholar]
33. Monaghan-Benson E, Burridge K. Регуляция проницаемости микрососудов, вызванная эндотелиальным фактором роста сосудов, требует Rac и активных форм кислорода. Журнал биологической химии . 2009;284(38):25602–25611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Beckers CML, van Hinsbergh VWM, Amerongen GPVN. Управление активностью Rho GTPase в эндотелиальных клетках регулирует целостность барьера.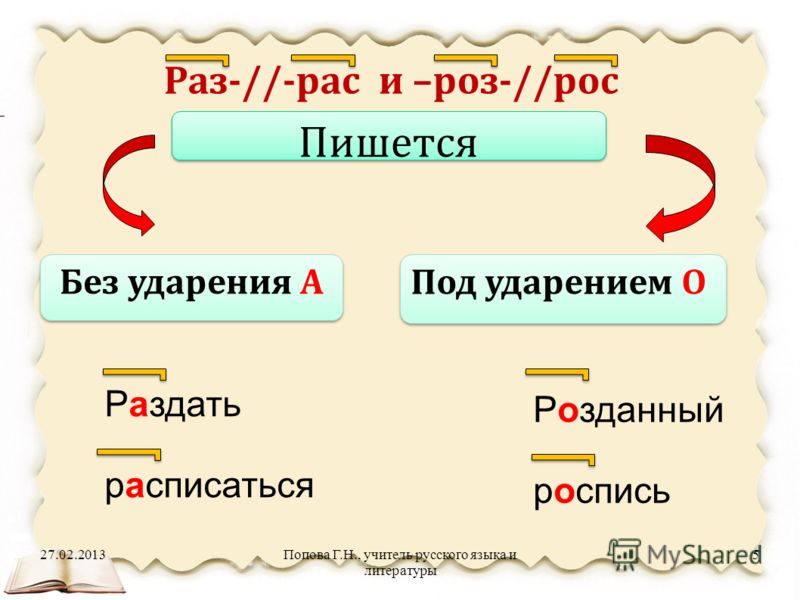 Тромбоз и гемостаз . 2010;103(1):40–55. [PubMed] [Google Scholar]
Тромбоз и гемостаз . 2010;103(1):40–55. [PubMed] [Google Scholar]
35. Peppelenbosch MP, Qiu RG, de Vries-Smits AMM, et al. Rac опосредует высвобождение арахидоновой кислоты, индуцированное фактором роста. Сотовый . 1995;81(6):849–856. [PubMed] [Google Scholar]
36. Woo CH, Lee ZW, Kim BC, Ha KS, Kim JH. Участие цитозольной фосфолипазы A2 и последующее высвобождение арахидоновой кислоты в передаче сигналов Rac для образования внутриклеточных активных форм кислорода в фибробластах Rat-2. Биохимический журнал . 2000;348(3):525–530. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Wu R, Coniglio SJ, Chan A, Symons MH, Steinberg BM. Активация Rac1 эпидермальным фактором роста опосредует экспрессию ЦОГ-2 в рецидивирующих респираторных папилломах. Молекулярная медицина . 2007;13(3-4):143–150. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Nimnual AS, Taylor LJ, Bar-Sagi D. Редокс-зависимое подавление Rho с помощью Rac. Природа Клеточная биология . 2003;5(3):236–241. [PubMed] [Google Scholar]
Природа Клеточная биология . 2003;5(3):236–241. [PubMed] [Google Scholar]
39. Wildenberg GA, Dohn MR, Carnahan RH, et al. p120-catenin и p190RhoGAP регулируют межклеточную адгезию, координируя антагонизм между Rac и Rho. Сотовый . 2006;127(5):1027–1039. [PubMed] [Академия Google]
40. Ян Дж. К., Ли С., Доманн Ф. Е., Бюттнер Г. Р., Оберли Л. В. Генерация супероксида в клетках HaCaT кератиноцитов человека, трансдуцированных v-Ha-ras. Молекулярный канцерогенез . 1999;26(3):180–188. [PubMed] [Google Scholar]
41. Yang JQ, Buettner GR, Domann FE, et al. v-Ha-ras митогенная передача сигналов через супероксид и производные активных форм кислорода. Молекулярный канцерогенез . 2002;33(4):206–218. [PubMed] [Google Scholar]
42. Lee AC, Fenster BE, Ito H, et al. Белки Ras вызывают старение, изменяя внутриклеточные уровни активных форм кислорода. Журнал биологической химии . 1999;274(12):7936–7940. [PubMed] [Google Scholar]
43. Seung BL, In HB, Yun SB, Um HD. Связь между митохондриями и изоферментом НАДФН-оксидазы 1 для устойчивого производства активных форм кислорода и гибели клеток. Журнал биологической химии . 2006;281(47):36228–36235. [PubMed] [Google Scholar]
Seung BL, In HB, Yun SB, Um HD. Связь между митохондриями и изоферментом НАДФН-оксидазы 1 для устойчивого производства активных форм кислорода и гибели клеток. Журнал биологической химии . 2006;281(47):36228–36235. [PubMed] [Google Scholar]
44. Дайбер А. Окислительно-восстановительная передача сигналов (перекрестная связь) от митохондрий и к митохондриям включает митохондриальные поры и активные формы кислорода. Биохимика и Биофизика Акта . 2010;1797(6-7):897–906. [PubMed] [Google Scholar]
45. Дикалов С. Взаимные помехи между митохондриями и НАДФН-оксидазами. Свободнорадикальная биология и медицина . 2011;51(7):1289–1301. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Cassano S, Agnese S, D’Amato V, et al. Активные формы кислорода, Ki-Ras и митохондриальная супероксиддисмутаза взаимодействуют в индуцированной фактором роста нервов дифференцировке клеток PC12. Журнал биологической химии . 2010;285(31):24141–24153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Baker TL, Booden MA, Buss JE. S-нитрозоцистеин увеличивает оборот пальмитата на Ha-Ras в клетках NIH 3T3. Журнал биологической химии . 2000;275(29):22037–22047. [PubMed] [Google Scholar]
48. Доусон ТМ, Сасаки М, Гонсалес-Зулуэта М, Доусон ВЛ. Регуляция нейрональной синтазы оксида азота и идентификация новых сигнальных путей оксида азота. Прогресс в исследованиях мозга . 1998; 118:3–11. [PubMed] [Google Scholar]
49. Lander HM, Hajjar DP, Hempstead BL, et al. Молекулярный редокс-переключатель p21(ras). Структурная основа взаимодействия оксида азота с p21(ras). Журнал биологической химии . 1997;272(7):4323–4326. [PubMed] [Google Scholar]
50. Lanďer HM, Mllbank AJ, Tauras JM, et al. Окислительно-восстановительная регуляция клеточной сигнализации. Природа . 1996;381(6581):380–381. [PubMed] [Google Scholar]
51. Lander HM, Ogiste JS, Pearce SFA, Levi R, Novogrodsky A. Стимулированный оксидом азота обмен гуаниновых нуклеотидов на p21(ras) Журнал биологической химии . 1995;270(13):7017–7020. [PubMed] [Google Scholar]
Стимулированный оксидом азота обмен гуаниновых нуклеотидов на p21(ras) Журнал биологической химии . 1995;270(13):7017–7020. [PubMed] [Google Scholar]
52. Lander HM, Sehajpal PK, Novogrodsky A. Передача сигналов оксида азота: возможная роль G-белков. Журнал иммунологии . 1993;151(12):7182–7187. [PubMed] [Google Scholar]
53. Сааведра А.П., Цыганкова О.М., Прендергаст Г.В., Дворет Дж.Х., Ченг Г., Мейнкот Дж.Л. Роль цАМФ, PKA и Rap1A в выживании фолликулярных клеток щитовидной железы. Онкоген . 2002;21(5):778–788. [PubMed] [Академия Google]
54. Миттар Д., Сехайпал П.К., Ландер Х.М. Оксид азота активирует Rap1 и Ral независимым от Ras способом. Сообщения о биохимических и биофизических исследованиях . 2004;322(1):203–209. [PubMed] [Google Scholar]
55. Lander HM, Tauras JM, Ogiste JS, Hori O, Moss RA, Schmidt AM. Активация рецептора конечных продуктов гликирования запускает p21(ras)-зависимый путь митоген-активируемой протеинкиназы, регулируемый оксидантным стрессом. Журнал биологической химии . 1997;272(28):17810–17814. [PubMed] [Google Scholar]
Журнал биологической химии . 1997;272(28):17810–17814. [PubMed] [Google Scholar]
56. Heo J, Campbell SL. Механизм S-нитрозилирования p21Ras и кинетика обмена гуаниновых нуклеотидов, опосредованного оксидом азота. Биохимия . 2004;43(8):2314–2322. [PubMed] [Google Scholar]
57. Heo J, Prutzman KC, Mocanu V, Campbell SL. Механизм свободнорадикальной диссоциации гуаниновых нуклеотидов Ras, опосредованной оксидом азота. Журнал молекулярной биологии . 2005;346(5):1423–1440. [PubMed] [Академия Google]
58. Хео Дж., Кэмпбелл С.Л. Супероксидный анион-радикал модулирует активность Ras и связанных с Ras ГТФаз по механизму, основанному на радикалах, аналогичному механизму оксида азота. Журнал биологической химии . 2005;280(13):12438–12445. [PubMed] [Google Scholar]
59. Heo J, Campbell SL. Механизм редокс-опосредованного обмена гуаниновых нуклеотидов на редокс-активных Rho GTPases. Журнал биологической химии . 2005;280(35):31003–31010. [PubMed] [Академия Google]
[PubMed] [Академия Google]
60. Хео Дж., Рейнс К.В., Мокану В., Кэмпбелл С.Л. Редокс-регуляция RhoA. Биохимия . 2006;45(48):14481–14489. [PubMed] [Google Scholar]
61. Агаджанян А., Виттхен Э.С., Кэмпбелл С.Л., Берридж К. Прямая активация RhoA активными формами кислорода требует редокс-чувствительного мотива. ПЛОС ОДИН . 2009;4(11):с. е8045. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Хео Дж. Окислительно-восстановительная регуляция Ran GTPase. Биохимические и биофизические исследовательские коммуникации . 2008;376(3):568–572. [PubMed] [Google Scholar]
63. Hordijk OL. Регуляция НАДФН-оксидаз: роль белков Rac. Исследование кровообращения . 2006;98(4):453–462. [PubMed] [Google Scholar]
64. Harrison D, Griendling KK, Landmesser U, Hornig B, Drexler H. Роль окислительного стресса в развитии атеросклероза. Американский журнал кардиологии . 2003;91(3):7А–11А. [PubMed] [Google Scholar]
65. Лассег Б., Клемпус Р.Э. Сосудистые НАД(Ф)Н-оксидазы: особенности, экспрессия и регуляция. Американский журнал физиологии — регуляторная интегративная и сравнительная физиология . 2003; 285(2):R277–R297. [PubMed] [Google Scholar]
Лассег Б., Клемпус Р.Э. Сосудистые НАД(Ф)Н-оксидазы: особенности, экспрессия и регуляция. Американский журнал физиологии — регуляторная интегративная и сравнительная физиология . 2003; 285(2):R277–R297. [PubMed] [Google Scholar]
66. Мадаманчи Н.Р., Вендров А., Рунге М.С. Окислительный стресс и сосудистые заболевания. Артериосклероз, тромбоз и биология сосудов . 2005;25(1):29–38. [PubMed] [Google Scholar]
67. Gregg D, Rauscher FM, Goldschmidt-Clermont PJ. Rac регулирует сердечно-сосудистый супероксид посредством различных молекулярных взаимодействий: больше, чем бинарное переключение GTP. Американский журнал физиологии — клеточная физиология . 2003; 285(4):C723–C734. [PubMed] [Google Scholar]
68. Seshiah PN, Weber DS, Rocic P, Valppu L, Taniyama Y, Griendling KK. Стимуляция ангиотензином II активности НАД(Ф)Н-оксидазы: восходящие медиаторы. Исследование кровообращения . 2002;91(5):406–413. [PubMed] [Google Scholar]
69. Zuo L, Ushio-Fukai M, Ikeda S, Hilenski L, Patrushev N, Alexander RW. Кавеолин-1 необходим для активации Rac1 и NAD(P)H оксидазы после стимуляции рецептора ангиотензина II типа 1 в гладкомышечных клетках сосудов: роль в окислительно-восстановительной передаче сигналов и гипертрофии сосудов. Артериосклероз, тромбоз и биология сосудов . 2005; 25(9):1824–1830. [PubMed] [Google Scholar]
Zuo L, Ushio-Fukai M, Ikeda S, Hilenski L, Patrushev N, Alexander RW. Кавеолин-1 необходим для активации Rac1 и NAD(P)H оксидазы после стимуляции рецептора ангиотензина II типа 1 в гладкомышечных клетках сосудов: роль в окислительно-восстановительной передаче сигналов и гипертрофии сосудов. Артериосклероз, тромбоз и биология сосудов . 2005; 25(9):1824–1830. [PubMed] [Google Scholar]
70. дель Позо М.А., Баласубраманиан Н., Олдерсон Н.Б. и соавт. Фосфокавеолин-1 опосредует интернализацию регулируемого интегрином мембранного домена. Природа Клеточная биология . 2005;7(9):901–908. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Vecchione C, Patrucco E, Marino G, et al. Защита от опосредованного ангиотензином II васкулотоксического и гипертензивного ответа у мышей, лишенных PI3K γ . Журнал экспериментальной медицины . 2005;201(8):1217–1228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Валко М., Лейбфриц Д. , Монкол Дж., Кронин М.Т.Д., Мазур М., Телсер Дж. Свободные радикалы и антиоксиданты в нормальных физиологических функциях и заболеваниях человека. Международный журнал биохимии и клеточной биологии . 2007;39(1):44–84. [PubMed] [Google Scholar]
, Монкол Дж., Кронин М.Т.Д., Мазур М., Телсер Дж. Свободные радикалы и антиоксиданты в нормальных физиологических функциях и заболеваниях человека. Международный журнал биохимии и клеточной биологии . 2007;39(1):44–84. [PubMed] [Google Scholar]
73. Kim KS, Takeda K, Sethi R, et al. Защита от реоксигенационного повреждения за счет ингибирования Rac1. Журнал клинических исследований . 1998; 101 (9): 1821–1826. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Harada N, Iimuro Y, Nitta T, et al. Инактивация малой ГТФазы Rac1 защищает печень от ишемии/реперфузии у крыс. Хирургия . 2003;134(3):480–491. [PubMed] [Google Scholar]
75. Андреадис А.А., Хазен С.Л., Comhair SAA, Erzurum SC. Окислительные и нитрозативные явления при бронхиальной астме. Свободнорадикальная биология и медицина . 2003;35(3):213–225. [PubMed] [Академия Google]
76. Rabe KF, Dent G, Magnussen H. Перекись водорода сужает дыхательные пути человека in vitro : роль эпителия. Американский журнал физиологии — клеточная и молекулярная физиология легких . 1995;269(3):L332–L338. [PubMed] [Google Scholar]
Американский журнал физиологии — клеточная и молекулярная физиология легких . 1995;269(3):L332–L338. [PubMed] [Google Scholar]
77. Kojima K, Kume H, Ito S, et al. Прямое влияние перекиси водорода на тонус гладких мышц дыхательных путей: роль притока Ca 2+ и Rho-киназы. Европейский журнал фармакологии . 2007; 556 (1–3): 151–156. [PubMed] [Академия Google]
78. Джин Л., Ин З., Уэбб Р.С. Активация сигнального пути Rho/Rho киназы активными формами кислорода в аорте крысы. Американский журнал физиологии — физиология сердца и кровообращения . 2004;287(4):h2495–h2500. [PubMed] [Google Scholar]
79. Ханахан Д., Вайнберг Р.А. Признаки рака. Сотовый . 2000;100(1):57–70. [PubMed] [Google Scholar]
80. Hu Y, Lu W, Chen G, et al. Трансформация K-rasG12V приводит к митохондриальной дисфункции и метаболическому переключению с окислительного фосфорилирования на гликолиз. Клеточные исследования . В прессе. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Weinberg F, Hamanaka R, Wheaton WW, et al. Митохондриальный метаболизм и генерация АФК необходимы для Kras-опосредованной онкогенности. Труды Национальной академии наук Соединенных Штатов Америки . 2010;107(19):8788–8793. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Kamp DW, Shacter E, Weitzman SA. Хроническое воспаление и рак: роль митохондрий. Онкология . 2011;25(5):400–410. [PubMed] [Google Scholar]
83. Хипперт М.М., О’Тул П.С., Торберн А. Аутофагия при раке: хорошо, плохо или и то, и другое? Исследование рака . 2006;66(19):9349–9351. [PubMed] [Google Scholar]
84. Kim MJ, Woo SJ, Yoon CH и др. Участие аутофагии в онкогенной K-Ras-индуцированной злокачественной трансформации клеток. Журнал биологической химии . 2011;286(15):12924–12932. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Guo JY, Chen HY, Fan J, et al. Активированный Ras требует аутофагии для поддержания окислительного метаболизма и онкогенеза. Гены и развитие . 2011;25(5):460–470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гены и развитие . 2011;25(5):460–470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Buyru N, Tigli H, Ozcan F, Dalay N. Онкогенные мутации Ras в осадках мочи пациентов с раком мочевого пузыря. Журнал биохимии и молекулярной биологии . 2003;36(4):399–402. [PubMed] [Google Scholar]
87. Choudhary S, Wang HCR. Проапоптотическая способность онкогенных H-Ras облегчать апоптоз, индуцированный ингибиторами гистондеацетилазы в раковых клетках человека. Молекулярная терапия рака . 2007;6(3):1099–1111. [PubMed] [Google Scholar]
88. Choudhary S, Wang HCR. Роль активных форм кислорода в проапоптотической способности онкогенных H-Ras повышать восприимчивость клеток рака мочевого пузыря человека к ингибитору гистондеацетилазы для индукции каспазы. Журнал исследований рака и клинической онкологии . 2009;135(11):1601–1613. [PubMed] [Google Scholar]
89. Чоудхари С., Ратор К., Ван Х.Р. Дифференциальная индукция активных форм кислорода посредством Erk1/2 и Nox-1 с помощью FK228 для селективного апоптоза онкогенных H-Ras-экспрессирующих клеток рака мочевого пузыря человека J82. Журнал исследований рака и клинической онкологии . 2011;137(3):471–480. [PubMed] [Google Scholar]
Журнал исследований рака и клинической онкологии . 2011;137(3):471–480. [PubMed] [Google Scholar]
90. Choudhary S, Rathore K, Wang HCR. FK228 и онкогенный H-Ras синергетически побуждают Mek1/2 и Nox-1 генерировать активные формы кислорода для дифференцированной гибели клеток. Противораковые препараты . 2010;21(9):831–840. [PubMed] [Google Scholar]
91. Choudhary S, Wang KKA, Wang HCR. Онкогенный H-Ras, FK228 и экзогенный H 2 O 2 совместно активировали путь erk при селективной индукции гибели клеток j82 рака мочевого пузыря человека. Молекулярный канцерогенез . 2011;50(3):215–219. [PubMed] [Google Scholar]
92. Деора А.А., Хаджар Д.П., Ландер Х.М. Рекрутинг и активация киназы Raf-1 с помощью ras, активируемого оксидом азота. Биохимия . 2000;39(32):9901–9908. [PubMed] [Google Scholar]
93. Wells PG, McCallum GP, Chen CS, et al. Окислительный стресс в происхождении болезней развития: тератогенез, нарушения развития нервной системы и рак. Токсикологические науки . 2009;108(1):4–18. [PubMed] [Академия Google]
Токсикологические науки . 2009;108(1):4–18. [PubMed] [Академия Google]
Ras, ROS и протеотоксический стресс: тонкий баланс
- Список журналов
- Рукописи авторов HHS
- PMC3179373
Являясь библиотекой, NLM предоставляет доступ к научной литературе. Включение в базу данных NLM не означает одобрения или согласия с содержание NLM или Национальных институтов здравоохранения. Узнайте больше о нашем отказе от ответственности.
Раковая клетка. Авторская рукопись; доступно в PMC 2012 13 сентября.
Опубликовано в окончательной редакции как:
Раковая клетка. 2011 г., 13 сентября; 20(3): 281–282.
doi: 10.1016/j.ccr.2011. 08.020
08.020PMCID: PMC3179373
NIHMSID: NIHMS324123
PMID: 21907917 900 05
, 1 , 2 и 1, *
Информация об авторе Информация об авторских правах и лицензиях Отказ от ответственности
Клетки с нарушенной регуляцией Ras нуждаются в активных формах кислорода для пролиферации. Они выживают в результате протеотоксического стресса, поддерживая достаточный уровень восстановленного глутатиона и оптимально функционируя механизм реакции на стресс. В этом выпуске Cancer Cell De Raedt et al. определить новую стратегию, которая использует эту зависимость, чтобы вызвать гибель клеток.
Малый белок GTPase Ras связан с плазматической мембраной и передает сигналы от рецепторов клеточной поверхности к цитозольным эффекторам, чтобы способствовать росту и выживанию клеток. При нарушении регуляции путем мутации или другими способами белки Ras становятся важными медиаторами злокачественной трансформации (Downward, 2003). Несмотря на то, что в течение более чем двух десятилетий были предприняты значительные усилия для разработки терапии, нацеленной на Ras, эти инициативы оказались менее успешными, чем ожидалось (Matallanas and Crespo, 2010). Более того, Ras-опосредованные опухоли часто очень агрессивны и устойчивы к обычной химиотерапии, что подчеркивает неудовлетворенную потребность в выявлении новых стратегий для нацеливания на этот онкоген. В этом выпуске Раковая клетка , De Raedt et al. описывают эффективную стратегию, которая сочетает в себе два препарата, нацеленных на разные молекулы, молекулярный белок теплового шока 90 (Hsp90) и мишень для млекопитающих рапамицин (mTOR), для индукции катастрофического стресса эндоплазматического ретикулума (ER). используя зависимость опухолей, вызываемых Ras, от активных форм кислорода (АФК) (De Raedt et al., 2011).
Несмотря на то, что в течение более чем двух десятилетий были предприняты значительные усилия для разработки терапии, нацеленной на Ras, эти инициативы оказались менее успешными, чем ожидалось (Matallanas and Crespo, 2010). Более того, Ras-опосредованные опухоли часто очень агрессивны и устойчивы к обычной химиотерапии, что подчеркивает неудовлетворенную потребность в выявлении новых стратегий для нацеливания на этот онкоген. В этом выпуске Раковая клетка , De Raedt et al. описывают эффективную стратегию, которая сочетает в себе два препарата, нацеленных на разные молекулы, молекулярный белок теплового шока 90 (Hsp90) и мишень для млекопитающих рапамицин (mTOR), для индукции катастрофического стресса эндоплазматического ретикулума (ER). используя зависимость опухолей, вызываемых Ras, от активных форм кислорода (АФК) (De Raedt et al., 2011).
В нормальных условиях Ras активируется, когда он связывается с GTP, и инактивируется, когда его активность GTPase стимулируется белками, называемыми RasGAP (белки, активирующие Ras-GTPase), одним из которых является супрессор опухоли NF1 (нейрофиброматоз типа 1). Соматические инактивирующие мутации NF1, которые приводят к аберрантной активации Ras, были обнаружены при спорадической глиобластоме, немелкоклеточном раке легкого (NSCLC) и злокачественных опухолях оболочек периферических нервов (MPNST) (Jett and Friedman, 2010). В результате дерегуляции Ras mTOR активируется в опухолях с дефицитом NF1, а ингибиторы mTOR, такие как рапамицин, подавляют рост опухоли in vitro , но продемонстрировали только цитостатическую активность in vivo . При поиске агентов для повышения эффективности рапамицина Де Рэдт и его коллеги обнаружили, что реагенты, разрушающие ER, такие как туникамицин и тапсигаргин, в синергизме с рапамицином вызывают гибель раковых клеток, управляемых Ras (но не нетрансформированных клеток). Однако ни туникамицин, препятствующий гликозилированию белков в ER, ни тапсигаргин, способствующий высвобождению кальция из ER, не являются клинически жизнеспособными. Де Редт и др. обнаружили, что несколько Hsp90 ингибиторы, которые в настоящее время проходят обширную клиническую оценку в качестве противораковых препаратов, включая IPI-504 (ретаспимицин), также проявляли синергизм с рапамицином.
Соматические инактивирующие мутации NF1, которые приводят к аберрантной активации Ras, были обнаружены при спорадической глиобластоме, немелкоклеточном раке легкого (NSCLC) и злокачественных опухолях оболочек периферических нервов (MPNST) (Jett and Friedman, 2010). В результате дерегуляции Ras mTOR активируется в опухолях с дефицитом NF1, а ингибиторы mTOR, такие как рапамицин, подавляют рост опухоли in vitro , но продемонстрировали только цитостатическую активность in vivo . При поиске агентов для повышения эффективности рапамицина Де Рэдт и его коллеги обнаружили, что реагенты, разрушающие ER, такие как туникамицин и тапсигаргин, в синергизме с рапамицином вызывают гибель раковых клеток, управляемых Ras (но не нетрансформированных клеток). Однако ни туникамицин, препятствующий гликозилированию белков в ER, ни тапсигаргин, способствующий высвобождению кальция из ER, не являются клинически жизнеспособными. Де Редт и др. обнаружили, что несколько Hsp90 ингибиторы, которые в настоящее время проходят обширную клиническую оценку в качестве противораковых препаратов, включая IPI-504 (ретаспимицин), также проявляли синергизм с рапамицином. Предыдущее исследование идентифицировало трансмембранные киназы ER и эффекторы реакции на стресс, инозитол, требующие фермента-1 (IRE-1), и протеинкиназу, РНК-подобную киназу эндоплазматического ретикулума (PERK), как Hsp90-зависимые белки (Marcu et al., 2002). Де Редт и др. подтверждают этот более ранний вывод и дополнительно подтверждают, что ингибиторы Hsp90, такие как IPI-504, лишают клетки способности создавать эффективный ответ ER при столкновении с тяжелым протеотоксическим стрессом.
Предыдущее исследование идентифицировало трансмембранные киназы ER и эффекторы реакции на стресс, инозитол, требующие фермента-1 (IRE-1), и протеинкиназу, РНК-подобную киназу эндоплазматического ретикулума (PERK), как Hsp90-зависимые белки (Marcu et al., 2002). Де Редт и др. подтверждают этот более ранний вывод и дополнительно подтверждают, что ингибиторы Hsp90, такие как IPI-504, лишают клетки способности создавать эффективный ответ ER при столкновении с тяжелым протеотоксическим стрессом.
Определенный уровень протеотоксического стресса ER является общей характеристикой раковых клеток и вызывается различными факторами, включая гипоксию, окислительный стресс и высокую мутационную нагрузку. Таким образом, раковые клетки зависят от оптимальной функции механизма клеточного ответа на стресс, потому что катастрофический стресс ER вызывает гибель клеток. В отличие от восстановительной среды цитозоля ЭР обеспечивает уникальную окислительную среду, способствующую образованию дисульфидных связей белков. Накапливающиеся данные указывают на то, что образование АФК является побочным продуктом окисления белка в ЭР. Поскольку окислительный стресс также вызывает стресс ER, стойкое повышение АФК в сочетании с нарушенным механизмом реакции ER на стресс инициирует порочный круг, ведущий к коллапсу ER и гибели клеток.
Накапливающиеся данные указывают на то, что образование АФК является побочным продуктом окисления белка в ЭР. Поскольку окислительный стресс также вызывает стресс ER, стойкое повышение АФК в сочетании с нарушенным механизмом реакции ER на стресс инициирует порочный круг, ведущий к коллапсу ER и гибели клеток.
Зависимость рака, вызванного Ras, от повышенного уровня АФК делает их особенно чувствительными к этой стратегии, как показано De Raedt et al. Важно отметить, что АФК необходимы для Ras-зависимой пролиферации клеток. Дерегуляция Ras способствует тонической активации каскада передачи сигнала Raf-MEK-ERK. В то время как низкие уровни активации ERK способствуют пролиферации, высокие уровни активации приводят к остановке роста (Meloche and Pouyssegur, 2007). Таким образом, Ras-активированные раковые клетки должны буферировать уровень активации ERK, чтобы быть совместимым с пролиферацией, и для этой цели они используют митохондриальные АФК (см. «1» в Weinberg et al., 2010). С другой стороны, уровень АФК должен жестко регулироваться, поскольку слишком сильный окислительный стресс вреден по причинам, описанным выше. Таким образом, рак, вызванный Ras, особенно зависит от поддержания соответствующего, но не чрезмерного уровня АФК. Чтобы достичь этого баланса, раковые клетки должны поддерживать достаточную восстановительную способность, которая частично достигается за счет метаболизма глюкозы через пентозофосфатный путь с образованием НАДФН, который, в свою очередь, способствует накоплению восстановленного глутатиона (GSH). Действительно, метаболизм глюкозы через пентозофосфатный путь важен для Ras-стимулированного роста в нормоксических условиях (Weinberg et al., 2010). Ключевым ферментом этого пути является глюкозо-6-фосфатдегидрогеназа (Г6ФД). Как показали De Raedt и коллеги, G6PD регулируется mTOR, компонентом второго сигнального пути, управляемого Ras (12). Таким образом, Ras-зависимая активация mTOR необходима для поддержания достаточных уровней восстановленного глутатиона (см. «2» на рис.). Из этого следует, что ингибирование mTOR рапамицином препятствует важному механизму удаления АФК (см. «3» на рис.
Таким образом, рак, вызванный Ras, особенно зависит от поддержания соответствующего, но не чрезмерного уровня АФК. Чтобы достичь этого баланса, раковые клетки должны поддерживать достаточную восстановительную способность, которая частично достигается за счет метаболизма глюкозы через пентозофосфатный путь с образованием НАДФН, который, в свою очередь, способствует накоплению восстановленного глутатиона (GSH). Действительно, метаболизм глюкозы через пентозофосфатный путь важен для Ras-стимулированного роста в нормоксических условиях (Weinberg et al., 2010). Ключевым ферментом этого пути является глюкозо-6-фосфатдегидрогеназа (Г6ФД). Как показали De Raedt и коллеги, G6PD регулируется mTOR, компонентом второго сигнального пути, управляемого Ras (12). Таким образом, Ras-зависимая активация mTOR необходима для поддержания достаточных уровней восстановленного глутатиона (см. «2» на рис.). Из этого следует, что ингибирование mTOR рапамицином препятствует важному механизму удаления АФК (см. «3» на рис. ).
).
Открыть в отдельном окне
Взаимосвязь между Ras-управляемыми сигнальными путями, АФК, Hsp90 и стрессом ER. Ras-управляемая пролиферация требует буферизации ROS активируемой Ras активности ERK1/2 (1). Уровень АФК частично регулируется восстановленным глутатионом (GSH), что требует достаточного количества НАДФН, генерируемого G6PD-опосредованным окислением глюкозы через пентозофосфатный путь (2). Экспрессия G6PD регулируется mTOR, компонентом второго Ras-управляемого сигнального пути, который ингибируется рапамицином (3). Hsp90 буферизует клеточные АФК и необходим для стабилизации и активности трансмембранных киназ ER PERK и IRE1, двух компонентов механизма стрессовой реакции ER. Ингибитор Hsp90 IPI-504 вызывает повышение уровня АФК, одновременно подавляя реакцию ЭР на стресс (4). Комбинация IPI-504 и рапамицина нарушает баланс между ROS и GSH, вызывая катастрофический стресс ER и гибель клеток.
Сообщалось, что Hsp90 буферирует клеточные АФК в других системах, хотя механизм его действия остается плохо изученным (Yang et al. , 2011). Тем не менее, эти данные подтверждают наблюдения Де Рэдта и его коллег о том, что IPI-504 и другие Hsp90 ингибиторы увеличивают ROS в Ras-управляемых раковых клетках (см. «4» на рис. ). В дополнение к этой активности и устранению сильной стрессовой реакции ER, ингибирование Hsp90 также подавляет передачу сигналов mTOR (Ohji et al., 2006), что объясняет текущие данные о том, что комбинированное введение рапамицина и IPI-504 оказывает более сильное влияние на G6PD. экспрессия и уровни GSH в MPNST in vivo , чем любой агент по отдельности. Кроме того, эти данные согласуются и, возможно, объясняют основную основу недавнего сообщения о том, что мутация Ras при НМРЛ вызывает повышенную зависимость от Hsp9.0 (Сос и др., 2009). De Raedt и коллеги обнаружили, что цитотоксичность (как in vitro , так и in vivo ) комбинации ингибиторов Hsp90/mTOR улучшалась при введении аскорбиновой кислоты, удаляющей АФК. Это, безусловно, согласуется с гипотезой о том, что отмена стрессовой реакции ER одновременно с подавлением регуляции ROS ответственна за выраженную противоопухолевую активность.
, 2011). Тем не менее, эти данные подтверждают наблюдения Де Рэдта и его коллег о том, что IPI-504 и другие Hsp90 ингибиторы увеличивают ROS в Ras-управляемых раковых клетках (см. «4» на рис. ). В дополнение к этой активности и устранению сильной стрессовой реакции ER, ингибирование Hsp90 также подавляет передачу сигналов mTOR (Ohji et al., 2006), что объясняет текущие данные о том, что комбинированное введение рапамицина и IPI-504 оказывает более сильное влияние на G6PD. экспрессия и уровни GSH в MPNST in vivo , чем любой агент по отдельности. Кроме того, эти данные согласуются и, возможно, объясняют основную основу недавнего сообщения о том, что мутация Ras при НМРЛ вызывает повышенную зависимость от Hsp9.0 (Сос и др., 2009). De Raedt и коллеги обнаружили, что цитотоксичность (как in vitro , так и in vivo ) комбинации ингибиторов Hsp90/mTOR улучшалась при введении аскорбиновой кислоты, удаляющей АФК. Это, безусловно, согласуется с гипотезой о том, что отмена стрессовой реакции ER одновременно с подавлением регуляции ROS ответственна за выраженную противоопухолевую активность. В настоящее время проводится клиническое исследование по оценке активности IPI-504 и ингибитора mTOR эверолимуса при НМРЛ с мутацией Ras (http://www.infi.com/product-candidates-pipeline-ipi-504.asp).
В настоящее время проводится клиническое исследование по оценке активности IPI-504 и ингибитора mTOR эверолимуса при НМРЛ с мутацией Ras (http://www.infi.com/product-candidates-pipeline-ipi-504.asp).
Одновременное нацеливание на Hsp90 и mTOR также демонстрирует синергическую активность в нескольких других моделях рака, включая гепатоцеллюлярную карциному, рак молочной железы и множественную миелому. Будет интересно определить, применим ли в этих случаях аналогичный основной механизм, включающий дерегуляцию ROS и коллапс ER. Учитывая, что повышенный окислительный стресс характерен для большинства видов рака, стратегии, направленные на использование этой общей склонности, могут помочь улучшить меньшую, чем ожидалось, клиническую активность Hsp9.0 ингибиторов при использовании в качестве отдельных агентов.
Правовая оговорка издателя: Это PDF-файл неотредактированной рукописи, которая была принята к публикации. В качестве услуги нашим клиентам мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута редактированию, набору текста и рецензированию полученного доказательства, прежде чем она будет опубликована в ее окончательной цитируемой форме. Обратите внимание, что в процессе производства могут быть обнаружены ошибки, которые могут повлиять на содержание, и все правовые оговорки, применимые к журналу, относятся к нему.
Рукопись будет подвергнута редактированию, набору текста и рецензированию полученного доказательства, прежде чем она будет опубликована в ее окончательной цитируемой форме. Обратите внимание, что в процессе производства могут быть обнаружены ошибки, которые могут повлиять на содержание, и все правовые оговорки, применимые к журналу, относятся к нему.
- De Raedt, et al. Раковая клетка. 2011; (данный выпуск) [Google Scholar]
- Downward J. Нацеливание на сигнальные пути RAS при лечении рака. Нат Рев Рак. 2003; 3:11–22. [PubMed] [Google Scholar]
- Джетт К., Фридман Дж. М. Клинико-генетические аспекты нейрофиброматоза 1. Genet Med. 2010; 12:1–11. [PubMed] [Google Scholar]
- Марку М.Г., Дойл М., Бертолотти А., Рон Д., Хендершот Л., Некерс Л. Белок теплового шока 90 модулирует реакцию развернутого белка, стабилизируя IRE1alpha. Мол Селл Биол. 2002; 22:8506–8513. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Маталланас Д., Креспо П. Новые лекарственные мишени в пути Ras? Curr Opin Mol Ther.
 2010;12:674–683. [PubMed] [Google Scholar]
2010;12:674–683. [PubMed] [Google Scholar] - Meloche S, Pouyssegur J. Путь митоген-активируемой протеинкиназы ERK1/2 как главный регулятор перехода G1-к S-фазе. Онкоген. 2007; 26:3227–3239. [PubMed] [Google Scholar]
- Ohji G, Hidayat S, Nakashima A, Tokunaga C, Oshiro N, Yoshino K, Yokono K, Kikkawa U, Yonezawa K. Подавление сигнального пути mTOR-raptor ингибитором теплового шока белок 90 гельданамицин. Дж Биохим. 2006; 139: 129–135. [PubMed] [Google Scholar]
- Sos ML, Michel K, Zander T, Weiss J, Frommolt P, Peifer M, Li D, Ullrich R, Koker M, Fischer F, et al. Прогнозирование лекарственной чувствительности немелкоклеточного рака легкого на основе генетических поражений. Джей Клин Инвест. 2009; 119:1727–1740. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Вайнберг Ф., Хаманака Р., Уитон В.В., Вайнберг С., Джозеф Дж., Лопес М., Кальянараман Б., Мутлу Г.М., Будингер Г.Р., Чандель Н.С. Митохондриальный метаболизм и генерация АФК необходимы для Kras-опосредованной онкогенности.


 2010;12:674–683. [PubMed] [Google Scholar]
2010;12:674–683. [PubMed] [Google Scholar]
Leave A Comment