Пробный (репетиционный) вариант ОГЭ по химии 2018 (Санкт-Петербург)
Пробный ОГЭ по химии
Вариант № 1
1. В атоме химического элемента содержится 16 электронов. Сколько из них находятся на внешнем энергетическом уровне?
1) 2 2) 4 3) 6 4) 8
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. Какой вид химической связи характерен для меди?
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
4. В каком соединении сера имеет наивысшую степень окисления?
1) 2) 3) 4)
5. Сложным является каждое из двух веществ:
1) нитрат калия и хлор 2) белый фосфор и озон
3) гидроксид калия и аргон 4) угарный газ и аммиак
6. Взаимодействие между оксидом меди(II) и водородом при нагревании – это
реакция
1) разложения 2) замещения 3) соединения 4) обмена
7. Больше всего ионов водорода образуется в водном растворе из одного моля
1) 2) 3) 4)
8. Осадок образуется при взаимодействии водных растворов
1) нитрата аммония и гидроксида калия
2) соляной кислоты и гидроксида бария
3) нитрата серебра и бромида кальция
4) азотной кислоты и карбоната натрия
9. С кислородом может реагировать
1) медь
2) оксид углерода(IV)
3) гидроксид натрия
4) серная кислота
10. Оксид серы(VI) реагирует с
1) нитратом натрия
2) хлором
3) оксидом алюминия
4) оксидом кремния
11. Азотная кислота образуется в реакции между соляной кислотой и
1) аммиаком
2) нитратом бария
3) азотом
4) нитратом серебра
12. В реакцию и с гидроксидом кальция, и с нитратом серебра вступает
1) карбонат магния
2) хлорид аммония
3) нитрат натрия
4) сульфат бария
13. Верны ли следующие суждения о правилах безопасной работы в лаборатории?
А. При получении кислорода из раствора пероксида водорода необходимо использовать резиновые перчатки.
Б. При растворении соды в воде необходимо надеть защитные очки.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
14. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
РЕАКТИВ
А) (р-р) и (р-р)
Б) (р-р) и (р-р)
В) (р-р) и (р-р)
1) (р-р)
2) (р-р)
3) (р-р)
4) (р-р)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
АБ
В
15. На какой диаграмме распределение массовых долей элементов соответствует ?
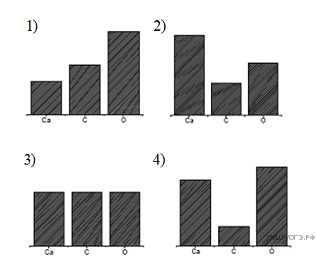
16. В ряду химических элементов: происходит уменьшение (ослабление)
1) заряда ядра
2) степени окисления в высших оксидах
3) числа атомов водорода в летучем водородном соединении
4) радиуса атома
5) числа электронов на внешнем энергетическом уровне
17. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Этилен
1) относится к непредельным углеводородам
2) не реагирует с кислородом
3) реагирует с водородом
4) имеет только одинарные связи
5) вступает в реакции замещения
18. Хлороводород является восстановителем в реакции с
1) 2) 3) 4)
19. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВАПРОДУКТЫ РЕАКЦИИ
А)
Б)
В)
1)
2)
3)
4)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
АВ
20. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель
21. К 340 г раствора с массовой долей нитрата серебра 6 % добавили избыток раствора хлорида железа (III). Вычислите массу образовавшегося осадка.
22. Даны вещества: FeCl3, H2SO4(конц.), Fe, Cu, NaOH, CuSO4.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II).
Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Пробный ОГЭ по химии
Вариант № 2
1. На внешнем энергетическом уровне элемента 2-го периода – в два раза больше электронов, чем на внутреннем уровне. Этот элемент –
1) литий 2) бериллий 3) углерод 4) кислород
2. Неметаллические свойства углерода выражены сильнее, чем неметаллические свойства
1) кислорода 2) кремния 3) азота 4) фтора
3. Ковалентной полярной связью образовано каждое из веществ в группе
1)
2)
3)
4)
4. Сера имеет самую низкую степень окисления в
1) 2) 3) 4)
5. Оксиду меди(I) и гидроксиду меди(I) соответствуют формулы
1) и 2) и
3) и 4) и
6. Пример реакции обмена:
1)
2)
3)
4)
7. В растворе сульфата аммония находится 0,6 моль положительных ионов. Количество отрицательных ионов в этом растворе равно
1) 0,2 моль 2) 0,3 моль 3) 0,6 моль 4) 1,2 моль
8. Взаимодействию карбоната магния с бромоводородной кислотой соответствует сокращённое ионное уравнение
1)
2)
3)
4)
9. Хлор реагирует с
1) 2) 3) 4)
10. Химическая реакция возможна между
1) оксидом серы(IV) и соляной кислотой
2) оксидом алюминия и гидроксидом натрия
3) оксидом бериллия и кислородом
4) оксидом железа(II) и оксидом калия
11. Какие вещества из приведённых ниже образуются при взаимодействии гидроксида меди(II) с соляной кислотой?
A) Б) B) Г) Д)
Выберите ответ с набором букв, которые соответствуют образующимся веществам.
1) БГ 2) БВ 3) АД 4) АГ
12. При взаимодействии растворов силиката натрия и соляной кислоты образуется(-ются) хлорид натрия и
1) 2) 3) 4)
13. Верны ли следующие суждения об обращении с растворами щелочей?
А. При попадании раствора щелочи на кожу рук его надо смыть водой.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
14. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
РЕАКТИВ
А) (р-р) и (р-р)
Б) (р-р) и (р-р)
В) (р-р) и (р-р)
1) лакмус (р-р)
2) (р-р)
3) (р-р)
4) (р-р)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Б
В
15. На какой диаграмме распределение массовых долей элементов соответствует ?
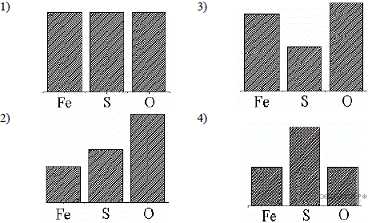
1) 1 2) 2 3) 3 4) 4
16. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов
1) увеличивается заряд ядер атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
17. Для этилена верны следующие утверждения:
1) составу молекулы соответствует общая формула
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены одинарной связью
4) вступает в реакции присоединения
5) при горении образуется углерод и водород
18. Подтвердить качественный состав сульфата железа(II) можно с помощью двух растворов, содержащих соответственно ионы
1) и 2) и 3) и 4) и
19. Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВАA)
1)
Б)
2)
B)
3)
4)
5)
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель
21. Для определения концентрации серной кислоты к её раствору добавляли хлорид бария до прекращения выпадения осадка. Для взаимодействия с 20 г раствора кислоты потребовалось 52 г 10-процентного раствора хлорида бария. Определите массовую долю серной кислоты в исходном растворе.
22. Даны вещества: Cu, NaOH, HCl, AgNO3, MgSO4.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II).
Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
infourok.ru
ОГЭ 2018. Химия. 32 варианта тестовых заданий / Ю.Н. Медведев
Уважаемые учителя и 9-классники!
Основное общее образование завершается Основным государственным экзаменом выпускников, в ходе которого проверяется соответствие их знаний требованиям государственного образовательного стандарта.
Экзамен выпускников 9 класса общеобразовательных организаций проводится в виде тестирования.
Требования к уровню подготовки выпускников по химии, указанные в федеральном компоненте государственного стандарта общего образования, являются основой разработки контрольных измерительных материалов для ОГЭ.
Согласно этим требованиям обязательной для усвоения является определенная система знаний о неорганических и органических веществах, их составе, свойствах и применении. Эта система знаний, в основе которой лежат Периодический закон и Периодическая система химических элементов Д.И. Менделеева, составляет инвариантное ядро всех общеобразовательных программ по химии. В предлагаемой экзаменационной работе именно это содержание явилось основой для разработки контрольных измерительных материалов.
Цель данного пособия состоит в том, чтобы познакомить учителей и учащихся со структурой и содержанием экзаменационной работы, дать возможность выпускнику самостоятельно проверить свою готовность к новой форме экзамена по химии — в виде тестирования.
Большую помощь в этом могут оказать представленные в пособии варианты, комментарии к решению всех заданий одного из вариантов и приведенные ответы на задания всех вариантов.
Выполнение представленных заданий является одним из способов закрепления, систематизации и обобщения полученных знаний, а также способом самоконтроля имеющихся у выпускников знаний.
Обратим внимание на один важный момент. Содержащиеся в вариантах экзаменационной работы задания различны по своей форме и требуют для своего выполнения разные типы ответов: при выполнении заданий части 1 с кратким ответом (задания 1-15) достаточно записать номер выбранного правильного ответа, при выполнении заданий части 1 с кратким ответом (задания 16-19) необходимо дать ответ в виде числа или набора цифр. Ответ в части 2 предлагает запись необходимых уравнений реакций или произведенных расчетов при решении задачи.
Задания части 1 (1-15) с кратким ответом соответствуют требованиям базового уровня подготовки выпускников основной школы по химии. Они формулируются в виде короткого утверждения, окончанием которого является соответствующий вариант ответа. В каждом из заданий предлагается четыре варианта ответа, только один из которых является верным.
Задания части 1 (16-19) с кратким ответом, в отличие от заданий 1-15, имеют повышенный уровень сложности и поэтому содержат больший объем информации, которую нужно осмыслить и понять. Именно поэтому выполнение таких заданий потребует осуществления большего числа учебных действий, чем в случае выбора одного верного ответа. В ответе следует записать набор цифр.
Задания части 2 с развернутым ответом по своему содержанию соответствуют наиболее сложным заданиям традиционных письменных работ. Они предназначены для проверки владения умениями, которые отвечают наиболее высоким требованиям к уровню подготовки выпускников основной школы. Для выполнения этих заданий необходимо уметь:
1) составлять уравнения окислительно-восстановительных реакций и расставлять в них коэффициенты с помощью метода электронного баланса;
2) проводить расчеты массовой доли растворенного вещества, количества вещества, массы или объема по количеству вещества. Ответ предполагает запись необходимых уравнений реакций или произведенных расчетов при решении задачи;
3) выбирать необходимые реактивы из предложенного перечня веществ для получения указанного вещества, составлять уравнения реакций, описывать признаки реакций, для реакций ионного обмена записывать сокращенные ионные уравнения.
В отличие от предыдущих лет, начиная с 2014 г. в содержание экзамена вводится эксперимент по получению вещества, названного в задании 22. В ходе выполнения эксперимента ученик должен уметь:
1) читать и анализировать инструкцию по выполнению химического эксперимента;
2) подготовить лабораторное оборудование для проведения эксперимента;
3) составить схему превращений, в результате которых можно получить указанное вещество;
4) проводить реакции в соответствии с составленной схемой превращений и получить вещество;
5) делать вывод о химических свойствах веществ, участвующих в реакции, и признаках классификации реакций.
Чтобы в процессе самостоятельной работы при выполнении того или иного варианта успешно выполнить каждое из заданий, следует не только внимательно отнестись к решению заданий вариантов 9 и 18, но и проанализировать их.
www.egeigia.ru
ОГЭ по химии 2018
ОГЭ по химии – это один из экзаменов в конце 9-го класса, который может сдаваться по выбору ученика. Результаты этого экзамена будут рассматриваться при зачислении в 10-й класс с профильным уклоном, а также при поступлении в профессиональные училища, где требуется знание химии, например, в медицинские училища, в которые также необходимо сдавать ОГЭ по биологии. В экзамене сочетается большое количество заданий и очень ограниченное время на их выполнение – на одно задание приходится 5,5 минут.
После ознакомления с общей информацией об экзамене сразу приступайте к подготовке. Экзамен в этом году совсем не отличается от прошлых лет, потому готовиться можно по материалам и 2016-го, и 2017 года.
Оценивание ОГЭ
Минимальный порог по химии в 2018 году равен девяти баллам. Чтобы набрать необходимый минимум, достаточно верно выполнить первые девять заданий теста.
Экзамен оценивается по пятибалльной системе, в зависимости от набранных баллов выставляется соответствующая отметка. Максимальный балл, в зависимости от типа теста, может быть равен 34 или 38.
Структура ОГЭ
Тип 1. Экзамен состоит из двух частей, включающих в себя 22 задания.
- Часть 1: 19 заданий (1–19) с кратким ответом. Записывается в виде цифры либо в виде последовательности цифр.
- Часть 2: три задания (20–22) с развернутым ответом. Дайте полный ответ, включающий в себя необходимые уравнения реакций и расчеты.
Тип 2. Экзамен состоит из двух частей, включающих в себя 23 задания.
- Часть 1: 19 заданий (1–19) с кратким ответом. Записывается в виде цифры либо в виде последовательности цифр.
- Часть 2: четыре задания (20–23) с развернутым ответом и лабораторным экспериментом. Дайте полный ответ, включающий в себя необходимые уравнения реакций и расчеты, а также проведите реальный опыт с лабораторным оборудованием под наблюдением экспертов-экзаменаторов.
Подготовка к ОГЭ
- На нашем сайте вы можете пройти тесты ОГЭ онлайн бесплатно без регистрации и СМС. На данный момент раздел обновляется, и со временем в нем будут появляться новые тесты за весь период проведения ОГЭ. Представленные тесты по своей сложности и структуре идентичны реальным экзаменам, проводившимся в соответствующие годы.
- Скачайте демонстрационные варианты ОГЭ по химии, которые позволят лучше подготовиться к экзамену и легче его сдать. Все предложенные тесты разработаны и одобрены для подготовки к ОГЭ Федеральным институтом педагогических измерений (ФИПИ). В этом же ФИПИ разрабатываются все официальные варианты ОГЭ.
Задания, которые вы увидите, скорее всего, не встретятся на экзамене, но будут задания, аналогичные демонстрационным, по той же тематике или просто с другими цифрами. - Ознакомьтесь с основными формулами для подготовки к экзамену, они помогут освежить память перед тем, как приступить к выполнению демонстрационных и тестовых вариантов.
Общие сведения об ОГЭ
Время проведения экзамена: 120 минут (2 часа) / 140 минут (2 часа 20 минут).
Разрешенные материалы: периодическая система химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов, непрограммируемый калькулятор.
Минимальный балл (соответствует тройке): 9.
Максимальный балл: 34/38.
Количество заданий: 22.
К списку вопросов об ОГЭ >>
Полезные ссылки:
www.examen.ru
Подготовка к ОГЭ (ГИА) по химии. Тематические тесты для подготовки к ОГЭ по химии.
Для кого предназначены эти тесты?
Данные материалы предназначены для школьников, готовящихся к ОГЭ-2018 по химии. Их также можно использовать для самоконтроля при изучении школьного курса химии. Каждый тест посвящен определенной теме, которая встретится девятикласснику на экзамене. Номер теста — это номер соответствующего задания в бланке ОГЭ.
Как устроены тематические тесты?
Каждый тренировочный тест состоит из 10 заданий различного уровня сложности. Задачи 1-5 наиболее легкие, подойдут для тех, кто начинает готовиться к ОГЭ по химии «с нуля». Задания 6-10 соответствуют уровню ГИА или немного сложнее.
Чем отличаются тематические тесты от «обычных» тестов ОГЭ?
«Обычные» тесты проверяют общий уровень знаний по химии. Каждый из тематических тестов посвящен только одной теме.
Полные варианты ОГЭ (например, этот или этот) целесообразно использовать для периодического самоконтроля в процессе подготовки к экзамену, тематические тесты — для работы над конкретными разделами программы по химии, которые вызывают наибольшие сложности.
Какое место занимают тематические тесты в подготовке к ОГЭ по химии?
Разумеется, данные тренировочные тесты нельзя рассматривать как замену школьного учебника химии. Прежде чем начинать работать над тестом, следует внимательно изучить соответствующую тему по учебнику или обратиться к помощи преподавателя. Тесты ничего не объясняют. Они лишь помогают вам лучше усвоить соответствующий материал и оценить уровень своей подготовки.
Как интерпретировать результаты тестов?
Если вы набираете 4-5 баллов в первой части и 4-5 баллов во второй, можете считать, что соответствующая тема усвоена вами отлично. Если во второй части вы сможете решить правильно 2-3 задания и 3-4 задания в первой части, советую еще немного потренироваться.
Если вы даже в I части делаете более трех ошибок, результат неудовлетворительный! Тренируйтесь! Попробуйте еще раз разобрать соответствующую тему. Если возникают сложности, обратитесь к помощи репетитора.
Будут ли на этом сайте публиковаться другие тематические тесты?
Безусловно! Я планирую разместить тесты по 23 темам, по 10 заданий в каждом. Следите за обновлениями!
Что еще есть на этом сайте для готовящихся к ОГЭ-2018 по химии?
Демонстрационные тесты ОГЭ и ЕГЭ и тесты по химии для школьников 8 — 11 классов. Статьи, посвященные решению сложных задач, и справочник по химии.Вам кажется, что чего-то не хватает? Вам хотелось бы расширить какие-то разделы? Нужны какие-то новые материалы? Что-то надо исправить? Нашли ошибки?
Пожалуйста, свяжитесь со мной.
Успехов всем готовящимся к ОГЭ и ЕГЭ!
www.repetitor2000.ru
Демоверсия ОГЭ по химии 2018 год (ГИА 9 класс)
- Категория: Химия
- Опубликовано: 14 Ноябрь 2017
На официальном сайте ФИПИ опубликованы проекты демоверсии ОГЭ 2018 года по химии (ГИА 9 класс).
Максимальное количество баллов, которое может получить экзаменуемый за выполнение всей экзаменационной работы, – 34/38 баллов.
Результаты экзамена ОГЭ по химии в 9 классе могут быть использованы при приеме обучающихся в профильные классы средней школы.
Ориентиром при отборе в профильные классы может быть показатель, нижняя граница которого соответствует 25 баллам.
Демоверсия ОГЭ по химии 2018 год (9 класс) от ФИПИ
Продолжительность ОГЭ по химии— 120/140 минут
На выполнение экзаменационной работы в соответствии с моделью 1 отводится 120 минут; в соответствии с моделью 2 – 140 минут (на лабораторную работу (задание 23) дополнительно выделяется 20 минут).
Примерное время, отводимое на выполнение отдельных заданий, составляет:
1) для каждого задания части 1 – 3–8 минуты;
2) для каждого задания части 2 – 12–17 минут;
Изменения в КИМ 2018 года по сравнению с КИМ 2017 года — отсутствуют
Максимальный первичный балл – 34/38.
Каждый вариант экзаменационной работы состоит из двух частей.
Часть 1 содержит 19 заданий с кратким ответом, в их числе 15 заданий базового уровня сложности (порядковые номера этих заданий: 1, 2, 3, 4, …15) и 4 задания повышенного уровня сложности (порядковые номера этих заданий: 16, 17, 18, 19). При всем своем различии задания этой части сходны в том, что ответ к каждому из них записывается кратко в виде одной цифры или последовательности цифр (двух или трех). Последовательность цифр записывается в бланк ответов без пробелов и других дополнительных символов.
Часть 2 в зависимости от модели КИМ содержит 3 или 4 задания высокого уровня сложности, с развернутым ответом. Различие экзаменационных моделей 1 и 2 состоит в содержании и подходах к выполнению последних заданий экзаменационных вариантов:
• экзаменационная модель 1 содержит задание 22, предусматривающее выполнение «мысленного эксперимента»;
• экзаменационная модель 2 содержит задания 22 и 23, предусматривающие выполнение лабораторной работы (реального химического эксперимента).
Задания расположены по принципу постепенного нарастания уровня их сложности. Доля заданий базового, повышенного и высокого уровней сложности составила в работе 68, 18 и 14% соответственно.
Условия проведения ОГЭ по химии в 9 классе
При проведении экзамена по модели 1 в аудиторию не допускаются специалисты по химии. При проведении ОГЭ по химии по модели 2 подготовку и выдачу лабораторных комплектов осуществляют специалисты.
Для оценки проведения химического эксперимента, предусмотренного моделью 2, в аудиторию должны обязательно приглашаться эксперты.
Дополнительные материалы и оборудование
Перечень дополнительных материалов и оборудования, пользование которыми разрешено на ОГЭ, утвержден приказом Минобрнауки России. На экзамене по химии разрешается использовать следующие материалы и оборудование:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
Проведение лабораторной работы в соответствии с экзаменационной моделью 2 осуществляется в специально помещении – химической лаборатории, оборудование которой должно отвечать требованиям СанПиН.
Смотрите также:
vpr-ege.ru

Leave A Comment