ОГЭ по химии. Разбор задания № 1
Химия ОГЭ 2020, часть 1. Задание 1 с комментариями экспертов (разбор задания № 1 на 3 примерах). Материал для подготовки к экзамену.
ОГЭ по химии. Разбор задания № 1
Пример 1.
Решение задания (с комментариями)
Пример 2.
Решение задания (с комментариями)
Пример 3.
Решение задания (с комментариями)
Ответами к заданиям 1–19 являются цифра или последовательность цифр.
Пример 1.
ОГЭ по химии. Задание 1.
Выберите два высказывания, в которых говорится о железе как о химическом элементе.
- 1) Железо реагирует с бромом.
- 2) Железо быстро ржавеет в морской воде.
- 3) Магнитный железняк является сырьём для получения железа.
- 4) Кислород в клетки организма человека переносит содержащий железо белок гемоглобин.

- 5) Для повышения содержания гемоглобина рекомендуется употреблять содержащие железо продукты, например яблоки и смородину.
Запишите в поле ответа номера выбранных высказываний. Ответ: [ ] [ ].
Решение задания (с комментариями)
Базовые знания. Химическим элементом называют совокупность атомов, которые имеют одинаковый заряд ядра.
Элементы в природе могут находиться в виде отдельных атомов, образовывать простые вещества и входить в состав сложных веществ (химических соединений).
1) «Железо реагирует с бромом», то есть железо (простое вещество, образованное только атомами химического элемента железо) реагирует с бромом (простое вещество, которое состоит только из атомов элемента брома) и образуется какое–то сложное вещество, состоящее из атомов железа и атомов брома.
Вывод: в этом предложении слово «железо» относится к простому веществу, ответ неправильный.
2) «Железо быстро ржавеет в морской воде», то есть какой–то предмет, например железный гвоздь, в морской воде изменяет свой внешний вид (ржавеет, поверхность покрывается бурыми пятнами).
Вывод: в этом предложении слово «железо» относится к предметам, изготовленным из простого вещества железа, ответ неправильный.
3) «Магнитный железняк является сырьём для получения железа», то есть из какого–то сложного вещества (магнитного железняка), в состав которого входили атомы элемента железа, выделили вещество железо.
Вывод: в этом предложении слово «железо» относится к простому веществу, ответ неправильный.
4) «Кислород в клетки организма человека переносит содержащий железо белок гемоглобин», то есть какое–то сложное вещество (гемоглобин), в состав которого входят атомы железа, участвует в переносе кислорода.
Вывод: в этом предложении слово «железо» относится к атомам, входящим в состав сложного вещества, то есть к химическому элементу, ответ правильный.
5) «Для повышения содержания гемоглобина рекомендуется употреблять содержащие железо продукты, например яблоки и смородину».
Вывод: в этом предложении слово «железо» относится к атомам, входящим в состав сложного вещества, то есть к химическому элементу, ответ правильный.
Ответ: 4 5.
Пример 2.
ОГЭ по химии. Задание 1.
Выберите два высказывания, в которых говорится о сере как о простом веществе.
- Аминокислота цистеин содержит серу.
- Один из продуктов обжига пирита содержит серу.
- При растворении серы в концентрированной азотной кислоте образуется серная кислота и выделяется бурый газ.
- Сера не относится к биогенным элементам и не используется в составе удобрений.
- Мази для лечения некоторых заболеваний кожи изготавливают, перемешивая серу с вазелином.
Запишите в поле ответа номера выбранных высказываний. Ответ: [ ] [ ].
Решение задания (с комментариями)
1) «Аминокислота цистеин содержит серу».
Аминокислоты – сложные органические вещества, которые состоят из атомов углерода, водорода, азота, кислорода и некоторых других элементов, например серы.
Вывод: в этом предложении слово «сера» относится к атомам, входящим в состав сложного вещества, то есть к химическому элементу; ответ неправильный.
2) «Один из продуктов обжига пирита содержит серу».
Пирит – сложное вещество, в состав которого входят атомы серы (элемента серы). При обжиге пирита образуется другое сложное вещество, в состав которого также входят атомы серы (элемента серы).
Вывод: в этом предложении слово «сера» относится к атомам, входящим в состав сложного вещества, то есть к химическому элементу; ответ неправильный.
3) «При растворении серы в концентрированной азотной кислоте образуется серная кислота и выделяется бурый газ».
В этом предложении описывается взаимодействие серы, простого вещества, состоящего из атомов элемента серы, с концентрированной азотной кислотой. В результате реакции атомы, входившие в состав простого вещества, образуют сложное вещество – серную кислоту, состоящую из атомов водорода, серы и кислорода (элементов водорода, серы и кислорода).
Вывод: в этом предложении слово «сера» относится к простому веществу; ответ правильный.
4) «Сера не относится к биогенным элементам и не используется в составе удобрений».
В качестве удобрений используются соединения, которые содержат необходимые для жизнедеятельности растений элементы – азот, фосфор, калий и некоторые другие.
Вывод: в этом предложении слово «сера» относится к атомам, входящим в состав сложного вещества, то есть к химическому элементу; ответ неправильный.
5) «Мази для лечения некоторых заболеваний кожи изготавливают, перемешивая серу с вазелином».
В этой фразе описан процесс смешивания серы (простое вещество) и вазелина (сложное органическое вещество), в результате образуется механическая смесь двух веществ.
Вывод: в этом предложении слово «сера» относится к простому веществу; ответ правильный.
Ответ: 3 5.
Пример 3.
ОГЭ по химии. Задание 1.
Выберите два высказывания, в которых говорится об азоте как о химическом веществе.
- 1) Азот в хлориде аммония имеет степень окисления –3.
- 2) Для восполнения потерь азота после уборки урожая в почву вносят, в частности, мочевину и некоторые соли азотной кислоты.

- 3) Азот – газ без цвета и запаха, мало растворим в воде.
- 4) Электронная формула азота 1s22s22р3.
- 5) Азот является сырьём для получения аммиака.
Запишите в поле ответа номера выбранных высказываний. Ответ: [ ] [ ].
Решение задания (с комментариями)
1) «Азот в хлориде аммония имеет степень окисления –3». Хлорид аммония NH4Cl – сложное вещество, состоящее из атомов элементов азота, водорода и хлора.
Вывод: ответ неверный.
2) «Для восполнения потерь азота после уборки урожая в почву вносят, в частности, мочевину и некоторые соли азотной кислоты».
В состав гумуса, питательного компонента почвы, входят как неорганические, так и органические азотсодержащие вещества. Восстанавливают количество связанного азота в почве с помощью азотных удобрений, например, мочевины (CO(NH2)2), селитры (аммиачной NH4NO3, калийной KNO3, натриевой NaNO3) или навоза.
Вывод: ответ неверный.
3) «Азот – газ без цвета и запаха, мало растворим в воде». В этом предложении описываются свойства вещества – агрегатное состояние (газ), цвет, запах и растворимость в воде.
Вывод: ответ правильный.
4) «Электронная формула азота 1s22s22p3». Электронные формулы описывают расположение электронов в атомах химических элементов.
Вывод: ответ неверный.
5) «Азот является сырьём для получения аммиака». В промышленности аммиак NH3 получают при взаимодействии газообразного азота N, (простое вещество, которое выделяют из воздуха) и водорода Н2 (простое вещество, которое получают из воды или органических веществ).
Вывод: ответ правильный.
Ответ: 3 5.
Вы смотрели: Химия ОГЭ 2020, часть 1. Задание 1 с комментариями экспертов (разбор задания № 1 на 3 примерах). Материал для подготовки к экзамену.
Разбор всех типов задачи 22 ОГЭ по химии | ОГЭ — Химия
https://ds02.infourok.ruЗадача 22.
Существует всего три типа задач, которые встречаются в этом задании, но все они решаются по уравнению реакции, в вычислениях используют определенный набор формул:
основные формулы для решения задачи 22Для каждого из типов представлен алгоритм решения задач.
Первый тип задач.
Дана масса раствора исходного вещества и его массовая доля. Определить массу образовавшегося осадка.
1. Составить уравнение реакции, т.е. записать формулы веществ вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
3. Рассчитать массу вещества в растворе по формуле:
m(ве-ва) = m(ра-ра)∙ω.
4. Рассчитать количество вещества по формуле: n = m/M.
5. По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
6. Рассчитать массу осадка по формуле: m =M·n.
Пример 1. К 60 г раствора с массовой долей гидроксида калия 15% добавили избыток раствора нитрата меди (II). Определите массу выпавшего осадка.
Решение: 1. Записываем уравнение реакции, пользуясь таблицей растворимости устанавливаем вещество, которое выпадает в осадок:
2. Найдем массу гидроксида калия (m(ве-ва)):
m(ве-ва) = m(ра-ра)∙ω
m(КОН) = 60*15/100% = 9 г
3. Найдем количество вещества КОН:
n = m/M
nКОН = 9/56 = 0, 16 моль
4. По уравнению реакции найдем количество вещества Cu(OH)2:
2 моль КОН — 1 моль Cu(OH)2
0,16 моль КОН — х моль Cu(OH)2
х = 0,16*1/2 = 0,8 моль
5. Найдем массу осадка:
m =M·n
mCu(OH)2 = 98*0,8 = 78,4 г
Ответ: 78,4 г.
Второй тип задач.
Дана масса раствора вещества или продукта реакции. Вычислить массовую долю вещества или продукта реакции.
1. Составить уравнение реакции, т.е. записать формулы веществ, вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. Вычисляем количество исходного вещества (или продукта) реакции по формуле: n = m/M, если дан объем газа, то по формуле: n =V*Vm .
3. Вычисляем массу исходного вещества (или продукта) реакции по формуле: m = n*M.
4.Знаем массу исходного вещества (продукта) — нашли в предыдущем действии. Знаем массу раствора – дана в условии. Находим массовую долю по формуле: ω = m(вещества)/m(раствора)∙.
Пример2: К 85 г раствора серной кислоты добавили порцию карбоната калия. При этом выделилось 0,896 л газа. Вычислите массовую долю исходного раствора серной кислоты.
Решение: 1. Записываем уравнение реакции:
2. Найдем количество вещества CO2:
n = V/Vm
nCO2 = 0,896/22,4 = 0, 04 моль
3.По уравнению реакции найдем количество вещества Н2SO4:
nCO2 = nН2SO4 = 0,04 моль
1. Найдем массу серной кислоты (m(ве-ва)):
Найдем массу серной кислоты (m(ве-ва)):
m(Н2SO4) = n*M
m(Н2SO4) = 0,04*98 = 3,92 г
5. Найдем массовую долю серной кислоты в растворе:
ω (Н2SO4) = 3,92/85*100% = 4,6%
Ответ: 4,6%
Третий тип задач.
Дана массовая доля раствора исходного вещества. Определить массу исходного вещества в растворе.
1. Составить уравнение реакции, т.е. записать формулы веществ вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. Рассчитать количество вещества образовавшегося осадка или выделившегося газа по формуле:
n = m/M или n = V/Vm
3. По уравнению реакции рассчитать количество вещества, массу которого необходимо найти в вопросе задачи.
4. Рассчитать массу вещества в растворе по формуле:
m(Na2SO4) = n*M
5. Найдем масcу растворa:
m(ра-ра) = m(ве-ва) /ω.
Пример 3: К раствору сульфата натрия с массовой долей 9% добавили избыток раствора нитрата бария. В результате образовался осадок массой 9,85г. Определите массу исходного раствора сульфата натрия.
В результате образовался осадок массой 9,85г. Определите массу исходного раствора сульфата натрия.
Решение: 1. Записываем уравнение реакции, пользуясь таблицей растворимости устанавливаем вещество, которое выпадает в осадок:
2. Найдем количество вещества BaSO4:
n = m/M
nBaSO4 = 9,85/230 = 0,04 моль
3.По уравнению реакции найдем количество вещества Na2SO4:
n BaSO4 = nNa2SO4 = 0,04 моль
4. Найдем массу вещества сульфата натрия (m(ве-ва)):
m(Na2SO4) = n*M
m(Н2SO4) = 0,04*119 = 4,76 г
5. Найдем масcу растворa сульфата натрия:
m(ра-ра) = m(ве-ва) /ω.
m(ра-ра) = 4,76*100% /9 = 52,89 г
Ответ: 52,89 г
Задачи для самостоятельного решения.
1. К 160 г раствора с массовой долей нитрата серебра 5% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
2. К 80 г раствора с массовой долей нитрата бария 9% добавили избыток раствора серной кислоты. Определите массу выпавшего осадка.
Определите массу выпавшего осадка.
3. К 180 г раствора с массовой долей гидроксида натрия 10% добавили избыток раствора хлорида железа (III). Определите массу выпавшего осадка.
4. К 150 г раствора соляной кислоты добавили раствор сульфида калия. При этом выделилось 8,96 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
5. К 75 г раствора серной кислоты добавили порцию карбоната кальция. При этом выделилось 2, 24 л газа. Вычислите массовую долю исходного раствора серной кислоты.
6. К 125 г раствора соляной кислоты добавили порцию сульфита калия. При этом выделилось 4,48 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
7. К раствору сульфата калия с массовой долей 6% добавили избыток раствора хлорида бария. В результате образовался осадок массой 8,95г. Определите массу исходного раствора сульфата калия.
8. К раствору фосфата натрия с массовой долей 12% добавили избыток раствора нитрата серебра. В результате образовался осадок массой 12,45г. Определите массу исходного раствора фосфата натрия.
В результате образовался осадок массой 12,45г. Определите массу исходного раствора фосфата натрия.
9. К раствору хлорида кальция с массовой долей 8% добавили избыток раствора нитрата серебра. В результате образовался осадок массой 9,85г. Определите массу исходного раствора хлорида кальция.
Анализ рабочих материалов и данных об окружающей среде
Лабораторные услуги
У вас есть вопросы по химическому анализу или процессу, связанные с транспортировкой и использованием природного газа? Наш Центр компетенций по качеству газа с собственной лабораторией всегда готов помочь вам.
В нашей лаборатории мы анализируем газы, сопутствующие вещества и расходные материалы для газов. Для этого мы можем использовать высокоэффективные методы измерения и многолетний опыт эксплуатации собственной газотранспортной системы и сотрудничества с нашими клиентами. Наш центр компетенции по качеству газа сертифицирован в соответствии с DIN EN ISO 9.001, а наша испытательная лаборатория аккредитована для анализа природного газа в соответствии с DIN EN ISO/IEC 17025.
Воспользуйтесь услугами нашей лаборатории для решения различных задач, в том числе:
- Определение состава природного газа в соответствии с нормами DVGW. Практика G 260
- Анализ природного газа до C14
- Определение следовых концентраций сопутствующих веществ
- Анализ воды на подогревателях в соответствии с DVGW G 495
- Подготовка паспорта безопасности природного газа
- Регистрация значений ориентации природного газа
Ваша инфраструктура должна функционировать надежно и безопасно. Чтобы убедиться в этом, все соответствующие рабочие материалы и расходные материалы должны подвергаться постоянному химическому анализу. Мы предлагаем аналитические услуги по воде, смазочному маслу и этиленгликолю для сушки, а также услуги по тестированию следовых концентраций сопутствующих веществ в газовой сети. Кроме того, мы также поддерживаем вас ценными химическими/аналитическими услугами в области анализа окружающей среды и опасных веществ:
Кроме того, мы также поддерживаем вас ценными химическими/аналитическими услугами в области анализа окружающей среды и опасных веществ:
- Анализ воды для систем предварительного нагрева в соответствии с DVGW G 495
- Анализ смазочных масел и этиленгликоля для сушки
- Анализ отходов и окружающей среды (почва, вода, воздух)
- Исследование отложений, продуктов коррозии и остатков всех видов
- Измерение и мониторинг опасных веществ на рабочем месте
- Управление опасными веществами
Мы с нетерпением ждем вашего ответа и будем рады помочь.
Просто сделайте запрос или запишитесь на личную встречу прямо сейчас.
Сделать запросЗаписаться на прием
Брошюра / pdf / 404.91 КБ
Анализ воды на подогревателях
Центр компетенции по качеству газа, Технический паспорт (только на немецком языке), февраль 2020 г.
Паспорт безопасности природного газа
в соответствии с Регламентом (ЕС) № 1907/2006 (REACH), § 5 Директивы Германии об опасных веществах (GefStoffV)
Предварительная загрузка
Информация о рынке / pdf / 470.94 KB
Значения ориентации на природный газ Open Grid Europe
2022 Предварительная загрузка 9000view (только на немецком языке) 9000view
Другое / pdf / 431.85 KB
Аттестат аккредитации
Deutsche Akkreditierungsstelle GmbH
PreviewDownload
Другое / pdf / 1.70 MB
Приложение 9 к аттестату аккредитации0004
Deutsche Akkreditierungsstelle GmbH
PreviewDownload
Надежный анализ вашего газа
в нашей собственной лаборатории
подробнее
Надежный анализ вашего газа 900 90 002 в нашей собственной лаборатории4 900 собственная лаборатория
подробнее
ОГЭ Energy Corp. (OGE) Technical Analysis
OGE Energy Corp. Technicals
Technicals
OGE Energy Corp.(ALLUS_OGE)
$37,62▲0,59%
₹
$
Рынок закрыт — открывается 24.04.2023 19:00
Рынок закрыт — открывается 24.04.2023
- OGE Energy Corp. в настоящее время находится в нейтральной торговой позиции согласно индикаторам технического анализа .
- На основании анализа технического индикатора Oscillators текущая рыночная тенденция для акций OGE Energy Corp. предполагает, что они находятся в диапазоне, и на основе этой информации нельзя принять решение
- На основании анализа технического индикатора Moving Averages, OGE Акции Energy Corp. находятся в восходящем тренде ↗️
- Основываясь на анализе точек разворота, текущая рыночная тенденция по акциям OGE Energy Corp.
 предполагает, что сейчас хорошее время для продажи или плохое время для открытия новой позиции
предполагает, что сейчас хорошее время для продажи или плохое время для открытия новой позиции
Осцилляторы
Продать
Нейтрально
Купить
Скользящие средние
Продать
Нейтральные
Купить
Развороты
Продать
Нейтральные5
Купить
Осцилляторы
Скользящие средние
Простые скользящие средние
Период (дни) 55 Значение | Действие | ||
|---|---|---|---|
10 | 38.17 | Купить | |
20 | 37.07 | 93 6 | 2 |
50 | 37,03 | Продажа |
Экспоненциальная скользящая средняя
19439Значение | Действие | |
|---|---|---|
10 | 37,97 | Купить |
20 | 91035 9005 9005 37,4 0 Купить | |
50 | 37,33 | Продажа |
Период (дни)
Значение
Действие
10
38. 17
17
Нейтральный
2 210
36,98
Нейтральный
50
36,89
Двойная экспоненциальная скользящая средняя
Период (дни) | Значение | Действие | |||
|---|---|---|---|---|---|
10 | 38,54 | 9 | 520 | 38.09 | Купить |
50 | |||||
Продажа |
Тройная экспоненциальная скользящая средняя
Период (дней) | Значение | Действие | ||
|---|---|---|---|---|
10 | 9 | 3 | 3 | 32 Продать |
20 | 38,75 | Купить | ||
Цена | ||||
Сопротивление L2 | 38,26 | |||
0 Опора L105 35 37,71 | ||||
Опора L2 | 37,48 | |||
Точка поворота 7 | 0||||
Сопротивление L1 | 38. |



 предполагает, что сейчас хорошее время для продажи или плохое время для открытия новой позиции
предполагает, что сейчас хорошее время для продажи или плохое время для открытия новой позиции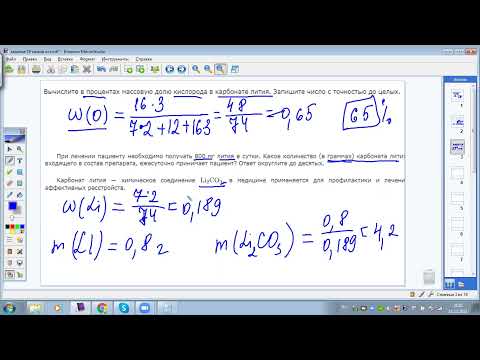
Leave A Comment