Задание №2 ЕГЭ по химии
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.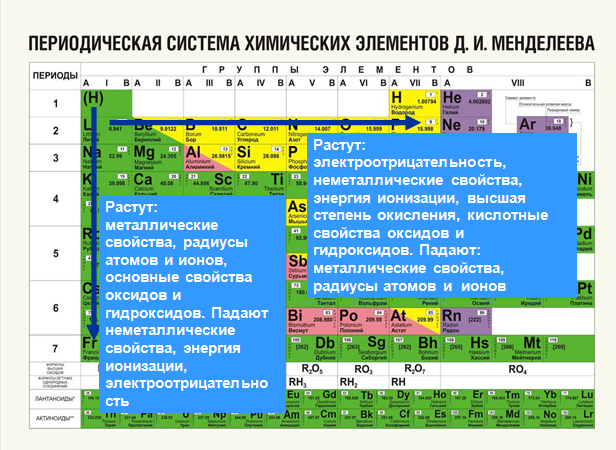
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Задание 2 ЕГЭ по химии 2019: теория и практика
Рассмотрим задания, представленные в экзаменационной работе, обратившись для этого к демонстрационному варианту ЕГЭ по химии 2019 г.
Блок «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Закономерности изменения свойств химических элементов по периодам и группам». «Строение вещества. Химическая связь»
Этот блок содержит задания только базового уровня сложности, которые были ориентированы на проверку усвоения понятий, характеризующих строение атомов химических элементов и строение веществ, а также на проверку умений применять Периодический закон для сравнения свойств элементов и их соединений.
Рассмотрим эти задания.
Задания 1-3 объединены единым контекстом:
|
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы |
Задание 2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
|
Ответ: |
|
|
|
Успешное выполнение задания 2 предполагает понимание смысла Периодического закона Д.И. Менделеева и закономерностей изменения химических свойств элементов и их соединений по периодам и группам в связи с особенностями строения атомов элементов. Необходимо обратить внимание на то, что надо не просто выбрать элементы, находящиеся в одном периоде, а обязательно расположить их в определенной последовательности. В данном задании следует расположить элементы в порядке возрастания их металлических свойств. Для этого надо вспомнить, что в пределах одного периода с возрастанием заряда ядра атома металлические свойства элементов уменьшаются. Поэтому в порядке возрастания металлических свойств элементы III периода следует расположить в последовательности: Si — Mg — Na.
В 2018 г. задание 2 успешно выполнили 62,0 % экзаменуемых.
ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Реальный вариант ЕГЭ по химии-2020
Друзья! Предлагаю вашему вниманию реальный вариант ЕГЭ по химии-2020, который составил из материалов, выложенных в интернете участниками экзамена, которые после экзаменов смогли записать и запомнить задания.
Обращаю Ваше внимание, что вариант составлен на скорую руку из материалов в интернете. Некоторые формулировки и задания могут быть неточными или не соответствовать формулировкам на экзамене. Это не официальные и не точные материалы. Тем не менее, составить общее представление о прошедшем экзамене они позволяют.
Полный вариант реального ЕГЭ по химии 16 июля 2020 года можно скачать здесь.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Cl 2) Sr 3) Se 4) P 5) K Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
| Задание 1. Определите два элемента, электронные конфигурации ионов которых соответствуют электронной конфигурации атома криптона. |
Ответ: 23
| Задание 2. Из указанных в ряду химических элементов выберите три р-элемента. Расположите выбранные элементы в порядке уменьшения их валентности в летучих водородных соединениях. Запишите номера выбранных элементов в нужной последовательности. |
Ответ:
| Задание 3. Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в кислородсодержащих анионах может быть одинаковой. Запишите в номера выбранных элементов. |
Ответ: 14
| Задание 4. Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную полярную связь. 1) гидроксид натрия 2) нитрид натрия 3) хлорид бария 4) бромоводород 5) оксид кремния Запишите в поле ответа номера выбранных соединений. |
Ответ: 15
| Задание 5. | Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. соответствие между формулой соли и типом гидролиза. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) HClO3 Б) AlOH(NO3 В) Ba(CH3COO)2 | 1) кислая соль 2) основная соль 3) средняя соль 4) кислота |
Ответ: 423
| Задание 6. Из предложенного перечня выберите два вещества, с каждым из которых реагирует калий. 1) водород 2) хлорид лития 3) вода 4) сульфат натрия 5) натрий Запишите в поле ответа номера выбранных соединений. |
Ответ: 13
| Задание 7. Вещество Х разделили на две пробирки. В первую пробирку добавили гидроксид калия, во вторую добавили раствор слабого электролита Y. В обеих пробирках выпал осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) KF 2) KHCO3 3) NH3·H2O 4) Mg3(PO4) 2 5) Fe2(SO4)3 Запишите в таблицу номера выбранных веществ под соответствующими буквами. |
Ответ: 53
| Задание 8. | К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Na2SiO3 Б) CuO В) HCl Г) FeCl3 | 1) CaBr2, CO2(р—р), HNO3 2) NH3, CO, HBr 3) Br2, H2, ZnO 4) LiOH, NaOH, NaHCO3 5) Ba(OH)2, Pb(NO3)2, O2 |
Ответ: 1244
| Задание 9. | Установите соответствие между веществом и продуктами его разложения. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Fe(NO3)3 Б) NaHCO3 В) Fe(NO3)2 Г) NH4NO3 | 1) Fe2O3, NO2, O2 2) Na2CO3, CO2, H2O 3) FeO, NO2, O2 4) N 5) Na2O, CO2, H2O |
Ответ: 1214
| Задание 10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y. 1) AgNO3 2) NH3 3) N2 4) N2O 5) Ca(NO3)2 |
Ответ: 21
| Задание 11. | Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| A) Этиленгликоль Б) Изопрен В) Триолеат глицерина Г) Дибутиловый эфир | 1) сложные эфиры 2) простые эфиры 3) спирты 4) углеводороды |
Ответ: 3412
| Задание 12. Выберите, в каких соединениях только один атом углерода находится в состоянии sp3-гибридизации. 1) толуол 2) стирол 3) фенол 4) этанол 5) этаналь Запишите в поле ответа номера выбранных веществ. |
Ответ: 15
| Задание 13. Из предложенного перечня выберите вещества, которые реагируют с водным раствором перманганата калия. 1) толуол 2) ацетилен 3) изобутан 4) бензол 5) метан Запишите в поле ответа номера выбранных веществ. |
Ответ: 12
| Задание 14. Из предложенного перечня выберите вещества, с которыми реагирует и бензальдегид, и пропеновая кислота. 1) СuO 2) H2 3) Cu(OH)2 4) HCl 5) Ag Запишите в поле ответа номера выбранных веществ. |
Ответ: 23
| Задание 15. Из предложенного перечня выберите два вещества, с которыми реагирует анилин. 1) аммиак 2) хлорид аммония 3) хлороводород 4) гидроксид натрия 5) хлорэтан Запишите в поле ответа номера выбранных веществ. |
Ответ: 35
| Задание 16. | Установите соответствие между названием реакции и продуктом, который преимущественно образуется в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| А) гидратация бутина-1 Б) дегидрохлорирование 2-бромбутана В) гидратация бутина-2 Г) дегидрогалогенирование 2,2-дибромбутана | 1) бутанол-2 2) бутанон 3) пропанол-1 4) бутен-2 5) бутин-1 6) бутин-2 7) пропанол-2 |
Ответ: 2426
| Задание 17. | Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
 | 1) пропан 2) бутан 3) этан 4) этен 5) пропен 6) уксусная кислота |
Ответ: 6343
| Задание 18. Задана следующая схема превращений веществ: метан → Х → этаналь → Y → пропилацетат Определите, какие из указанных веществ являются веществами X и Y. 1) ацетилен 2) бромметан 3) этилен 4) муравьиный альдегид 5) уксусная кислота Запишите в поле ответа номера выбранных веществ. |
Ответ: 15
| Задание 19. Из предложенного перечня веществ выберите два, взаимодействие которых с концентрированной серной кислотой является окислительно-восстановительной реакцией. 1) фосфин 2) гидроксид железа (III) 3) оксид меди (II) 4) гидроксид натрия 5) оксид меди (I) Запишите в поле ответа номера выбранных веществ. |
Ответ: 15
| Задание 20. Из предложенного перечня выберите два вещества, на скорость реакции между которыми оказывает влияние давление. 1) оксид меди (II) 2) раствор серной кислоты 3) оксид кальция 4) водород 5) соляная кислота Запишите в поле ответа номера выбранных веществ. |
Ответ: 14
| Задание 21. | Установите соответствие между схемой реакции и свойством элемента железа, которое он проявляет в этой реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| СХЕМА РЕАКЦИИ | СВОЙСТВО ЖЕЛЕЗА |
| А) FeO + Cl2 + KOH → Fe(OH)3 + KCl Б) Fe2O3 + CO → FeO + CO3 В) FeO → Fe + Fe2O3 | 1) является и окислителем, и восстановителем 2) является окислителем 3) является восстановителем 4) не проявляет окислительно-восстановительных свойств |
Ответ: 321
| Задание 22. | Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaF Б) K2CO3 В) CuSO4 Г) CuBr2 | 1) металл и галоген 2) водород и кислород 3) металл и кислород 4) водород и галоген 5) металл и водород 6) водород и галоген |
Ответ: 2231
| Задание 23. | Установите соответствие между названием соли и средой раствора этой соли. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| НАЗВАНИЕ СОЛИ | СРЕДА РАСТВОРА |
| А) хлорид цинка Б) сульфат натрия В) нитрит калия Г) фенолят натрия | 1) нейтральная 2) кислая 3) щелочная |
Ответ: 2133
| Задание 24. | Установите соответствие между способом воздействия на систему:
и направлением смещения химического равновесия в результате этого воздействия. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры Б) добавление твердого KCNS В) добавление твердого FeCl3 Г) повышение давления | 1) в сторону прямой реакции 2) в сторону обратной реакции 3) практически не смещается |
Ответ: 2113
| Задание 25. | Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАГЕНТ |
| А) KOH и K2SO3 Б) KClO и HClO3 В) K2Cr2O7 и Br2 Г) NaCl и BaCl2 | 1) серная кислота 2) углекислый газ 3) сульфат бария 4) гидроксид натрия 5) фенолфталеин |
Ответ: 1541
| Задание 26. | Установите соответствие между областью применения и веществом, которое используется в этой области. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
| ОБЛАСТЬ ПРИМЕНЕНИЯ | ВЕЩЕСТВО |
| А) производство удобрений Б) производство фосфора В) выплавка чугуна | 1) HCl 2) Fe2O3 3) Ca3(PO4)2 4) ZnS |
Ответ: 332
| Задание 27. Определите массу 14 %-ного раствора соли, при добавлении к которому 10 г воды образуется раствор с массовой долей 8%. (Запишите число с точностью до десятых) |
Ответ: 13,3
| Задание 28. Определите количество теплоты (кДж), которое выделится при сгорании 11,2 л угарного газа (при н.у.) в соответствии с термохимическим уравнением: 2CO(г) + O2(г) = 2CO2(г) + 566 кДж |
Ответ: 141,5
| Задание 29. Вычислите массу оксида кремния (IV), который вступит в реакцию со фтором, если в ходе реакции выделилось 11,2 л кислорода (при н.у.). |
Уравнение реакции:
SiO2 + 2F2 = SiF4 + O2
Количество вещества кислорода: n(O2) = 11,2/22,4 = 0,5 моль
n(SiO2) = n(O2) = 0,5 моль
m(SiO2) = 0,5·60 = 30 г
Ответ: 30 г.
| Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид хрома (VI), гидроксид железа (II), азотная кислота, ацетат серебра (I), оксид бария, сульфат калия. |
| Задание 30. Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением бурого газа и образованием соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель, и запишите уравнение этой реакции. |
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
Fe+2 –1e = Fe+3
N+5 + 1e = N+4
Fe(OH)2 (за счет Fe+2) — восстановитель
HNO3 (за счет N+5) — окислитель
| Задание 31. Из предложенного перечня веществ выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. |
CH3COOAg + HNO3 = AgNO3 + CH3COOH
CH3COO– + Ag+ + H+ + NO3– = Ag+ + NO3– + CH3COOH
CH3COO– + H+ = CH3COOH
| Задание 32. Натрий сожгли в избытке кислорода. Полученное вещество растворили в растворе перманганата калия, подкисленного серной кислотой. Выделившийся газ смешали с пиритом. Полученное твердое вещество поместили в раствор йодоводородной кислоты. Напишите уравнения четырёх описанных реакций. |
2Na + O2 = Na2O2
5Na2O2 + 2KMnO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 5Na2SO4 + 8H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
| Задание 33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ. |
CH2Br-CH2-CH2-CH3 + KOH → CH2=CH-CH2-CH3+ KBr + H2O
CH2=CH-CH2-CH3 + HBr → CH3-CHBr-CH2-CH3
2CH3-CHBr-CH2-CH3 + 2Na → CH3-CH2-CH(CH3)—CH(CH3)-CH2-CH3 + 2NaBr


| Задание 34. Смесь меди и оксида меди (II) с массовой долей атомов меди 96% растворили в избытке концентрированной серной кислоты массой 472 г. При этом наблюдалось выделение газа. Минимальная масса 10%-го раствора NaOH, который может прореагировать с выделившимся газом, равна 200 г. Определите массовую долю соли в растворе, полученном растворением исходной смеси в серной кислоте. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). |
Пусть n(Cu) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди nат.(Cu) = (х+y) моль.
Масса атомов меди: mат.(Cu) = nат.(Сu)·M(Cu) = 64(x + y) г.
Масса чистой меди: m(Cu) = n(Cu)·M(Cu) = 64x г.
Масса оксида меди (II): m(CuO) = n(CuO)·M(CuO) = 80у г.
Масса смеси: mсм = m(Cu) + m(CuO) = (64х + 80у) г
Получаем выражение:
64(x + y)/(64х + 80у) = 0,96
Преобразуя приведённое выше равенство, получаем х = 5у.
Далее протекают реакции:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
CuO + H2SO4 = CuSO4 + H2O
Масса и количество гидроксида натрия:
m(NaOH) = mр-ра(NaOH)·ω(NaOH) = 200·0,1 = 20 г
n(NaOH) = m(NaOH)/M(NaOH) = 20/40 = 0,5 моль
Если количество щелочи минимально, то протекает реакция с образованием кислой соли:
SO2 + NaOH = NaHSO3
По уравнению третьей реакции:
n(SO2) = n(NaOH) = x = 0,5 моль
y = 1/5x = 0,1 моль
Масса чистой меди: m(Cu) = n(Cu)·M(Cu) = 64·0,5 = 32 г.
Масса оксида меди (II): m(CuO) = n(CuO)·M(CuO) = 80·0,1 = 8 г.
Масса диоксида серы: m(SO2) = n(SO2)·M(SO2) = 64·0,5 = 32 г.
Количество и масса сульфата меди (II):
n(CuSO4) = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = n(CuSO4)·M(CuSO4) = 160·0,6 = 96 г.
Масса раствора, полученного растворением исходной смеси в серной кислоте:
mр-ра = m(Cu) + m(CuO) + mр-ра(H2SO4) — m(SO2) = 32 + 8 + 472 — 32 = 480 г
Массовая доля сульфата меди (II) в растворе:
ω(CuSO4) = m(CuSO4)/mр-ра = 96/480 = 0,2 или 20%
Ответ: ω(CuSO4) = 20%
| Задание 35. Вещество А содержит 9,3% углерода, 10,85% азота, 24,8% серы, 49,6% кислорода по массе. Известно, что вещество А получают восстановлением вещества В цинком в присутствии серной кислоты. На основании данных условия задания:
|
Пусть формула вещества А CxHyNzStOh
Пусть масса вещества А равна 100 г m(А) = 100 г, тогда:
m(C) = 9,3 г, n(C) = 0,775 моль
m(N) = 10,85 г, n(N) = 0,775 моль
m(S) = 24,8 г, n(S) = 0,775 моль
m(O) = 49,6 г, n(O) = 3,1 моль
m(H) = 5,43 г, n(H) = 5,43 моль
Получаем выражение:
х:y:z:t:h = 0,775:5,43:0,775:0,775:3,1 или
х:y:z:t:h = 1:7:1:1:4
или CH7NSO4
Данной формуле и условию задачи соответствует гидросульфат метиламмония:
[CH3-NH3]HSO4
Вещество В — нитрометан
Реакция получения вещества А из вещества В:
CH3-NO2 + 3Zn + 4H2SO4 → [CH3-NH3]HSO4 + 3ZnSO4 + 2H2O
Ответ: [CH3-NH3]HSO4
Пробный вариант 2. ЕГЭ 2020 по химии
Скачать Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 2
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Li; 2) Cs; 3) Ba; 4) O; 5) F.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, в атомах каких из указанных элементов связь валентных электронов с ядром наиболее слабая. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения радиуса их простых ионов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые НЕ проявляют высшую степень окисления, равную номеру группы. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два соединения, которые имеют немолекулярное строение.
1) хлорид иода (III)
2) иод
3) гидроксид калия
4) уксусная кислота
5) красный фосфор
Запишите в поле ответа номера выбранных соединений.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) Ca | 1) соли средние |
| Б) CaHPO4 | 2) металлы |
| В) He | 3) благородные газы |
| 4) соли кислые |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид кремния (IV).
1) P2O5
2) CaCO3
3) H2O
4) HF
5) HCl
Запишите в поле ответа номера выбранных веществ.
- В одну из пробирок с раствором хлорида меди (II) добавили раствор сильного электролита Х, а в другую – раствор слабого электролита Y. В результате в каждой из пробирок НЕ наблюдали видимых изменений. Из предложенного перечня выберите вещества Х и Y, которые могут подходить под описание выше.
1) нитрат калия
2) нитрат серебра (I)
3) гидроксид калия
4) фосфорная кислота
5) уксусная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между названиями оксидов и реагентами, с каждым из которых они могут взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ОКСИДА | РЕАГЕНТЫ |
| А) оксид углерода (IV) | 1) C, HNO3, Cu |
| Б) оксид меди (II) | 2) Al, Cr2O3, H2O |
| В) оксид бария | 3) Mg, Sr(OH)2, H2O |
| Г) оксид углерода (II) | 4) KOH, Cl2, O2 |
| 5) CrO, CO2, H2O | |
| 6) H2O, SiO2, HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) KOH + SO2 (изб.) | 1) KOH + H2 |
| Б) KOH (изб.) + SO2 | 2) K2SO3 + H2O |
| В) K2O + H2O | 3) KHSO3 |
| Г) KOH + H2SO4 | 4) K2SO4 + H2O |
| 5) KHSO4 | |
| 6) KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) оксид алюминия
2) бромоводород
3) бромноватистая кислота
4) бромид алюминия
5) тетрагидроксоалюминат натрия
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) NH2 – CH2 – COOH Б) C4Н8 В) C3H6O2 | 1) органическая кислота 2) углеводород 3) амфотерное вещество 4) амин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, которые могут существовать в виде цис- и транс-изомеров.
1) этилен
2) 2-метилбутадиен-1,3
3) бутен-1
4) бутен-2
5) пентадиен-1,3
Запишите в поле ответа номера выбранных веществ.
- При взаимодействии вещества C3H6 с хлором при определённых учсловиях выделился хлороводород. Из предложенного перечня выберите класс исходного вещества и тип реакции.
1) алканы
2) алкены
3) алкины
4) замещения
5) присоединения
Запишите в поле ответов номера выбранных ответов.
- Из предложенного перечня выберите две пары веществ, в которых каждое из веществ реагирует с этанолом.
1) Na и HCOOH
2) NaOH и KBr
3) CuO и O2
4) CH4 и C2H6
5) Na2O и Al2O3
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два вещества, с которыми НЕ реагирует рибоза.
1) изопропилбензол
2) азотная кислота (конц.)
3) 1,3,5-трибромбензол
4) этанол (Н+)
5) уксусный ангидрид
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CH2COOCH3
2) CH3CH2COOH
3) CH3CH2CH2Br
4) CH3CH2CH2OH
5) CH3COOCH2CH3
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня выберите две схемы превращений, которые можно осуществить последовательно используя реакции ОВР, обмена и разложения.
1) Fe → FeSO4 → FeCl2 → Fe
2) Cu → Cu(NO3)2 → Cu(OH)2 → CuO
3) BaO → Ba(OH)2 → Ba(HCO3)2 → CO2
4) Zn(NO3)2 → Zn → K2[Zn(OH)4] → ZnSO4
5) Al → AlCl3 → Al(OH)3 → Al2O3
Запишите в поле ответа номера выбранных схем превращений.
- Из предложенного перечня выберите два вещества, которые будут взаимодействовать с водой с наибольшей скоростью.
1) железо
2) магний
3) натрий
4) алюминий
5) барий
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между химическим превращением и окислительно-восстановительными свойствами кислорода, которые он проявляет в этом превращении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА |
| А) растворение песка в фтороводородной кислоте | 1) является только восстановителем |
| Б) взаимодействие фтора с водой | 2) является и окислителем, и восстановителем |
| В) растворение хлора в гидроксиде калия | 3) не проявляет окислительно-восстановительных свойств |
| 4) является только окислителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) сульфид натрия | 1) сера и водород |
| Б) сульфат цинка | 2) калий и сера |
| В) хлорид цинка | 3) водород, хлор, цинк |
| Г) фторид цинка | 4) кислород, цинк, водород |
| 5) цинк и фтор | |
| 6) цинк и сернистый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) HCOOK | 1) гидролизуется по катиону |
| Б) K2S | 2) гидролизуется по аниону |
| В) Al2S3 | 3) гидролизу не подвергается |
| Г) NH4NO2 | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при понижении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) FeO (тв) + CO (г) ↔ Fe (тв) + CO2 (г) | 1) смещается в сторону продуктов реакции |
| Б) 2SO2 (г) + O2 (г) ↔ 2SO3 (г) | 2) смещается в сторону исходных веществ |
| В) 2CO2 (г) ↔ 2CO (г) + O2(г) | 3) практически не смещается |
| Г) H2 (г) + Br2 (г) ↔ 2HBr (г) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между двумя веществами, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) 2-гидрокси-2-метилпропановая кислота и молочная кислота | 1) Cu(OH)2 |
| Б) изопрен и пентан | 2) NaHCO3/H2O |
| В) этанол и пропандиол-1,2 | 3) KMnO4/H+ |
| Г) метанол и глицерин | 4) FeCl3 |
| 5) NaNO3/H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) SiO2 | 1) производство красителей |
| Б) C2H2 | 2) сварка и резка металлов |
| В) H2O2 | 3) производство стекла |
| 4) антисептик |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите массу бромида калия (в граммах), которую следует растворить в 180,0 г раствора с массовой долей этой соли 8%, чтобы массовая доля бромида калия возросла в 1,5 раза. (Запишите число с точностью до сотых.)
- Термохимическое уравнение реакции разложения известняка имеет вид:
CaCO3 (тв) → CaO (тв) + CO2 (г) – 157 кДж.
Вычислите, сколько теплоты (в кДж) затрачивается на разложение 1 кг известняка. (Запишите число с точностью до целых.)
- Вычислите массу железа (в граммах), необходимого для окисления до Fe3O4 кислородом объёмом 89,6 л (н.у.). (Запишите число с точностью до целых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфат натрия, пероксид водорода, карбонат кальция, иодноватая кислота, хлорид бария, гидроксид калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка тёмно-фиолетового цвета и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите нерастворимую соль и вещество, которое вступает с этой нерастворимой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Питьевую соду обработали избытком соляной кислоты. Выделившийся газ пропустили над раскалённым углём. В результате чего образовался новый газ, который затем смешали с сернистым газом при нагревании. Затем твёрдый продукт реакции полностью растворили в концентрированном растворе гидроксида натрия. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- В раствор нитрата серебра (I) массой 250 г поместили медную пластинку массой 80 г. После полного вытеснения серебра пластинку вынули, высушили и взвесили. Её масса увеличилась на 3,8%. Оставшийся раствор подвергли электролизу с инертными электродами до полного расходования соли. Рассчитайте массовую долю растворённого вещества в конечном растворе после электролиза (растворимостью газов пренебречь). В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- Неизвестное органическое вещество содержит 17,98% углерода, 2,25% водорода и 79,77% хлора по массе. Известно, что в этом веществе все атомы хлора находятся у одного атома углерода и это вещество подвергается щелочному гидролизу.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение щелочного гидролиза вещества в присутствии избытка гидроксида калия (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 23 |
| 2 | 154 |
| 3 | 45 |
| 4 | 35 |
| 5 | 243 |
| 6 | 24 |
| 7 | 15 |
| 8 | 3164 |
| 9 | 3264 |
| 10 | 24 |
| 11 | 321 |
| 12 | 45 |
| 13 | 24 |
| 14 | 13 |
| 15 | 13 |
| 16 | 2563 |
| 17 | 2116 |
| 18 | 12 |
| 19 | 25 |
| 20 | 35 |
| 21 | 313 |
| 22 | 1434 |
| 23 | 2244 |
| 24 | 3213 |
| 25 | 3311 |
| 26 | 324 |
| 27 | 8,18 |
| 28 | 1570 |
| 29 | 336 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2HIO3 + 5H2O2 → I2↓ + 5O2↑ + 6H2O
1 2I+5 + 10ē → I20
5 2O-1 – 2ē → O20
Пероксид водорода или кислород в степени окисления -1 является восстановителем.
Иодноватая кислота или иод в степени окисления +5 – окислителем
Задание 31
Вариант ответа:
CaCO3 + 2HIO3 = Ca(IO3)2 + H2O + CO2
CaCO3 + 2H+ + 2IO3— = Ca2+ + 2IO3— + H2O + CO2
CaCO3 + 2H+ = Ca2+ + H2O + CO2
Задание 32
Вариант ответа:
NaHCO3 + HCl = NaCl + H2O + CO2
CO2 + C = 2CO
CO + SO2 = 2CO2 + S
3S + +6NaOH = Na2SO3 + 2Na2S + 3H2O
или 4S + 6NaOH = Na2S2O3 + 2Na2S + 3H2O
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 1%
Задание 35
Найдем соотношение количества вещества углерода, водорода и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 17,98/12 = 1,5
n(Сl) = 79,77/35,5 = 2,25
n(H) = 2,25/1 = 2,25
Соотношение углерода к хлору и водороду 1,5 : 2,25 : 2,25 = 1 : 1,5 : 1,5 = 2 : 3 : 3
Молекулярная формула вещества C2H3Cl3
Структурная формула
Уравнение щелочного гидролиза в избытке гидроксида калия:
CH3-CCl3 + 4KOH = CH3COOK + 3KCl + 2H2O.
Также вы можете скачать:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
| На практике мы иногда сталкиваемся с проблемами, связанными с определением количественной оценки веществ, вступающих в химическую реакцию, с оценкой количества получаемых в этой реакции продуктов, веществ, представляющих для нас интерес. Хозяева, безусловно, часто определяют процентное содержание вещества в растворе и количество того или иного вещества, которое вам нужно принять. Как рассчитать количество вещества, которое будет нейтрализовано или нейтрализовано другим веществом? Сколько газа будет выделяться, если к раствору лимонной кислоты добавить соду? Как приготовить, например, 5% раствор перманганата калия, и много других задач, с которыми сталкиваются в повседневной практике. Цель этого статьи Решение задач по химии — показать, как можно легко решить эти задачи, не прибегая к сложным химическим расчетам и применяя только общие знания математики и немного общих знаний по химии. Что нужно знать, чтобы решать химические задачи Кстати, что нужно знать для решения простых задач по химии : Что ж, давайте посмотрим на самую распространенную задачу, как определить процентное содержание вещества в растворе и сколько вам нужно принять это вещество и раствор. Химическое задание 1: Решение: какой% вещества находится в растворе? В чистых веществах содержится в 100 мл раствора. Раствор состоит из чистого вещества и растворителя, поэтому 100 мл раствора будет состоять из 5 г чистых веществ (уксус) и 95 мл растворителя (вода) , что важно помнить! % = (М вещество ) / (М раствор ) 100. В задании у нас есть 20% раствор уксусной кислоты. Найти массу нового раствора, полученного путем добавления воды к 20% раствору. Из формулы получаем: (М вещества ) /% х 100, то есть 20 мл / 5 х 100 = 400 мл. Мы получили 400 мл раствора, содержащего 20 г чистых веществ (уксус), затем 400 мл — 20 = 380 мл воды в новом растворе. Но не забывайте, что 20% раствор содержал воду, и это было 80 г воды на 100 мл (95 + 5 = 100). Поэтому, чтобы разбавить нашу 20% уксусную кислоту, содержащую 80 мл воды, нам нужно на каждые 100 мл 20% исходного раствора добавить еще 380 — 80 = 300 мл чистой воды. — если вы не используете формулу, вы сделаете пропорцию: Задача определения количества продуктов реакции или реагентов. Предположим, это условие. Нам нужно нейтрализовать кислую среду. Вы случайно налили 200 мл соляной кислоты (HCl), и у вас есть промывочная сода (Na 2 CO 3 ) (или ее второе название — кальцинированная сода). Теперь: сколько нужно взять моющую соду, чтобы нейтрализовать 200 мл соляной кислоты !? напишите химическую реакцию соляной кислоты с промывкой соды: Такая химическая задача может быть немного сложной, учитывая концентрацию кислоты. В этом случае нам нужно рассчитать, сколько чистого вещества находится в растворе (как в предыдущем задании 1), а затем составить пропорцию с количеством соляной кислоты. Но в любом случае, даже если кислота имеет более низкую концентрацию, наш раствор удовлетворит это решение, потому что в этом случае сода будет забрана в избытке! Химическое задание 3 Химическое задание 4 Но, Вы когда-нибудь читали упаковку продуктов срок годности продуктов ! Для уверенности! Существует дата изготовления и срок годности при определенной температуре. Но не всегда возможно хранить продукты при рекомендуемой температуре. Сейчас! Можно определить Срок годности , если известны условия рекомендуемого хранения. Итак, задание по химии : |
экзаменов | ACS экзамены
Испытания, которые проходят пробные испытания весной / в начале лета 2020 года:
- GC20S — 2020 Экзамен по общей химии для второго семестра стандартной двухчленной последовательности по общей химии
- GC21C — 2021 Концептуальный экзамен по общей химии Полный год экзамен
- GC21CF -2021 Концептуальный экзамен по общей химии Экзамен первого года обучения
- GC21CS -2021 Концептуальный экзамен по общей химии Экзамен второго года обучения
- IN20 — 2020 Экзамен по неорганической химии для курса старшей ступени по неорганической химии (продолжение тестирования)
- IN21D — 2021 Основы неорганической химии, экзамен на уровне второкурсника (продолжение тестирования)
- Ph29 — 2019 Экзамен по физической химии: экзамены по динамике и термодинамике (продолжение тестирования)
- PL19 — 2019 Полимерные экзамены (продолжение испытаний)
Мы ожидаем пробные дополнительные экзамены, начиная с осени 2019 года, в том числе: TBA
Новые версии экзаменов ACS были выпущены в 2019 году:
- HS19 — 2019 год Экзамен для старшеклассников по первому курсу химии в старших классах
- GC19 — 2019 Экзамен по общей химии за полный год стандартной двухчленной последовательности по общей химии
- GC19Q1 — 2019 Экзамен по общей химии за первый квартал
- GC19Q2 — 2019 Экзамен по общей химии за второй квартал
- GC19Q3 — 2019 Третий квартал экзамены по общей химии
- CS19 — 2019 Экзамен по химической безопасности и гигиене труда для студентов, заканчивающих стандартный лабораторный курс по органической химии
- OR20 — 2020 Экзамен по органической химии на полный год стандартной двухчленной последовательности по органической химии
Выберите категорию ниже, чтобы просмотреть доступные экзамены.
биохимия
Заголовок: Экзамен по биохимии 2017 года — Экзамен по биохимии 2017 года включает экзамен из 60 пунктов, предназначенный для использования в конце 2-семестровой последовательности (заданный как основной + расширенный экзамен).
Заголовок: Экзамен по биохимии 2012 года — Биохимический экзамен 2012 года включает экзамен из 60 пунктов, предназначенный для использования в конце 2-семестровой последовательности (заданный как основной + расширенный экзамен).
Заголовок: Экзамен по биохимии 2007 года — Биохимический экзамен 2007 года включает в себя полный экзамен из 60 пунктов, предназначенный для использования в конце 2-семестровой последовательности с нормами, установленными также для 1-семестрового использования.
Химическое здоровье и безопасность
Генеральный Organic-биохимический
Высшая школа химии
Заголовок: Экзамен по химии в средней школе 2016 года — Традиционный экзамен для первого курса средней школы по химии.Доступны две формы с разными порядками вопросов.
Заголовок: Экзамен средней школы 2013 года — Традиционный экзамен для первого курса средней школы по химии. Доступны две формы с разными порядками вопросов.
Заголовок: Экзамен по химии в средней школе 2011 года — Традиционный экзамен для первого курса средней школы по химии.Доступны две формы с разными порядками вопросов.
Заголовок: 2009 химический экзамен средней школы — Традиционный экзамен для первого курса средней школы по химии. Доступны две формы с разными порядками вопросов.
Физическая химия
Заголовок: Модульный экзамен по физической химии 2014 года — Модульные разделы Термодинамика, Квантовая, Кинетика, Динамика и Статистическая механика, которые позволяют более индивидуализированные группы тем для теста по физической химии.
Специальная серия, включая экзамены для старших (DUCK)
,University of Waterloo’s Chem 13 News Exam и Avogadro Exam | Химия
Химия старшеклассников и учителей , это возможность проверить свои химические навыки и знания с другими учениками и вузами по всей Канаде и по всему миру.
Ежедневные экзамены Chem 13 News и Avogadro — это сложные онлайн-экзамены, проводимые более 6000 учениками 11 и 12 классов средней школы по химии каждый май. Они состоят из 40 вопросов с несколькими вариантами ответов, написанных в течение 75-минутного экзаменационного периода.
Все участники имеют право на сертификат от Университета Ватерлоо. Лучшие ученики из Северной Америки и их школы получают табличку с ограниченным тиражом с изображением элемента нашего плаката Timeline of Elements.
Экзамен Chem 13 News предназначен для учеников классов средней школы, изучающих химию, на втором курсе средней школы по химии. Темы включают: органическая химия, равновесия, кинетика, окисление-восстановление, связь, структура, реакции, растворы и газы.
Экзамен Avogadro рассчитан на учеников 11000 классов старших классов на первом курсе средней школы по химии. Темы включают в себя: структура вещества, связи, реакции, растворы и газы. Тест включает в себя несколько пробных и требовательных вопросов по некоторым из основных тем химии средней школы.
Результаты экзаменов и награды
Chem 13 Новости и результаты экзамена Avogadro доступны для учителей онлайн. Преподаватели могут увидеть, как их собственные студенты выполнили экзамен в целом, а также по каждому вопросу относительно всех студентов, которые написали экзамен.Мы также публикуем сводку результатов наших последних экзаменов, а также информацию о результатах экзаменов для лучших учеников.
Обратите внимание, : результаты экзамена не используются в качестве критерия для поступления в университет. Мы не показываем и не даем результатов ни одной приемной комиссии.
Вопросы
Если у вас есть какие-либо вопросы, пожалуйста, дайте нам знать. Электронная почта Кэти Джексон на [email protected].
,



Leave A Comment