Тепловой эффект химической реакции. Термохимические уравнения.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Термохимические расчёты
Термохимические расчёты
Огромное число химических реакций используется для получения энергии. К ним относятся, например, реакции сгорания различных топлив, для оценки которых требуется знать количество выделяемой тепловой энергии (тепловых эффектов).
Тепловые эффекты реакций определяют как экспериментально, так и с помощью термохимических расчётов, основанных на законе Гесса.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
См. также часть I. Тепловой эффект реакции Это можно показать на примере реакции горения метана:Задача 1. Рассчитайте количество теплоты, выделившейся при сгорании 0,25 моль метана, используя термохимическое уравнение реакции горения метана:
СН4 + 2О2 = СО2 + 2Н2О + 890 кДж Краткие условия: РешениеПри сгорании 1 моль CH
- Q = 0,25 моль · 890 кДж/1 моль = 223 кДж.
Ответ: Q = 223 кДж.
Задача 2. Известны стандартные молярные теплоты образования Qобр (кДж/моль) метана (74,9), СО (110), О2 (0) и воды (285,8). Вычислите тепловой эффект реакции неполного сгорания 1 моль метана до оксида углерода (II).
РешениеЗапишем уравнение реакции неполного сгорания метана.
- 2СН4 + 3О2 = 2СО + 4Н2О + Q
- Qреакции = ΣQобр.(продуктов) ΣQобр.(исх.веществ)
- Qреакции = 2Qобр(CO) + 4Qобр(H2O) – 2Qобр(CH4) – 3Qобр(O2) =
= 2 · 110 + 4 · 285,8 – 2 · 74,9 – 0 = 1213,4 кДж.
Ответ: Qреакции = 1213,4 кДж.
Задачи на термохимические уравнения | Подготовка к ЦТ и ЕГЭ по химии
Предлагаем вам задания-аналоги части В с подробными видео-объяснениями из ЦТ, РТ и ДРТ всех лет по теме: Термохимические уравнения.
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то у вас появится ссылка красного цвета, а если верный — то зелёного цвета. С помощью ссылки вы можете просмотреть подробное видео-объяснение этого задания, но помните, что ссылка неактивная, поэтому для просмотра видео-объяснения вам необходимо скопировать эту ссылку и вставить на новую страницу и нажать клавишу Enter, как результат у вас откроется видео на YouTube). 
1. Демо ЦТ по химии 2015/2016. В8. Химическая реакция протекает согласно термохимическому уравнению:
BaO(т) + SO
2(г) = BaSO3(т) + 65кДж. Установите соответствие:Количественные данные | Количество выделившейся теплоты |
А. m(BaO) = 61,2 гБ. V(SO2) = 14,56 дм3В. m(BaSO3) = 26,04 гГ. N(O) в BaSO3 = 5,418∙1024 | 1. 42,252. 7,83. 264. 195 |
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность, например А2Б3В1Г4.
2. ДРТ 2018/2019. В4. При сжигании метанола в кислороде, которое протекает по термохимическому уравнению 2CH
3OH + 3O2 = 2CO2 + 4H2O + 1452 кДж, выделилось 174,24 кДж теплоты, причём непрореагировавшим остался кислород объёмом (н.у.) 11,2 дм3. Рассчитайте массовую долю (%) кислорода в первоначальной смеси.3. РТ по химии 2015/2016 (3 этап). В10. Разложение сульфита бария протекает согласно термохимическому уравнению:
BaSO
3 (т) = BaO (т) + SO2(г) –599,04кДж.Для разложения образца сульфита бария необходимо 46,8 кДж теплоты. Выделившейся при этом газ был полностью поглощён раствором гидроксида натрия массой 160 г с массовой долей щёлочи 1,75%. Рассчитайте массовую долю (%) соли в полученном растворе.
4. РТ 2017/2018 (3 этап). В3. Превращение метана в метанол в промышленности осуществляют, сжигая часть метана до углекислого газа и используя выделяющееся тепло для превращения остальной части метана:
СH
4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + 890 кДж,2СH
4(г) + О2(г) = 2СН3ОН(г) – 174 кДж.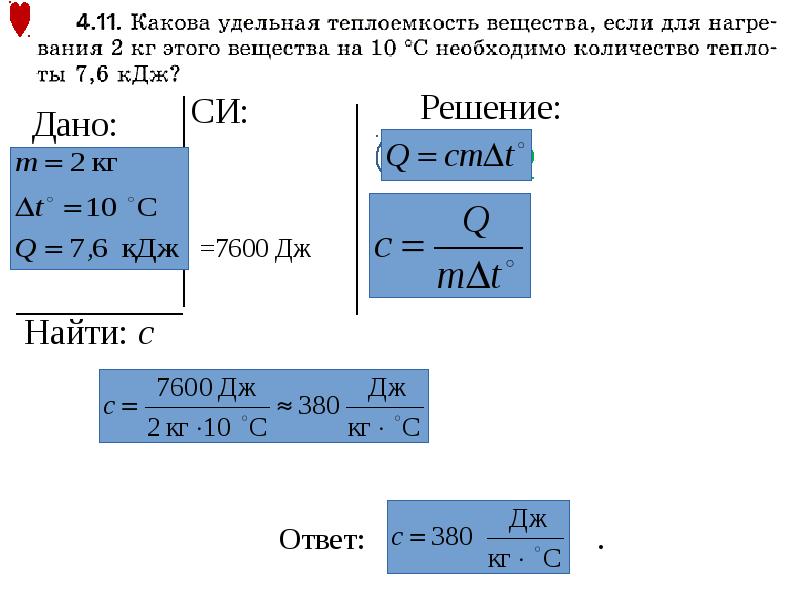
Рассчитайте, какой максимальный объём метанола (дм
3, в условиях опыта метанол – газ) можно получить из метана объёмом (н.у.) 2 м3 в этих условиях.5. РТ 2018/2019 (1 этап). В11. При полном сгорании ацетилена массой 31,2 г выделяется 1566 кДж теплоты, а при полном сгорании сероводорода массой 30,6 г – 506,52 кДж. Рассчитайте количество теплоты (кДж), которое выделится при полном сгорании смеси ацетилена с сероводородом объёмом (н.у.) 33,6 дм
3, если объём ацетилена в 2 раза меньше объёма сероводорода.6. РТ 2018/2019 (2 этап). В10. Рассчитайте количество теплоты (кДж), которые выделилось в результате реакции, протекающей по уравнению 2Са (тв.) + О
2 (г.) = 2СаО (тв.) + 1274 кДж, если для реакции взяли кальций и кислород общей массой 121,04 г, но кислород весь не прореагировал, так как был в избытке и его оставшийся объёмом составил 29,456 дм3 (н.у.).7. РТ 2019/2020 (2 этап). В2. Рассчитайте молярную массу (г/моль) смеси этана и пропана, при сжигании которой массой 200 г выделяется 10230 кДж. Также известно, что тепловой эффект сжигания этана равен 1560 кДж/моль, а пропана – 2220 кДж/моль.Ответы:
1.
 А3Б1В2Г4
А3Б1В2Г42. 78
3. 4
4. 1822
5. 1215
6. 898
7. 36
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.

Термохимические уравнения | Задачи 1.11
Задача 1.11
Теплота образования оксида железа (III) равна 817 кДж/моль. Определите тепловой эффект реакции, в которой из 16,8 г железа и необходимого количества кислорода образовался Fe
1) 245,1кДж; 2) 2723кДж; 3) 122,55 кДж; 4) 367,65 кДж.
Дано: теплота образования оксида железа (III) равна: Qобр (Fe2О3) = 817 кДж/моль;
масса потраченного железа: m (Fe) = 16,8 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию оксида железа (III) из Fe и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед Fe
2Fe(ТВ) + 3/2О2(г) → Fe2О3(ТВ) + 817 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед Fe2О3 остался равен «1», коэффициент перед кислородом должен быть дробным (3/2).
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании Fe
Составляем пропорцию:
при использовании 16,8 г Fe выделяется х кДж (по условию)
при использовании 111,7 г Fe выделяется 817 кДж (по уравнению)
Ближе всего подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 817 кДж выделяется при использовании 111,7 г Fe. При использовании 16,8 г Fe выделяется х кДж, следовательно, можно составить пропорцию:
817 кДж выделяется при при использовании 16,8 г Fe
х кДж выделяется при использовании 111,7 г Fe
Подходит ответ № 3.
Ответ: Q = 122,88 кДж.
Задача 1.12
На каталитическое окисление 5 л оксида серы (IV) до оксида серы (VI) расходуется кислород объемом:
1) 2,5 л; 2) 5 л; 3) 7,5 л; 4) 10 л.
Дано: объем оксида серы (IV) (н.у.): V(SО2) = 5 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение:
В первую очередь необходимо составить уравнение реакции:
2SО2 + О2 = 2SО
п = 2 моль п =1 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а V(SO2) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 1.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л SO2 взаимодействуют с х л О2 (по условию)
44,8 л SО2 взаимодействуют с 22,4 л О2(по уравнению)
Получили тот же вариант ответа № 1.
Ответ: V(O
Задача 1.13
Объем кислорода, необходимый для сгорания 2 л пропана равен:
1) 2 л; 2) 4 л; 3) 6 л; 4) 10 л.
Дано:
объем пропана(н.у.): V(С3Н8) = 2 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение :
В первую очередь необходимо составить уравнение реакции:
2С3Н8 + 10О2 = 6СО2 + 8Н2О
n= 2 моль n =10 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а V(С3Н8) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 2 .10/2 = 10л.
Подходит ответ № 4.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
2 л С3Н8 взаимодействуют с х л О2 (по условию)
44,8 л С3Н8 взаимодействуют с 224 л О2(по уравнению)
Получили тот же вариант ответа № 4.
Ответ: V(O2) = 10л.
Расчеты по термохимическому уравнению | Химия ЕГЭ
Задача 1.
При сгорании 560 мл (н.у.) ацетилена согласно термохимическому уравнению:
2С2Н2(Г) + 5О2(г) = 4СО2(Г) + 2Н2О(Г) + 2602,4 кДж
выделилось:
1) 16,256 кДж; 2) 32,53кДж; 3) 32530 кДж; 4) 16265кДж
Дано:
объем ацетилена: V(С2Н2) = 560 мл.
Найти: количество выделившейся теплоты.
Решение:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
Небольшая хитрость, приводящая невнимательных учеников к неверному ответу № 3, заключалась в единицах измерения объема ацетилена. Объем, указанный в условии в миллилитрах, обязательно нужно было перевести в литры, так как молярный объем измеряется в (л/моль).
Изредка встречаются задачи, в которых термохимическое уравнение необходимо составить самостоятельно по значению теплоты образования сложного вещества.
Задача 1.2.
Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодействии алюминия с кислородом получено
25,5г А12О3.
1) 140кДж; 2) 209,5кДж; 3) 419кДж; 4) 838кДж.
Дано:
теплота образования оксида алюминия: Qобр (А12О3) = = 1676 кДж/моль;
масса полученного оксида алюминия: m(А12О3) = 25,5 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию образования оксида алюминия из А1 и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед А12О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
2А1(ТВ) + 3/2О2(г) → А12О3(ТВ) + 1676 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед А12О3 остался равен «1», коэффициент перед кислородом должен быть дробным.
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании 25,5 г А12О3:
Составляем пропорцию:
при получении 25,5 г А12О3 выделяется х кДж (по условию)
при получении 102 г А12О3 выделяется 1676 кДж (по уравнению)
Подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1676 кДж выделяется при образовании 1 моль А12О3. Масса 1 моль А12О3 составляет 102 г, следовательно, можно составить пропорцию:
1676 кДж выделяется при образовании 102 г А12О3
х кДж выделяется при образовании 25,5 г А12О3
Подходит ответ № 3.
Ответ: Q = 419кДж.
Задача 1.3.
При образовании 2 моль СuS из простых веществ выделяется 106,2 кДж теплоты. При образовании 288г СuS выделяется теплота количеством:
1) 53,1кДж; 2) 159,З кДж; 3) 212,4 кДж; 4) 26,6кДж
Решение:
Находим массу 2 моль СuS:
m(СuS) = n(СuS) . М(СuS) = 2 . 96 = 192 г.
В текст условия вместо значения количества вещества СuS подставляем массу 2 моль этого вещества и получаем готовую пропорцию:
при образовании 192 г СuS выделяется 106,2 кДж теплоты
при образовании 288 г СuS выделяется теплота количеством х кДж.
Подходит ответ № 2.
Второй вид задач можно решать как по закону объемных отношений, так и без его использования. Рассмотрим оба варианта решения на примере.
Рассмотрим оба варианта решения на примере.
Задачи на применение закона объемных отношений:
Задача 1.4.
Определите объем кислорода (н.у.), который потребуется для сжигания 5 литров угарного газа (н.у.).
1) 5 л; 2) 10 л; 3) 2,5 л; 4) 1,5 л.
Дано:
объем угарного газа (н.у.): VСО) = 5 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение :
В первую очередь необходимо составить уравнение реакции:
2СО + О2 = 2СО
n = 2 моль n =1 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а
V(CO) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 3.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л С02 взаимодействуют с х л О2 (по условию) 44,8 л СО2 взаимодействуют с 22,4 л О2(по уравнению):
Получили тот же вариант ответа № 3.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Тепловой эффект химических реакций. Эндо- и экзо-термические реакции. Решение задач.
Урок № 38 (5) Предмет химия класс 8 (а,б,в), дата 25.01.17
Тема урока: Тепловой эффект химических реакций. Эндо- иэкзо-термические реакции. Решение задач.
Цели урока: Дать учащимся понятия « поглощение теплоты», « выделение теплоты», « энергия», « эндо – и экзотермические реакции», « тепловой эффект химической реакции».
Обучающая: Научить учащихся решать задачи по термохимическим уравнениям реакций.;
Развивающая: способствовать развитию у учащихся логического мышления, умения анализировать и сравнивать, работать с дополнительной информацией;
Воспитывающая: продолжать воспитывать интерес к предмету, умение работать в коллективе, бережное отношение к природе (атмосфере).
Тип урока: комбинированный
Форма проведения: лекция, самостоятельная работа.
Методы : словесный, проблема, практический, объяснително-иллюстрационный,
Оборудование урока: учебные таблицы.
Ход урока:
Организационный момент:
приветствие, перекличка, рабочий настрой, мотивационный аспект начала урока.
2. Актуализация опорных знаний (Мобилизующее начало урока):
1. Рассказать о термохимических реакциях?
2.какие реакции называют эндотермическими?
3. какие реакции называют экзотермическими?
Основной этап урока (Познавательно-операционная часть урока):
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MqO — 1204 кДж
По условию 3 моля MqO — Q1
Отсюда
3 моль* 1204кДж
Q1
=
————————
= 1803 кДж
2моль
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.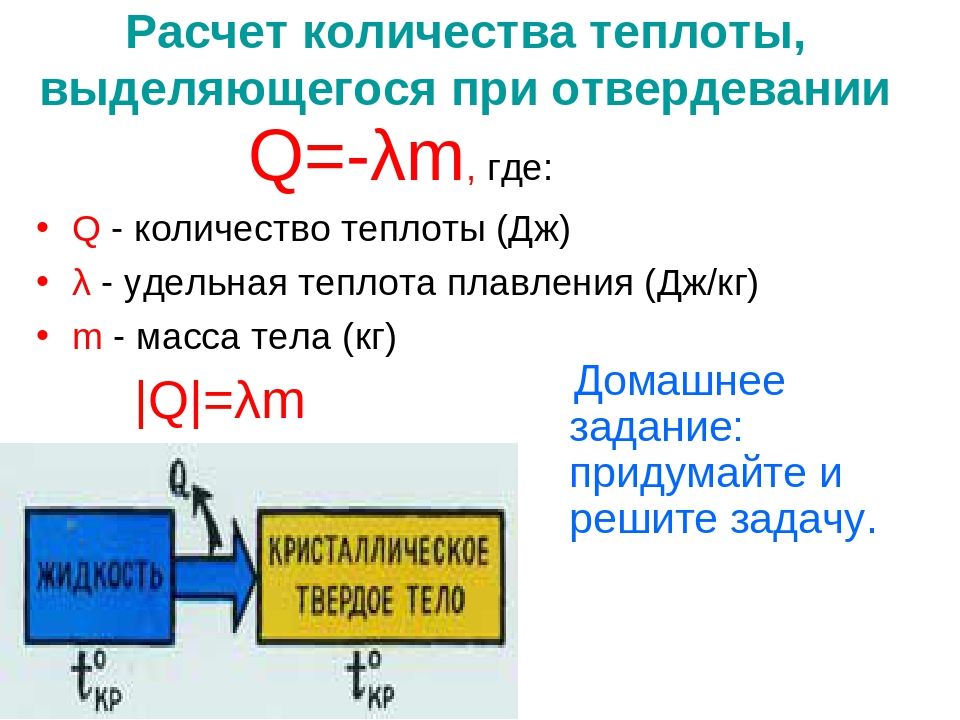
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
m(C2H2)-?
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
————————
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж
По уравнению 1 моль CH4 — Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
————————
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Задача 4. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
V (O2)-?
Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ———- 91 кДж
По условию х моль ———- 182 кДж
Решаем пропорцию
3 моль* 182 кДж
х
=
————————
= 6 моль
91 кДж
2) Вычислим объем кислорода, согласно закону Авогадро
(Vm = 22б4 л. моль) V = n * Vm
моль) V = n * Vm
V(O2) = 6 моль * 22,4 л/моль = 134,4 л
Ответ: объем выделившегося кислорода равен 134,4 л.
4.Закрепление полученных знаний, подведение выводов и записывание их в тетрадь
1.Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
5.Домашнее задание: повторение §38
6.Подведение итогов.
Учитель химии Саут А.К._______________
Задачи. Термохимические расчёты. 6 Дано термохимическое уравнение: 3Н 2 + N
A 30. Задачи. Термохимические расчёты.
6-1. Дано термохимическое уравнение: 3Н2 + N2 = 2NН3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака равен…
6-2. Дано термохимическое уравнение: 2SО2 + О2 = 2SО3 + 198 кДж. В результате реакции выделилось 495 кДж теплоты. Какая масса оксида серы (IV) (в граммах) прореагировала с кислородом?
6-3. В результате реакции, термохимическое уравнение которой 2SO2 + О2 = 2SО3 + 198 кДж,
выделилось 297 кДж теплоты. Объем
израсходованного оксида серы (1V)
равен…
Объем
израсходованного оксида серы (1V)
равен…
6-4. В реакции, протекающей в соответствии с термохимическим уравнением:
2Мg +O2 = 2МgО + 1204 кДж, выделилось 1806 кДж теплоты. Масса вступившего в реакцию магния равна…
6-5. Дано термохимическое уравнение: 2Мg + O2 = 2МgО + 1204 кДж. В результате реакции выделилось 903 кДж теплоты. Какая масса магния (в граммах) сгорела?
6-6. В соответствии с термохимическим уравнением реакции 2Са + О2 = 2СаО + 635,1 кДж
количество теплоты, выделяющееся при горении 10 г кальция, равно…
6-7. В реакцию, протекающую в соответствии с термохимическим уравнением
4Li + 2O2 = 2Li2O + 1198кДж, вступило 1 моль лития. Количество выделившейся теплоты равно …
6-8. При сжигании 6,5 г цинка выделилась теплота, равная 34,8 кДж. Составьте термохимическое уравнение реакции.
6-9.Термохимическое уравнение реакции: 4А1+3О2 =2А12О3+ 3350 кДж. Количество теплоты, выделившееся при окислении 54 г алюминия, равно…
6-10. Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодействии алюминия с кислородом получено 25,5 г А12О3.
6-11. Теплота образования оксида меди (II) равна 156 кДж/моль. Количество теплоты, выделившееся при окислении 32 г меди, равно…
6-12. Дано термохимическое уравнение: 2FеО + С = 2Fе + СО2 — 132 кДж. В результате реакции поглотилось 55 кДж теплоты. Какая масса оксида железа (П) в граммах прореагировала с углеродом?
6-13. Дано термохимическое уравнение: 2NО + О2 = 2NО2 + 114 кДж. Сколько теплоты (в кДж) выделится при взаимодействии 100 г оксида азота (II) с избытком кислорода?
6-14. В реакцию, протекающую в соответствии с термохимическим уравнением
2А1 + 3S = Аl2S3 + 509 кДж, вступило 108 г алюминия. Количество
выделившейся теплоты равно…
Количество
выделившейся теплоты равно…
6-15. Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 7 г железа с серой выделяется 12,15 кДж теплоты.
6-16. При соединении 4,2 г железа с серой выделилось 7,15 кДж теплоты. Составьте термохимическое уравнение реакции.
6-17. Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 0,5 моль натрия с хлором образуется хлорид натрия и выделяется 205 кДж теплоты.
6-18.Термохимическое уравнение реакции: 4Р + 5О2= 2Р2О5 + 3010 кДж. Сколько теплоты выделится при сгорании 310 г фосфора?
6-19. В соответствии с термохимическим уравнением 4Р + 5О2 = 2Р2О5 + 3010 кДж
1505 кДж выделится при сгорании фосфора массой
6-20. При сжигании 64 г серы выделилось 594 кДж теплоты. Теплота образования сернистого газа равна … кДж/моль.
6-21. Вычислите по термохимическому уравнению: С + O2 = CO2 + 402 кДж
сколько грамм углерода сгорело, если выделилось 2412 кДж теплоты.
6-22. В результате реакции, термохимическое уравнение которого С(графит) + О2(г) = СО2(г) + 393,5 кДж, выделилось 1967,5 кДж теплоты. Объем (н.у.) образовавшегося при этом углекислого газа равен…
6-23. Составьте термохимическое уравнение реакции, если известно, что при сгорании 20 г водорода в кислороде выделяется 2860 кДж теплоты.
6-24. Путем сжигания серы получено 3,2 г оксида серы (IV) и при этом выделилось 14,6 кДж теплоты. Составьте термохимическое уравнение реакции.
6-25. Вычислите по термохимическому уравнению реакции: СаСО3 = CaO + CO2 – 157 кДж
количество теплоты, требующееся для разложения 1 кг известняка.
6-26. При
растворении цинка в серной кислоте
выделилось 4 г водорода и 305 кДж. Определить,
сколько теплоты выделится при растворении
97 г цинка.
6-27. В соответствии с термохимическим уравнением реакции 2 CO(г) = СO2(г) + С(тв) + 173 кДж выделилось 1730 кДж теплоты. Объем оксида углерода (II) (н.у.), вступившего в реакцию, равен
6-28. В результате реакции, термохимическое уравнение которой
2АgNО3(тв) = 2Аg (тв) +2NO2(г) + О2(г) — 317 кДж, поглотилось 15,85 кДж теплоты. Масса выделившегося серебра равна…
6-29. В результате реакции, термохимическое уравнение которой 4NН3(г)+5O2(г)= 4NО(г)+6Н2О(г)+ 902 кДж, выделилось 1127,5 кДж теплоты. Объем (н.у.) образовавшегося при этом оксида азота (П) равен…
6-30. В результате реакции, термохимическое уравнение которой NH4NO2 = N2 + 2Н2O + 316 кДж,
выделилось 948 кДж теплоты. Масса разложившейся соли равна…
6-31. В результате реакции, термохимическое уравнение которой 2КСlО3 = 2КСl + 3O2 + 91 кДж,
выделилось 182 кДж теплоты. Масса образовавшегося кислорода равна…
6-32. Теплота образования сульфида натрия равна 372 кДж/моль. Количество теплоты, образующееся при взаимодействии 230 г натрия с избытком серы, равно..
6-33. При взаимодействии 5,6 л (и.у.) фтора, с избытком лития выделилось 308 кДж теплоты. Теплота образования фторида лития равна… кДж/моль.
6-34. При окислении 80 г кальция выделилось 1270 кДж теплоты. Теплота образования оксида кальция равна … кДж/моль.
6-35. При сжигании 1 моль ацетилена выделяется 1350 кДж теплоты. Сколько теплоты выделяется при сжигании 2 м3 ацетилена?
6-36. Теплота сгорания ацетилена равна 1350 кДж/моль. Какое количество теплоты выделится при сгорании ацетилена объемом 1 л (в пересчете на н.у.)?
6-37. На
основании термохимического уравнения
реакции полного сгорания ацетилена
На
основании термохимического уравнения
реакции полного сгорания ацетилена
2С2Н2 + 5О2= 4СО2 + 2Н2О + 2700 кДж рассчитайте, сколько теплоты выделится, если будет израсходовано: а) 13 г ацетилена; б) 0,5 моль ацетилена; в) 100 м3 ацетилена.
6-38.Термохимическое уравнение реакции горения ацетилена: 2С2Н2 + 5О2=4СО2 +2Н2О +2700 кДж. Сколько теплоты выделится при сгорании 58 г ацетилена?
6-39. В результате реакции, термохимическое уравнение которой 2С2Н2 +5О2=4СО2 +2Н2О +2700 кДж, выделилось 650 кДж теплоты. Объем сгоревшего ацетилена равен…
6-40. На основании термохимического уравнения реакции горения этилена
С2Н4 +3О2 =2СО2 + 2Н2О + 1400 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило: а) 1моль кислорода; б) 336 м3 кислорода; в)50 м3 этилена.
6-41. На основании термохимического уравнения реакции горения метана
СН4 +2О2 =СО2 + 2Н2О + 890 кДж рассчитайте, какой объем метана надо сжечь, чтобы получить 4,45∙105 кДж энергии.
6-42. Согласно термохимическому уравнению реакции СН4 + 2О2 = СО2 + 2Н2О + 802 кДж,
количество теплоты, выделившейся при сжигании 24 г метана, равно…
6-43. Найти тепловой эффект реакции горения метана, если при сгорании 0,1 моль его выделяется 89,3 кДж теплоты.
6-44. При горении 26 г метана в кислороде с образованием углекислого газа и воды выделяется 891 кДж теплоты. Составьте термохимическое уравнение реакции и найдите, сколько теплоты выделится при сгорании 2,7 моль метана.
6-45. В соответствии с термохимическим уравнением С6Н12О6 + 6O2 = 6СО2 + 6Н2O + 2816 кДж
выделится 1408 кДж теплоты, если в реакции участвует кислород количеством вещества…
6-46. В соответствии с термохимическим
уравнением реакции С6Н12О6 + 6O2 = 6СО2 + 6Н2O
+ 2816 кДж
В соответствии с термохимическим
уравнением реакции С6Н12О6 + 6O2 = 6СО2 + 6Н2O
+ 2816 кДж
140 кДж теплоты выделяется при сгорании глюкозы массой…
6-47. В результате реакции, термохимическое уравнение которой С2Н5ОН+3О2 =2СO2 +3Н2О +1374 кДж, выделилось 687 кДж теплоты. Количество вещества этанола равно…
Теплогенерация — обзор
5.07.5 Заключительные замечания
Генерация ТЭЦ обычно считается мерой повышения общей эффективности энергетических систем. Основное преимущество ТЭЦ заключается в том, что совместное производство тепла и электроэнергии требует значительно меньших затрат топлива, чем если бы эти два продукта производились на отдельных станциях. Таким образом, ТЭЦ на биомассе представляет собой альтернативу сочетанию эффективных энергетических технологий и возобновляемого, климатически нейтрального топлива. В этой главе были проанализированы и обсуждены системные аспекты биоэнергетических систем, включая ТЭЦ.В этом разделе резюмируются некоторые основные идеи и размышления.
В то время как ТЭЦ на биомассе, основанная на прямом сжигании и паровом цикле, является доминирующей технологией ТЭЦ на биомассе сегодня, технологии на основе газификации, такие как BIGCC CHP, могут стать более влиятельными в будущем. Основным преимуществом технологий ТЭЦ на основе газификации является возможность более высокой эффективности преобразования биомассы в электричество по сравнению с традиционными вариантами. Многие исследования показывают, что, когда технология BIGCC достигнет зрелости, она станет экономически конкурентоспособным вариантом и будет иметь благоприятные экологические характеристики.Однако до сих пор технология страдала из-за слишком высоких затрат на технологию, чтобы ее можно было развернуть в более широком масштабе. Таким образом, как это часто бывает с новыми технологиями, решающее значение имеет готовность участников взять на себя расходы на обучение и / или возможности найти нишевые рынки. Учитывая потенциальные выгоды, стимулы для дальнейшего развития и снижения затрат с социальной точки зрения кажутся высокими.
Учитывая потенциальные выгоды, стимулы для дальнейшего развития и снижения затрат с социальной точки зрения кажутся высокими.
В ситуации с неразвитыми рынками биомассы и высокими затратами на распределение биомассы, производство тепла на основе биомассы в значительной степени зависит от местных ресурсов.Это может привести к выбору неэффективных технологий с точки зрения более высокого уровня системы; например, высокая электрическая эффективность может быть проиграна высокой тепловой эффективности. Однако вполне вероятно, что рынки биомассы будут развиваться, и что биомасса (так же, как и другие варианты исходного сырья) в большей степени будет продаваться на более длинные расстояния. Эта тенденция уже наблюдается; например, древесные гранулы сегодня поставляются в Европу из Канады. Достижения в методах предварительной обработки, таких как торрефикация и пиролиз, которые увеличивают удельную энергию и, следовательно, снижают транспортные расходы, могут, кроме того, ускорить такое развитие.
Лучшие возможности для недорогой транспортировки биомассы также приносят пользу крупномасштабным ТЭЦ, работающим на биомассе. При больших масштабах эффективность ТЭЦ, работающих на биомассе, обычно увеличивается, в то же время уменьшаются удельные инвестиционные затраты. Однако, естественно, большие ТЭЦ также требуют большого количества тепла. Тепловые соединения между различными системами централизованного теплоснабжения являются одним из способов увеличения возможностей для крупных электростанций, хотя затраты, связанные с таким расширением, могут быть значительными.
Хотя биомассой можно торговать в глобальном масштабе, важно признать, что если в будущем будут применяться строгие ограничения выбросов парниковых газов в глобальном масштабе, биомасса будет ограниченным ресурсом. Таким образом, даже если биомассу в замкнутой системе можно считать климатически нейтральной, не все виды использования биомассы одинаково выгодны с системной точки зрения; различное распределение ресурсов биомассы связано с разными уровнями экологической и экономической эффективности. В анализе энергетических систем, заглядывая в будущее, это, в принципе, следует учитывать независимо от уровня изучаемой системы (например, уровня завода, глобальной энергетической системы и т. Д.).). Следует отметить, что выводы относительно экологических характеристик конкретного применения биомассы будут радикально отличаться в зависимости от того, влияет ли использование биомассы на другие альтернативные виды использования биомассы или предполагается, что повышенный спрос будет удовлетворен за счет увеличения предложения биомассы.
В анализе энергетических систем, заглядывая в будущее, это, в принципе, следует учитывать независимо от уровня изучаемой системы (например, уровня завода, глобальной энергетической системы и т. Д.).). Следует отметить, что выводы относительно экологических характеристик конкретного применения биомассы будут радикально отличаться в зависимости от того, влияет ли использование биомассы на другие альтернативные виды использования биомассы или предполагается, что повышенный спрос будет удовлетворен за счет увеличения предложения биомассы.
В связи с перспективой будущей ситуации, когда ресурсы биомассы ограничены и, следовательно, не могут использоваться для всех целей без ограничений, возникает вопрос, в каких секторах и для каких целей следует использовать ограниченное количество биомассы.Основными альтернативами являются либо использование биомассы для производства тепла и электроэнергии в стационарных энергетических системах, либо преобразование биомассы в жидкое или газообразное топливо для использования в транспортном секторе. Конечно, сочетание этих вариантов является наиболее вероятным сценарием в будущем, поскольку местные и региональные обстоятельства и стимулы будут благоприятствовать различным решениям. Даже в этом случае определение драйверов для того или иного варианта может быть полезно для понимания общих тенденций. Несмотря на ряд неопределенностей, многие исследования приходят к выводу, что биомасса используется более эффективно для производства тепла и энергии, чем в качестве транспортного биотоплива.Основная причина этого связана с потерями, связанными с преобразованием биомассы в жидкое или газообразное топливо, подходящее для транспортных средств. С другой стороны, готовность платить за топливо очень высока в транспортном секторе, а высокие цены на нефть могут привести к более широкому использованию конверсии твердого топлива в транспортное топливо. Однако в будущем с растущим спросом на энергосервис, а также с высокими амбициями в отношении сокращения выбросов парниковых газов, давление на эффективное использование биомассы будет высоким, как и спрос на энергоносители с высокой эксергетической энергией, такие как электричество. \ ominus_f \; (реагенты) \]
\ ominus_f \; (реагенты) \]
Поскольку энтальпия является функцией состояния, теплота реакции зависит только от конечного и начального состояний, а не от пути, по которому идет реакция. Например, реакция \ (A \ rightarrow B \) проходит через промежуточные этапы (т.е. \ (C \ rightarrow D \)), но A и B остаются нетронутыми.
Следовательно, можно измерить энтальпию реакции как сумму ΔH трех реакций, применив закон Гесса.
Пример \ (\ PageIndex {1} \): сжигание ацетилена
Вычислить изменение энтальпии при сгорании ацетилена (\ (\ ce {C2h3} \))
Решение
1) Первый шаг — убедиться, что уравнение сбалансировано и верно.Помните, что для сгорания углеводорода требуется кислород, что приводит к образованию углекислого газа и воды.
\ [\ ce {2C2h3 (г) + 5O2 (г) -> 4CO2 (г) + 2h3O (г)} \]
2) Затем найдите таблицу стандартных энтальпий образования, чтобы найти значения для компонентов реакции (таблица 7.2, текст Петруччи)
3) Сначала найдите энтальпии продуктов:
ΔHº f CO 2 = -393,5 кДж / моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 4 молям.
v p ΔH º f CO 2 = 4 моль (-393,5 кДж / моль)
= -1574 кДж
ΔH º f H 2 O = -241,8 кДж / моль
Стехиометрический коэффициент этого соединения равен 2 молям. Итак,
v p ΔH º f H 2 O = 2 моль (-241,8 кДж / моль)
= -483,6 кДж
Теперь сложите эти два значения, чтобы получить сумму произведений
Сумма произведений (Σ v p ΔHº f (продукты)) = (-1574 кДж) + (-483.6 кДж) = -2057,6 кДж
Теперь найдите энтальпии реагентов:
ΔHº f C 2 H 2 = +227 кДж / моль
Умножьте это значение на стехиометрический коэффициент, который в данном случае равен 2 молям.
v p ΔHº f C 2 H 2 = 2 моль (+227 кДж / моль)
= +454 кДж
ΔHº f O 2 = 0,00 кДж / моль
Стехиометрический коэффициент этого соединения равен 5 моль.Итак,
v p ΔHº f O 2 = 5 моль (0,00 кДж / моль)
= 0,00 кДж
Сложите эти два значения, чтобы получить сумму реагентов
Сумма реагентов (Δ v r ΔHº f (реагенты)) = (+454 кДж) + (0,00 кДж) = +454 кДж
Сумму реагентов и продуктов теперь можно подставить в формулу:
ΔHº = Δ v p ΔHº f (продукция) -? v r ΔHº f (реагенты)
= -2057.6 кДж — +454 кДж
= -2511,6 кДж
Теплопередача: от горячего к отрицательному — Урок
.Быстрый просмотр
Уровень оценки: 11 (10-12)
Требуемое время: 30 минут
Зависимость урока: Нет
Тематические области: Химия, Физика
Подпишитесь на нашу рассылку новостей
Резюме
Студенты изучают фундаментальные концепции теплопередачи и теплоты реакции.Сюда входят такие концепции, как физическая химия, уравнение теплопередачи и базовые знания об энергии и теплопередаче. Эта инженерная программа соответствует научным стандартам нового поколения (NGSS).Инженерное соединение
Помимо многих других вещей, которые мы используем каждый день, инженеры проектируют промышленные предприятия и процессы, которые производят полезные продукты из химических веществ, такие как продукты питания, лекарства, материалы и топливо.Чтобы безопасно и эффективно применять и контролировать эти процессы, инженеры должны знать, сколько тепла будет выделяться в данной реакции. Если выделяется слишком много тепла, белки денатурируют, продукты сгорают или разлагаются или реактор может взорваться. Если выделяется слишком мало тепла, химические вещества не вступают в реакцию, может не производиться достаточное количество энергии и производятся неправильные продукты.
Помимо температуры реакции, инженер должен также иметь представление об удельной теплоемкости различных веществ.Теплоемкость означает, сколько энергии требуется для изменения температуры вещества на одну единицу температуры. Инженеры должны понимать теплоемкость по разным причинам, например, для определения того, как нагреваются металлические детали двигателя или сколько энергии необходимо добавить в химический реактор, чтобы повысить или понизить его содержимое до желаемой температуры.
Цели обучения
После этого урока учащиеся должны уметь:
- Опишите, что удельная теплоемкость — это количество энергии, которое объект может поглотить до того, как температура изменится на одну единицу температуры.
- Объясните, как теплоемкость, теплоту реакции и теплопередачу можно применить в технике для понимания химических процессов и физических систем и управления ими.
- Определите экзотермические реакции как тепловыделение, а эндотермические реакции как тепловыделение.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными дисциплинами K-12, образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются Сетью стандартов достижений (ASN) , проект D2L (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например , естественные науки или математика; внутри типа по подтипу, затем по классу, и т. д. .
NGSS: научные стандарты нового поколения — наука| Ожидаемые характеристики NGSS | ||
|---|---|---|
HS-PS3-1. Создайте вычислительную модель для расчета изменения энергии одного компонента в системе, когда известно изменение энергии другого компонента (-ов) и потоки энергии в систему и из нее.(9–12 классы) Вы согласны с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другие учебные программы, соответствующие этим ожиданиям от результатов. | ||
| Этот урок посвящен следующим аспектам трехмерного обучения NGSS: | ||
| Наука и инженерная практика | Основные дисциплинарные идеи | Сквозные концепции |
| Создайте вычислительную модель или симуляцию явления, спроектированного устройства, процесса или системы. Соглашение о выравнивании: Спасибо за ваш отзыв! | Энергия — это количественное свойство системы, которое зависит от движения и взаимодействия материи и излучения внутри этой системы. То, что существует единственная величина, называемая энергией, объясняется тем фактом, что общая энергия системы сохраняется, даже если внутри системы энергия непрерывно передается от одного объекта к другому и между его различными возможными формами. Соглашение о выравнивании: Спасибо за ваш отзыв! Сохранение энергии означает, что полное изменение энергии в любой системе всегда равно общей энергии, переданной в систему или из нее.Соглашение о выравнивании: Спасибо за ваш отзыв! Энергия не может быть создана или уничтожена, но ее можно переносить из одного места в другое и передавать между системами.Соглашение о выравнивании: Спасибо за ваш отзыв! Математические выражения, которые количественно определяют, как запасенная энергия в системе зависит от ее конфигурации (например, относительное положение заряженных частиц, сжатие пружины) и как кинетическая энергия зависит от массы и скорости, позволяют использовать концепцию сохранения энергии. для прогнозирования и описания поведения системы.Соглашение о выравнивании: Спасибо за ваш отзыв! Наличие энергетических ограничений, которые могут возникнуть в любой системе.Соглашение о выравнивании: Спасибо за ваш отзыв! | Модели можно использовать для прогнозирования поведения системы, но эти прогнозы имеют ограниченную точность и надежность из-за допущений и приближений, присущих моделям. Соглашение о выравнивании: Спасибо за ваш отзыв! Наука предполагает, что Вселенная представляет собой огромную единую систему, в которой согласованы основные законы.Соглашение о выравнивании: Спасибо за ваш отзыв! |
- Перегруппируйте формулы, чтобы выделить интересующее количество, используя те же рассуждения, что и при решении уравнений.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Решите линейные уравнения и неравенства с одной переменной, включая уравнения с коэффициентами, представленными буквами.(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Энергия не может быть создана или уничтожена; однако его можно преобразовать из одной формы в другую.(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Энергию можно разделить на основные формы: тепловую, лучистую, электрическую, механическую, химическую, ядерную и другие.(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Определите различные формы энергии и рассчитайте их количество, измерив их определяющие характеристики.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Используйте прямые и косвенные доказательства для разработки прогнозов типов энергии, связанных с объектами.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
Какое альтернативное выравнивание вы предлагаете для этого контента?
Рабочие листы и приложения
Посетите [www.teachengineering.org/lessons/view/cub_heat_lesson01], чтобы распечатать или загрузить.Больше подобной программы
Выполнение математических расчетов: анализ сил в ферменном мостуИзучите основы анализа сил, которые инженеры применяют в соединениях фермы для расчета прочности моста фермы, известного как «метод соединений». Найдите напряжения и сжатия для решения системы линейных уравнений, размер которой зависит от количества элементов и узлов в ферме…
Предварительные знания
Алгебра: Студенты должны знать основы алгебраического манипулирования уравнениями и техники подстановки.
Химия: Студенты должны знать, что химические вещества взаимодействуют в реакциях, которые изменяют химические и / или физические свойства системы.
Физические науки: Студенты должны быть знакомы с концепцией энергии, с тем, что ею можно обмениваться и что она может проявляться в различных формах.
Введение / Мотивация
Некоторые из самых интересных демонстраций в науке и технике связаны с использованием энергии и тепла. Представьте воздушный шар, полный водорода, который зажигают спичкой, грелку для рук, излучающую тепло, или тающий лед. Такие теплообменники — это лишь небольшая часть широкого применения в инженерии и науке теплопередачи.Взрывное воспламенение топлива в ракете, обеспечивающей энергию для взлета, твердый материал на поверхности космического челнока, внутреннюю облицовку высокотемпературного реактора или даже химические процессы, необходимые для изготовления мороженого. все опираются на наши знания о теплопередаче.
Инженеры используют концепцию теплоты реакции, чтобы знать, сколько энергии мы можем ожидать от сжигания ракетного топлива или сколько энергии будет поглощено реакциями, которые производят все, от пластика до печенья.Знание теплоемкости позволяет инженерам предсказать, сколько энергии может выдержать материал до достижения определенной температуры, и затем соответствующим образом спроектировать продукт.
Что такое тепло? Может показаться сложным точно описать, что такое тепло. Некоторые люди могут описать тепло как жар, но это уже описывается температурой. Для ученых и инженеров тепло — это просто термин, относящийся к тепловой энергии, передаваемой между двумя телами. Тепло также может быть энергией, выделяющейся при реакции.Есть много приложений для получения знаний о тепле и теплопередаче. Как мы увидим, инженеры используют знание теплоты реакции, чтобы предсказать, сколько энергии будет произведено в химической системе, что важно для поддержания безопасности и эффективности реактора. Помимо химических реакций, тепло передается и для физических реакций. Некоторые примеры включают растворение одного химического вещества в другом или фазовые переходы между твердым телом, жидкостью и газом.
Теплота реакции — это количество тепловой энергии, генерируемой или поглощаемой при данной физической или химической реакции.Реакции могут либо выделять тепло, либо поглощать тепло. Когда что-то выделяет тепло, это называется экзотермическим . Примеры экзотермических реакций назвать несложно. Они включают сжигание дров, зажигание водородного шара и замораживание льда. С другой стороны, эндотермических реакций, реакций — это реакции с поглощением тепла. Приготовление пирога, кипячение воды и растворение некоторых солей в воде являются примерами эндотермических реакций. Теплоту реакции также часто называют энтальпией реакции .Теплота / энтальпия раствора — еще одно важное понятие. Это та же идея, но вместо химических реакций она относится к растворению одного химического вещества в другом (как простое определение). Также следует иметь в виду следующие термины: теплота парообразования и теплота плавления . Они описывают входы и выходы энергии при кипении и замораживании.
Еще одно важное понятие — тепловая мощность . Инженер-химик должен знать, насколько данное количество энергии повысит температуру компонентов реакции и самого реактора.Аэрокосмический инженер должен понимать допуски строительных материалов космического корабля, чтобы он мог успешно выдерживать экстремальные температуры космоса. Даже в кулинарии важно понимать теплоемкость, чтобы определить, например, как долго и насколько горячо готовить индейку. Теплоемкость можно представить как количество энергии, которое нужно вложить в что-то, прежде чем оно станет на один градус горячее. Это различно для разных веществ. Теплоемкость различных веществ зависит от сложных атомных и молекулярных взаимодействий, таких как способ соединения атомов друг с другом, прочность атомных связей и скорость передачи энергии атомами между собой.Обратитесь к соответствующему заданию Hot Potato, Cool Foil, чтобы дать ученикам возможность исследовать различные свойства материалов и основные принципы теплопередачи с помощью калориметров для определения удельной теплоемкости нескольких веществ.
Наконец, то, как теплообмен между двумя системами является важной частью инженерии. Знание того, как быстро и сколько тепла будет проводиться, важно для управления реакциями, а также для сохранения важных материалов и компонентов в устройстве в рабочих условиях.Например, инженеру-химику может потребоваться знать, сколько тепла будет передаваться снаружи реактора в окружающий воздух, или инженеру по вычислительной технике потребуются охлаждающие ребра и вентиляторы определенного типа и размера, чтобы предотвратить перегрев процессора.
Предпосылки и концепции урока для учителей
Тепло реакции и многое другое!
Что вызывает изменение энергии в реакции, растворении или фазовом переходе? Это связано с перестройкой атомов и молекул.В химической реакции энергия либо поглощается, либо высвобождается для образования химических связей между атомами. Если новое расположение связей более стабильно, чем исходное, оно менее энергично, чем раньше, и высвобождает лишнюю энергию, в которой не нуждается. Таким образом, представляет собой экзотермическую реакцию .
Если связь менее стабильна и требует больше энергии для существования, она поглощает энергию из своего окружения до тех пор, пока не стабилизируется. Это эндотермическая реакция . Тот же принцип применяется к роспуску.Когда вы растворяете поваренную соль NaCl в воде, вы разлагаете ее на окружающие молекулы ионы натрия и хлора. Поскольку для этого требуется подвод энергии, это называется эндотермическим. Некоторые соли экзотермичны и в той же ситуации выделяют энергию.
Наконец, кипение воды — это эндотермическая реакция, потому что молекулам воды необходимо поглощать энергию, чтобы разорвать межмолекулярное взаимодействие друг с другом и стать газом. Поэтому кипятим воду на горячей плите!
Количество тепла, передаваемого в данной реакции, можно предсказать, если мы знаем определенные вещи о том, что происходит.Во-первых, мы должны определить, является ли это химическим или физическим процессом. Есть ли химические изменения, например сжигание дров для получения золы и CO2? Или это физическое, например таяние льда для получения воды? После того, как мы определили тип реакции, мы можем найти стандартную теплоту реакции. Отрицательная теплота реакции экзотермична, а эндотермическая реакция положительна. Эти стандарты указаны из расчета на моль. Следовательно, теплота реакции — это количество тепла, произведенное для количества молей продукта в основном химическом уравнении.
Рис. 2. Нефтеперерабатывающий завод, одно из многих мест, где понимание и применение теплоемкости и теплоты реакции является ключевым моментом. Copyright
Copyright © Министерство энергетики США http://www1.eere.energy.gov/industry/ petroleum_refining / profile.html
Теплообмен
Теплообмен между двумя системами регулируется относительно простым уравнением, которое связывает передаваемую энергию с теплоемкостью и количеством вещества. Уравнение выглядит следующим образом: Q = mC P ∆T
В этом уравнении Q относится к количеству переданной энергии, м, — это масса рассматриваемого объекта, C P — его теплоемкость, а ∆ T — это изменение температуры вещества. между начальной температурой до передачи тепла и температурой после передачи тепла.Учащиеся могут проиллюстрировать эту идею с помощью упражнения «Подсчет калорий», построив калориметры постоянного давления для определения теплоты растворения хлорида калия в воде.
Мы можем установить тепло, выходящее из системы, равным теплу, поступающему в окружающую среду, которым может быть воздух, окружающий объект, или что-то, к чему объект прикасается. Идея сохранения энергии известна как первый закон термодинамики . Другими словами, энергию нельзя ни создать, ни уничтожить, а просто преобразовать в разные формы.Итак, если энергия покидает систему, она должна поступать в другую систему, потому что не может исчезнуть.
В случае двух веществ / объектов, изначально находящихся при разных температурах, которые вступают в контакт (например, две жидкости, смешанные вместе, горячие шарикоподшипники, закаленные в холодной воде), уравнение энергии можно использовать для создания математической модели для определения изменение энергии в одном веществе / объекте, когда известно изменение энергии в другом. Например, если горячий куб алюминия погрузить в холодную воду, можно использовать уравнение энергии, чтобы показать, что энергия, теряемая из-за алюминия, приобретается водой.
Q потеряно Al = Q получено водой
м Al C p, Al (T f, Al — T i, Al ) = m w C p, w (T f, w — T i, w )
Если алюминиевый куб оставить в воде на достаточно долгое время, вода и алюминий достигнут одинаковой температуры. Предполагая, что мы знаем массы, удельную теплоемкость и начальную температуру воды и алюминия, приведенный выше энергетический баланс можно перестроить, чтобы найти конечную температуру.Эта конечная температура затем может быть использована для определения изменения энергии воды и алюминия.
T f, Al = T f, w
T f = (m Al C p, Al T i, Al — m w C p, w T i, w ) / (m Al C p , Al — м w C p, w )
Сопутствующие мероприятия
- Подсчет калорий — учащиеся открывают для себя основы теплопередачи, создавая калориметры постоянного давления для определения теплоты растворения хлорида калия в воде.
- Hot Potato, Cool Foil — Учащиеся изучают свойства материалов и основные принципы теплопередачи с помощью калориметров для определения удельной теплоемкости нескольких веществ.
Закрытие урока
Теплопередача — чрезвычайно важный аспект почти во всех областях техники. Будь то ребра охлаждения компонента компьютера или система охлаждения двигателя автомобиля, инженеры применяют свои знания о теплопередаче во многих ситуациях.Теплоемкость описывает, сколько тепла может удерживать вещество при увеличении температуры на один градус. Это важно для таких применений, как приготовление пищи в промышленных масштабах, химические реакторы и допуски материалов для машин, таких как автомобили и космические корабли для защиты от тепла. Теплота реакции, растворения и фазовые превращения описывают энергию, поглощаемую или высвобождаемую при перегруппировке атомов и молекул при их взаимодействиях. Применения этого включают все: от разработки мощного ракетного топлива до создания эффективного антиобледенителя дороги.Наконец, понимание того, что такие реакции, как горение ракетного топлива, считаются экзотермическими, потому что они высвобождают энергию, а выпечка пирога или кипящей воды являются эндотермическими, поскольку они требуют ввода энергии, чтобы считаться «завершенными».
Словарь / Определения
эндотермический: процесс или реакция с поглощением энергии.
энтальпия: изменение энтальпии — это количество тепла, выделяемого или поглощаемого, когда химическая реакция происходит при постоянном давлении.
экзотермический: процесс или реакция, высвобождающая энергию.
тепло: энергия, передаваемая между двумя системами в результате разницы температур.
теплоемкость: количество передаваемой энергии, необходимое для повышения или понижения данного количества вещества на одну единицу температуры при постоянном давлении.
Теплота реакции: количество энергии, выделяемой или поглощаемой для данного количества реагирующих химикатов.
Оценка
Оценка перед уроком
Обсуждение: Соберите и обсудите идеи студентов.
- Что такое энергия? (Ответ: способность системы выполнять работу; кинетическая энергия, потенциальная энергия, электрическая энергия и т. Д.)
- Что такое тепло? (Ответ: Энергия, передаваемая между двумя системами в результате разницы температур.)
- В чем разница между теплом и энергией? (Ответ: Тепло — это форма энергии; она имеет те же единицы, но в частности энергия, передаваемая через температурный градиент.)
Оценка после введения
Повседневные примеры: В классе подумайте о примерах теплопередачи, тепла реакции и тепла раствора в повседневной жизни и перечислите их на доске. (Возможные ответы: печи, дорожная соль для плавления льда, печи и т. Д.)
Итоги урока Оценка
Применение концепций для решения проблем: попросите учащихся работать в небольших группах по 2-3 человека, чтобы заполнить Лист проблем теплопередачи. Просмотрите решения как класс, позволяя группам при желании показать свои решения на доске.В задачах учащимся предлагается использовать концепции, изученные на этом уроке, для разработки вычислительных моделей для расчета изменения энергии в виде тепла. Решения доступны для использования учителем в Ключе с ответами на листе проблем теплопередачи.
Мозговой штурм: Разделите учащихся на небольшие группы для мозгового штурма о том, как знание теплоты реакции и теплопередачи может быть полезно. Это должно включать приложения для повседневной жизни, промышленности, науки / техники и, по крайней мере, еще одну категорию (приготовление пищи, ремонт автомобилей и т. Д.).
- Предложите учащимся представить свои идеи классу.
- Предложите студентам подумать, как бы они объяснили кому-нибудь причины, лежащие в основе высокой температуры реакции, растворения и фазовых изменений. Им следует найти хорошие аналогии или даже разыграть роли атомов в этих ситуациях.
использованная литература
Блэр, Джон, Национальный институт стандартов и технологий, NIST Tech Beat, 23 января 2008 г., по состоянию на 12 ноября 2009 г.http://www.nist.gov/public_affairs/techbeat/tb2008_0123.htm.
Министерство энергетики, энергоэффективности и возобновляемых источников энергии США, Нефтеперерабатывающая промышленность для будущего, 5/16/2007, по состоянию на 15 ноября 2009 г. http://www1.eere.energy.gov/industry/petroleum_refining/profile.html
авторское право
© 2009 Регенты Университета Колорадо.Авторы
Джеймс Прагер; Меган Шредер; Малинда Зарске; Джанет ЙоуэллПрограмма поддержки
Комплексная программа преподавания и обучения, Инженерный колледж, Университет Колорадо в БоулдереБлагодарности
Содержание этой учебной программы по цифровой библиотеке было разработано за счет гранта Фонда улучшения послесреднего образования (FIPSE), U.S. Министерство образования и Национальный научный фонд ГК-12, грант No. 0338326. Однако это содержание не обязательно отражает политику Министерства образования или Национального научного фонда, и вам не следует предполагать, что оно одобрено федеральным правительством.
Последнее изменение: 19 января 2021 г.
Учебное пособие по физике
Ранее в этом уроке были даны пять словарных определений температуры.Их было:
- Степень жара или холода тела или окружающей среды.
- Мера тепла или холода предмета или вещества по отношению к некоторому стандартному значению.
- Мера средней кинетической энергии частиц в образце вещества, выраженная в единицах или градусах, обозначенных на стандартной шкале.
- Мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.
- Любая из различных стандартизированных числовых мер этой способности, например шкала Кельвина, Фаренгейта и Цельсия.
Как уже упоминалось, первые два пункта имеют довольно очевидное значение. Третий пункт — тема предыдущей страницы этого урока. Пятым пунктом было определение, с которого мы начали, когда обсуждали температуру и работу термометров; это была тема второй страницы этого урока. Это оставляет нам четвертый пункт — определение температуры с точки зрения способности вещества передавать тепло другому веществу.Эта часть Урока 1 посвящена пониманию того, как относительная температура двух объектов влияет на направление передачи тепла между двумя объектами.
Представьте себе очень горячую кружку кофе на столешнице вашей кухни. В целях обсуждения мы скажем, что чашка кофе имеет температуру 80 ° C, а окружающая среда (столешница, воздух на кухне и т. Д.) Имеет температуру 26 ° C.Как вы думаете, что произойдет в этой ситуации? Я подозреваю, что вы знаете, что чашка кофе со временем будет постепенно остывать. При температуре 80 ° C кофе пить не посмеешь. Даже кофейная кружка, скорее всего, будет слишком горячей, чтобы ее можно было прикасаться. Но со временем и кофейная кружка, и кофе остынут. Скоро он будет пригоден для питья. А если устоять перед соблазном выпить кофе, то со временем он достигнет комнатной температуры. Кофе охлаждается от 80 ° C до примерно 26 ° C. Так что же происходит с течением времени, чтобы кофе остыл? Ответом на этот вопрос могут быть как макроскопические , так и макрочастицы в природе.
На макроскопическом уровне мы бы сказали, что кофе и кружка передают тепло окружающей среде. Эта передача тепла происходит от горячего кофе и горячей кружки к окружающему воздуху. Тот факт, что кофе снижает температуру, является признаком того, что средняя кинетическая энергия его частиц уменьшается. Кофе теряет энергию. Кружка тоже понижает температуру; средняя кинетическая энергия его частиц также уменьшается.Кружка тоже теряет энергию. Энергия, теряемая кофе и кружкой, передается в более холодную среду. Мы называем эту передачу энергии от кофе и кружки окружающему воздуху и столешнице теплом. В этом смысле тепло — это просто передача энергии от горячего объекта к более холодному.
Теперь рассмотрим другой сценарий — банку с холодным напитком, установленную на той же кухонной стойке. В целях обсуждения мы скажем, что крышка и банка, в которой она содержится, имеют температуру 5 ° C и что окружающая среда (столешница, воздух на кухне и т. Д.)) имеет температуру 26 ° C. Что произойдет с холодной банкой с попой со временем? Еще раз, я подозреваю, что вы знаете ответ. И холодная закуска, и контейнер нагреются до комнатной температуры. Но что заставляет эти объекты, температура которых ниже комнатной, повышать свою температуру? Ускользает ли холод от шипучки и ее контейнера? Нет! Не существует таких вещей, как — холодный уход или — утечка . Скорее, наше объяснение очень похоже на объяснение, используемое для объяснения того, почему кофе остывает.Есть теплообмен.
Со временем температура крышки и контейнера повышается. Температура повышается с 5 ° C до почти 26 ° C. Это повышение температуры является признаком того, что средняя кинетическая энергия частиц внутри хлопка и контейнера увеличивается. Чтобы частицы внутри хлопка и контейнера увеличили свою кинетическую энергию, они должны откуда-то получать энергию. Но откуда? Энергия передается из окружающей среды (столешница, воздух на кухне и т. Д.) в виде тепла. Как и в случае с охлаждающей кофейной кружкой, энергия передается от объектов с более высокой температурой к объекту с более низкой температурой. Еще раз, это известно как тепло — передача энергии от объекта с более высокой температурой к объекту с более низкой температурой.
Другое определение температурыОба этих сценария можно резюмировать двумя простыми утверждениями. Объект понижает свою температуру, выделяя энергию в виде тепла в окружающую среду.И объект увеличивает свою температуру, получая энергию в виде тепла от окружающей среды. И , нагревающий , и , охлаждающий объектов работают одинаково — за счет передачи тепла от объекта с более высокой температурой к объекту с более низкой температурой. Итак, теперь мы можем осмысленно переформулировать определение температуры. Температура — это мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.Чем выше температура объекта, тем больше у него тенденция к передаче тепла. Чем ниже температура объекта, тем больше у него тенденция оказаться на принимающем конце теплопередачи.
Но, возможно, вы спрашивали: что происходит с температурой окружающей среды? Повышается ли температура столешницы и воздуха на кухне, когда кружка и кофе остывают? Уменьшается ли температура на столешнице и в воздухе на кухне, когда банка с крышкой нагревается? Ответ: да! Доказательство? Просто прикоснитесь к столешнице — она должна быть прохладнее или теплее, чем до того, как кофейная кружка или баночка были помещены на столешницу.А как насчет воздуха на кухне? Теперь немного сложнее представить убедительное доказательство. Тот факт, что объем воздуха в комнате такой большой и энергия быстро рассеивается от поверхности кружки, означает, что изменение температуры воздуха на кухне будет аномально небольшим. На самом деле это будет , пренебрежимо маленький . Прежде чем произойдет заметное изменение температуры, должно быть намного больше теплопередачи.
При обсуждении охлаждения кофейной кружки столешница и воздух на кухне упоминались как окружение .В физических дискуссиях такого типа принято использовать мысленную структуру системы и окружения . Кофейная кружка (и кофе) будут рассматриваться как система , а все остальное во вселенной будет рассматриваться как , окружающая среда . Чтобы не усложнять задачу, мы часто сужаем диапазон окружения от остальной вселенной до тех объектов, которые непосредственно окружают систему. Такой подход к анализу ситуации с точки зрения системы и окружения настолько полезен, что мы будем применять этот подход до конца этой главы и следующей.
Теперь представим третью ситуацию. Предположим, что небольшая металлическая чашка с горячей водой помещена в большую чашку из пенополистирола с холодной водой. Предположим, что температура горячей воды изначально составляет 70 ° C, а температура холодной воды во внешней чашке изначально составляет 5 ° C. И давайте предположим, что обе чашки оснащены термометрами (или датчиками температуры), которые измеряют температуру воды в каждой чашке с течением времени. Как вы думаете, что произойдет? Прежде чем читать дальше, подумайте над вопросом и дайте какой-нибудь ответ.Когда холодная вода нагревается, а горячая — остывает, их температура будет одинаковой или другой? Будет ли холодная вода нагреваться до более низкой температуры, чем температура, до которой остывает горячая вода? Или по мере потепления и похолодания их температуры будут пересекаться друг с другом ?
К счастью, это эксперимент, который можно провести, и на самом деле он проводился много раз. График ниже является типичным представлением результатов.
Как видно из графика, горячая вода остыла примерно до 30 ° C, а холодная вода нагрелась примерно до той же температуры. Тепло передается от высокотемпературного объекта (внутренняя емкость с горячей водой) к низкотемпературному объекту (внешняя емкость с холодной водой). Если мы обозначим внутреннюю чашу с горячей водой как , система , то мы можем сказать, что существует поток тепла от системы к окружающей среде .Пока существует разница температур между системой и окружающей средой, между ними существует тепловой поток. Поначалу тепловой поток более быстрый, о чем свидетельствует более крутой наклон линий. Со временем разница температур между системой и окружающей средой уменьшается, а скорость теплопередачи снижается. Это обозначается более пологим наклоном двух линий. (Подробная информация о скорости теплопередачи будет обсуждаться позже в этом уроке.) В конце концов, система и окружающая среда достигают одинаковой температуры, и теплопередача прекращается.Говорят, что именно в этот момент два объекта достигли теплового равновесия.
В нашей главе об электрических цепях мы узнали, что разница в электрическом потенциале между двумя местоположениями вызывает поток заряда по проводящему пути между этими местоположениями. Пока сохраняется разность электрических потенциалов, будет существовать поток заряда. Теперь в этой главе мы узнаем аналогичный принцип, связанный с потоком тепла.Разница температур между двумя местоположениями вызовет поток тепла по (теплопроводящему) пути между этими двумя местоположениями. Пока сохраняется разница температур, будет происходить поток тепла. Этот поток тепла продолжается до тех пор, пока два объекта не достигнут одинаковой температуры. Когда их температуры становятся равными, считается, что они находятся в тепловом равновесии, и поток тепла больше не происходит.
Этот принцип иногда называют нулевым законом термодинамики.Этот принцип был формализован в виде закона после того, как первый, второй и третий законы термодинамики уже были открыты . Но поскольку этот закон казался более фундаментальным, чем три ранее открытых, он был назван нулевым законом . Все объекты подчиняются этому закону — стремлению к тепловому равновесию. Он представляет собой ежедневную задачу для тех, кто хочет контролировать температуру своего тела, еды, напитков и своего дома. Мы используем лед и изоляцию, чтобы наши холодные напитки оставались холодными, и мы используем изоляцию и непрерывные импульсы микроволновой энергии, чтобы наши горячие напитки оставались горячими.Мы оборудуем наши автомобили, наши дома и офисные здания кондиционерами и вентиляторами, чтобы они оставались прохладными в теплые летние месяцы. И мы оборудуем эти же автомобили и здания печами и обогревателями, чтобы согревать их в холодные зимние месяцы. Всякий раз, когда температура какой-либо из этих систем отличается от температуры окружающей среды и не является полностью изолированной от окружающей среды (идеальная ситуация), тепло будет течь. Этот тепловой поток будет продолжаться до тех пор, пока система и окружающая среда не достигнут одинаковых температур.Поскольку эти системы имеют значительно меньший объем, чем окружающие, будут более заметные и существенные изменения температуры этих систем.
Теория калорийностиУченые давно задумались о природе тепла. В середине XIX века наиболее распространенным понятием тепла было то, что оно ассоциировалось с жидкостью, известной как калорийность. Известный химик Антуан Лавуазье рассуждал, что существует две формы калорийности — та, которая скрыта или хранится в горючих материалах, и другая, которую можно ощутить и наблюдать при изменении температуры.Для Лавуазье и его последователей сжигание топлива привело к выделению этого скрытого тепла в окружающую среду, где, как было замечено, это вызвало изменение температуры окружающей среды. Для Лавуазье и его последователей жар всегда присутствовал — либо в скрытой, либо в ощутимой форме. Если в горячем чайнике вода остыла до комнатной температуры, это объяснялось перетеканием калорий из горячей воды в окружающую среду.
Согласно теории теплоты, тепло было материалом по природе .Это была физическая субстанция. Было штук, штук. Как и все вещи в мире Лавуазье, калорийность была консервированной. Подобно нашему современному взгляду на тепло, взгляд калориста заключался в том, что если калорийность выделялась одним объектом, то она была получена другим объектом. Общее количество калорий никогда не менялось; он просто переносился с одного объекта на другой и трансформировался из одного типа (скрытого) в другой (осмысленный). Но в отличие от нашего современного взгляда на тепло, калорийность была реальной физической субстанцией — жидкостью, которая могла перетекать от одного объекта к другому.И в отличие от наших современных взглядов, тепло всегда присутствовало в той или иной форме. Наконец, с современной точки зрения, тепло присутствует только при передаче энергии. Бессмысленно говорить о том, что тепло все еще существует, когда два объекта пришли в тепловое равновесие. Тепло — это не что-то, что содержится в объекте; скорее это что-то переданное между объектами. Когда передача прекращается, тепла больше не существует.
Падение теории калорийностиХотя альтернативы теории калорийности существовали всегда, она была наиболее распространенной до середины 19 века.Одним из первых вызовов теории калорийности стал англо-американский ученый Бенджамин Томпсон (он же граф Рамфорд). Томпсон был одним из первых ученых, которым поручили расточить стволы пушек для британского правительства. Томпсон был поражен высокими температурами, достигаемыми пушками, и стружкой, которая проливалась из пушек во время процесса бурения. В одном эксперименте он погрузил пушку в резервуар с водой во время процесса бурения и заметил, что тепло, выделяемое в процессе бурения, способно вскипятить окружающую воду в течение нескольких часов.Томпсон продемонстрировал, что это тепловыделение происходило в отсутствие каких-либо химических или физических изменений в составе пушки. Он объяснил возникновение тепла трением между пушкой и буровым инструментом и утверждал, что это не могло быть результатом перетекания жидкости в воду. В 1798 году Томпсон опубликовал статью, в которой оспаривалось мнение о том, что тепло — это сохраняемая жидкость. Он выступал за с механической точки зрения на тепло, предполагая, что его происхождение связано с движением атомов, а не с переносом жидкости.
Английский физик Джеймс Прескотт Джоуль продолжил там, где остановился Томпсон, нанеся ряд роковых ударов теории калорийности посредством серии экспериментов. Джоуль, в честь которого теперь названа стандартная метрическая единица измерения энергии, провел эксперименты, в которых он экспериментально связал количество механической работы с количеством тепла, передаваемого механической системой. В одном эксперименте Джоуль позволил падающим весам вращать гребное колесо, которое было погружено в резервуар с водой.Справа изображен чертеж аппарата (из Викимедиа; общественное достояние). Падающие грузы действовали на гребное колесо, которое, в свою очередь, нагревало воду. Джоуль измерял как количество выполненной механической работы, так и количество тепла, полученного водой. Подобные эксперименты, демонстрирующие, что тепло может генерироваться электрическим током, нанесли еще один удар по мысли о том, что тепло — это жидкость, которая содержится в веществах и всегда сохраняется.
Как мы подробно узнаем в следующей главе, объекты обладают внутренней энергией.В химических реакциях часть этой энергии может выделяться в окружающую среду в виде тепла. Однако эта внутренняя энергия не является материальной субстанцией или жидкостью, содержащейся в объекте. Это просто потенциальная энергия, хранящаяся в связях, которые удерживают частицы внутри объекта вместе. Тепло или тепловая энергия — это форма, которой эта энергия обладает, когда она передается между системами и окружающей средой . В тепле нет ничего материального. Это не консервируемая субстанция и не жидкость.Тепло — это форма энергии, которая может передаваться от одного объекта к другому или даже создаваться за счет потери других форм энергии.
Итак, температура — это мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе. Если два объекта — или система и ее окружение — имеют разную температуру, то у них разная способность передавать тепло. Со временем будет перетекать энергия от более горячего объекта к более холодному.Этот поток энергии называется теплом. Тепловой поток заставляет более горячий объект остывать, а более холодный — нагреваться. Поток тепла будет продолжаться, пока они не достигнут той же температуры. В этот момент два объекта установили тепловое равновесие друг с другом.
В следующей части этого урока мы исследуем механизм теплопередачи. Мы рассмотрим различные методы, с помощью которых тепло может передаваться от объекта к объекту или даже от одного места внутри объекта к другому.Мы узнаем, что макроскопическое можно объяснить с точки зрения микроскопического.
Проверьте свое понимание
1. Для каждого из следующих обозначений системы и окружающей среды укажите направление теплового потока: от системы к окружающей среде или от окружающей среды к системе.
Система | Окрестности | Dir’n of Heat Transfer | |
а. | Гостиная (T = 78 ° F) | Наружный воздух | |
г. | Гостиная | Чердак | |
г. | Чердак | Наружный воздух |
2. Учитель химии утверждает, что теплосодержание конкретного вещества составляет 246 кДж / моль. Учитель химии утверждает, что вещество содержит тепло? Объясните, что подразумевается под этим утверждением.
3.Объясните, почему высококачественные термосы имеют вакуумную подкладку, которая является основным компонентом их изоляционных свойств.
Какую роль играет тепло в химических реакциях?
Поскольку тепло является формой энергии, оно играет важную роль в химических реакциях. В некоторых случаях для начала реакции требуется тепло; Например, для разжигания костра нужна спичка и растопка. Реакции потребляют тепло или производят его в зависимости от задействованных химикатов.Тепло также определяет скорость, с которой происходят реакции, и идут ли они в прямом или обратном направлении.
TL; DR (слишком долго; не читал)
Вообще говоря, тепло помогает ускорить химическую реакцию или вызвать химическую реакцию, которая не могла бы произойти в противном случае.
Эндотермические и экзотермические реакции
Многие известные химические реакции, такие как горение угля, ржавчина и взрыв пороха, выделяют тепло; химики называют эти реакции экзотермическими.Поскольку реакции выделяют тепло, они повышают температуру окружающей среды. Другие реакции, такие как объединение азота и кислорода с образованием оксида азота, включают тепло, снижая температуру окружающей среды. Поскольку они отводят тепло из окружающей среды, эти реакции носят эндотермический характер. Многие реакции и потребляют, и выделяют тепло, но если в конечном итоге выделяется тепло, реакция экзотермична; в противном случае он эндотермический.
Тепло и молекулярная кинетическая энергия
Тепловая энергия проявляется как случайные толкающие движения молекул в веществе; по мере увеличения температуры вещества его молекулы вибрируют и отскакивают с большей энергией и с большей скоростью.При определенных температурах вибрации преодолевают силы, заставляющие молекулы прилипать друг к другу, заставляя твердые тела плавиться в жидкости, а жидкости — в газы. Газы реагируют на тепло увеличением давления, поскольку молекулы сталкиваются с их контейнером с большей силой.
Уравнение Аррениуса
Математическая формула, называемая уравнением Аррениуса, связывает скорость химической реакции с ее температурой. При абсолютном нуле, теоретической температуре, которая не может быть достигнута в реальных условиях лаборатории, тепло полностью отсутствует и химические реакции отсутствуют.При повышении температуры происходят реакции. Обычно более высокие температуры означают более высокие скорости реакции; поскольку молекулы перемещаются быстрее, молекулы реагентов с большей вероятностью будут взаимодействовать, образуя продукты.
Принцип Ле Шателье и тепло
Некоторые химические реакции обратимы: реагенты объединяются, образуя продукты, а продукты перестраиваются в реагенты. Одно направление выделяет тепло, а другое потребляет его. Химики говорят, что когда реакция может произойти в любом случае с равной вероятностью, она находится в равновесии.Принцип Ле Шателье гласит, что для реакций в равновесии добавление большего количества реагентов к смеси делает прямую реакцию более вероятной, а обратную — менее вероятной. И наоборот, добавление большего количества продуктов делает обратную реакцию более вероятной. Для экзотермической реакции тепло является продуктом; если вы добавите тепло к экзотермической реакции в равновесии, вы сделаете обратную реакцию более вероятной.
Информационный бюллетень: Реакции нагрева | PennEHRS
Оценка опасности
Проведение экспериментов при повышенных температурах увеличивает риск пожара, взрыва, избыточного давления и химического воздействия.Оцените все опасности до начала экспериментов при повышенной температуре. Учитывайте точки кипения, точки воспламенения и потенциальную температуру термического разложения химикатов, так как они будут определять температуру, до которой можно безопасно нагревать материалы. Кроме того, примите во внимание реакционную способность материалов и определите, существует ли вероятность неуправляемой реакции, образования газа или взрыва. Если вам нужна помощь в оценке свойств ваших материалов или опасностей реактивности, проконсультируйтесь со своим руководителем, обратитесь в EHRS или обратитесь к библиотекарю химического отдела за ресурсами.Есть определенные химические вещества, которые нельзя нагревать, например пирофорные соединения, сильные окислители и перекиси. Никогда не нагревайте растворитель выше его точки кипения в закрытой системе, если вы не приняли во внимание давление, которое будет создаваться в результате. Увеличивая масштаб реакции, переоцените опасность, особенно если она более чем в три раза превышает исходную шкалу.
Для получения конкретных рекомендаций по безопасности при нагревании агарозы см. Информационный бюллетень: Безопасность при нагревании агарозы.
Типовая установка
Горячие плиты, нагревательные кожухи и нагревательные блоки — распространенные методы повышения температуры реакции.Никогда не используйте открытое пламя (например, горелку Бунзена) для нагрева реакции. Соберите оборудование так, чтобы можно было быстро удалить источник тепла, не нарушая нагрева смеси. Это можно сделать с помощью лабораторных домкратов и зажимов.
Используйте механизм перемешивания во всех реакциях, чтобы предотвратить неравномерный нагрев. При выборе метода перемешивания учитывайте вязкость смеси и важность равномерного перемешивания для реакции. Выберите магнитную мешалку подходящего размера или подумайте, требуется ли механическое перемешивание на потолке.
Реакции, нагретые до температуры, близкой к температуре кипения растворителя или выше, требуют дополнительных мер контроля для предотвращения испарения растворителя и повышения давления. Используйте конденсационный аппарат и постоянно продувайте систему через барботер.
Средства индивидуальной защиты (СИЗ)
Всегда используйте стандартные средства индивидуальной защиты (перчатки, лабораторный халат и защитные очки). При работе с горячей стеклянной посудой или ванной рекомендуется использовать термостойкие перчатки.
Средства инженерного контроля
Тип используемого нагревательного устройства и способ его использования влияют на безопасность эксперимента.См. Разделы «Неисправности горячей плиты» и «Предупреждение о неправильном использовании» для получения дополнительной информации о выборе правильного оборудования и безопасных методах использования плит и каминных досок.
Для снижения риска всегда используйте следующие технические средства контроля. (См. Фото)
- По возможности используйте термопару / термостат, управляемый нагревом (например, устройство, показанное ниже).
- Надежно зажмите зонд термопары в теплоносителе.
- Непосредственно контролируйте температуру смеси через многогорлую колбу с адаптером для термометра, когда стабильность температуры критична.
- Закрепите трубки конденсатора проволокой, чтобы избежать утечек / затоплений — избегайте смешивания воды и горячего масла, это приведет к разбрызгиванию горячего масла.
- Используйте лабораторный домкрат для быстрого извлечения нагревательной бани из реакционной колбы.
- Подумайте, оправдывают ли опасности использование противовзрывной защиты.
Административный контроль
Для снижения риска всегда используйте следующие методы работы.
- Удалите все ненужные легковоспламеняющиеся и горючие материалы из вытяжного шкафа перед для нагрева реакционной смеси.
- Перед работой с продуктом дайте реакции полностью остыть до комнатной температуры.
- Используйте таймер на конфорке (если есть), чтобы контролировать продолжительность нагрева, или используйте звуковой таймер в качестве напоминания, чтобы проверить вашу реакцию и / или при необходимости отрегулировать нагрев.
- Дайте реакции достичь целевой температуры и прийти в равновесие, прежде чем отойти от вытяжки.
- Четко пометьте ручки перемешивания и нагрева.
- Не оставляйте без присмотра горячие реакции
Если горячая плита
должна использоваться без присмотра , составьте план по снижению рисков Пример регулировки предела безопасной температуры (из руководства пользователя IKA для модели C-Mag HS7)- Разместите знак «Работа без участия оператора» с описанием реакции или материалов, которые нагреваются.Включите дату и контактную информацию для экстренного вызова лица, ответственного за работу. (Скачать шаблон ниже)
- Дважды убедитесь, что из вытяжки удалены все легковоспламеняющиеся и горючие материалы.
- Установите регулируемый контроль превышения температуры (если имеется) как минимум на 15 градусов (C) ниже безопасного предела температуры для работы. (Это управление обычно устанавливается с помощью отвертки сбоку или сзади устройства, как показано на рисунке. Инструкции по настройке максимальной температуры см. В руководстве оператора.Заводские настройки могут быть выше желаемых.)
- Надежно закрепите шланги конденсатора и датчики температуры.
- Не оставляйте устройство без присмотра, пока заданная температура не будет достигнута и поддерживается.
Различные методы нагрева
Масляные бани являются наиболее часто используемым методом нагрева реакции, поскольку они обеспечивают наилучшую передачу тепла от источника тепла к реакционной смеси. Однако использование масляных ванн сопряжено с риском.По возможности используйте источники тепла с термопарой или термостатом. Змеевики погружного нагрева (показаны справа) с оголенными электрическими проводниками НЕ допускаются в качестве источника тепла.
Убедитесь, что жидкие нагревательные бани установлены ровно на нагревательном аппарате, и постоянно следите за температурой. Независимо от того, какую среду вы используете, не заполняйте резервуар ванны более чем на половину.
Выбросьте обесцвеченную среду ванны, например материал, показанный слева.Черный цвет указывает на разрушение масла и загрязнение в результате разливов, которые могут изменить свойства носителя. Немедленно убирайте пролитое масло. Гексаны и другие неполярные растворители наиболее эффективны при ликвидации разливов нефти. Собирайте отработанное масло и маркируйте его отдельно от других потоков отходов. Укажите любое известное химическое загрязнение на этикетке отходов.
В зависимости от условий реакции потребуются ванны из разных материалов. Убедитесь, что среда ванны способна безопасно нагреваться до желаемой температуры.В таблице ниже перечислены некоторые из наиболее часто используемых носителей и их свойства. Носитель никогда не должен нагреваться до температуры воспламенения.
Материал ванны | Температура вспышки (oC) | Полезный диапазон (oC) |
Вода | NA | 0-70 |
Минеральное масло | 113 | 25-100 |
Силиконовое масло | 300 | 25-230 |
Смеси эвтектических солей (51.3% KNO3; 48,7% NaNO3 или 40% NaNO2; 7% NaNO3; 53% KNO3) | NA | 142-500 |
Песок | NA | 25-500 + |
Большинство масляных бань подходят для реакций нагрева <200 oC; однако для реакций, требующих более высоких температур, необходимо использовать нагревательные мантии и песчаные или соляные ванны.Аппараты обогревающего кожуха управляются с помощью регулятора переменного напряжения (Variac), поэтому температуру реакции необходимо контролировать напрямую. Никогда не полагайтесь только на относительное напряжение на шкале, чтобы определить, до какой температуры поднимется нагревательный кожух. Всегда постепенно регулируйте напряжение, пока не будет достигнута желаемая температура и не стабилизируется.
Общие процедуры с нагревательными плитами / камином
- ЗАПРЕЩАЕТСЯ хранить легковоспламеняющиеся или горючие материалы на нагревательном устройстве или рядом с ним.
- Отключайте нагревательное оборудование, когда оно не используется, или используйте таймер прибора, чтобы гарантировать, что источник тепла отключен от источника питания, когда в лаборатории нет людей. [См .: Предупреждение о безопасности: неисправности нагревательной плиты]
- Используйте пластины только для перемешивания при перемешивании в емкостях, не являющихся термостойкими, или при смешивании материалов, которые никогда не должны подвергаться нагреву, например, те, которые могут воспламениться, взорваться или выделять газ при нагревании.
- Никогда не используйте конфорки в холодном помещении. Холод и конденсат могут повредить оборудование.
- Дважды убедитесь, что термопара надежно закреплена в ванне, чтобы предотвратить неконтролируемый нагрев.
- НЕ используйте нагревательное оборудование с поврежденными шнурами или вилками, а также оборудование, которое не функционирует должным образом.
Скорая помощь
Контакты для экстренных случаев
Общую информацию о реагировании на чрезвычайные ситуации можно найти в Службе экстренной помощи
.Пожар
НИКОГДА не пытайтесь тушить огонь масляной ванны водой. Всегда храните песок в легкодоступном месте для тушения огня.
Тепло, температура и проводимость | Глава 2: Состояния материи
Примечание. Энергия также может передаваться посредством излучения и конвекции, но в этой главе речь идет только о передаче тепла посредством теплопроводности.
Обсудите, что происходит, когда ложку помещают в горячую жидкость, например суп или горячий шоколад.
Спросите студентов:
- Вы когда-нибудь клали металлическую ложку в горячий суп или горячий шоколад, а затем прикасались ложкой ко рту? Как вы думаете, что может происходить между молекулами супа и атомами в ложке, чтобы ложка стала горячей?
- В настоящее время учащимся не обязательно полностью отвечать на эти вопросы.Более важно, чтобы они начали думать, что что-то происходит на молекулярном уровне, что заставляет одно вещество делать другое горячее.
Раздайте каждому учащемуся лист с упражнениями.
Студенты будут записывать свои наблюдения и отвечать на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально в зависимости от ваших инструкций.Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся изучить, что происходит, когда металл комнатной температуры помещается в горячую воду.
Если вы не можете получить материалы для всех групп для выполнения этого задания, вы можете выполнить задание в качестве демонстрации или показать учащимся видеоролики «Нагревательные стиральные машины и охлаждающие стиральные машины».
Вопрос для расследования
Почему температура объекта меняется, когда он помещен в горячую воду?
Материалы для каждой группы
- 2 комплекта больших металлических шайб на шнурке
- Стакан из пенополистирола с горячей водой
- Вода комнатной температуры
- 2 термометра
- Градуированный цилиндр или стакан
Материалы для учителя
- 1 стакан из пенополистирола
- Термометр
- Плита или кофеварка
- Большой стакан или кофейник
Подготовка учителей
- С помощью веревки свяжите вместе 5 или 6 металлических шайб, как показано.Каждой группе учеников понадобится два набора шайб, завязанных веревкой.
- Повесьте один комплект стиральных машин для каждой группы в горячей воде на плите или в воде в кофеварке, чтобы стиральные машины могли нагреться. Эти стиральные машины должны оставаться горячими до второй половины работы.
- Другой набор следует оставить при комнатной температуре, и его можно раздать студентам вместе с материалами для упражнения.
- Непосредственно перед упражнением налейте около 30 миллилитров (2 столовых ложки) горячей воды (около 50 ° C) в чашку из пенополистирола для каждой группы.Обязательно налейте одну чашку горячей воды, чтобы использовать ее в качестве контроля.
Скажите студентам, что они собираются посмотреть, изменится ли температура горячей воды в результате помещения в воду металлических шайб комнатной температуры. Единственный способ узнать, вызывают ли стиральные машины изменение температуры, — это выпить чашку горячей воды без стиральных машин. Объясните, что у вас будет чашка с горячей водой, которая будет контрольным.
Вам нужно будет поместить термометр в чашку с горячей водой одновременно с учениками.Попросите учащихся записать начальную температуру контрольной панели в своих таблицах на листе действий вместе с начальной температурой их собственной чашки с горячей водой. Температура двух образцов должна быть примерно одинаковой.
Процедура
- Поместите в чашку термометр, чтобы измерить начальную температуру воды. Запишите температуру воды в столбце «До» таблицы на листе активности. Не забудьте также записать начальную температуру воды в контрольной чашке.
Используйте другой термометр для измерения температуры стиральных машин. Запишите это в колонку «До».
Примечание. Измерять температуру шайб обычным термометром немного неудобно, потому что между шариком термометра и поверхностью шайб есть небольшая точка соприкосновения. Стиральные машины должны иметь комнатную температуру.
Попросите учащихся сделать прогноз:
- Что произойдет с температурой воды и стиральных машин, если вы поместите стиральные машины в горячую воду?
Пока термометр все еще находится в воде, возьмитесь за шнур и полностью опустите металлические шайбы в горячую воду.
- Наблюдайте за любым изменением температуры воды. Оставьте стиральные машины в воде, пока температура не перестанет меняться. Запишите температуру воды в каждой чашке в столбце «После».
| Температура… | Перед | После |
|---|---|---|
| Вода в чашке | ||
| Вода в контрольной чашке | ||
| Металлические шайбы |
- Снимите шайбы с воды.Затем измерьте и запишите температуру стиральных машин в столбце «После».
- Опорожните чашку в контейнер для отходов или раковину.
Ожидаемые результаты
Температура воды немного снизится, а температура стиральных машин немного повысится. Величина понижения и повышения температуры на самом деле не так уж и важна. Важно то, что температура воды понижается, а в стиральных машинах повышается.
Подробнее об энергии и температуре читайте в разделе «Биография учителя».
Примечание. В конце концов, два соприкасающихся объекта с разной температурой будут иметь одинаковую температуру. Во время занятия мойки и вода, скорее всего, будут разной температуры. В этом упражнении стиральная машина и вода контактируют только в течение короткого времени, поэтому, скорее всего, температура не будет одинаковой.
Студенты могут спросить, почему температура воды снизилась на другую величину, чем повысилась температура стиральных машин.В воде осталось то же количество энергии, что и в стиральных машинах, но для изменения температуры разных веществ требуется другое количество энергии.
Предложите учащимся изучить, что происходит, когда горячий металл помещается в воду комнатной температуры.
Спросите студентов:
- Как вы думаете, изменится температура, если вы поместите горячие стиральные машины в воду комнатной температуры?
Налейте в контрольную чашку около 30 миллилитров воды комнатной температуры.Поместите термометр в чашку и скажите учащимся температуру воды.
- Налейте в чашку из пенополистирола около 30 миллилитров воды комнатной температуры.
- Поместите термометр в воду и запишите его температуру в столбце «До» таблицы на листе активности. Не забудьте также записать начальную температуру воды в контрольной чашке.
- Извлеките стиральные машины из горячей воды, в которой они нагревали, и быстро используйте термометр, чтобы измерить температуру стиральных машин.Запишите это в столбце «До» на листе занятий.
- Пока термометр все еще находится в воде, возьмитесь за шнур и полностью опустите горячие металлические шайбы в воду.
- Наблюдайте за любым изменением температуры воды. Оставьте стиральные машины в воде, пока температура не перестанет меняться. Запишите температуру воды в вашей чашке в столбце «После» в таблице ниже. Также запишите температуру воды в контрольной чашке.
- Выньте шайбы из воды.Измерьте и запишите температуру стиральных машин.
| Температура… | Перед | После |
|---|---|---|
| Вода в чашке | ||
| Вода в контрольной чашке | ||
| Металлические шайбы |
Ожидаемые результаты
Температура воды повышается, а температура стиральных машин понижается.
Обсудите наблюдения студентов и то, что могло вызвать изменение температуры металлических шайб и воды.
Спросите студентов:
- Как изменилась температура стиральных машин и воды в обеих частях деятельности?
- Исходя из своих данных, ученики должны понимать, что температура стиральных машин и воды изменилась.
- Почему, как вы думаете, изменилась температура, зная, что вы делаете с нагреванием и охлаждением атомов и молекул?
- Если необходимо, помогите студентам задуматься о том, почему температура каждого из них изменилась, спросив их, что, вероятно, движется быстрее, атомы в металлических шайбах или молекулы в воде.Скажите студентам, что анимация молекулярной модели, которую вы покажете дальше, покажет им, почему изменилась температура обоих.
Покажите две анимации, чтобы помочь учащимся понять, как энергия передается от одного вещества к другому.
Показать анимацию молекулярной модели Ложка с подогревом.
Укажите студентам, что молекулы воды в горячей воде движутся быстрее, чем атомы в ложке.Молекулы воды ударяются об атомы ложки и передают этим атомам часть своей энергии. Вот как энергия воды передается ложке. Это увеличивает движение атомов в ложке. Поскольку движение атомов в ложке увеличивается, температура ложки увеличивается.
Это нелегко заметить, но когда быстро движущиеся молекулы воды ударяются о ложку и ускоряют атомы в ложке, молекулы воды немного замедляются.Таким образом, когда энергия передается от воды к ложке, ложка становится теплее, а вода холоднее.
Объясните студентам: когда быстро движущиеся атомы или молекулы сталкиваются с более медленно движущимися атомами или молекулами и увеличивают их скорость, передается энергия. Передаваемая энергия называется теплом. Этот процесс передачи энергии называется проводимостью.
Покажите анимацию молекулярной модели «Охлажденная ложка».
Укажите студентам, что в этом случае атомы в ложке движутся быстрее, чем молекулы воды в холодной воде.Быстрее движущиеся атомы в ложке передают часть своей энергии молекулам воды. Это заставляет молекулы воды двигаться немного быстрее, а температура воды повышается. Поскольку атомы в ложке передают часть своей энергии молекулам воды, атомы в ложке немного замедляются. Это приводит к снижению температуры ложки.
Спросите студентов:
Опишите, как процесс проводимости вызвал изменение температуры омывателей и воды в процессе работы.
- Стиральные машины комнатной температуры в горячей воде
- Когда стиральные машины комнатной температуры помещаются в горячую воду, более быстро движущиеся молекулы воды ударяются о медленно движущиеся атомы металла и заставляют атомы в шайбах двигаться немного быстрее. Это вызывает повышение температуры стиральных машин. Поскольку часть энергии воды была передана металлу, чтобы ускорить их, движение молекул воды уменьшается. Это приводит к понижению температуры воды.
- Горячие стиральные машины в воде комнатной температуры
- Когда горячие металлические шайбы помещаются в воду комнатной температуры, более быстро движущиеся атомы металла сталкиваются с более медленно движущимися молекулами воды и заставляют молекулы воды двигаться немного быстрее. Это вызывает повышение температуры воды. Поскольку часть энергии от атомов металла была передана молекулам воды, чтобы ускорить их, движение атомов металла уменьшается. Это вызывает снижение температуры стиральных машин.
Обсудите связь между движением молекул, температурой и проводимостью.
Спросите студентов:
- Как движение атомов или молекул вещества влияет на температуру вещества?
- Если атомы или молекулы вещества движутся быстрее, это вещество имеет более высокую температуру. Если его атомы или молекулы движутся медленнее, значит, он имеет более низкую температуру.
- Что такое проводимость?
- Проводимость возникает, когда два вещества при разных температурах контактируют. Энергия всегда передается от вещества с более высокой температурой к веществу с более низкой температурой. По мере того как энергия передается от более горячего вещества к более холодному, более холодное вещество нагревается, а более горячее вещество — холоднее. В конце концов, два вещества становятся одной температуры.
Студенты склонны понимать нагревание, но часто имеют неправильное представление о том, как вещи охлаждаются.Так же, как нагревание вещества, охлаждение вещества также работает за счет проводимости. Но вместо того, чтобы сосредотачиваться на ускорении более медленных молекул, вы сосредотачиваетесь на замедлении более быстро движущихся молекул. Более быстрые атомы или молекулы более горячего вещества контактируют с более медленными атомами или молекулами более холодного вещества. Более быстрые атомы и молекулы передают часть своей энергии более медленным атомам и молекулам. Атомы и молекулы более горячего вещества замедляются, и его температура понижается.Объект или вещество не могут стать холоднее, если добавить им «холода». Что-то может стать холоднее, только если его атомы и молекулы передадут свою энергию чему-то более холодному.
Попросите учащихся нарисовать молекулярные модели, чтобы показать проводимость между ложкой и водой.
Примечание. На модели, которую вы покажете учащимся, изменение скорости как молекул воды, так и атомов в ложке представлено разным количеством линий движения.Учащиеся могут помнить, что, когда атомы или молекулы движутся быстрее, они отдаляются друг от друга, а когда они движутся медленнее, они сближаются. Для этого действия изменение расстояния между молекулами воды или между атомами в ложке не является фокусом, и поэтому оно не отображается в модели. Вы можете сказать учащимся, что модели могут выделять одну особенность над другой, чтобы помочь сосредоточиться на главном представляемом моменте.
Ложка комнатной температуры, помещенная в горячую воду
Проецируйте иллюстрации «Ложка в горячей воде до и после» из рабочего листа.
Попросите учащихся взглянуть на линии движения на картинке «До» на их рабочем листе. Затем спросите студентов, как изменится движение атомов и молекул на картинке «После». На листе действий вместе с проецируемым изображением нет линий движения на рисунке «После». Правильно их ввести — задача студентов.
Попросите учащихся добавить линии движения к иллюстрации «После» и добавить описательные слова, такие как «теплее» или «холоднее», чтобы описать изменение температуры воды и ложки.
Горячая ложка в воде комнатной температуры
Проектируйте иллюстрации Горячая ложка в воде комнатной температуры до и после из рабочего листа
Попросите учащихся посмотреть второй набор картинок «До» и «После». Попросите учащихся добавить линии движения к иллюстрации «После» и добавить описательные слова, такие как «теплее» или «холоднее», чтобы описать изменение температуры воды и ложки.
Покажите моделирование, чтобы проиллюстрировать, что температура — это средняя кинетическая энергия атомов или молекул.
Следующая симуляция показывает, что при любой температуре атомы или молекулы вещества движутся с разными скоростями. Некоторые молекулы движутся быстрее других, некоторые медленнее, но большинство находятся посередине.
Примечание. После нажатия кнопки «Старт» симуляция будет работать лучше всего, если вы переберете все кнопки перед тем, как использовать ее для обучения учащихся.
Показать температуру моделирования.
- Перебрав кнопки «Холодный», «Средний» и «Горячий», выберите «Средний», чтобы начать обсуждение с учащимися.Скажите студентам, что это моделирование показывает взаимосвязь между энергией, движением молекул и температурой.
Скажите студентам, что все, что имеет массу и движется, независимо от размера или размера, обладает определенным количеством энергии, называемой кинетической энергией. Температура вещества дает вам информацию о кинетической энергии его молекул. Чем быстрее движутся молекулы вещества, тем выше кинетическая энергия и температура. Чем медленнее движутся молекулы, тем ниже кинетическая энергия и температура.Но при любой температуре молекулы не все движутся с одинаковой скоростью, поэтому температура на самом деле является мерой средней кинетической энергии молекул вещества.
- Эти идеи применимы к твердым телам, жидкостям и газам. Маленькие шарики в симуляции представляют молекулы и меняют цвет, чтобы помочь визуализировать их скорость и кинетическую энергию. Медленные — синие, более быстрые — фиолетовые или розовые, а самые быстрые — красные. Объясните также, что скорость отдельных молекул изменяется в зависимости от их столкновений с другими молекулами.Молекулы передают свою кинетическую энергию другим молекулам посредством проводимости. Когда быстро движущаяся молекула сталкивается с более медленной молекулой, более медленная молекула ускоряется (и становится более красной), а более быстрая молекула замедляется (и становится более синей).
- Объясните, что при любой температуре большинство молекул движутся примерно с одинаковой скоростью и имеют примерно одинаковую кинетическую энергию, но всегда есть некоторые, которые движутся медленнее, а некоторые — быстрее. Температура на самом деле представляет собой комбинацию или среднее значение кинетической энергии молекул.Если бы вы могли поместить в эту симуляцию термометр, он бы столкнулся с молекулами, движущимися с разной скоростью, так что он регистрировал бы среднюю кинетическую энергию молекул.
Чтобы добавить энергии, начните с «Холодный», затем нажмите «Средний», а затем «Горячий».
Спросите студентов:
- Что вы замечаете в молекулах при добавлении энергии?
- По мере прибавления энергии больше молекул движется быстрее.Розовых и красных молекул больше, но есть еще более медленные синие.
Чтобы удалить энергию, начните с «Горячий», затем нажмите «Средний», а затем «Холодный».
Спросите студентов:
- Что вы замечаете в молекулах по мере удаления энергии?
- По мере удаления энергии большее количество молекул движется медленнее. Пурпурных и синих молекул больше, но некоторые все еще меняют цвет на розовый.
Предложите студентам попробовать одно или несколько расширений и использовать дирижирование, чтобы объяснить эти общие явления.
Сравните фактическую температуру и ее ощущения для различных предметов в комнате.
Спросите студентов:
- Коснитесь металлической части стула или ножки стола, а затем прикоснитесь к обложке учебника. Кажется, что эти поверхности имеют одинаковую или разную температуру?
- Они должны чувствовать себя по-другому.
- Почему металл становится холоднее, хотя его температура такая же, как у картона?
- Сообщите учащимся, что, хотя металл кажется холоднее, температура металла и картона на самом деле одинакова.Если учащиеся не верят этому, они могут использовать термометр, чтобы измерить температуру металла и картона в комнате. Находясь в одном помещении с одинаковой температурой воздуха, обе поверхности должны иметь одинаковую температуру.
Покажите анимацию «Проводя энергию», чтобы ответить на вопрос, почему металл холоднее картона.
Скажите студентам, чтобы они наблюдали за движением молекул в металле, картоне и в пальце.
Объясните: молекулы в вашем пальце движутся быстрее, чем молекулы металла, имеющего комнатную температуру.Таким образом, энергия вашего пальца передается металлу. Поскольку металл является хорошим проводником, энергия передается от поверхности через металл. Молекулы в вашей коже замедляются, поскольку ваш палец продолжает отдавать энергию металлу, поэтому ваш палец кажется более прохладным.
Подобно металлу, молекулы в вашем пальце движутся быстрее, чем молекулы в картоне, имеющем комнатную температуру. Энергия передается от пальца к поверхности картона.Но поскольку картон является плохим проводником, энергия не может легко отводиться от поверхности через картон. Молекулы в вашей коже движутся примерно с одинаковой скоростью. Поскольку ваш палец не теряет много энергии для картона, он остается теплым.
Сравните фактическую температуру с ощущением температуры воды и воздуха.
Попросите учащихся использовать два термометра для сравнения температуры воды комнатной температуры и температуры воздуха.Они должны быть примерно одинаковыми.
Спросите студентов:
- Опустите палец в воду комнатной температуры, а другой — в воздух. Кажется, что вода и воздух имеют одинаковую или разную температуру?
- Палец в воде должен стать холоднее.
- Почему вода кажется прохладнее, хотя ее температура такая же, как у воздуха?
- Напомните ученикам, что, хотя вода кажется более холодной, на самом деле вода и воздух примерно одинаковой температуры.

Leave A Comment