Таблица Менделеева для ЕГЭ по химии 2022 📓.
Таблица Менделеева для ЕГЭ по химии 2022 📓. | Университет СИНЕРГИЯКурс подготовки к ЕГЭ и ОГЭ. Идёт набор!
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности.
Какую профессию можно получить, сдав обществознание и английский
25.10.2022
Из чего складывается проходной балл
30.06.2022
Что значит первичный балл в ЕГЭ
14.06.2022
Самые высокооплачиваемые профессии, связанные с биологией
14.06.2022
Распределение баллов ЕГЭ по русскому языку
14.04.2022
Куда можно поступить после 9 класса с обществознанием и информатикой
28.03.2022
Смотреть все
Всё нужное в твоём телефоне
Скачай приложение и узнавай самую актуальную информацию
ПОДБЕРИ КУРС ЕГЭ И ОГЭ
Ответь на пять вопросов и узнай, где будешь учиться!
Подобрать программуОбразование для карьеры
К каким профессиям вы более склонны?
ТехническимГуманитарнымТворческимМедицинским
Какой у вас уровень образования?
Без образованияШкола 9-11 классКолледжБакалавриатМагистратураАспирантура
Какой формат обучения вам подходит?
ОчноЗаочноОнлайнПо выходным дням
Вас интересуют бюджетные места?
ДаНет
И последний вопрос. Вы из Москвы?
Вы из Москвы?
ДаНет
Мы подобрали вам программу обучения
Заполните форму, чтобы узнать больше о программе и наших предложениях
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Симферополь Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
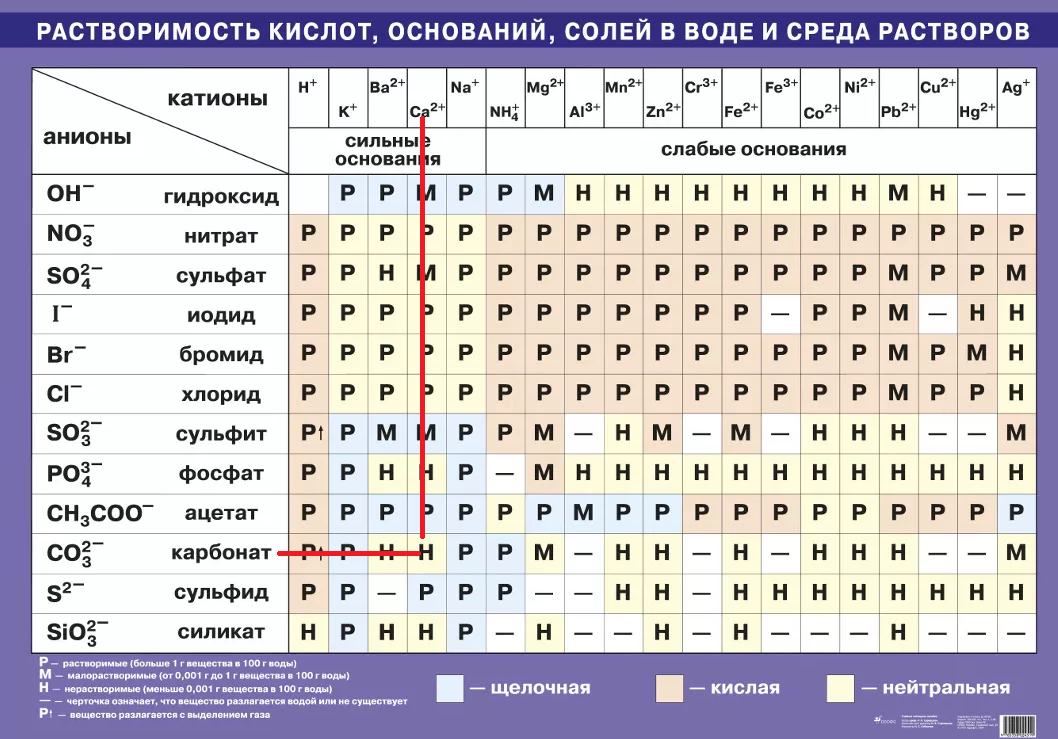
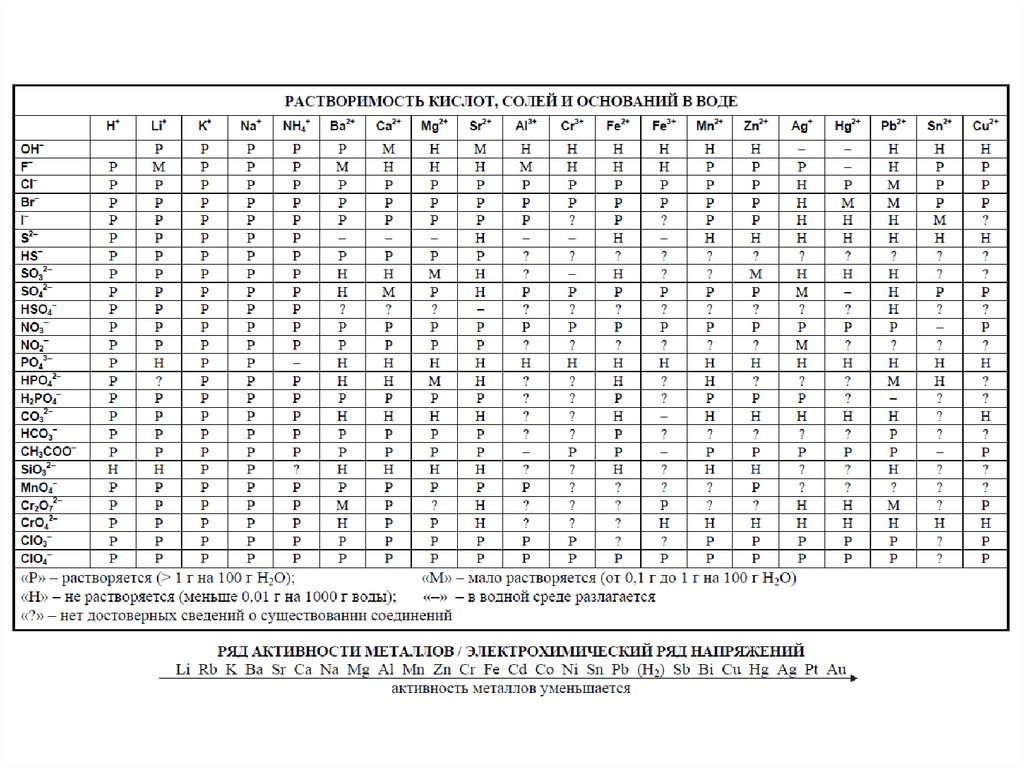
распечатать периодическую таблицу в хорошем качестве для ЕГЭ
Мы живем в мире химических элементов, которые окружают нас на каждом шагу. Да и наш собственный организм состоит из них. Вот почему так важно знать эти элементы и то, как они связаны между собой.
Да и наш собственный организм состоит из них. Вот почему так важно знать эти элементы и то, как они связаны между собой.
Периодическая таблица Менделеева явилась величайшим открытием в химии потому, что она доказала единство всех химических элементов и установила периодическую зависимость между ними. Дмитрий Иванович Менделеев на основе своей таблицы смог предсказать существование новых химических элементов, которые и были открыты впоследствии.
Что такое таблица Менделеева
Периодическая система элементов Д. И. Менделеева представляет собой классификацию химических элементов, в которой устанавливается зависимость между зарядом атомного ядра и свойствами элементов. Этот периодический закон имеет графическое изображение – ту самую таблицу, названную именем своего создателя, великого ученого Менделеева.
Периодическая система химических элементов Д.И. МенделееваРаспечатанную таблицу Менделеева можно использовать как шпаргалку при подготовке к контрольным работам и ЕГЭ.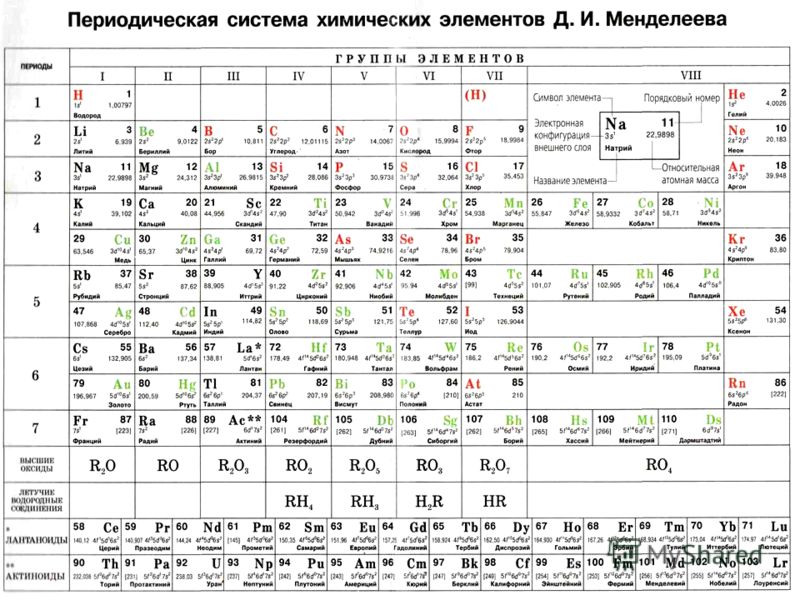
История открытия периодического закона Менделеевым
Активные попытки создания системы химических элементов предпринимались в середине ХIХ века. В это время уже были открыты 63 элемента, поэтому многих ученых интересовал поиск закономерности в их строении и свойствах. Периодическую систему пытались создать такие западные ученые, как И. Деберейнер, А. Э. Шанкуртуа, Д. А. Ньюлендс. Ближе всех к решению этой проблемы подошел Ю. Л. Мейер, который в дальнейшем претендовал на независимое от Менделеева открытие периодической таблицы. Однако его таблица не основывалась на периодическом законе и не позволяла предсказывать неизвестные еще химические элементы и их свойства. Поэтому честь открытия периодической таблицы по праву принадлежит Дмитрию Ивановичу Менделееву.
Существует легенда, что свое открытие периодического закона Д. И. Менделеев сделал во сне. Якобы ему приснилась вся таблица целиком, и наутро ему осталось только зарисовать ее. По поводу этой легенды сам Дмитрий Иванович заявлял, что работал над таблицей в течение 20 лет.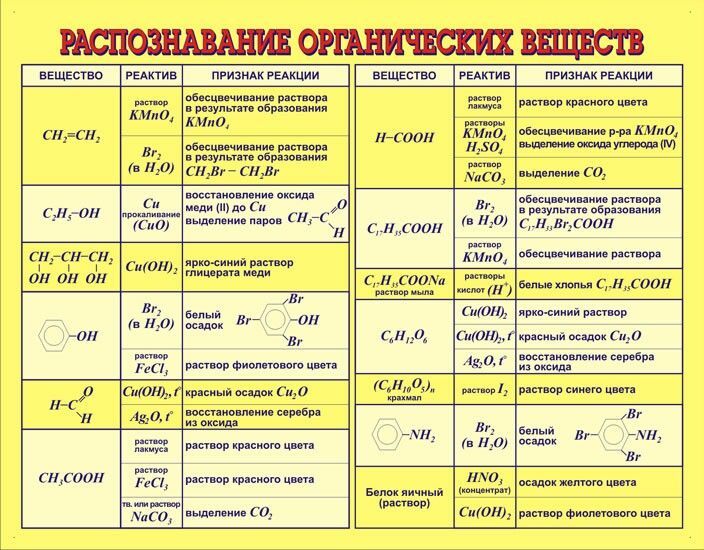 «А вы думаете: сидел и вдруг… готово», – писал он.
«А вы думаете: сидел и вдруг… готово», – писал он.
Свои научные изыскания великий русский химик проводил следующим образом. Он на отдельных карточках написал названия всех известных в то время элементов и их основные свойства. После этого он стал раскладывать карточки, пытаясь найти периодическую закономерность между этими элементами. Такой «химический пасьянс» требовал больших знаний, наблюдательности и кропотливого труда. В 1869 году был завершен первый вариант Периодической системы элементов. В 1871 году Д. И. Менделеев сформулировал периодический закон и создал второй вариант таблицы, усовершенствованный.
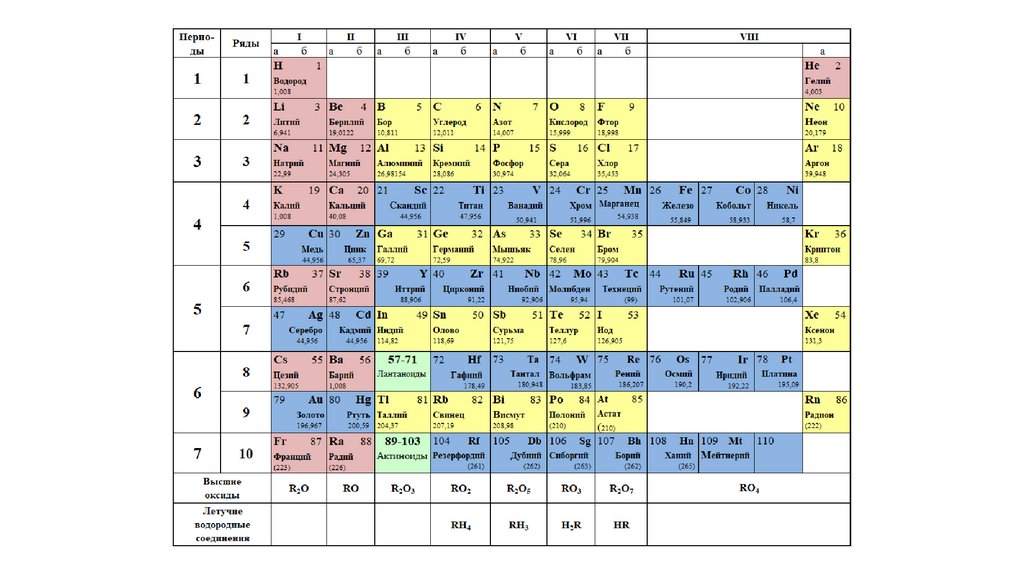
Группы и периоды Периодической системы
Группа Периодической системы химических элементов – это последовательность элементов в таблице Менделеева, расположенных по возрастанию заряда ядра атома и обладающих сходными свойствами. Номер группы зависит от количества электронов на внешней оболочке атома.
В настоящее время в таблице выделяют следующие группы: 1 – щелочные металлы, 2 – щелочноземельные металлы, 3 – подгруппа скандия, 4 – подгруппа титана, 5 – подгруппа ванадия, 6 – подгруппа хрома, 7 – подгруппа марганца, 8 – подгруппа железа, 9 – подгруппа кобальта, 10 – подгруппа никеля, 11 – подгруппа меди, 12 – подгруппа цинка, 13 – подгруппа бора, 14 – подгруппа углерода, 15 – подгруппа азота, 16 – подгруппа кислорода, 17 – галогены, 18 – инертные газы.
Период – это строка в Периодической таблице, где химические элементы расположены по возрастанию заряда ядра и заполнения электронами внешней электронной оболочки.
Элементы сгруппированы в 7 периодов. К малым периодам относятся первый (содержит 3 элемента), второй и третий (имеющие по 8 элементов). Остальные 4 периода называются большими и содержат по 18 и более элементов. Каждый период, кроме первого, начинается с металла и заканчивается благородным газом.
Расшифровка обозначений в таблице химических элементовСвойства элементов таблицы Менделеева
Периодический закон Д. И. Менделеева гласит: «Свойства химических элементов находятся в периодической зависимости от заряда ядра атома». Исходя из этого закона элементы и расположены в периодической таблице. У атомов элементов одной группы сходное строение внешней электронной оболочки. Поэтому они обладают похожими химическими свойствами. У атомов элементов одного периода одинаковое число энергетических уровней.
Свойства элементов в периодах слева направо изменяются следующим образом: увеличивается заряд ядер атомов, количество электронов на внешнем уровне, степень окисления и электроотрицательность; уменьшается радиус атомов и металлические свойства.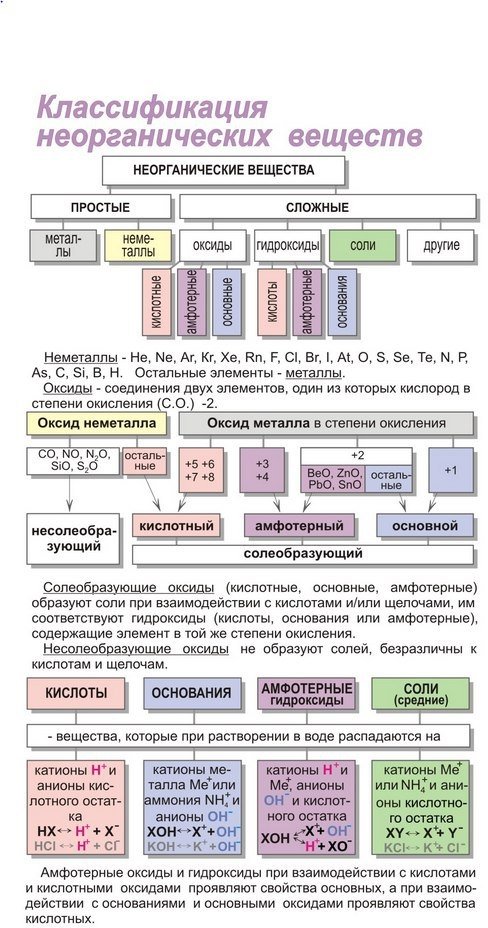
В группе сверху вниз происходят такие изменения свойств элементов: увеличивается заряд ядер атомов, радиус атомов, число электронных слоев, металличность; уменьшается электроотрицательность и прочность связи электронов внешнего уровня с ядром.
это интересно
Валентность
Что это такое, как ее определить и какова ее роль в химии. А также выясним, чем валентность отличается от степени окисления
подробнее
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок».
Сколько элементов в таблице Менделеева?
В настоящее время Периодическая таблица Менделеева содержит 118 химических элементов. Если учесть, что первоначальный вариант таблицы включал всего 63 элемента, то прогресс науки налицо. За последние полвека были открыты 17 новых элементов с порядковыми номерами от 102 до 118. Из них российские ученые открыли девять химических элементов. Таким образом, оказался полностью завершенным седьмой ряд Периодической таблицы Менделеева. Сейчас ведутся работы над синтезом 119 и 120 химических элементов. В России этой проблемой занимаются в Объединенном институте ядерных исследований в городе Дубна. Когда эти элементы будут синтезированы, они положат начало восьмому периоду таблицы.
Таким образом, оказался полностью завершенным седьмой ряд Периодической таблицы Менделеева. Сейчас ведутся работы над синтезом 119 и 120 химических элементов. В России этой проблемой занимаются в Объединенном институте ядерных исследований в городе Дубна. Когда эти элементы будут синтезированы, они положат начало восьмому периоду таблицы.
Как быстро выучить таблицу Менделеева?
Можно порекомендовать несколько способов. Желательно распечатать таблицу, чтобы она всегда была под рукой, и заглядывать в нее как можно чаще. Еще лучше – начертить ее своими руками и заполнить все необходимые клеточки.
Самостоятельно разделите таблицу на части и раскрасьте в разные цвета, как вам будет удобно. Постоянно обращайтесь к ее изучению в любое свободное время, например в общественном транспорте.
Ассоциируйте названия химических элементов с известными именами, событиями, фактами. Например, серебро (аргентум) похоже на Аргентину, железо (феррум) – на «Феррари», цезий – на Цезаря, бор – на Борна, карбон – на барона и так далее.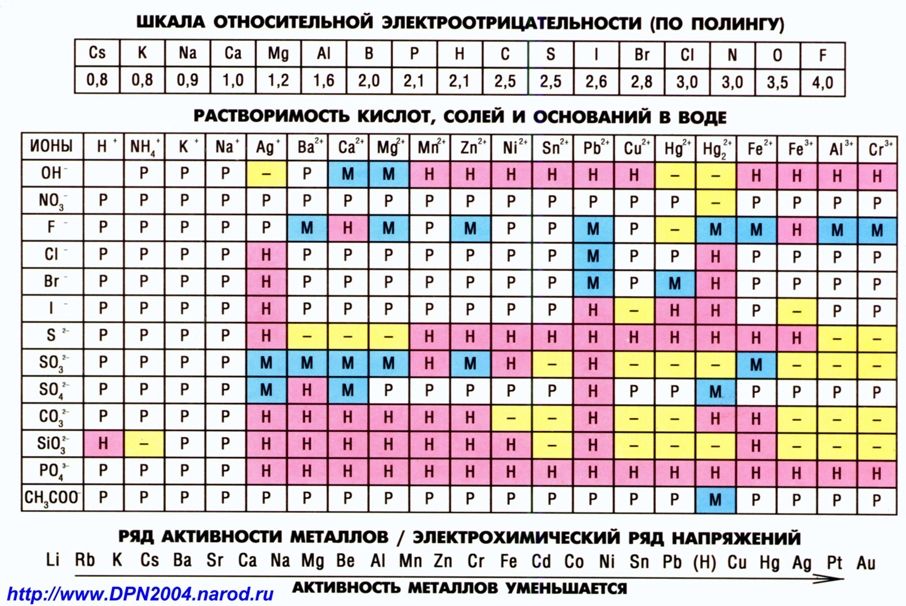
Хорошо зарекомендовало себя игровое обучение, когда для заучивания материала используются настольные и компьютерные игры. Таблица Менделеева может стать полем морского боя, где корабли носят наименования химических элементов.
Наконец, есть специальные стихотворения, которые также помогут запомнить содержание таблицы:
Самый первый — водород.
Это знает весь народ.
Гелий, литий и бериллий,
Бор, а следом — углерод,
Там азот, а за азотом
Двухвалентный Кислород.
Фтор с неоном, натрий, магний,
Алюминий, кремний тут.
Фосфор, сера, хлор с аргоном,
Калий с кальцием идут.
Как правильно пользоваться таблицей Менделеева?
Существует определенный алгоритм, который позволяет с помощью таблицы Менделеева получать необходимую информацию. Для этого лучше придерживаться следующей последовательности.
1. Таблица Менделеева начинается в левом верхнем углу и заканчивается в правом нижнем углу.
2. Каждый элемент обозначается одной или несколькими латинскими буквами. Узнайте полное название химического элемента.
Каждый элемент обозначается одной или несколькими латинскими буквами. Узнайте полное название химического элемента.
3. Найдите атомный номер (от 1 до 118). Он соответствует числу протонов в атоме и чаще всего количеству электронов. Каждый следующий элемент в таблице содержит на один протон больше.
4. Определите элементы со сходными физическими и химическими свойствами. Как правило, они располагаются в соответствующей вертикальной колонке и обозначаются одним цветом.
5. Каждая строка таблицы представляет собой период. Количество орбиталей в атомах соответствует номеру периода.
6. Узнайте, почему в таблице имеются пустые ячейки.
7. Научитесь различать в таблице металлы, неметаллы и металлоиды.
Таблица химических формул AP® и таблица Менделеева: формулы, которые нужно помнить
Table of ContentsЧто такое AP Chemistry Formula SheetПериодическая таблица элементов
AP® Chemistry — это курс, который охватывает много информации, включая значение и функции нескольких уравнений, констант и периодической таблицы.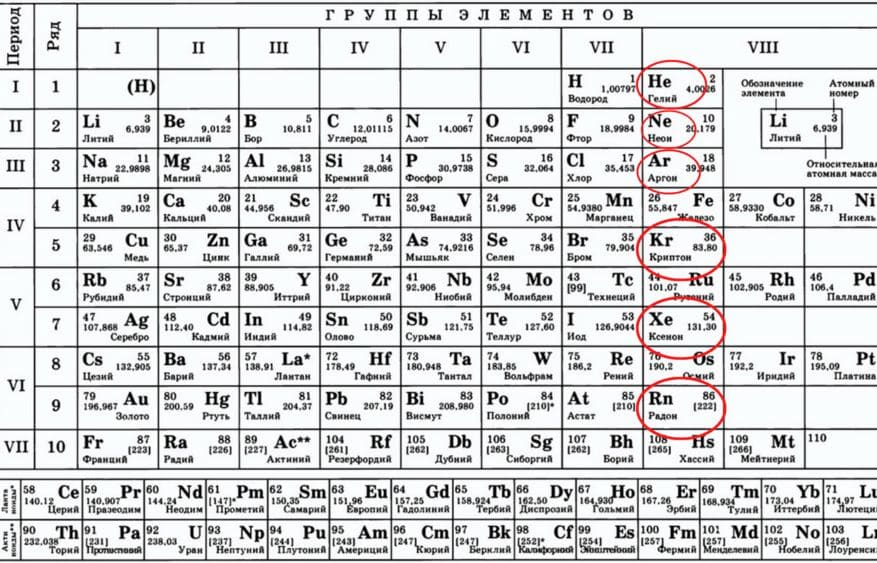 Это может показаться огромным количеством контента, но вы можете расслабиться, потому что вам не нужно запоминать все это!
Это может показаться огромным количеством контента, но вы можете расслабиться, потому что вам не нужно запоминать все это!
Что такое таблица формул AP Chemistry?
Лист формул AP Chemistry занимает две страницы и содержит сокращения единиц измерения, а также уравнения, константы и определения переменных, сгруппированных по темам. Таблица формул AP Chemistry и таблица Менделеева предоставляются в начале экзамена AP Chemistry как с множественным выбором, так и со свободным ответом.
Хотя вам, возможно, не придется запоминать всю информацию, предоставленную вам на листе уравнений AP Chemistry и периодической таблице, вам все же необходимо понимать содержащиеся в нем формулы и переменные, знать, как применять уравнения и понимать значение значений. по периодической таблице. Распечатка периодической таблицы AP Chemistry и таблицы формул AP Chemistry для использования во время практических тестов — отличная подготовка к экзамену.
Использование листа формул AP Chemistry
Чтобы сделать вашу подготовку к экзамену проще и быстрее, мы составили копию листа формул AP Chemistry, который обычно включается в ваш буклет экзамена AP Chemistry. Используйте этот лист при работе с вопросами на практических экзаменах AP Chemistry и ознакомьтесь со структурой уравнений и констант AP Chemistry. Это поможет вам быстро получить доступ к этим формулам при решении проблемы. Это значительно улучшит вашу скорость ответа на вопрос в день экзамена.
Используйте этот лист при работе с вопросами на практических экзаменах AP Chemistry и ознакомьтесь со структурой уравнений и констант AP Chemistry. Это поможет вам быстро получить доступ к этим формулам при решении проблемы. Это значительно улучшит вашу скорость ответа на вопрос в день экзамена.
Ниже приведено все, что вам нужно знать о том, какая информация содержится в таблице уравнений и периодической таблице AP Chemistry.
Единицы с первого взгляда
Ниже приведены единицы измерения, обычно используемые в AP Chemistry. Вы увидите эти аббревиатуры единиц, используемые на экзамене AP Chemistry.
Структура атома
Структура атома исследует состав атома, его электронную структуру и то, что происходит во время электронных переходов, когда фотон поглощается или испускается. Уравнения и константы, связанные с этими идеями, представлены в разделе «Атомная структура» листа уравнений AP Chemistry.
Энергия фотона уравнения
- Уравнение (1) показывает, как энергия E фотона связана с постоянной Планка h и частотой ν .

- Уравнение (2) связывает скорость света c с длиной волны λ и частотой ν .
Константы (числовое значение, которое всегда одинаково и не меняется), такие как постоянная Планка, скорость света, число Авогадро и заряд электрона.
Химия AP® — это сложно, но мы можем помочь.
Учитесь по расписанию, в своем темпе и по доступной цене.
Равновесие
Равновесие фокусируется на обратимых реакциях, включая некоторые кислотно-основные реакции, и на том, как изменение условий реакции влияет на направление реакции. Выполнение расчетов с использованием константы равновесия K и понимание того, что значение K подразумевает в отношении равновесных концентраций, необходимы для успешной сдачи экзамена AP Chemistry.
Раздел «Равновесие» листа формул AP Chemistry дает несколько уравнений, необходимых для задач, связанных с равновесной или кислотно-основной химией.
Константа равновесия K уравнения
- K определяется как отношение либо равновесных молярных концентраций, либо парциальных давлений продуктов над реагентами, где каждое возводится в степень соответствующего стехиометрического коэффициента (число перед продуктом или реагентом в сбалансированном уравнении реакции).

- Уравнение (1) определяет K c , константу равновесия при использовании равновесных молярных концентраций.
- Уравнение (2) определяет K p , константу равновесия при использовании парциальных давлений.
Уравнения кислотно-основной химии
- Константа равновесия для кислоты или основания представляет собой отношение равновесных концентраций ионов продукта к неионизированному реагенту. Это значение описывает силу кислоты или основания.
- Уравнение (3) определяет константу кислотного равновесия K a .
- Уравнение (4) определяет базовую константу равновесия K b .
- Уравнение (5) показывает автоионизацию воды K w .
- Уравнение (6) определяет, как рассчитать кислотность (pH) раствора, используя концентрацию ионов водорода [H + ].

- Уравнение (7) показывает, как рассчитать основность (pOH) раствора, используя концентрацию ионов гидроксида [OH — ].
- Уравнение (8) показывает, как в числовом выражении связаны pH и pOH.
- Уравнение (9) представляет собой уравнение Хендерсона-Хассельбаха, полученное из выражения K a и использующее pH, p K a и отношение концентраций сопряженного основания [A — ] и кислоты [HA].
- Уравнение (10) показывает, как выразить
- Уравнение (11) в этом разделе показывает, как выразить K b через p K b .
Кинетика
Кинетика фокусируется на скорости реакции или на том, как быстро происходит химическая реакция. Скорость реакции описывается законом скорости, а константа скорости k , используемая в выражениях закона скорости, рассчитывается путем измерения изменения концентрации реагентов во времени. Данные, полученные в результате измерения изменения концентрации реагентов во времени, наносятся тремя способами, и один из трех графиков будет линейным, что указывает на порядок реакции.
Данные, полученные в результате измерения изменения концентрации реагентов во времени, наносятся тремя способами, и один из трех графиков будет линейным, что указывает на порядок реакции.
Раздел «Кинетика» таблицы уравнений экзамена AP Chemistry содержит различные уравнения, которые можно использовать для расчета константы скорости k в зависимости от порядка реакции.
Интегральные уравнения скоростей
- Используя Уравнение (1) , можно вычислить k для реакций нулевого порядка.
- Используя Уравнение (2) , вы можете рассчитать k для реакций первого порядка.
- Использование Уравнение (3) , можно рассчитать k для реакций второго порядка.
- Период полураспада t 1/2 реакции – это время, за которое концентрация реагентов уменьшается вдвое.
- Уравнение (4) позволяет вам рассчитать k для реакций первого порядка, если вы знаете t 1/2 реакции.

Газы, жидкости и растворы
Вещество существует в различных состояниях (т. е. твердое, жидкое или газообразное), и твердые вещества можно растворить в жидкости, чтобы получить раствор. Различные состояния вещества и растворов проявляют различные макроскопические (то есть «крупномасштабные») свойства, такие как давление, плотность, температура и концентрация.
Раздел «Газы, жидкости и растворы» таблицы уравнений AP Chemistry содержит несколько уравнений, используемых для расчета различных макроскопических свойств газов, жидкостей и растворов, а также различные константы, используемые в этих уравнениях.
Уравнения газа
- Уравнение (1) — это закон идеального газа, который иллюстрирует поведение идеального газа и используется для предсказания поведения реального газа. Закон идеального газа показывает, что давление P и объем V прямо пропорциональны количеству молей газа n и температуре T .

- Уравнение (2) использует мольную долю X A и общее давление P Всего в контейнере для расчета парциального давления одного компонента P A в образце.
- Уравнение (3) показывает, что общее давление P total в контейнере представляет собой сумму парциальных давлений каждого компонента ( P A , P B и т. д.) в образце.
- Уравнение (4) показывает, как рассчитать количество молей n вещества, используя массу м и молярная масса м этого вещества. Это уравнение не ограничивается использованием в газовых уравнениях. Несколько различных типов расчетов требуют
Уравнения молекулярного движения
- Уравнение (5) показывает, как преобразовать температуру T в градусах Цельсия (°C) в Кельвины (K). Важно знать, что делать с уравнениями, требующими температуры Кельвина, такими как закон идеального газа.

- Уравнение (7) показывает, как масса m и скорость v используются для расчета кинетической энергии KE молекулы.
Решения уравнений
- Уравнение (6) показывает, что плотность D вещества есть отношение массы m к объему V.
- Уравнение (8) описывает, как рассчитать концентрацию (молярность) раствора, используя количество молей растворенного вещества и объем раствора.
- Уравнение (9) в этом разделе представляет собой закон Бера, который используется в УФ-видимой спектроскопии (измерении поглощения УФ-видимого света раствором при разных длинах волн). Закон Бера описывает взаимосвязь между коэффициентом поглощения A, молярным коэффициентом поглощения ε, длиной пути b сосуда, через который проходит свет, и концентрацией раствора c.
Константы
Даны три значения газовой постоянной R (используемой в законе идеального газа). Единственная разница между каждым значением заключается в единицах давления.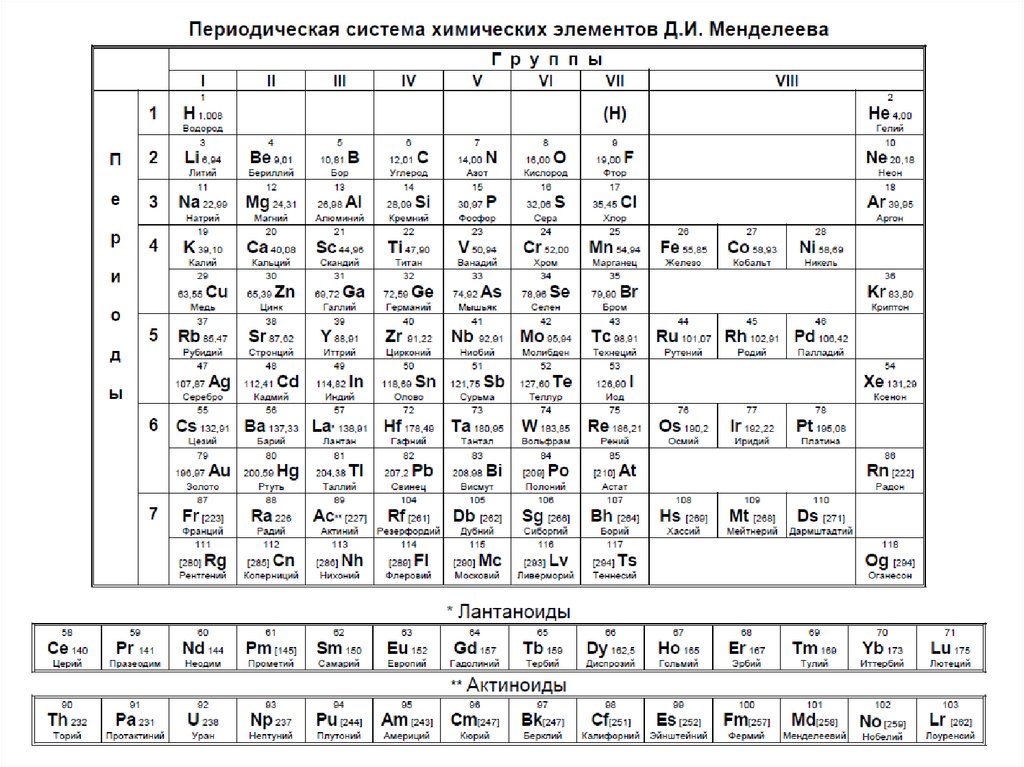 Вы можете использовать любое из этих значений в уравнении закона идеального газа, если единицы давления для значения R соответствует единицам давления для P .
Вы можете использовать любое из этих значений в уравнении закона идеального газа, если единицы давления для значения R соответствует единицам давления для P .
Откладываете подготовку к экзамену AP?
Хотите учиться, но не можете сосредоточиться? Сделайте UWorld своим компаньоном.
Также приведены условия СТП (стандартная температура и давление) и молярный объем идеального газа при СТП.
Термодинамика/электрохимия
Термодинамика фокусируется на связи между свободной энергией Гиббса G , энтальпией H и энтропией S , и как изменение стандартной свободной энергии Гиббса Δ G ° связано с благоприятностью химической реакции.
Электрохимия охватывает гальванические и электролитические элементы, как определить стандартный потенциал элемента E ° и свободную энергию элемента, а также как применить уравнение Нернста и закон Фарадея.
Последний раздел листа формул AP Chemistry содержит несколько уравнений и констант, используемых в задачах, связанных с термодинамикой и электрохимией.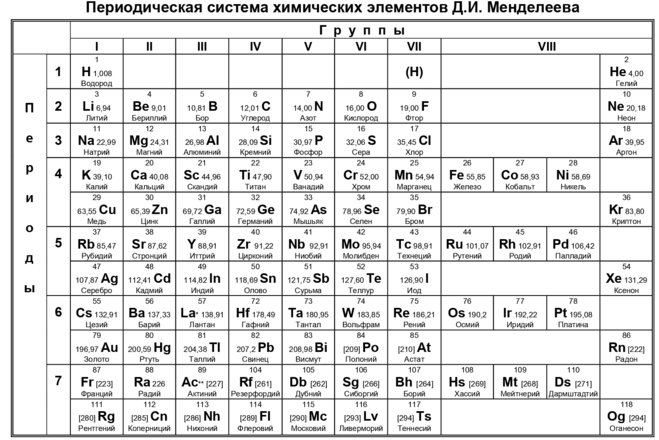
Уравнения термодинамики
- Уравнение (1) используется для определения количества тепла q поглощаемого или выделяемого веществом и требует знания массы вещества m , удельной теплоемкости этого вещества c , а изменение температуры Δ T (т.е. T конечное − T начальное ) в ℃. Это уравнение часто используется в задачах калориметрии.
- Уравнение (2) показывает, что стандартное изменение энтропии Δ S ° для реакции рассчитывается путем вычитания суммы стандартных энтропий продуктов S ° продуктов из суммы стандартных энтропий реагенты S ° реагенты .
- Уравнение (3) используется для расчета стандартного изменения энтальпии Δ H ° для реакции. Δ H ° определяется вычитанием суммы стандартных энтальпий образования продуктов Δ H f ° продуктов из суммы стандартных энтальпий образования реагентов Δ H f ° реагентов .

- Уравнение (4) показывает, что стандартное изменение свободной энергии Гиббса Δ G ° для реакции находится вычитанием суммы стандартных свободных энергий образования продуктов Δ G f ° произведения из суммы стандартных свободных энергий образования реагентов Δ H f ° реагенты .
- Не забудьте умножить значения S °, Δ H f ° и Δ G f ° из сбалансированного уравнения реакции на стехиометрический коэффициент .
- Уравнение (5) связывает стандартное изменение свободной энергии Гиббса Δ G ° с изменениями энтальпии Δ H °, энтропии Δ S °, а температура Δ T .
- Уравнение (6) связывает стандартное изменение свободной энергии Гиббса Δ G ° и константу равновесия K .
Уравнения электрохимии
- Уравнение (7) показывает, как рассчитать Δ G ° электрохимической ячейки, используя число переданных электронов n , стандартную ячейку и потенциал Фарадея F Е °.

- Уравнение (8) дает взаимосвязь между током I , зарядом q и временем t . Это уравнение используется вместе с законом Фарадея в задачах, связанных с электролизом.
- Уравнение (9) представляет собой уравнение Нернста, которое используется для определения E ячейки в нестандартных условиях (стандартными условиями являются концентрации раствора 1 М, давление в системе 1 атм и температура 25 ℃).
Константы
Приведена постоянная Фарадея F , которая используется в некоторых расчетах Δ G ° и уравнения Нернста. Дано соотношение между вольтами, джоулями и кулонами.
Периодическая таблица элементов
Вам также предоставляется периодическая таблица элементов для справки на экзамене AP по химии. Периодическая таблица содержит ценную информацию, которую вы будете использовать для решения различных задач на экзамене. Ниже приведены компоненты, содержащиеся в каждом квадрате периодической таблицы, и некоторые особенности периодической таблицы AP Chemistry, с которыми вы должны быть знакомы в день экзамена.
- Каждый квадрат периодической таблицы содержит
- Атомный номер в верхней части квадрата. Это значение соответствует количеству протонов в ядре.
- Уникальный одно- или двухбуквенный химический символ для соответствующего элемента в центре квадрата.
- Внизу квадрата находится атомная масса (молярная масса) , выраженная в а.е.м. или г/моль. Это значение говорит вам о массе одного моля элемента.
- Номер группы расположен в верхней части каждого столбца периодической таблицы.
Поздравляем! Вы завершили обзор важных уравнений, констант и частей периодической таблицы на листе уравнений, который выдали вам на экзамене AP Chemistry. Вы будете готовы решать проблемы с помощью таблицы уравнений с уверенностью и опытом! Просто помните, чтобы успешно сдать экзамен AP Chemistry, важно знать как структуру листа формул, так и то, как применять уравнения и константы к любым математическим задачам, с которыми вы сталкиваетесь.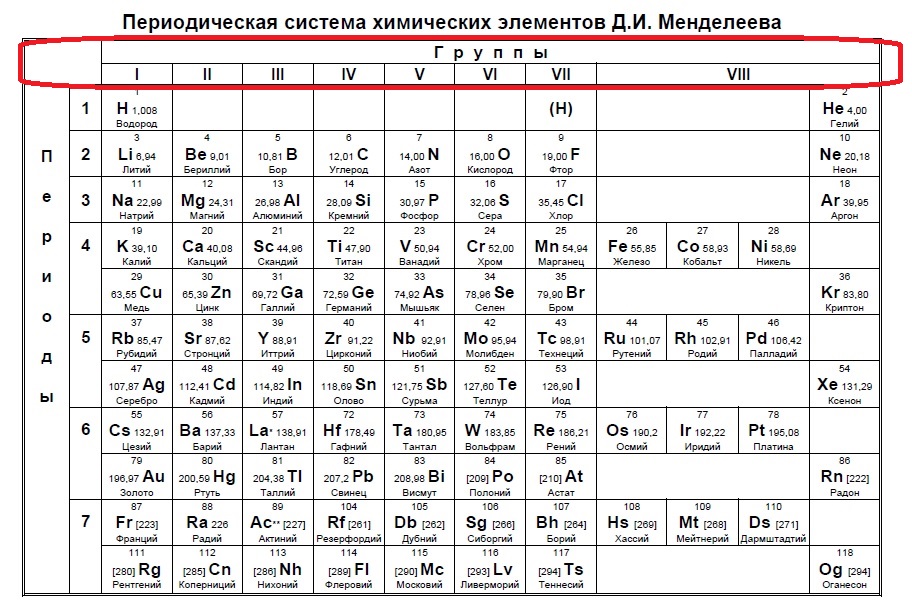
Не откладывайте подготовку к экзаменам AP!
Позвольте нам помочь вам раскрыть секрет успеха AP. Учитесь умнее с визуальным обучением.
Узнайте больше о программе AP Chemistry
Учебное пособие и материалы программы AP Chemistry
Хотите узнать о стратегиях начисления очков для поступления в элитные школы? Посетите наше созданное экспертами учебное пособие AP Chem со всеми необходимыми ресурсами для успешной сдачи экзамена.
Описание курса и экзамена AP Chem
Хотите знать, как выглядит каждый раздел, тема и концепция в AP Chemistry? Узнайте о каждом из 9единиц, 4 больших идеи и 6 лабораторных работ в нашем CED AP Chemistry.
Формат экзамена AP по химии
Формат экзамена AP может сбивать с толку. Ознакомьтесь с нашей статьей о формате экзамена AP по химии, в которой объясняется формат экзамена, типы вопросов и многое другое!
Об экзамене AP Chemistry
Хотите лучше понять курс и экзамен AP Chem? Мы составили список часто задаваемых вопросов, а также ценную информацию об AP Chemistry.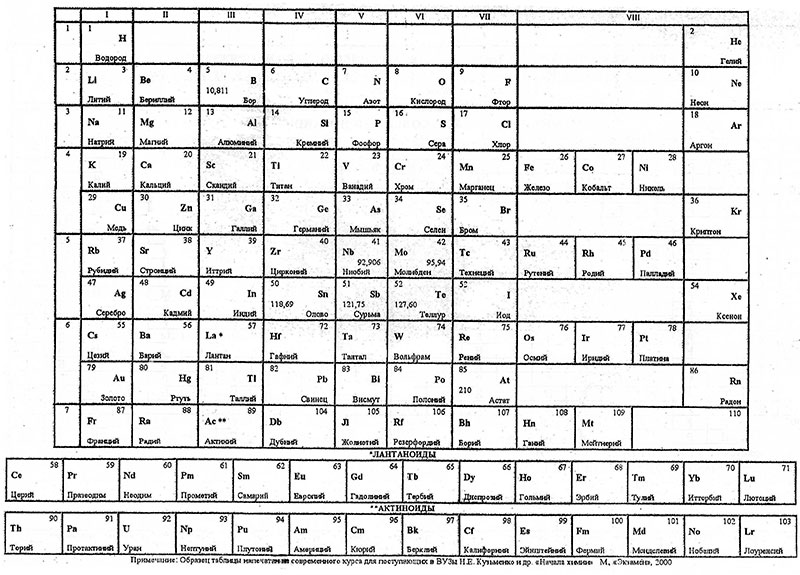
Что на нем и как им пользоваться
Студентам, изучающим AP Chemistry, нужно запоминать много информации, но у нас есть хорошие новости! Во время экзамена AP у вас будет доступ к листу формул, который включает периодическую таблицу, а также полезные уравнения. Однако вам нужно хорошо понимать, что содержится в листе формул AP Chem и как его использовать, чтобы максимально использовать его во время теста.
В этом руководстве мы объясним все, что вам нужно знать о справочной таблице AP Chemistry. Мы рассмотрим, как выглядит лист формул, что он включает, какую важную информацию он не содержит, но которую вы должны знать, и как вы можете извлечь из него максимальную пользу.
Что указано в таблице формул AP Chem?
Справочный лист AP Chemistry на самом деле состоит из трех страниц информации. Он будет находиться в начале разделов теста с несколькими вариантами ответов и разделов со свободным ответом, поэтому у вас будет доступ к нему на протяжении всего экзамена AP по химии.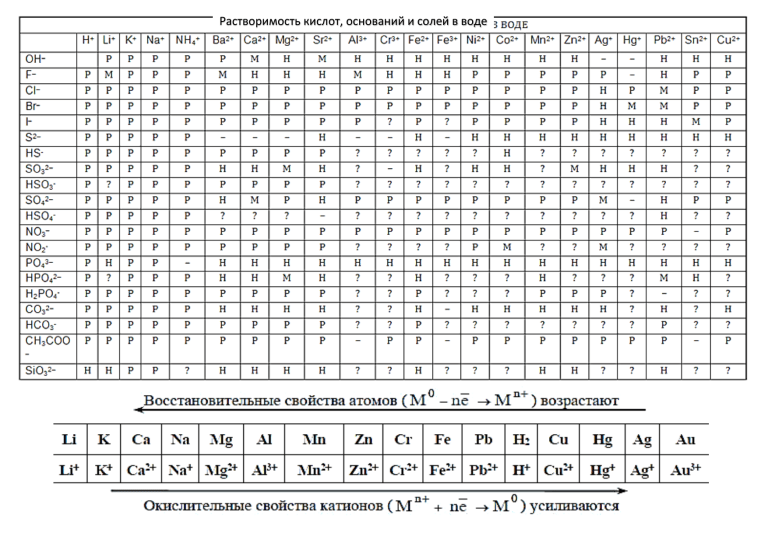 Это означает, что вам не нужно запоминать какую-либо информацию, содержащуюся в листе формул.
Это означает, что вам не нужно запоминать какую-либо информацию, содержащуюся в листе формул.
Так что же написано в этом справочном листе AP Chem? Проверьте это здесь на страницах 2-4, а также на скриншотах ниже (нажмите на каждое изображение, чтобы увеличить).
Таблица уравнений AP Chem охватывает шесть основных тем.
- Периодическая таблица элементов
- Атомная структура
- Равновесие
- Кинетика
- Газы, жидкости и растворы
- Термодинамика/электрохимия
Периодическая таблица элементов
Таблица уравнений AP Chem включает полную периодическую таблицу. Для каждого элемента он включает название элемента, символ, атомный номер и атомную массу.
Атомная структура
- 2 уравнения
- Значения для:
- постоянная Планка
- Скорость света
- Номер Авогадро
- Заряд электрона
Равновесие
- 9 уравнений
Кинетика
- 3 уравнения
Газы, жидкости и растворы
- 9 уравнений
- Значения для:
- Газовая постоянная (3)
- 1 атм
- СТП
- Идеальный газ при STP
Термодинамика/электрохимия
- 9 уравнений
- Значения для:
- Постоянная Фарадея
Чего нет в формуляре AP Chem, что необходимо знать для экзамена?
Хотя справочная таблица AP Chemistry хорошо охватывает большинство уравнений, которые вам нужно знать для экзамена, в ней отсутствует некоторая информация.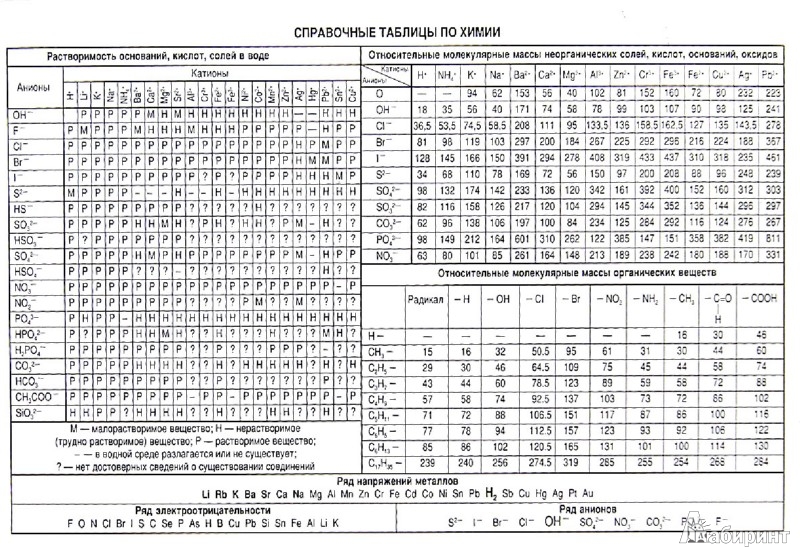 Это то, что мы рассмотрим в этом разделе. Обязательно выучите эти уравнения для экзамена.
Это то, что мы рассмотрим в этом разделе. Обязательно выучите эти уравнения для экзамена.
Закон скорости
Один из законов, который вы изучаете в AP Chemistry, заключается в том, что при постоянной температуре скорость химической реакции зависит только от концентраций веществ, влияющих на скорость. Эти вещества обычно являются реагентами, но могут также включать продукты и катализаторы.
Формула закона скорости: скорость = k [A] a [B] b
[A] и [B] представляют собой молярные концентрации реагентов
k — постоянная скорость 903 (которая варьируется в зависимости от реакции и температуры)
a и b обычно являются положительными целыми числами, которые должны быть найдены экспериментально
Закон скорости используется для оценки взаимосвязи между скоростью реакции и концентрациями реагентов. Вы можете увидеть это в вопросах, связанных с кинетикой.
Закон Кулона
Закон Кулона гласит, что величина электрической силы между зарядами q 1 и q 2 прямо пропорциональна величине зарядов и обратно пропорциональна квадрату расстояния между ними. Вы можете увидеть это в вопросах электрохимии.
F= k (q 1 q 2 /r)
F= электрическая сила
K = константа кулонов
Q 1 и Q 2 = Зарядки
R = Расстояние разделения
Важные проценты
Вам может потребоваться использование этих уравнений на любом крыш. Они определяют, насколько точные оценки сравниваются с фактическими результатами.
%ошибка = ((фактическое значение — теоретическое значение)/(теоретическое значение))*100
%выход = (фактический выход/теоретический выход)*100
Ищете помощь в подготовке к экзамену AP?
Наши индивидуальные услуги онлайн-репетиторов AP помогут вам подготовиться к экзаменам AP. Найди лучшего репетитора, получившего высокий балл на экзамене, к которому ты готовишься!
Найди лучшего репетитора, получившего высокий балл на экзамене, к которому ты готовишься!
4 совета по получению максимальной отдачи от листа формул AP Chem
Лист формул AP Chemistry может быть чрезвычайно полезен во время экзамена, но только если вы знаете, как правильно им пользоваться. Вот четыре совета, как извлечь из этого максимальную пользу.
#1: Знайте, как использовать каждое уравнение на листе формул AP Chem
Справочный лист AP Chem содержит 32 уравнения, , и вы должны знать, как каждое из них работает до дня тестирования. Совет колледжей не из тех, кто включает лишнюю информацию в листы с формулами, поэтому , если формула включена в лист, это означает, что есть большая вероятность, что вам нужно будет использовать ее на экзамене. Вы же не хотите тратить свой экзамен на то, чтобы научиться пользоваться, скажем, уравнением Планка, и надеяться, что у вас все получится!
Задолго до экзамена обязательно просмотрите каждую формулу на листе и убедитесь, что вы ее понимаете и знаете, как ее использовать.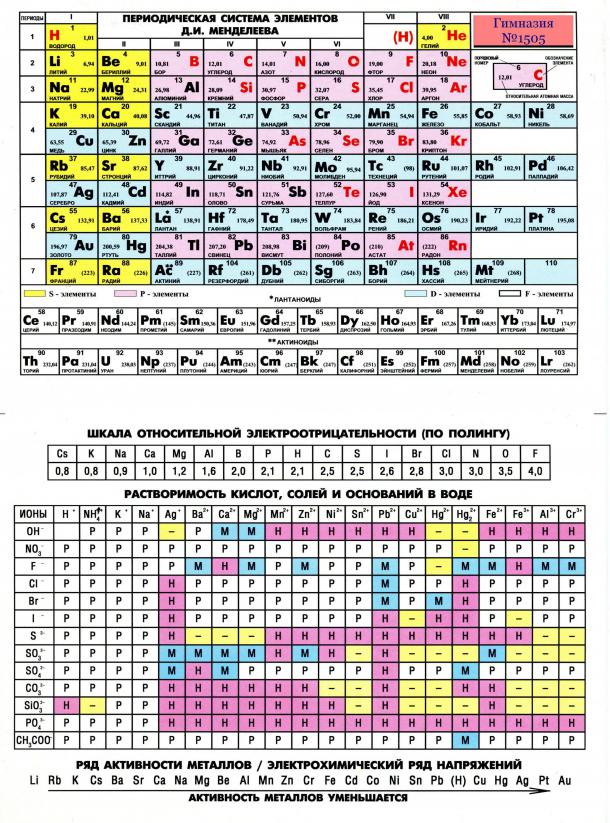 Ключи, включенные в лист формул, также полезны для выяснения того, что различные переменные представляют в уравнениях, поэтому не пренебрегайте ими.
Ключи, включенные в лист формул, также полезны для выяснения того, что различные переменные представляют в уравнениях, поэтому не пренебрегайте ими.
#2. Используйте калькулятор с умом
Вам разрешено пользоваться графическим калькулятором в части экзамена со свободными ответами, но не в части с несколькими вариантами ответов. Вы можете эффективно использовать свой калькулятор, запрограммировав в него константы и формулы, чтобы упростить решение уравнений. Однако не думайте, что это означает, что вы отказываетесь от понимания самих формул. Вам по-прежнему необходимо знать, когда и как использовать каждое уравнение в справочной таблице AP Chemistry 9.0605 , не говоря уже о том, что у вас не будет калькулятора для вопросов с несколькими вариантами ответов. Так что знайте, когда ваш калькулятор полезен, но не слишком на него полагайтесь.
№3. Прохождение пробных тестов с использованием таблицы формул
Ответы на практические вопросы и прохождение пробных тестов с использованием таблицы формул AP Chem являются ключом к успешной сдаче экзамена. Перед настоящим экзаменом AP вам следует пройти несколько пробных тестов по химии. Для каждого из них используйте официальную таблицу формул. Ваш учитель также, вероятно, даст вам копию формуляра AP Chem для ваших экзаменов в классе, так что вы тоже сможете немного попрактиковаться.
Перед настоящим экзаменом AP вам следует пройти несколько пробных тестов по химии. Для каждого из них используйте официальную таблицу формул. Ваш учитель также, вероятно, даст вам копию формуляра AP Chem для ваших экзаменов в классе, так что вы тоже сможете немного попрактиковаться.
Если вам нужна помощь в поиске практических тестов, ознакомьтесь с нашим руководством, в частности, о том, где найти лучшие практические вопросы и тесты AP Chemistry.
#4: Станьте экспертом по периодической таблице
Если и есть гарантия сдачи экзамена AP по химии, так это то, что во время теста вам нужно будет смотреть на прилагаемую периодическую таблицу. Периодическая таблица, включенная в лист уравнений AP Chemistry, содержит всю информацию, которая вам понадобится, чтобы ответить на вопросы о ней. Однако это не означает, что вы можете игнорировать его, пока не придет время сдавать тест. Очень важно быть знакомым с периодической таблицей в течение всего года. Вы должны знать, что представляет собой каждое значение в таблице, как использовать числа групп для определения количества связей и валентных электронов, которые может образовать элемент, и каковы ключевые периодические тенденции. Больше всего времени уделяйте группам 1-8А, так как именно эти элементы будут проверяться чаще всего.
Вы должны знать, что представляет собой каждое значение в таблице, как использовать числа групп для определения количества связей и валентных электронов, которые может образовать элемент, и каковы ключевые периодические тенденции. Больше всего времени уделяйте группам 1-8А, так как именно эти элементы будут проверяться чаще всего.
Что дальше?
Чем отличаются занятия и экзамены AP Physics? Узнайте разницу между Физикой 1, Физикой 2 и Физикой С в нашем руководстве по физике AP.
Сколько всего курсов AP вы должны пройти? Что делать, если вы хотите поступить в школу Лиги плюща? Ознакомьтесь с нашими рекомендациями по загрузке курса AP здесь.
Тоже готовишься к ACT/SAT? Придумайте целевой балл ACT или SAT на основе ваших лучших школ.
Хотите улучшить свой балл SAT на 160 баллов или свой балл ACT на 4 балла? Для каждого теста мы составили руководство по 5 основным стратегиям, которые вы должны использовать, чтобы попытаться улучшить свой результат.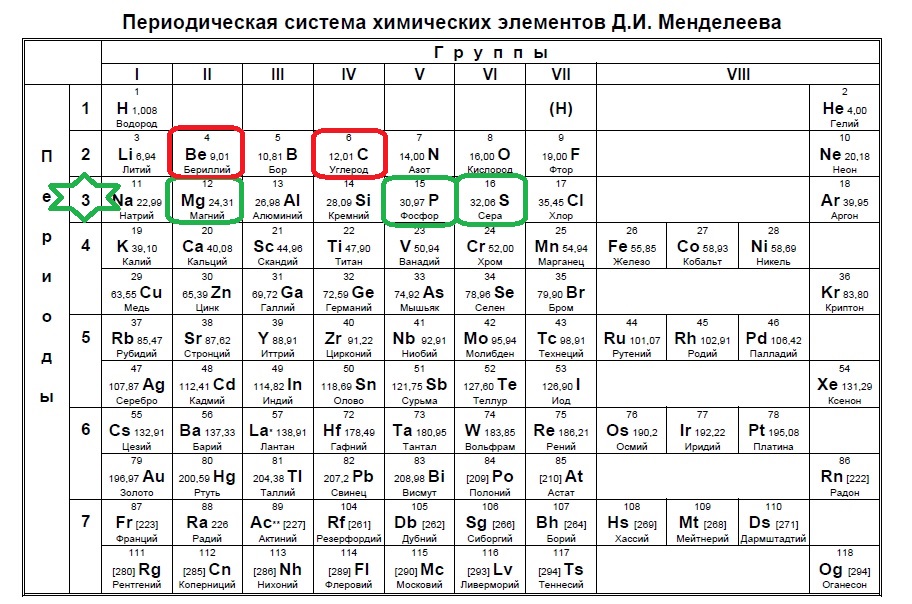





Leave A Comment