Четвёртый период периодической системы — это… Что такое Четвёртый период периодической системы?
К четвёртому пери́оду периоди́ческой систе́мы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами, а остальные относятся к р-блоку. Следует обратить внимание, что заполненные 3d-орбитали появляются только у элементов 4 периода. Все элементы этого периода имеют стабильные изотопы, следовательно, они могут встречаться в природе.
Элементы
Заметим, что исключение из эмпирического правила Клечковского, составляют следующие элементы: хром (Cr), никель (Ni) и медь (Cu).
Калий
Калий (K) — лёгкий серебристый щелочной металл с атомным номером 19 и атомной массой 39,0983. В природе встречается в виде двух стабильных изотопов: 39К (93,10% по массе) и 41К (6,88%), а также одного радиоактивного 40К (0,02%). Период полураспада калия-40 составляет 1,28 миллиарда лет.[2] Калий очень мягок, легко режется ножом и поддается прессованию и прокатке. Химически очень активен, легко взаимодействует с кислородом воздуха с образованием смеси, состоящей из пероксида К
Содержание калия в земной коре 2,41% по массе, калий входит в первую десятку наиболее распространённых элементов (7-е место). Калий — один из важнейших биогенных элементов, постоянно присутствующий во всех клетках живых организмов. Ионы калия участвуют в работе ионных каналов и регуляции проницаемости биологических мембран, в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия.
Кальций
Кальций (Ca) — серебристо-белый щелочноземельный металл с атомным номером 20 и атомной массой 40,078. Из-за высокой реактивности с водой в природе в чистом виде не встречается.[3] По распространённости в земной коре занимает 5-е место (минералы: кальцит, гипс, флюорит и др.).[4]
Как активный восстановитель кальций служит для получения урана (U), тория (Th), ванадия (V), хрома (Cr), цинка (Zn), бериллия (Be) и других металлов из их соединений. Используется для раскисления сталей, бронз и т. д. Входит в состав антифрикционных материалов.
Кальций — пятый по количеству из присутствующих в человеческом организме минеральных компонентов: примерно 1000-1200 г в теле взрослого человека. Основная роль кальция — организация целостной скелетной системы, в которой и находится 99% всего кальция организма. Оставшийся 1% играет важнейшую роль в свертывании крови, генерации и передаче нервных импульсов, сокращении мышечных волокон, активации определённых ферментативных систем и выделении некоторых гормонов.[5]
Примечания
Ссылки
Четвёртый период периодической системы — Карта знаний
Источник: Википедия
Связанные понятия
Ко второ́му пери́оду периоди́ческой систе́мы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Второй период содержит…Четвёртый период периодической системы — Википедия. Что такое Четвёртый период периодической системы
К четвёртому пери́оду периоди́ческой систе́мы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами, а остальные относятся к р-блоку. Следует обратить внимание, что заполненные 3d-орбитали появляются только у элементов 4 периода. Все элементы этого периода имеют стабильные изотопы, все они встречаются в природе.[1]
Элементы
Заметим, что исключение из эмпирического правила Клечковского, составляют следующие элементы: хром (Cr), никель (Ni) и медь (Cu).
Калий
Калий (K) — лёгкий серебристый щелочной металл с атомным номером 19 и атомной массой 39,0983. В природе встречается в виде двух стабильных изотопов: 39К (93,10% по массе) и 41К (6,88%), а также одного радиоактивного 40К (0,02%). Период полураспада калия-40 составляет 1,28 миллиарда лет.[2] Калий очень мягок, легко режется ножом и поддается прессованию и прокатке. Химически очень активен, легко взаимодействует с кислородом воздуха с образованием смеси, состоящей из пероксида К2О2 и супероксида KO2(К2О4). В природе в чистом виде не встречается.
Содержание калия в земной коре 2,41% по массе, калий входит в первую десятку наиболее распространённых элементов (7-е место). Калий — один из важнейших биогенных элементов, постоянно присутствующий во всех клетках живых организмов. Ионы калия участвуют в работе ионных каналов и регуляции проницаемости биологических мембран, в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия.
Кальций
Кальций (Ca) — серебристо-белый щелочноземельный металл с атомным номером 20 и атомной массой 40,078. Из-за высокой реактивности с водой в природе в чистом виде не встречается.[3] По распространённости в земной коре занимает 5-е место (минералы: кальцит, гипс, флюорит и др.).[4]
Как активный восстановитель кальций служит для получения урана (U), тория (Th), ванадия (V), хрома (Cr), цинка (Zn), бериллия (Be) и других металлов из их соединений. Используется для раскисления сталей, бронз и т. д. Входит в состав антифрикционных материалов.
Кальций — пятый по количеству из присутствующих в человеческом организме минеральных компонентов: примерно 1000-1200 г в теле взрослого человека. Основная роль кальция — организация целостной скелетной системы, в которой и находится 99% всего кальция организма. Оставшийся 1% играет важнейшую роль в свертывании крови, генерации и передаче нервных импульсов, сокращении мышечных волокон, активации определённых ферментативных систем и выделении некоторых гормонов.[5]
Примечания
Ссылки
Четвёртый период периодической системы — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
К четвёртому пери́оду периоди́ческой систе́мы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами, а остальные относятся к р-блоку. Следует обратить внимание, что заполненные 3d-орбитали появляются только у элементов 4 периода. Все элементы этого периода имеют стабильные изотопы, все они встречаются в природе.[1]
Элементы
Заметим, что исключение из эмпирического правила Клечковского, составляют следующие элементы: хром (Cr), никель (Ni) и медь (Cu).
Калий
Калий (K) — лёгкий серебристый щелочной металл с атомным номером 19 и атомной массой 39,0983. В природе встречается в виде двух стабильных изотопов: 39К (93,10% по массе) и 41К (6,88%), а также одного радиоактивного 40К (0,02%). Период полураспада калия-40 составляет 1,28 миллиарда лет.[2] Калий очень мягок, легко режется ножом и поддается прессованию и прокатке. Химически очень активен, легко взаимодействует с кислородом воздуха с образованием смеси, состоящей из пероксида К2О2 и супероксида KO2(К2О4). В природе в чистом виде не встречается.
Содержание калия в земной коре 2,41% по массе, калий входит в первую десятку наиболее распространённых элементов (7-е место). Калий — один из важнейших биогенных элементов, постоянно присутствующий во всех клетках живых организмов. Ионы калия участвуют в работе ионных каналов и регуляции проницаемости биологических мембран, в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия.
Кальций
Кальций (Ca) — серебристо-белый щелочноземельный металл с атомным номером 20 и атомной массой 40,078. Из-за высокой реактивности с водой в природе в чистом виде не встречается.[3] По распространённости в земной коре занимает 5-е место (минералы: кальцит, гипс, флюорит и др.).[4]
Как активный восстановитель кальций служит для получения урана (U), тория (Th), ванадия (V), хрома (Cr), цинка (Zn), бериллия (Be) и других металлов из их соединений. Используется для раскисления сталей, бронз и т. д. Входит в состав антифрикционных материалов.
Кальций — пятый по количеству из присутствующих в человеческом организме минеральных компонентов: примерно 1000-1200 г в теле взрослого человека. Основная роль кальция — организация целостной скелетной системы, в которой и находится 99% всего кальция организма. Оставшийся 1% играет важнейшую роль в свертывании крови, генерации и передаче нервных импульсов, сокращении мышечных волокон, активации определённых ферментативных систем и выделении некоторых гормонов.[5]
Напишите отзыв о статье «Четвёртый период периодической системы»
Примечания
- ↑ [www.science.co.il/PTelements.asp?s=Earth List of Elements of the Periodic Table — Sorted by Abundance in Earth’s crust]
- ↑ [webelements.narod.ru/elements/K.htm Калий]
- ↑ [www.chemguide.co.uk/inorganic/group2/reacth3o.html Reactions of the Group 2 elements with water]
- ↑ [webelements.narod.ru/elements/Ca.htm Кальций]
- ↑ [www.vitaminas.ru/calcium.html Кальций в медицине]
Ссылки
- [www.xumuk.ru/encyklopedia/ Химическая энциклопедия]
Отрывок, характеризующий Четвёртый период периодической системы
– Как видишь, – сказал он.– Вот как, да, да! – улыбаясь, сказал Борис, – а мы тоже славный поход сделали. Ведь ты знаешь, его высочество постоянно ехал при нашем полку, так что у нас были все удобства и все выгоды. В Польше что за приемы были, что за обеды, балы – я не могу тебе рассказать. И цесаревич очень милостив был ко всем нашим офицерам.
И оба приятеля рассказывали друг другу – один о своих гусарских кутежах и боевой жизни, другой о приятности и выгодах службы под командою высокопоставленных лиц и т. п.
– О гвардия! – сказал Ростов. – А вот что, пошли ка за вином.
Борис поморщился.
– Ежели непременно хочешь, – сказал он.
И, подойдя к кровати, из под чистых подушек достал кошелек и велел принести вина.
– Да, и тебе отдать деньги и письмо, – прибавил он.
Ростов взял письмо и, бросив на диван деньги, облокотился обеими руками на стол и стал читать. Он прочел несколько строк и злобно взглянул на Берга. Встретив его взгляд, Ростов закрыл лицо письмом.
– Однако денег вам порядочно прислали, – сказал Берг, глядя на тяжелый, вдавившийся в диван кошелек. – Вот мы так и жалованьем, граф, пробиваемся. Я вам скажу про себя…
– Вот что, Берг милый мой, – сказал Ростов, – когда вы получите из дома письмо и встретитесь с своим человеком, у которого вам захочется расспросить про всё, и я буду тут, я сейчас уйду, чтоб не мешать вам. Послушайте, уйдите, пожалуйста, куда нибудь, куда нибудь… к чорту! – крикнул он и тотчас же, схватив его за плечо и ласково глядя в его лицо, видимо, стараясь смягчить грубость своих слов, прибавил: – вы знаете, не сердитесь; милый, голубчик, я от души говорю, как нашему старому знакомому.
– Ах, помилуйте, граф, я очень понимаю, – сказал Берг, вставая и говоря в себя горловым голосом.
– Вы к хозяевам пойдите: они вас звали, – прибавил Борис.
Берг надел чистейший, без пятнушка и соринки, сюртучок, взбил перед зеркалом височки кверху, как носил Александр Павлович, и, убедившись по взгляду Ростова, что его сюртучок был замечен, с приятной улыбкой вышел из комнаты.
– Ах, какая я скотина, однако! – проговорил Ростов, читая письмо.
– А что?
– Ах, какая я свинья, однако, что я ни разу не писал и так напугал их. Ах, какая я свинья, – повторил он, вдруг покраснев. – Что же, пошли за вином Гаврилу! Ну, ладно, хватим! – сказал он…
В письмах родных было вложено еще рекомендательное письмо к князю Багратиону, которое, по совету Анны Михайловны, через знакомых достала старая графиня и посылала сыну, прося его снести по назначению и им воспользоваться.
– Вот глупости! Очень мне нужно, – сказал Ростов, бросая письмо под стол.
– Зачем ты это бросил? – спросил Борис.
– Письмо какое то рекомендательное, чорта ли мне в письме!
– Как чорта ли в письме? – поднимая и читая надпись, сказал Борис. – Письмо это очень нужное для тебя.
– Мне ничего не нужно, и я в адъютанты ни к кому не пойду.
– Отчего же? – спросил Борис.
– Лакейская должность!
– Ты всё такой же мечтатель, я вижу, – покачивая головой, сказал Борис.
– А ты всё такой же дипломат. Ну, да не в том дело… Ну, ты что? – спросил Ростов.
– Да вот, как видишь. До сих пор всё хорошо; но признаюсь, желал бы я очень попасть в адъютанты, а не оставаться во фронте.
– Зачем?
– Затем, что, уже раз пойдя по карьере военной службы, надо стараться делать, коль возможно, блестящую карьеру.
– Да, вот как! – сказал Ростов, видимо думая о другом.
Он пристально и вопросительно смотрел в глаза своему другу, видимо тщетно отыскивая разрешение какого то вопроса.
Старик Гаврило принес вино.
– Не послать ли теперь за Альфонс Карлычем? – сказал Борис. – Он выпьет с тобою, а я не могу.
– Пошли, пошли! Ну, что эта немчура? – сказал Ростов с презрительной улыбкой.
– Он очень, очень хороший, честный и приятный человек, – сказал Борис.
Ростов пристально еще раз посмотрел в глаза Борису и вздохнул. Берг вернулся, и за бутылкой вина разговор между тремя офицерами оживился. Гвардейцы рассказывали Ростову о своем походе, о том, как их чествовали в России, Польше и за границей. Рассказывали о словах и поступках их командира, великого князя, анекдоты о его доброте и вспыльчивости. Берг, как и обыкновенно, молчал, когда дело касалось не лично его, но по случаю анекдотов о вспыльчивости великого князя с наслаждением рассказал, как в Галиции ему удалось говорить с великим князем, когда он объезжал полки и гневался за неправильность движения. С приятной улыбкой на лице он рассказал, как великий князь, очень разгневанный, подъехав к нему, закричал: «Арнауты!» (Арнауты – была любимая поговорка цесаревича, когда он был в гневе) и потребовал ротного командира.
– Поверите ли, граф, я ничего не испугался, потому что я знал, что я прав. Я, знаете, граф, не хвалясь, могу сказать, что я приказы по полку наизусть знаю и устав тоже знаю, как Отче наш на небесех . Поэтому, граф, у меня по роте упущений не бывает. Вот моя совесть и спокойна. Я явился. (Берг привстал и представил в лицах, как он с рукой к козырьку явился. Действительно, трудно было изобразить в лице более почтительности и самодовольства.) Уж он меня пушил, как это говорится, пушил, пушил; пушил не на живот, а на смерть, как говорится; и «Арнауты», и черти, и в Сибирь, – говорил Берг, проницательно улыбаясь. – Я знаю, что я прав, и потому молчу: не так ли, граф? «Что, ты немой, что ли?» он закричал. Я всё молчу. Что ж вы думаете, граф? На другой день и в приказе не было: вот что значит не потеряться. Так то, граф, – говорил Берг, закуривая трубку и пуская колечки.
– Да, это славно, – улыбаясь, сказал Ростов.
Но Борис, заметив, что Ростов сбирался посмеяться над Бергом, искусно отклонил разговор. Он попросил Ростова рассказать о том, как и где он получил рану. Ростову это было приятно, и он начал рассказывать, во время рассказа всё более и более одушевляясь. Он рассказал им свое Шенграбенское дело совершенно так, как обыкновенно рассказывают про сражения участвовавшие в них, то есть так, как им хотелось бы, чтобы оно было, так, как они слыхали от других рассказчиков, так, как красивее было рассказывать, но совершенно не так, как оно было. Ростов был правдивый молодой человек, он ни за что умышленно не сказал бы неправды. Он начал рассказывать с намерением рассказать всё, как оно точно было, но незаметно, невольно и неизбежно для себя перешел в неправду. Ежели бы он рассказал правду этим слушателям, которые, как и он сам, слышали уже множество раз рассказы об атаках и составили себе определенное понятие о том, что такое была атака, и ожидали точно такого же рассказа, – или бы они не поверили ему, или, что еще хуже, подумали бы, что Ростов был сам виноват в том, что с ним не случилось того, что случается обыкновенно с рассказчиками кавалерийских атак. Не мог он им рассказать так просто, что поехали все рысью, он упал с лошади, свихнул руку и изо всех сил побежал в лес от француза. Кроме того, для того чтобы рассказать всё, как было, надо было сделать усилие над собой, чтобы рассказать только то, что было. Рассказать правду очень трудно; и молодые люди редко на это способны. Они ждали рассказа о том, как горел он весь в огне, сам себя не помня, как буря, налетал на каре; как врубался в него, рубил направо и налево; как сабля отведала мяса, и как он падал в изнеможении, и тому подобное. И он рассказал им всё это.
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
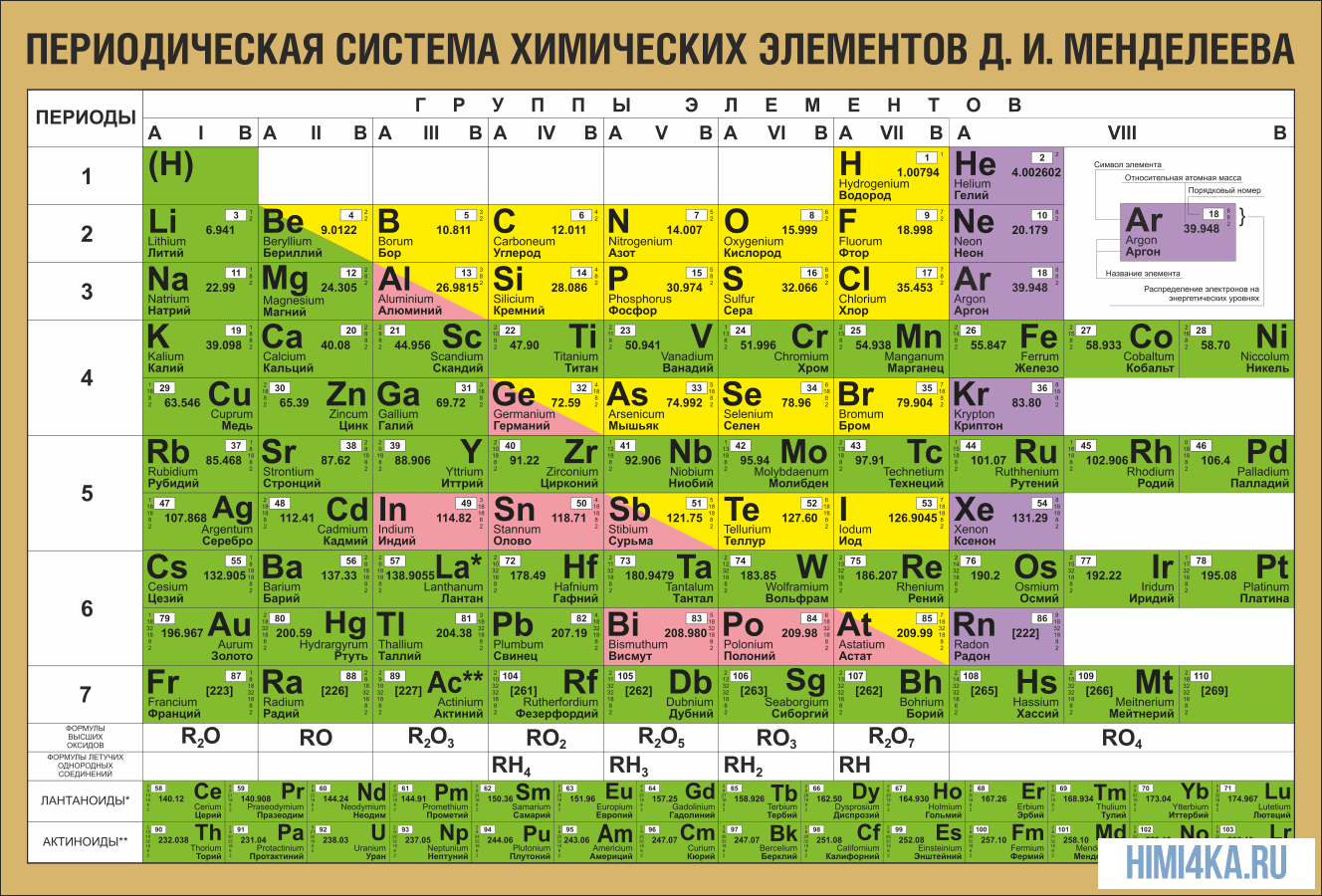
 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.


Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.


Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
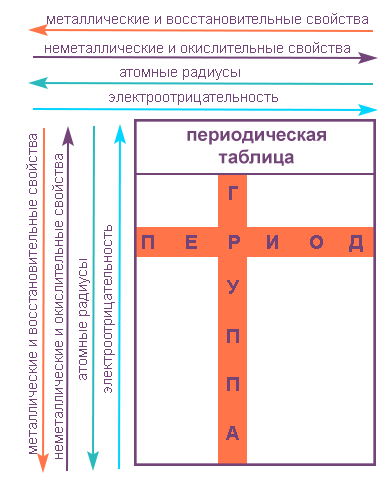
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn22.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1400x0_80_0_0_327f27e6c5de26f58c6b56745af3b111.jpg
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn22.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1400x0_80_0_0_327f27e6c5de26f58c6b56745af3b111.jpg
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1400x0_80_0_0_ea1a97db94c5c634470ab3a4a5093098.jpg
https://cdn24.img.ria.ru/images/99408/72/994087230_334:0:1667:1333_1400x0_80_0_0_f74f233d0894b64ca028e09f0becd2af.jpg
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
Россия, Москва, Зубовский бульвар, 4
7 495 645-6601
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходств», составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классическая короткая форма Периодической системы химических элементов.Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали «большой гонкой».Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия «химический элемент» и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Период периодической системы — это… Что такое Период периодической системы?
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 мая 2011. |
Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки.
Периодическая система имеет семь периодов. Первый период, содержащий 2 элемента, а также второй и третий, насчитывающие по 8 элементов, называются малыми. Остальные периоды, имеющие 18 и более элементов — большими. Седьмой период не завершён. Номер периода, к которому относится химический элемент, определяется числом его электронных оболочек (энергетических уровней).
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
В первом периоде, кроме гелия, имеется только один элемент — водород, сочетающий свойства, типичные как для металлов, так и (в большей степени) для неметаллов. У этих элементов заполняется электронами 1s-подоболочка.
У элементов второго и третьего периода происходит последовательное заполнение s— и р-подоболочек. Для элементов малых периодов характерно достаточно быстрое увеличение электроотрицательности с увеличением зарядов ядер, ослабление металлических свойств и усиление неметаллических.
Четвёртый и пятый периоды содержат декады переходных d-элементов (от скандия до цинка и от иттрия до кадмия), у которых после заполнения электронами внешней s-подоболочки заполняется, согласно правилу Клечковского, d-подоболочка предыдущего энергетического уровня.
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
6f 7d 7f
...
В шестом и седьмом периоде происходит насыщение 4f— и 5f-подоболочек, вследствие чего они содержат ещё на 14 элементов больше по сравнению с 4-м и 5-м периодами (лантаноиды в шестом и актиноиды в седьмом периоде).
Вследствие различия периодов по длине и другим признакам существуют разные способы их относительного расположения в периодической системе. В короткопериодном варианте, малые периоды содержат по одному ряду элементов, большие имеют по два ряда. В длиннопериодном варианте все периоды состоят из одного ряда. Ряды лантаноидов и актиноидов обычно записывают отдельно внизу таблицы.
| Малые периоды | Большие периоды | |
| Количество элементов | 2 или 8 | 18 и более |
| Количество рядов | 1 | 2 |
| Распределение электронов | заполняются только s— и р-подоболочки | заполняются также предвнешние d-подоболочки и предпредвнешние f-подоболочки |
| Изменение свойств элементов | металлические свойства быстро убывают | медленный переход от металлических свойств к неметаллическим |
Элементы одного периода имеют близкие значения атомных масс, но разные физические и химические свойства, в отличие от элементов одной группы. С возрастанием заряда ядра у элементов одного периода уменьшается атомный радиус и увеличивается количество валентных электронов, вследствие чего происходит ослабление металлических и усиление неметаллических свойств элементов, ослабление восстановительных и усиление окислительных свойств образуемых ими веществ.
Chem4Kids.com: Элементы и Периодическая таблица: Периодическая таблица
Периодическая таблица организована как большая сетка. Каждый элемент размещается в определенном месте из-за его атомарной структуры. Как и в любой другой сетке, в периодической таблице есть строки (слева направо) и столбцы (вверх и вниз). Каждая строка и столбец имеют определенные характеристики. Например, магний (Mg) и кальций (Mg) находятся во втором столбце и имеют определенные сходства, в то время как калий (K) и кальций (Ca) из четвертой строки имеют разные характеристики.Магний и натрий (Na) также имеют общие качества, потому что находятся в одном периоде (аналогичные электронные конфигурации). Несмотря на то, что они пропускают некоторые квадраты между ними, все строки читаются слева направо. Когда вы смотрите на периодическую таблицу, каждая строка называется периодом (Понять? Как таблица PERIODic.). Все элементы в периоде имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере движения вниз по таблице каждая строка добавляет орбиталь. В настоящее время существует максимум семь электронных орбиталей. Теперь вы знаете, что месячные идут слева направо. Таблица Менделеева также имеет специальное название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.
Каждый элемент в первом столбце (первая группа) имеет один электрон во внешней оболочке. Каждый элемент во втором столбце (вторая группа) имеет два электрона во внешней оболочке. Продолжая считать столбцы, вы будете знать, сколько электронов находится во внешней оболочке. Когда вы смотрите на элементы перехода, есть исключения из порядка, но вы понимаете общую идею. Переходные элементы добавляют электроны на предпоследнюю орбиталь.
Например, азот (N) имеет атомный номер семь.Атомный номер говорит о том, что в нейтральном атоме азота семь электронов. Сколько электронов находится на его внешней орбитали? Азот находится в пятнадцатом столбце, обозначенном «Группа VA». «V» — это римская цифра для пяти, обозначающая количество электронов на внешней орбитали. Вся эта информация говорит вам, что на первой орбитали есть два электрона, а на второй — пять (2-5).
Фосфор (P) также находится в группе VA, что означает, что он также имеет пять электронов на своей внешней орбитали.Однако, поскольку атомный номер фосфора равен пятнадцати, электронная конфигурация составляет 2-8-5.
Водород (H) и гелий (He) — особые элементы. Водород в нейтральной форме не имеет нейтрона. Есть только один электрон и один протон. Вы, вероятно, не найдете атомарного водорода, плавающего сами по себе. Атомарный водород хочет объединиться с другими элементами, чтобы заполнить свою внешнюю оболочку. Ваша химическая работа, скорее всего, будет использовать молекулярный водород (H 2 ) или ионы водорода (H + , протоны). Гелий (He) отличается от всех других элементов. Он очень стабилен, поскольку на его внешней орбитали (валентной оболочке) всего два электрона. Несмотря на то, что у него всего два электрона, он все еще сгруппирован с благородными газами, у которых есть восемь электронов на их внешних орбиталях. Благородные газы и гелий «счастливы», потому что их валентная оболочка заполнена.
ChemCam Rock Laser для MSL (видео Лос-Аламоса, Нидерланды)
,
Периодическая таблица элементов и химия
Chemicool
руб.| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Период 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 Б | 6 К | 7 № | 8 O | 9 ф | 10 Ne | ||||||||||
| 3 | 11 Na | 12 мг | 13 Al | 14 Si | 15 п | 16 ю | 17 Класс | 18 Ар | ||||||||||
| 4 | 19 К | 20 Ca | 21 СК | 22 Ti | 23 В | 24 Кр | 25 млн | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 Как | 34 SE | 35 руб. | 36 Kr |
| 5 | 37 | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Пн | 43 Tc | 44 Ру | 45 Rh | 46 Pd | 47 Ag | 48 Кд | 49 В | 50 Sn | 51 Сб | 52 Te | 53 I | 54 Xe |
| 6 | 55 CS | 56 Ba | 57-71 | 72 Hf | 73 Ta | 74 Вт | 75 Re | 76 Ос | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Тл | 82 Pb | 83 Bi | 84 Po | 85 При | 86 Rn |
| 7 | 87 Fr | 88 Ra | 89-103 | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 HS | 109 тонн | 110 DS | 111 Rg | 112 Cn | 113 Nh | 114 эт | 115 Mc | 116 Ур. | 117 Ts | 118 Ог |
| 57 La | 58 CE | 59 Пр | 60 Nd | 61 пм | 62 См | 63 Eu | 64 Gd | 65 ТБ | 66 Dy | 67 Ho | 68 Er | 69 Тм | 70 Yb | 71 Лю | ||||
| 89 Ac | 90 Чт | 91 Па | ||||||||||||||||
10,4 Период 3 Хлориды | A * Химия
Обзор свойств хлоридов периода 3
Реакция с водой, H 2O
- Хлорид натрия растворяется в воде с образованием нейтрального раствора хлорида натрия.
NaCl (т) + водн. → Na⁺ (водн.) + Cl⁻ (водн.); pH = 7
- Хлорид магния растворяется в воде при небольшом гидролизе с образованием раствора хлорида магния
MgCl2 (тв) + 6h3O → [Mg (h3O) 6] ²⁺ (водн.) + 2Cl⁻ (водн.)
ионы гексааквамагния
[Mg (h3O) 6] ²⁺ (водн.) + H3O (l) ⇌ [Mg (h3O) 5 (OH)] ⁺ (водн.) + H4O⁺ (водн.); pH = 6.5
- Хлорид алюминия , AlCl3 гидролизуется в воде с образованием кислого раствора, образуются белые пары газообразного хлористого водорода
AlCl3 (т) + 6h3O (l) → [Al (h3O) 6] ³⁺ (вод.) + 3Cl⁻ (вод.) [Al (h3O) 6] ³⁺ (водн.) + H3O (l) ⇌ [Al ( h3O) 5 (OH)] 2⁺ (водн.) + h4O (водн.); pH = 3
- Тетрахлорид кремния подвергается полному гидролизу в воде с образованием сильнокислого раствора, образуются белые пары газообразного хлороводорода
SiCl4 (ж) + 2h3O (ж) → SiO2 (т) + 4HCl (г); pH = 2
- Хлорид фосфора (III) бурно реагирует с водой в реакции гидролиза с образованием сильно кислого раствора и паров газообразного хлористого водорода
PCl3 (l) + 3h3O (l) → h4PO3 (водн.) + 3HCl (г); pH = 2
Хлорид фосфора (V) представляет собой грязно-белое ионное твердое вещество при комнатной температуре, которое сублимируется при 163 ° C с образованием хлорида фосфора (III) и газообразного хлора.
PCl5 (s) ⇌ PCl3 (l) + Cl2 (г)
Он бурно реагирует с водой в реакции гидролиза с образованием сильнокислотного раствора и паров газообразного хлористого водорода.
PCl5 (s) + 4h3O (l) → h4PO4 (водн.) + 5HCl (г); pH = 2
- Кислотность хлоридов увеличивается на в течение периода, поскольку природа хлоридов изменяется с ионной на ковалентную

Leave A Comment