Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
h3SO4+KOH=
сколько граммов сахарозы c2h32o11 необходимо. ..
..
Зробіть ланцюг перетворень
формула вещества, реагирующего с раствором гидроксида кальция
Решите пожалуйста
Задание №19 ЕГЭ по физике
атом, атомное ядро, ядерные реакции
Первичный бал: 1 Сложность (от 1 до 3): 1 Среднее время выполнения: 1 мин.
Для решения заданий № 19 требуется понимание структуры атома по Резерфорду, а также сущности процессов, происходящих при ядерных реакциях, например, при α-распаде.
Задание EF17569Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Ответ:
- только А
- только Б
- и А, и Б
- ни А, ни Б
Алгоритм решения
- Кратко описать суть и результаты опыта, проведенного Резерфордом.

- Установить, какие выводы позволил сделать этот опыт.
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда.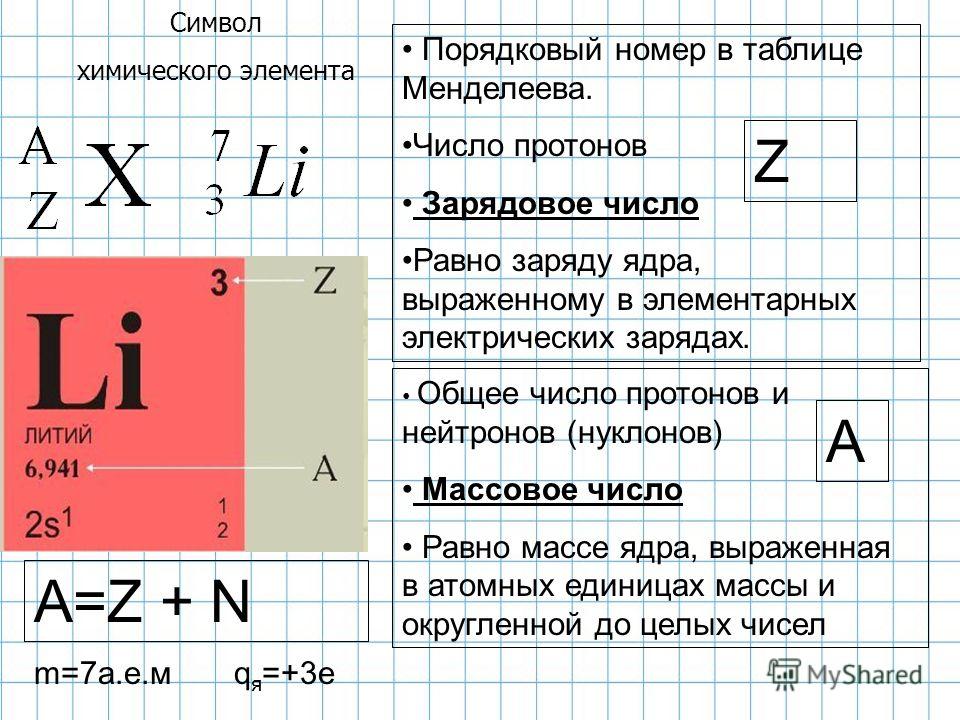 Чёрными точками обозначены электроны. Атому 63Li соответствует схема:
Чёрными точками обозначены электроны. Атому 63Li соответствует схема:
Алгоритм решения
- Описать планетарную модель атома.
- Установить, какой рисунок подходит для данного химического элемента.
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18691Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
Ответ:
а) нейтральным атомом углерода96C б) ионом бериллия 74Be в) ионом лития 93Li г) нейтральным атомом бериллия 74B
Алгоритм решения
- Установить, будет ли атом нейтральным.

- Выбрать подходящий ответ.
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
Ответ: бpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17709Какая из строчек таблицы правильно отражает структуру ядра 49115 In?
Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17974Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.

- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: аpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18942На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17710 Каково массовое число ядра Х в реакции 95241 Am + 24 He→ X + 2 01 n?Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.

- Составить уравнение и вычислить искомое массовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
241 + 4 = A + 2
A = 243
Ответ: 243pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18442Определите массовое и зарядовое число частицы, которая вызывает ядерную реакцию37 Li + … → 48 Вe + 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
- Составить уравнение и вычислить искомое зарядовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
7 + А = 8 + 1
A = 2
Составим уравнение, используя только массовые числа ядер и частиц:
3 + Z = 4 + 0
Z = 1
Ответ: 21pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18660Закону сохранения электрического заряда не противоречит реакция:
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Проверить, где выполняется это правило.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых и зарядовых чисел до реакции и после нее не изменится. Проверим правильность реакций.
Реакция «а»:
7 + 1 = 8
4 + 0 < 5
Реакция «б»:
13 = 1 + 12
8 = 1 + 7
Реакция «в»:
7 + 1 > 6
3 + 0 > 2
Реакция «г»:
12 > 7 + 4
7 > 4 + 2
Подходит только реакция «б».
pазбирался: Алиса Никитина | обсудить разбор | оценить
👀 7.3k |
2.4: Ядра атомов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16145
- Анонимный
- LibreTexts
Цели обучения
- Определение и различие между атомным номером и массовым числом элемента.
- Объясните, чем изотопы отличаются друг от друга.
Теперь, когда мы знаем, как вообще устроены атомы, как выглядят атомы любого конкретного элемента? Сколько протонов, нейтронов и электронов содержится в атоме определенного типа? Во-первых, если атом в целом электрически нейтрален, то количество протонов равно количеству электронов. Поскольку эти частицы имеют одинаковые, но противоположные заряды, равные числа компенсируются, образуя нейтральный атом.
Поскольку эти частицы имеют одинаковые, но противоположные заряды, равные числа компенсируются, образуя нейтральный атом.
Атомный номер
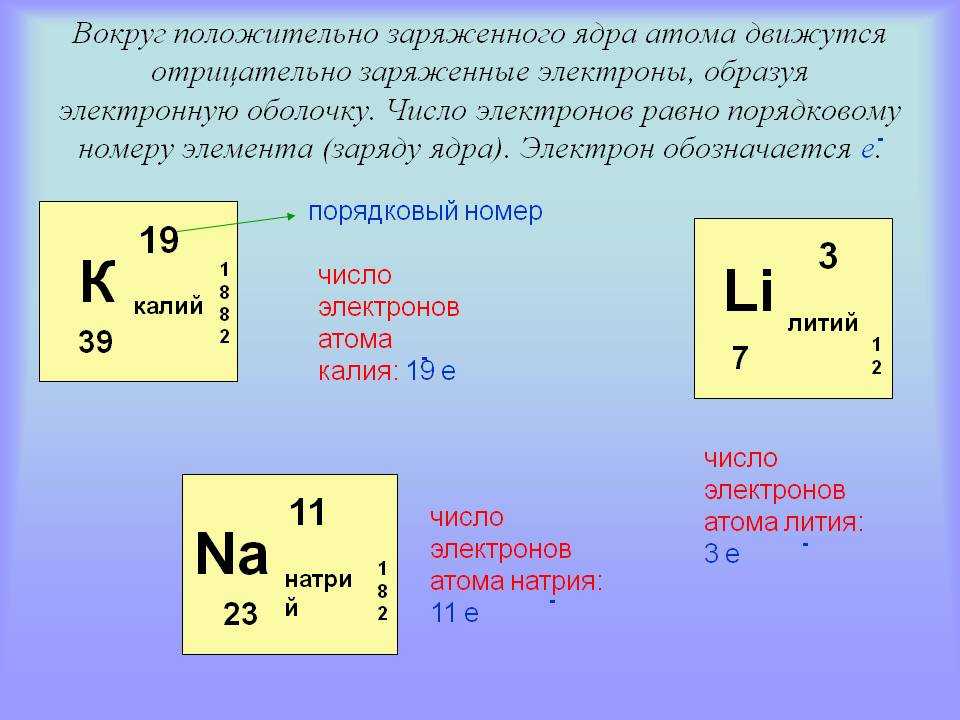
В 1910-х годах эксперименты с рентгеновскими лучами привели к следующему полезному выводу: величина положительного заряда в ядре каждого атома определенного элемента одинакова. Другими словами, все атомы одного и того же элемента имеют одинаковое количество протонов. Кроме того, разные элементы имеют разное количество протонов в ядрах, поэтому количество протонов в ядре атома характерно для конкретного элемента. Это открытие было настолько важно для нашего понимания атомов, что количество протонов в ядре атома называется атомным номером (Z).
Например, водород имеет атомный номер 1; все атомы водорода имеют в ядре 1 протон. Гелий имеет атомный номер 2; все атомы гелия имеют 2 протона в своих ядрах. Не бывает атома водорода с двумя протонами в ядре; ядро с 2 протонами было бы атомом гелия. Атомный номер определяет элемент. В таблице \(\PageIndex{1}\) перечислены некоторые общие элементы и их атомные номера. По его атомному номеру можно определить число протонов в ядре атома. Самые большие атомы имеют более 100 протонов в своих ядрах.
В таблице \(\PageIndex{1}\) перечислены некоторые общие элементы и их атомные номера. По его атомному номеру можно определить число протонов в ядре атома. Самые большие атомы имеют более 100 протонов в своих ядрах.
| Элемент | Атомный номер | Элемент | Атомные номера |
|---|---|---|---|
| алюминий (Al) | 13 | магний (мг) | 12 |
| америций (Am) | 95 | марганец (Mn) | 25 |
| аргон (Ar) | 18 | ртуть (Hg) | 80 |
| барий (Ba) | 56 | неон (Ne) | 10 |
| бериллий (Be) | 4 | никель (Ni) | 28 |
| бром (Br) | 35 | азот (N) | 7 |
| кальций (Ca) | 20 | кислород (О) | 8 |
| углерод (С) | 6 | фосфор (P) | 15 |
| хлор (Cl) | 17 | платина (Pt) | 78 |
| хром (Cr) | 24 | калий (К) | 19 |
| цезий (Cs) | 55 | радон (Рн) | 86 |
| фтор (F) | 9 | серебро (Ag) | 47 |
| галлий (Ga) | 31 | натрий (Na) | 11 |
| золото (золото) | 79 | стронций (Sr) | 38 |
| гелий (Не) | 2 | сера (S) | 16 |
| водород (Н) | 1 | титан (Ti) | 22 |
| железо (Fe) | 26 | вольфрам (Вт) | 74 |
| йод (I) | 53 | уран (U) | 92 |
| свинец (Pb) | 82 | цинк (Zn) | 30 |
| литий (Li) | 3 | цирконий (Zr) | 40 |
Пример \(\PageIndex{1}\)
Каково число протонов в ядре каждого элемента?
- алюминий
- железо
- углерод
- Ответить на
Согласно таблице 2.
 4.1, алюминий имеет атомный номер 13. Следовательно, каждый атом алюминия имеет в ядре 13 протонов.
4.1, алюминий имеет атомный номер 13. Следовательно, каждый атом алюминия имеет в ядре 13 протонов.- Ответ б
Железо имеет атомный номер 26. Следовательно, каждый атом железа имеет 26 протонов в ядре.
- Ответ c
Углерод имеет атомный номер 6. Следовательно, каждый атом углерода имеет 6 протонов в своем ядре.
Упражнение \(\PageIndex{1}\)
Каково число протонов в ядре каждого элемента? Используйте Таблицу 2.4.1.
- натрий
- кислород
- хлор
- Ответить на
В ядре натрия 11 протонов.
- Ответ б
В ядре кислорода 8 протонов.
- Ответ c
В ядре хлора 17 протонов
Сколько электронов в атоме? Ранее мы говорили, что для электрически нейтрального атома электронов равно протонов, поэтому сумма противоположных зарядов компенсируется. Таким образом, атомный номер элемента также дает число электронов в атоме этого элемента. (Позже мы обнаружим, что некоторые элементы могут приобретать или терять электроны от своих атомов, так что эти атомы больше не будут электрически нейтральными. Таким образом, нам понадобится способ дифференцировать количество электронов для этих элементов.)
Таким образом, атомный номер элемента также дает число электронов в атоме этого элемента. (Позже мы обнаружим, что некоторые элементы могут приобретать или терять электроны от своих атомов, так что эти атомы больше не будут электрически нейтральными. Таким образом, нам понадобится способ дифференцировать количество электронов для этих элементов.)
Пример \(\PageIndex{2}\)
Сколько электронов присутствует в атомах каждого элемента?
- сера
- вольфрам
- аргон
- Ответить на
Атомный номер серы равен 16. Следовательно, в нейтральном атоме серы 16 электронов.
- Ответ б
Атомный номер вольфрама 74. Следовательно, в нейтральном атоме вольфрама 74 электрона.
- Ответ c
Атомный номер аргона 18. Следовательно, в нейтральном атоме аргона 18 электронов.

Упражнение \(\PageIndex{2}\)
Сколько электронов присутствует в атомах каждого элемента?
- магний
- калий
- йод
- Ответить на
Mg имеет 12 электронов.
- Ответ б
К имеет 19 электронов.
- Ответ c
I имеет 53 электрона.
Изотопы
Сколько нейтронов содержится в атомах определенного элемента? Сначала считалось, что число нейтронов в ядре также является характеристикой элемента. Однако было обнаружено, что атомы одного и того же элемента могут иметь различных нейтронов. Атомы одного и того же элемента (то есть с одинаковым атомным номером Z), имеющие разное количество нейтронов, называются изотопами. Например, 99% атомов углерода на Земле имеют в своих ядрах 6 нейтронов и 6 протонов; около 1% атомов углерода имеют в своем ядре 7 нейтронов. Таким образом, встречающийся в природе углерод на Земле на самом деле представляет собой смесь изотопов, хотя смесь на 99% состоит из углерода с 6 нейтронами в каждом ядре.
Таким образом, встречающийся в природе углерод на Земле на самом деле представляет собой смесь изотопов, хотя смесь на 99% состоит из углерода с 6 нейтронами в каждом ядре.
Важный ряд изотопов обнаружен с атомами водорода. Большинство атомов водорода имеют ядро только с одним протоном. Однако примерно 1 из 10 000 ядер водорода также имеет нейтрон; этот конкретный изотоп называется дейтерий . Чрезвычайно редкий изотоп водорода, тритий , имеет в ядре 1 протон и 2 нейтрона. На рисунке \(\PageIndex{1}\) сравниваются три изотопа водорода.
Рисунок \(\PageIndex{1}\): Изотопы водорода. Большинство атомов водорода имеют в ядре только протон (а). Небольшое количество водорода существует в виде изотопа дейтерия, в ядре которого есть один протон и один нейтрон (б). Небольшое количество изотопа водорода трития с одним протоном и двумя нейтронами в ядре также существует на Земле (с). Ядра и электроны пропорционально намного меньше, чем изображено здесь. Открытие изотопов потребовало незначительных изменений в атомной теории Дальтона. Дальтон считал, что все атомы одного и того же элемента абсолютно одинаковы.
Дальтон считал, что все атомы одного и того же элемента абсолютно одинаковы.
Большинство элементов существуют в виде смесей изотопов. Фактически, в настоящее время известно более 3500 изотопов всех элементов. Когда ученые обсуждают отдельные изотопы, им нужен эффективный способ указать количество нейтронов в любом конкретном ядре. Массовое число (А) атома представляет собой сумму числа протонов и нейтронов в ядре. Зная массовое число ядра (и зная атомный номер этого конкретного атома), вы можете определить количество нейтронов, вычитая атомный номер из массового числа. 9{масса\: число\xrightarrow{\hspace{45px}} 56}_{атомный\: число \xrightarrow{\hspace{35px}} 26}Fe} \label{Eq1} \]
, что указывает на конкретный изотоп железо. 26 — это атомный номер (одинаковый для всех атомов железа), а 56 — это массовое число изотопа. Чтобы определить количество нейтронов в этом изотопе, вычтем из 56 26: 56 − 26 = 30, значит, в этом атоме 30 нейтронов.
Пример \(\PageIndex{3}\)
Сколько протонов и нейтронов содержится в каждом атоме? 9{23}_{11}Na}\) в каждом ядре 11 протонов и 23 − 11 = 12 нейтронов.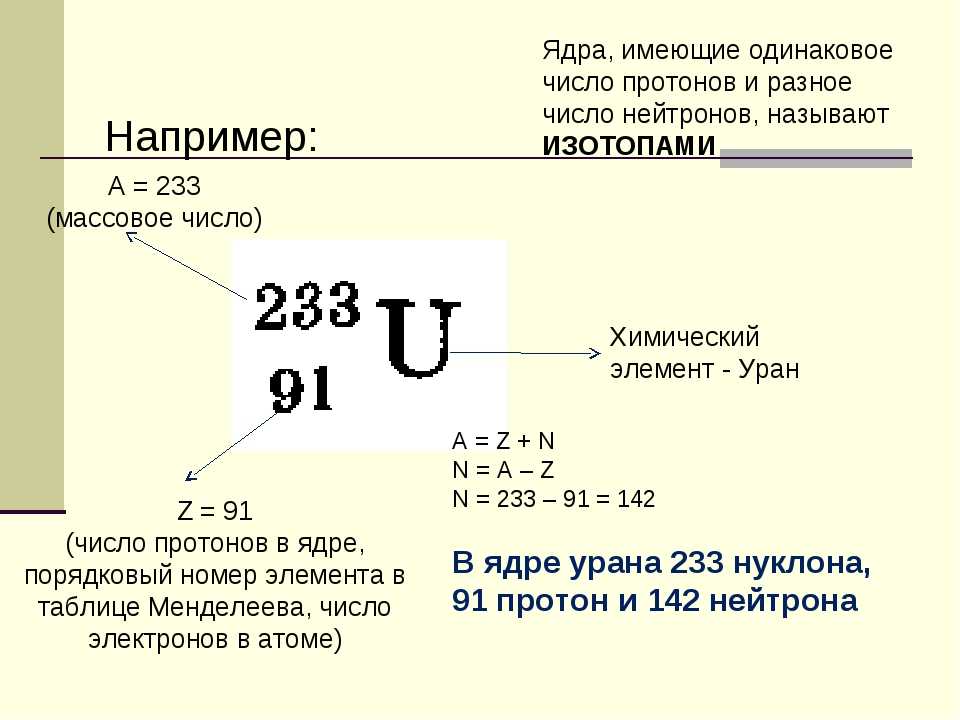
Нет необходимости указывать атомный номер в качестве нижнего индекса, потому что каждый элемент имеет свой уникальный атомный номер. Многие изотопы обозначаются только верхним индексом, например 13 C или 235 U. Вы также можете увидеть изотопы, представленные в печати, например, как углерод-13 или уран-235.
Резюме
Атом состоит из дискретных частиц, которые определяют его химическое и физическое поведение. Каждый атом элемента содержит одинаковое количество протонов, то есть атомный номер (Z) . Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами . Каждый изотоп данного элемента имеет одинаковый атомный номер, но различное массовое число (A) , которое представляет собой сумму числа протонов и нейтронов .
Почти вся масса атома приходится на общее количество протонов и нейтронов, содержащихся в крошечном (и, следовательно, очень плотном) ядре. Большую часть объема атома составляет окружающее пространство, в котором находятся электроны. Представление атома углерода-12 показано ниже на рисунке \(\PageIndex{2}\).
Большую часть объема атома составляет окружающее пространство, в котором находятся электроны. Представление атома углерода-12 показано ниже на рисунке \(\PageIndex{2}\).
Упражнения по обзору концепции
- Почему атомный номер так важен для идентификации атома?
- Какая связь между числом протонов и числом электронов в атоме?
- Чем изотопы элемента отличаются друг от друга?
- Что такое массовое число элемента?
Ответы
- Атомный номер определяет идентичность элемента. Он описывает количество протонов в ядре.
- В электрически нейтральном атоме количество протонов равно количеству электронов.

- Изотопы элемента имеют одинаковое количество протонов, но разное количество нейтронов в ядрах.
- Массовое число – это сумма количества протонов и нейтронов в ядре атома.
Ключевые выводы
- Каждый элемент идентифицируется своим атомным номером. Атомный номер указывает положение элемента в периодической таблице .
- Изотопы элемента имеют разные массы и идентифицируются по их массовым числам.
Эта страница под названием 2.4: Nuclei of Atoms распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Anonymous с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
- атомная масса
- изотопов
- источник@https://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological
На февраль это железо — атомный № 26
Год (био)химических элементов
Кира Зейдан
1 февраля 2019 г.
Гемоглобин представляет собой тетрамер, состоящий из четырех полипептидных цепей. Каждый мономер содержит гемовую группу, в которой ион железа связан с кислородом. При железодефицитной анемии сердце работает интенсивнее, чтобы перекачивать больше кислорода через тело, что часто приводит к сердечной недостаточности или заболеванию. Мы отмечаем 150-летие периодической таблицы Менделеева, выделяя каждый месяц один или несколько химических элементов с важными биологическими функциями. в 2019 году. В январе мы представили атом № 1 и проанализировали роль водорода в окислительно-восстановительных реакциях и электрохимических градиентах как движущей силе энергии для клеточного роста и активности.
в 2019 году. В январе мы представили атом № 1 и проанализировали роль водорода в окислительно-восстановительных реакциях и электрохимических градиентах как движущей силе энергии для клеточного роста и активности.
В феврале мы выбрали железо, самый распространенный элемент на Земле, с химическим символом Fe (от латинского слова «ferrum») и атомным номером 26.
Нейтральный атом железа содержит 26 протонов и 30 нейтронов плюс 26 электронов. в четырех разных оболочках вокруг ядра. Как и в случае с другими переходными металлами, различное количество электронов из двух самых внешних оболочек железа доступно для соединения с другими элементами. Обычно железо использует два (степень окисления +2) или три (степень окисления +3) своих доступных электронов для образования соединений, хотя в природе присутствуют степени окисления железа в диапазоне от -2 до +7.
Железо естественным образом встречается в известной вселенной. Он в изобилии образуется в ядрах массивных звезд при слиянии хрома и гелия при чрезвычайно высоких температурах. Каждая из этих сверхгигантских железосодержащих звезд живет лишь короткое время, прежде чем взорваться как сверхновая, разбрасывая железо в космос и на твердые планеты, такие как Земля. Железо присутствует в земной коре, ядре и мантии, где оно составляет около 35 процентов от общей массы планеты.
Каждая из этих сверхгигантских железосодержащих звезд живет лишь короткое время, прежде чем взорваться как сверхновая, разбрасывая железо в космос и на твердые планеты, такие как Земля. Железо присутствует в земной коре, ядре и мантии, где оно составляет около 35 процентов от общей массы планеты.
Железо имеет решающее значение для выживания всех живых организмов. Биологические системы постоянно подвергаются воздействию высоких концентраций железа в изверженных и осадочных породах. Микроорганизмы могут поглощать железо из окружающей среды, секретируя железохелатирующие молекулы, называемые сидерофорами, или через связанные с мембраной белки, которые восстанавливают Fe+3 (трехвалентное железо) до более растворимого Fe+2 (двухвалентное железо) для внутриклеточного транспорта. Растения также используют механизмы секвестрации и восстановления для получения железа из ризосферы, тогда как животные получают железо из пищевых источников.
Попав внутрь клетки, железо связывается с белками-носителями и с железозависимыми ферментами. Белки-носители, называемые ферритинами (присутствующие как у прокариот, так и у эукариот), хранят, транспортируют и безопасно высвобождают железо в необходимых областях, предотвращая избыток свободных радикалов, генерируемых высокоэнергетическим железом. Железозависимые ферменты включают бактериальные нитрогеназы, которые содержат железо-серные кластеры, катализирующие восстановление азота (N2) до аммиака (Nh4) в процессе, называемом фиксацией азота. Этот процесс необходим для жизни на Земле, потому что он необходим всем формам жизни для биосинтеза нуклеотидов и аминокислот.
Белки-носители, называемые ферритинами (присутствующие как у прокариот, так и у эукариот), хранят, транспортируют и безопасно высвобождают железо в необходимых областях, предотвращая избыток свободных радикалов, генерируемых высокоэнергетическим железом. Железозависимые ферменты включают бактериальные нитрогеназы, которые содержат железо-серные кластеры, катализирующие восстановление азота (N2) до аммиака (Nh4) в процессе, называемом фиксацией азота. Этот процесс необходим для жизни на Земле, потому что он необходим всем формам жизни для биосинтеза нуклеотидов и аминокислот.
Некоторые железосвязывающие белки содержат гем — порфириновое кольцо, координированное с ионом железа. Белки гема включают цитохромы, каталазу и гемоглобин. В цитохромах железо действует как одноэлектронный челнок, облегчающий реакции окислительного фосфорилирования и фотосинтеза для получения энергии и питательных веществ. Каталаза железа опосредует преобразование вредной перекиси водорода в кислород и воду, защищая клетки от окислительного повреждения. У позвоночных Fe+2 в гемоглобине обратимо окисляется до Fe+3, что позволяет связывать, хранить и транспортировать кислород по всему телу до тех пор, пока он не потребуется для производства энергии путем метаболического окисления глюкозы.
У позвоночных Fe+2 в гемоглобине обратимо окисляется до Fe+3, что позволяет связывать, хранить и транспортировать кислород по всему телу до тех пор, пока он не потребуется для производства энергии путем метаболического окисления глюкозы.
Живые организмы адаптировались к обилию и доступности железа, включив его в биомолекулы для выполнения связанных с металлом функций, необходимых для жизни во всех экосистемах.
Год (био)химических элементов
Читать всю серию:
Для января это атомный номер 1
Для февраля это железо — атомный номер 26
Для марта это почечная тройка -fer: натрий, калий и хлор
Для апреля это медь — атомный № 29
Для мая это в ваших костях: кальций и фосфор
Для июня и июля это атомные номера 6 и 7
Дышите глубже — для августа это кислород
Марганец редко путешествует один
В октябре магний помогает листья остаются зелеными
Ноябрь — это запах серы
Завершение года с помощью никеля и цинка
Приятного чтения ASBMB Today?
Станьте участником, чтобы ежемесячно получать печатное издание и еженедельно цифровое издание.
Узнать больше
Кира Зейдан
Кира Зейдан — координатор ASBMB по образованию и связям с общественностью.
Расскажите свою историю
Особенность
Исследователь и тараканы
25 марта 2023 г.
Цзинвэй Ли, студентка Университета Кейс Вестерн Резерв, изучала тараканов, чтобы узнать о болезни Паркинсона. Он представит свою работу на #DiscoverBMB.
Подробнее
Новости журнала
Бактериальный белок устраняет бесплодие за счет снижения уровня холестерина
24 марта 2023 г.
Исследователи обращают внимание на бесплодие в доклинических моделях путем снижения уровня холестерина ЛПВП с помощью белка вирулентности бактерий.
Подробнее
Особенность
Наступательные стратегии в лаборатории
24 марта 2023 г.

 30 нейтронов и 26 электронов содержит ЖЕЛЕЗО, чей порядковый номер равен 26.
30 нейтронов и 26 электронов содержит ЖЕЛЕЗО, чей порядковый номер равен 26.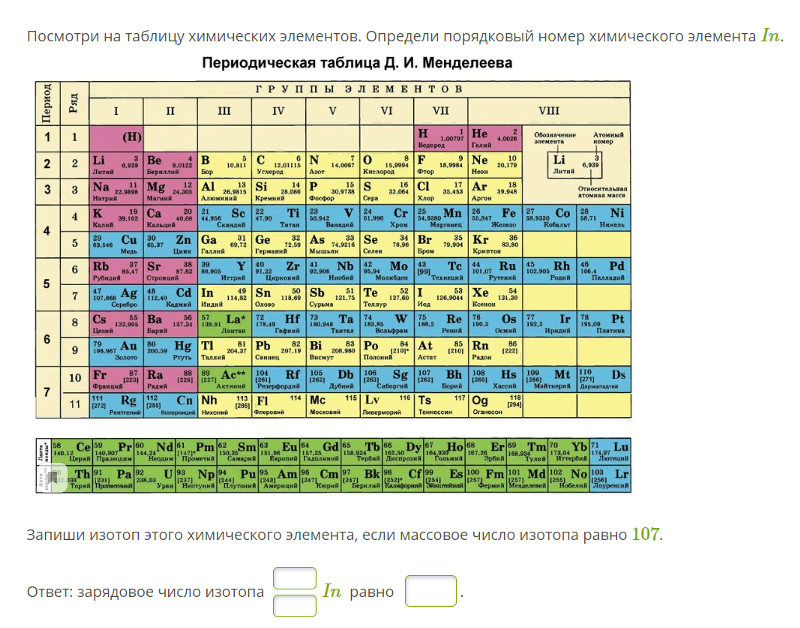



 4.1, алюминий имеет атомный номер 13. Следовательно, каждый атом алюминия имеет в ядре 13 протонов.
4.1, алюминий имеет атомный номер 13. Следовательно, каждый атом алюминия имеет в ядре 13 протонов.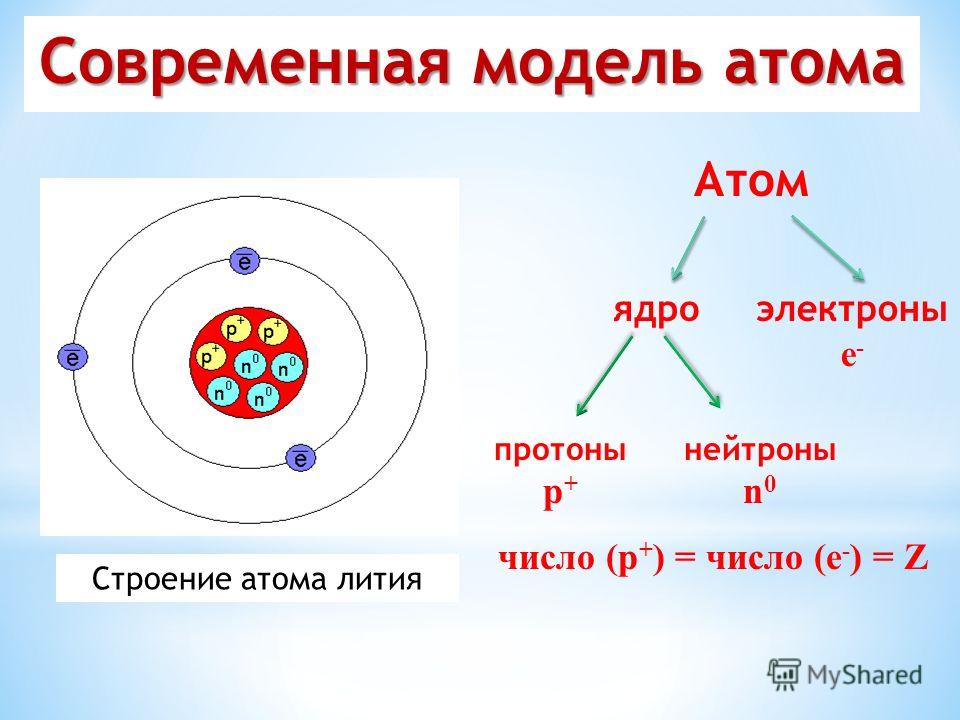

Leave A Comment