подскажите плиз..вопрос не сложный=))какого значение закона Пруста о постоянстве состава вещества??
К основным законам химии относится закон постоянства состава: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен. Закон постоянства состава впервые сформулировал французский ученый-химик Ж. Пруст в 1808 г. Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь». В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения. Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н. С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона) , вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения) . Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям. В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение. Cостав соединений молекулярной структуры, т. е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
А из формулировки не понял? Любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Оксид алюминия будет Al2O3 и больше никак его не запишешь, независимо от способа его получения. Когда тебя спрашивают формулу какого-то вещества, то ты её говоришь, так как она постоянна. Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава) . Однако условно для простоты состав многих бертоллидов записывают как постоянный.
Закон постоянства свойств — Справочник химика 21
Закон постоянства свойств. Кристаллохимическое строение и свойства. Логическим следствием закона постоянства состава является закон постоянства свойств (Пруст, 1806) — свойства веществ не зависят от способа его получения и предыдущей обработки. Совершенно очевидно, что этот закон относится только к молекулярным соединениям. Свойства химических соединений, не имеющих молекулярной структуры, прямо зависят от способа получения и предыдущей обработки. Это прежде всего связано с тем, что количест-В основе контроля чистоты веществ по их свойствам лежит закон постоянства свойств (Пруст, 1806 г.) свойства чистого вещества не зависят от его происхождения и предыдущей обработки. Закон этот строго соблюдается только для газов и жидкостей, тогда как у твердых веществ некоторые свойства могут изменяться в зависимости от обработки. Поэтому применительно к твердым веществам законом постоянства свойств приходится пользоваться с известной осторожностью. [c.49]
Из отдельных свойств веществ для контроля их чистоты лучше всего подходят те, которые могут быть измерены и выражены числом. Имея для какого-либо вещества точно установленные константы (постоянные),, на основании закона постоянства свойств следует ожидать, что такие же значения констант будет иметь любой другой образец того же вещества, если он достаточно чист. Таким образом, для контроля чистоты полученные результаты с уже имеющимися данными для заведомо чистого образца. На практике чаще всего определяют следующие константы плотность, температуру плавления и температуру кипения.
Закон постоянства свойств. Кристаллохимическое строение и свойства. Логическим следствием закона постоянства состава является закон постоянства свойств (Пруст, 1806) — свойства вещества не зависят от способа его получения и предыдущей обработки. Этот закон относится только к молекулярным соединениям. Свойства химических соединений, не имеющих молекулярной структуры, прямо зависят от способа получения и предыдущей обработки. Это прежде всего связано с тем, что количественный состав соединения зависит от условий его получения. А свойства вещества яв.пяются в первую очередь функцией состава. Однако, по Бутлерову, свойства вещества зависят не только от качественного и количественного состава, но и от химического строения. Но классическая теория химического строения Бутлерова относится к молекулярной химии, поскольку она рассматривает химическое строение именно молекул. Это и понятно, так как
Только для особо чистых пеществ достаточно строго соблюдается закон постоянства свойств .
До утверждения в науке закона постоянства свойств нередко сходные, но все же неодинаковые по свойствам вещества принимались за одно и то же вещество и, наоборот, различные лишь по происхождению образцы одного и того же вещества получали разные названия в зависимости от способа получения, т. е. принимались за разные вещества. [c.19]
Наиболее непосредственное практическое применение закон постоянства свойств нашел в метрологии — в создании системы физических единиц измерения (грамм, калория, градус). В основание ее были положены свойства вещества, повсеместно доступ-
Неравновесность отдельного типа комплексных соединений ведет к тому, что в химии комплексных соединений оказываются не связаиными причинной связью два основных закона химии — закон постоянства состава и закон постоянства свойств. Эти два закона оказались бы непооредственно связанными, если бы процессы перехода одного изотопа в другой, одного аллотропического видоизменения в другое, одного изомера в другой и т. п. происходили с моментальной скоростью, обратимо, т. е. если бы эти процессы были равновесными. [c.13]
М. В. Ломоносов первый указал на необходимость тщательно вычищать каждое из изучаемых в еществ, дабы посторонние примеси не затемнили присущих ему свойств. Поэтому ему фактически принадлежит открытие закона постоянства свойств химически чистых веществ физические и химические свойства каждого химически чистого вещества в одних и тех же условиях оказываются одними и теми же, неза Висимо от источника и способа его получения.
Таким образом, научно обоснованный синтез разлагающихся соединений (благодаря высокой упругости паров одного из компонентов) заданного состава требует знания полной Р—Г—х-диаграммы системы А—В, где Р — давление пара. Классическое учение о гетерогенном равновесии (Г. Тамман) и физико-химический анализ Н. С. Курнако-ва рассматривали конденсированные системы без учета паровой фазы (Т—дг-диаграммы). С развитием химии полупроводников значение и роль Р—Г—л -диаграмм неизмеримо возросли. Для соединений с конечной областью гомогенности соблюдение закона постоянства свойств требует, чтобы синтез различных образцов одного и того же соединения проводился при одинаковых температуре и давлении . Практн-
www.chem21.info
Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав
Поиск ЛекцийКласс 1 полугодие
Знать : знаки хим.элементов. табл. на с.43
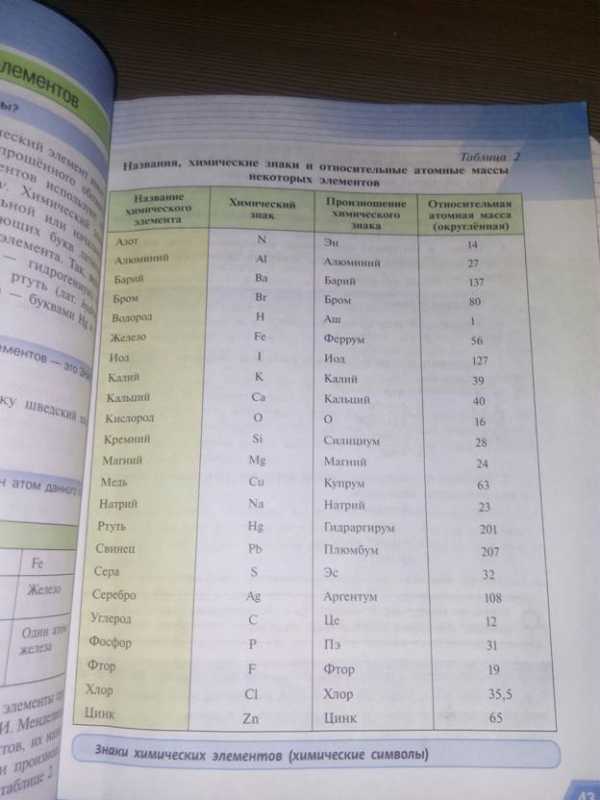
Знать определения:
атом-Мельчайшая частица химического элемента, состоящая из ядра и электронов
протон- Элементарная частица, ядро атома водорода.
нейтрон —Входящая в ядро атома нестабильная материальная частица, лишённая электрического заряда.
электрон Элементарная частица с наименьшим отрицательным электрическим зарядом.
молекула Мельчайшая частица вещества, имеющая все его основные химические свойства.
ион Электрически заряженная частица (атом, группа атомов).
простые вещества-вещества, состоящие исключительно из атомов одного химического элемента
сложные вещества это вещества, состоящие из атомов разных химических элементов.
смеси с.35 табл.1

химический элемент это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке.
хим. формула условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков.
Коэффициент (большая цифра, которая ставится ПЕРЕД формулой) показывает, сколько молекул или атомов участвует в процессе. Например, 2Mg, 8S.
индекс (маленькая цифра, которая ставится справа внизу в формуле) (показатель) показывает, сколько атомов или одинаковых групп входит в состав молекулы.
массовая доля элемента отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
валентность способность атомов химических элементов образовывать определённое число химических связей
правило суммарной валентности,
постоянная и переменная валентность- хз если чесн☺
высшая валентность равна номеру группы.
низшая валентность
бинарные соединения химические вещества, образованные двумя химическими элементами
хим.уравнение краткая запись реакции (Символы, обозначающие вступающие в реакцию вещества, находятся в левой части уравнения, а обозначения продуктов реакции в правой: Q – тепловой эффект реакции.)
типы хим. реакций
| Тип химической реакции | Определение | Пример |
| Соединения | Реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество. | CaO+h3O=Ca(OH)2 PbO+SiO2=PbSiO3 2Na+Cl2=2NaCl |
| Разложения | Реакции, при которых из одного вещества образуется несколько простых или сложных веществ. | Cu(OH)2=CuO+h3O CaCO3=CaO+CO2 Nh5Cl=Nh4+HCl |
| Замещения | Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного | CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 |
| Обмена | Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями | AgNO3+KBr=AgBr NaOH+HCl=NaCl+h3O |
катализаторы химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
оксиды это сложные вещества, которые состоят из 2 элементов, одним из которых является кислород.
реакция окисления это химический процесс, сопровождающийся увеличением степени окисления атома окисляемого вещества посредством передачи электронов
реакция горения химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла.
аллотропия- способность образовывать несколько различных простых веществ (к примеру аллотропной модификацией кислорода является озон)
гидриды — реакция водорода с активными металлами с образованием не лутучих соединений(NaH, Cah3)
восстановление -?!?!??!?
анализ метод определения состава вещества путём его разложения на более простые
синтез получение сложных веществ из более простых
аэрация воды насыщение воды кислородом для очистки
растворы однородные смеси, состоящие из растворителя, растворённого в нём вещества и продуктов их взаимодействия
суспензии взвеси в которых медкие частицы твёрдого вещества равномерно распределены между молекулами воды (смесь воды с глиной)
эмульсии взвеси в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды
растворимость максимально возможное число граммов вещества, которое может раствориться в 100г растворителя при данной температуре
насыщенные раствор в котором данное вещество при данной температуре больше не растворяется
ненасыщенные раствор в котором вещества ещё могут растворяться
массовая доля растворенного вещества отношение массы растворённого вещества к массе раствора (в процентах)
Знать законы химии:
Закон постоянства состава вещества с.45 (Пруст)
Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав
Закон сохранения массы вещества с.63 (Ломоносова- Лавуазье)
Рекомендуемые страницы:
poisk-ru.ru
Закон постоянства состава вещества. Законы сохранения в химии
Химия относится к разряду точных наук, и наряду с математикой и физикой устанавливает закономерности существования и развития материи, состоящей из атомов и молекул. Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. Закон постоянства состава вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.

Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной действительностью, нужно иметь представление о том, из чего она состоит. По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.

Открытия и ошибки Дж. Дальтона
Спустя 50 лет идеи Ломоносова стал развивать английский ученый Дж. Дальтон. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных химических веществ. Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.

Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря представлению о сохранении массы веществ, вступивших в реакцию и образовавшихся после нее. Кроме Дальтона, измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью углеродной нанотрубки. Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.
Почему так важен закон сохранения массы веществ
Сформулированный М. В. Ломоносовым выше названный химический постулат доказывает тот факт, что во время реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не появляются из ничего. Их количество сохраняется без изменения до и после химического процесса. Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Идеи Ж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава. Химия конца 18 – начала 19 века — наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и К. Бертолле. Первый утверждал, что состав веществ, образовавшихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений – продуктов реакции влияет еще и относительное количество взаимодействующих между собой веществ. Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Ж. Прустом в 1808 году. В качестве доказательств он приводит следующие образные примеры: малахит из Сибири имеет такой же состав, как и минерал, добытый в Испании; в мире есть только одно вещество киноварь, и не имеет значения, из какого месторождения она получена. Таким образом Пруст подчеркивал постоянство состава вещества, независимо от места и способа его добычи.
Не бывает правил без исключений
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определённых весовых соотношениях. Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, тяжелая вода, нитрид циркония.

У этих веществ на 1 весовую часть одного элемента приходится различное количество другого элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1,24 до 1,82 части висмута. Позже химики установили, что, кроме соединения металлов друг с другом, вещества, не подчиняющиеся закону постоянства состава, есть в таком классе неорганических соединений, как оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла увязать весовую характеристику соединения с изотопным содержанием элементов, образующих его. Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), – 20 %.
Характеристика бертоллидов
Как мы уже выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и являются абсолютно верными для веществ постоянного состава – дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырёхвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 части кислорода. Вещества непостоянного состава не имеют молекулярного строения, их кристаллические решетки состоят из атомов. Поэтому химические формулы соединений лишь отражают границы их состава. У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ – бертоллидов, то для них также неприменим и закон кратных отношений.
Из всех вышеприведенных примеров сделаем вывод: теоретически в химии присутствуют две группы веществ: с постоянным и переменным составом. Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
fb.ru
Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Методические указания к практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневной и вечерней форм обучения
Нижний Новгород
Составители: А.Л.Галкин, Т.В.Сазонтьева, Г.А.Паничева, О.Н.Ковалева, Ю.В.Батталова, Ж.В.Мацулевич
УДК 54 (07)
Основные законы химии: метод. указания к практ. занятиям по курсу общей химии для студентов химических и нехимических специальностей дневной и вечерней форм обучения/ НГТУ; сост.: А.Л.Галкин и др.Н.Новгород, 2006 — 16 с.
Методические указания включают краткое теоретическое введение, примеры решения задач, задания для текущего контроля знаний и описание лабораторных работ по теме.
Научный редактор Ю.М.Тюрин
Редактор Э.Б.Абросимова
Подп. к печ. 24.01.06 Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ.л. 1,0 . Уч.-изд.л.1,0.Тираж 800 экз. Заказ .
__________________________________________________________
Нижегородский государственный технический университет.
Типография НГТУ. 603600, Н.Новгород, ул.Минина, 24.
ÓНижегородский государственный
технический университет, 2006
Химия – это одна из естественных наук. Она имеет дело со свойствами веществ в зависимости от их состава, строения и внешних условий. Изучение химии – это изучение законов, управляющих превращением веществ друг в друга. Химические реакции сводятся к взаимодействию самых внешних электронных оболочек атомов, в результате чего образуются новые химические связи, при этом исходные вещества (реагенты) исчезают, а новые вещества (продукты) образуются. Результатом химической реакции может быть изменение состава, структуры или заряда реагирующих частиц, при этом химическая природа атомов (заряд их ядра) не изменяется.
В химии принято выделять три основных типа реакций:
1.Реакции обмена. Происходит изменение состава молекул за счет обмена ионами:
BaCl2 + Na2SO4 ® BaSO4 + 2NaCl
2.Окислительно-восстановительные реакции. Изменяются степени окисления атомов или заряд ионов за счет перехода электронов от частицы-восстановителя к частице-окислителю:
Zn + CuSO4 ® ZnSO4 + Cu
3.Реакции изомеризации. Происходит изменение структуры молекул. В результате у вещества появляются новые физические и химические свойства:
CH2=CH-CH2-CH3 ® CH3-CH-CH-CH3
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯ
Современные теоретические представления в химии базируются на атомно-молекулярном учении, в рамках которого вводятся некоторые понятия и величины.
АТОМ – электронейтральная система взаимодействующих элементарных частиц, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, сохраняющая свойства химического элемента.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – это совокупность атомов, имеющих одинаковый заряд атомного ядра. Заряд ядра атома равен его порядковому номеру в периодической системе элементов и определяет его местоположение.
МОЛЕКУЛА – Это наименьшая электрически нейтральная частица вещества, обладающая его химическими свойствами и способная к самостоятельному существованию. Молекулы могут содержать от одного (инертные газы) до многих тысяч атомов (органические молекулы).
ИОН – это заряженная частица, представляющая собой атом или группу химически связанных друг с другом атомов с избытком (анионы:SO42-, Cl—, ClO4—) или недостатком (катионы: Na+, Ca2+, NH4+) электронов.
СВОБОДНЫЕ РАДИКАЛЫ – это частицы, содержащие ненасыщенные (одноэлектронные) связи (-CH3, -NH2, -H)
Сила, с которой два атома удерживаются вместе в составе молекулы определяет прочность химической связи, а энергия, необходимая для ее разрыва, называется энергией химической связи.Ее величина изменяется от 80 до 800 кДж/моль.
ХИМИЧЕСКАЯ ФОРМУЛА – это символическая запись, характеризующая качественный и количественный состав химического соединения и отражающая количественные соотношения между атомами разных элементов, образующих данную частицу. Химическая формула достоверно отражает количественный состав веществ, у которых преобладает ковалентная связь (Cl2, H2, H2O). Для веществ с большой долей ионной связи и веществ металлоидного типа количественные соотношения между атомами в формуле носят усредненный характер и не отражают реального состава.
АТОМНАЯ ЕДИНИЦА МАССЫ (а.е.м.). Атомная единица массы определяется как 1/12 часть массы атома углерода в ядре которого содержится 6 протонов и 6 нейтронов. 1а.е.м. = 1,66·10-27кг. Условно можно считать массы протона и нейтрона одинаковыми и равными (приблизительно) 1 а.е.м. В химии чаще пользуются относительными атомными массами химических элементов (Ar). Это отношение массы атома данного элемента к 1/12 массы атома изотопа углерода 12С. Относительная атомная масса является величиной безразмерной.
МОЛЬ – это единица количества вещества. 1 моль содержит столько же структурных единиц (атомов, ионов, молекул), сколько содержится атомов в 12 граммах углерода (изотоп 12С) Число атомов в 12 граммах углерода легко рассчитывается как отношение массы 1 моль (молярной массы) к массе 1 атома углерода:
Na = 12 г/моль /1,993·10-23г = 6,022·1023моль-1.
Число Na является одной из фундаментальных констант и носит название постоянная Авогадро (число Авогадро).
ПРИМЕР:1 моль электронов содержит 6,022·1023моль-1структурных единиц (электронов), каждый из которых имеет заряд 1,606·10-19 Кл. Таким образом, заряд 1 моль электронов является константой и называется число Фарадея (F)
F = 6,022·1023моль-1· 1,606·10-19Кл = 96713 Кл/моль.
МОЛЯРНАЯ МАССА (М) – это масса 1 моль вещества. Она численно равна отношению массы вещества к количеству его моль (М = m /n) и измеряется в г/моль или кг/кмоль. Численное значение молярной массы, измеренное в г/моль совпадает по величине с молекулярной, атомной и формульной массой данного вещества.
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА (Mr) – это отношение массы молекулы вещества к 1/12 массы атома углерода (изотоп 12С). Поскольку химические формулы чаще всего отражают лишь формальный количественный состав соединения, то правильнее говорить о ФОРМУЛЬНОЙ МАССЕ ВЕЩЕСТВА, понимая под ней сумму атомных масс всех элементов, входящих в соединение, с учетом числа атомов каждого из элементов в формуле.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Среди множества законов, на которые опирается химия можно выделить ряд основных. Это законы, сформулированные в рамках атомно-молекулярного учения. К ним относят закон сохранения массы, законы постоянства состава, кратных и объемных соотношений, закон Авогадро. Эти законы называют стехиометрическими, поскольку именно они положены в основу всех количественных расчетов масс и объемов веществ, принимающих участие в химических превращениях.
ЗАКОН СОХРАНЕНИЯ МАССЫ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Сохранение массы вещества в химических реакциях объясняется тем, что при химических превращениях атомы не разрушаются и не образуются. Таким образом, при постоянстве их массы и количества, массы веществ до и после реакции должны быть одними и теми же.
ЗАКОН ПОСТОЯНСТВА СОСТАВА
Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Данный закон строго применим только для веществ молекулярного типа. Большинство соединений с атомной или ионной структурой имеют переменный состав в следствии ненасыщаемости их химических связей.
Из закона постоянства состава химических веществ следует, что они вступают во взаимодействие друг с другом в строго определенных массовых соотношениях или эквивалентных количествах.
ЗАКОН ЭКВИВАЛЕНТОВ
Массы реагирующих друг с другом веществ пропорцианальны их эквивалентам или эквивалентным массам:
m1/m2 = Э1/Э2 .
Из закона следует, что при любом химическом взаимодействии один эквивалент вещества всегда реагирует с одним эквивалентом другого вещества.
Химический эквивалент (n) элемента или соединения – это такое его количество, которое может провзаимодействовать (реально или формально) с 1 моль атомов водорода или заместить его в химических реакциях.
Единицей химического эквивалента является моль. 5
ПРИМЕР:
n (H2) = 1/2 моль; n (О2) = 1/4 моль; n (СО) =1/2 моль; n (СО2) = 1/4 моль
Эквивалентная масса (Эm, г/моль )– это масса одного эквивалента вещества. Эквивалентная масса элемента или соединения рассчитывается по формуле: Э = М · n, где М – молярная масса элемента или соединения, n – химический эквивалент этого элемента или соединения.
ПРИМЕР: Эm (Н2) = 2 г/моль · 1/2 моль = 1 г .
Эm (О2) = 32 г/моль · 1/4 моль = 8 г .
Эm (SiO) = 28 г/моль · 1/2 моль = 14 г .
Эm (SiO2) = 44 г/моль · 1/4 моль = 11 г .
Эm (Cr2O3) = 152 г/моль · 1/6 моль = 25,3 г .
Эквивалентный объем (Эv ,л/моль) –это объем, занимаемый одним эквивалентом газообразного вещества. Эквивалентный объем газа находят умножением молярного объема газа на его эквивалент.
ПРИМЕР: Эv (Н2) = 22,4 л/моль · 1/2 моль = 11,2 л .
Эv (О2) = 22,4 л/моль · 1/4 моль = 5,6 л .
Эv (Сl2) = 22,4 л/моль · 1/2 моль = 11,2 л .
Таким образом, эквивалент составляет некоторую часть моля или равен ему, а эквивалентная масса равна такой же части молярной массы или равна ей. Эквивалентный объем равен такой же части молярного объема или равен ему.
Для расчетов в окислительно-восстановительных реакциях используется понятие окислительно-восстановительного эквивалента (redox эквивалент).Это такое количества элемента или соединения, которое может отдать или присоединить 1 моль электронов.
Химический эквивалент KМnO4 = 1 моль, а его окислительно-восстановительный эквивалент непостоянен и зависит от числа электронов, присоединяемых в окислительно-восстановительной реакции.
ПРИМЕР: РЕАКЦИЯ REDOX ЭКВИВАЛЕНТ
MnO4— +8H+ +5e = Mn2+ +4H2O 1/5 моль
MnO4— + 2 H2O +3е = MnO2 + 4OH— 1/3 моль
MnO4— + е = MnO42-1 моль
На количественное соотношение реагирующих веществ в уравнениях химических реакций указывают стехиометрические коэффициенты, стоящие перед символом веществ: 3H2 + N2 = 2NH3. Стехиометрические коэффициенты могут указывать на соотношение взаимодействующих частиц (атомов, молекул, ионов) или их молей.
ЗАКОН АВОГАДРО
В равных объемах любых газов, находящихся при одинаковых температуре и давлении, содержится одинаковое число молекул.
Из закона Авогадро следует, что 1 моль любого газа занимает одинаковый объем.
При нормальных условиях (н.у.) (Т=273К или 00С и Р=101325 Па или 1 атм или 760 мм.рт.ст.) этот объем называется молярным (Vm) и равен 22,4 л.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
megalektsii.ru

Leave A Comment