Периодический закон и периодическая система химических элементов Д.И.Менделеева
17 В каком ряду химические элементы расположены в порядке увеличения радиуса атома?
1)K, Na, Li
2)F, O, N
3)P, S, Cl
4)Ca, Mg, Be
18 В порядке увеличения зарядов ядер атомов химические элементы расположены в ряду?
1)Br, Cl, F
2)O, N, C
3)Si, P, S
4)Al, Mg, Na
19 В каком ряду химические элементы расположены в порядке увеличения радиуса атома?
1)B, C, N
2)Br, Cl, F
3)O, S, Se
4)Ca, Mg, Be
20 В каком ряду химические элементы расположены в порядке увеличения числа валентных электронов?
1)Be, B, C
2)K, Na, Li
3)S, P, C
4)C, Si, Ge
21 В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
1)P – S – Cl
2)N – P – As
3)O – S – Se
4)S – P – Si
22 В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
1)N – P – As
2)Al – Si – P
3)O – S – Se
4)Cl – S — P
23 В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1)Na – Mg – Al
2)K – Na – Li
3)Ca – Mg – Be
4)Al – Mg – Na
24 В каком ряду химические элементы расположены в порядке ослабления неметаллических свойств?
1)K – Na – Li
2)Mg – Al – Si
3)Si – P – S
4)Cl – S – P
25 В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1)Al – Si – P
2)B – Be – Li
3)Ca – Mg – Be
4)K – Na – Li
26 В каком ряду химические элементы расположены в порядке ослабления неметаллических свойств?
1)Si – Al – Mg
2)B – C – N
3)Li – Be – B
4)K – Na – Li
27 Свойства оксидов в ряду Al2O3 – SiO2 — P2O5 изменяются от
1)амфотерных к кислотным
2)основных к кислотным
3)амфотерных к основным
4)кислотных к основным
28 Свойства оксидов в ряду CO2 – B2O3 – BeO изменяются от
1)кислотных к амфотерным
2)основных к кислотным
3)амфотерных к основным
4)основных к амфотерным
29 В ряду химических элементов Rb – K – Na
1)усиливаются металлические свойства
2)ослабевают восстановительные свойства
3)уменьшается электроотрицательность атомов
4)возрастает высшая степень окисления в оксидах
30 В ряду химических элементов Mg – Al – Si
1)усиливаются металлические свойства
3)уменьшается электроотрицательность атомов
4)уменьшается высшая степень окисления в оксидах
31 В ряду оксидов MgO – Al2O3 – SiO2 свойства изменяются от
1)кислотных к амфотерным
2)амфотерных к основным
3)основных к кислотным
4)кислотных к основным
32 В ряду оксидов Li2O – BeO – B2O3 свойства изменяются от
1)кислотных к амфотерным
2)амфотерных к основным
3)основных к кислотным
4)кислотных к основным
ГИА.
 Вопрос А2. ПЗ и ПСХЭ
Вопрос А2. ПЗ и ПСХЭПохожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Выход
ГИА
А2 ПЗ и ПСХЭ
Автор: Грачёва
Ирина
Александровна
29.04.2018
Баженов А.А.
Класс: 9
Пуск
Выход
• 1. В каком ряду химические элементы
расположены в порядке увеличения радиуса
атома?
• K, Na, Li
• F, O, N
• P, S, Cl
• Ca, Mg, Be
29.04.2018
Баженов А.А.
Далее
Выход
• 2. В порядке увеличения зарядов ядер атомов
• Br, Cl, F
• O, N, C
• Si, P, S
• Al, Mg, Na
29.
 04.2018
04.2018Баженов А.А.
Далее
Выход
• 3. В каком ряду химические элементы
расположены в порядке увеличения радиуса
атомов?
• B, C, N
• Br, Cl, F
• O, S, Se
• Ca, Mg, Be
29.04.2018
Баженов А.А.
Далее
Выход
• 4. В каком ряду химические элементы
расположены в порядке увеличения числа
валентных электронов?
• Be, B, C
• K, Na, Li
• S, P, C
• C, Si, Ge
29.04.2018
Баженов А.А.
Далее
Выход
• 5. В каком ряду химические элементы
неметаллических свойств?
• P → S → Cl
• N → P → As
• O → S → Se
• S → P → Si
29.04.2018
Баженов А.А.
Далее
Выход
• 6. В каком ряду химические элементы
расположены в порядке усиления
неметаллических свойств?
• N → P → As
• Al → Si → P
• O → S → Se
• Cl → S → P
29.04.2018
Баженов А.А.
Далее
Выход
• 7. В каком ряду химические элементы
расположены в порядке усиления
металлических свойств?
• Na → Mg → Al
• K → Na → Li
• Ca → Mg → Be
• AL → Mg → Na
29.
Баженов А.А.
Далее
Выход
• 8. В каком ряду химические элементы
расположены в порядке услабления
неметаллических свойств?
• K → Na → Li
• Mg → Al → Si
• Si → P → S
• Cl → S → P
29.04.2018
Баженов А.А.
Далее
Выход
• 9. В каком ряду химические элементы
расположены в порядке усиления
металлических свойств?
• Al → Si → P
• B → Be → Li
• Ca → Mg → Be
• K → Na → Li
29.04.2018
Баженов А.А.
Далее
Выход
• 10. В каком ряду химические элементы
расположены в порядке услабления
неметаллических свойств?
• Si → Al → Mg
• Al → C → N
• Na → Mg → Al
• K → Na → Li
29.04.2018
Баженов А.А.
Выход
• 11. Свойства оксидов в ряду
Al2O3 → SiO2 → P2O5 изменяются от:
• Амфотерных к кислотным
• Основных к кислотным
• Амфотерных к основным
• Кислотных к основным
29.04.2018
Баженов А.А.
Далее
Выход
• 12. Свойства оксидов в ряду
СO2 → B2O3 → BeO изменяются от:
• Кислотных к амфотерным
• Основных к кислотным
• Амфотерных к основным
• Основных к амфотерным
29.
 04.2018
04.2018Баженов А.А.
Далее
Выход
• 13. В ряду химических элементов
Rb → K → Na
• Усиливаются металлические свойства
• Ослабевают восстановительные свойства
• Возрастает высшая степень окисления в оксидах
29.04.2018
Баженов А.А.
Далее
Выход
• 14. В ряду химических элементов
Mg → Al → Si
• Усиливаются металлические свойства
• Ослабевают восстановительные свойства
• Уменьшается электроотрицательность атомов
• Уменьшается высшая степень окисления в оксидах
29.04.2018
Баженов А.А.
Далее
Выход
• 15. В ряду оксидов
MgO → Al2O3 → SiO2 свойства изменяются от:
• Кислотных к амфотерным
• Амфотерных к основным
• Основных к кислотным
• Кислотных к основным
29.04.2018
Баженов А.А.
Далее
Выход
Li2O → BeO → B2O3 свойства изменяются от:
• Кислотных к амфотерным
• Амфотерных к основным
• Основных к кислотным
• Кислотных к основным
29.
 04.2018
04.2018Баженов А.А.
Далее
Анализ работы с тестом
Количество правильных ответов
Количество ошибочных ответов
Процент правильных ответов
Ваша оценка
Повторить
29.04.2018
Выход
Баженов А.А.
English Русский Правила
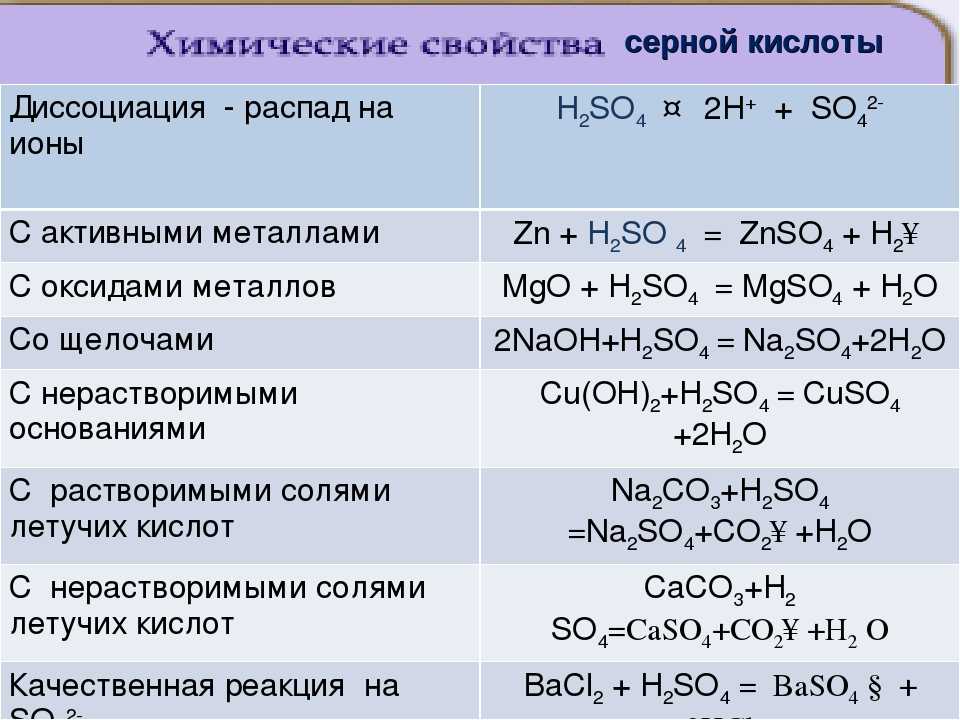
Кислотно-щелочное поведение оксидов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3665
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются реакции оксидов элементов периода 3 (натрия в хлор) с водой и, где это уместно, с кислотами или основаниями (как и прежде, аргон опущен, поскольку он не образует оксид).
Краткий обзор тенденций
Оксиды: Оксиды, представляющие интерес, приведены ниже:
| Na 2 O | MgO | SiO 2 | П 4 О 10 | СО 3 | Класс 2 О 7 | |
| П 4 О 6 | СО 2 | Класс 2 О |
Тенденцию кислотно-щелочного поведения можно резюмировать следующим образом:
Кислотность возрастает слева направо, от сильно основных оксидов слева до сильнокислых справа, с амфотерным оксидом (оксидом алюминия) в середине.
Амфотерный оксид — это тот, который проявляет как кислотные, так и основные свойства.
Эта тенденция применима только к самым высоким оксидам отдельных элементов (см. верхнюю строку таблицы) в самых высоких степенях окисления для этих элементов. Для других оксидов картина менее ясна. Кислотность оксида неметалла определяется с точки зрения кислых растворов, образующихся в реакциях с водой, например, триоксид серы реагирует с водой с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия, как подробно описано ниже.
Оксид натрия
Оксид натрия представляет собой простой сильноосновный оксид. Он является основным, поскольку содержит ион оксида O 2-, который является очень сильным основанием с высокой склонностью к соединению с ионами водорода.
Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14.
Концентрированный раствор оксида натрия в воде будет иметь pH 14.
\[ Na_2O + H_2O \rightarrow 2NaOH\]
Реакция с кислотами: Будучи сильным основанием, оксид натрия также реагирует с кислотами. Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия.
\[Na_2O + 2HCl \rightarrow 2NaCl + H_2O\]
Оксид магния
Оксид магния — еще один простой основной оксид, который также содержит оксидные ионы. Однако он не такой сильно основной, как оксид натрия, потому что ионы оксида не так слабо связаны. В оксиде натрия твердое тело удерживается вместе за счет притяжения между ионами 1+ и 2-. В оксиде магния притяжение находится между 2+ и 2- ионами. Из-за более высокого заряда металла требуется больше энергии, чтобы разорвать эту ассоциацию. Даже принимая во внимание другие факторы (такие как энергия, высвобождаемая при ионно-дипольных взаимодействиях между катионами и водой), чистый эффект заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции с оксидом натрия.
Реакция с водой: На первый взгляд кажется, что порошок оксида магния не реагирует с водой. Однако рН полученного раствора составляет около 9, что указывает на образование ионов гидроксида. На самом деле в реакции образуется некоторое количество гидроксида магния, но, поскольку эти соединения почти нерастворимы, на самом деле растворяется небольшое количество гидроксид-ионов. Реакция показана ниже:
\[MgO + H_2O \rightarrow Mg(OH)_2\]
Реакция с кислотами: Оксид магния реагирует с кислотами, как предсказано для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
\[MgO + 2HCl \rightarrow MgCl_2+H_2O\]
Оксид алюминия
Описание свойств оксида алюминия может привести к путанице, поскольку он существует в различных формах. Одна из этих форм очень нереактивна (химически известна как альфа-Al 2 O 3 ) и образуется при высоких температурах. Следующие реакции относятся к более реакционноспособным формам молекулы. Оксид алюминия амфотерен. Он вступает в реакцию как с основанием, так и с кислотой.
Следующие реакции относятся к более реакционноспособным формам молекулы. Оксид алюминия амфотерен. Он вступает в реакцию как с основанием, так и с кислотой.
Реакция с водой: Оксид алюминия нерастворим в воде и не вступает в реакцию, как оксид натрия и оксид магния. Оксидные ионы слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой.
Реакция с кислотами: Оксид алюминия содержит оксид-ионы и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Оксид алюминия реагирует с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
\[Al_2O_3 + 6HCl \rightarrow 2AlCl_3 + 3H_2O\]
Эта и другие реакции демонстрируют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, что проявляется в его реакциях с основаниями, такими как гидроксид натрия. Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, поскольку алюминий может образовывать ковалентные связи с кислородом. Это возможно потому, что разница электроотрицательностей между алюминием и кислородом мала, в отличие, например, от разницы между натрием и кислородом (электроотрицательность увеличивается по периоду)
Это возможно потому, что разница электроотрицательностей между алюминием и кислородом мала, в отличие, например, от разницы между натрием и кислородом (электроотрицательность увеличивается по периоду)
Оксид алюминия вступает в реакцию с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия:
\[Al_2O_3 + 2NaOH +3H_2O \rightarrow 2NaAl(OH)_4\]
Диоксид кремния (оксид кремния(IV))
Кремний слишком похож по электроотрицательности на кислород, чтобы образовывать ионные связи. Следовательно, поскольку диоксид кремния не содержит ионов оксида, он не обладает основными свойствами. На самом деле он очень слабокислотный, реагирующий с сильными основаниями.
Реакция с водой: Диоксид кремния не вступает в реакцию с водой из-за термодинамических трудностей разрушения его сетчатой ковалентной структуры.
Реакция с основаниями : Диоксид кремния реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора силиката натрия:
\[SiO_2 + 2NaOH \rightarrow Na_2SiO_3 + h3O\]
В другом примере кислого диоксида кремния Реагируя с основанием, извлечение железа из доменной печи, оксид кальция из известняка реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция:
\[SiO_2 + CaO \rightarrow CaSiO_3\]
Оксиды фосфора
Два оксида фосфора, оксид фосфора(III), P 4 O 6 , и оксид фосфора(V), P 4 O 10 , здесь учитываются.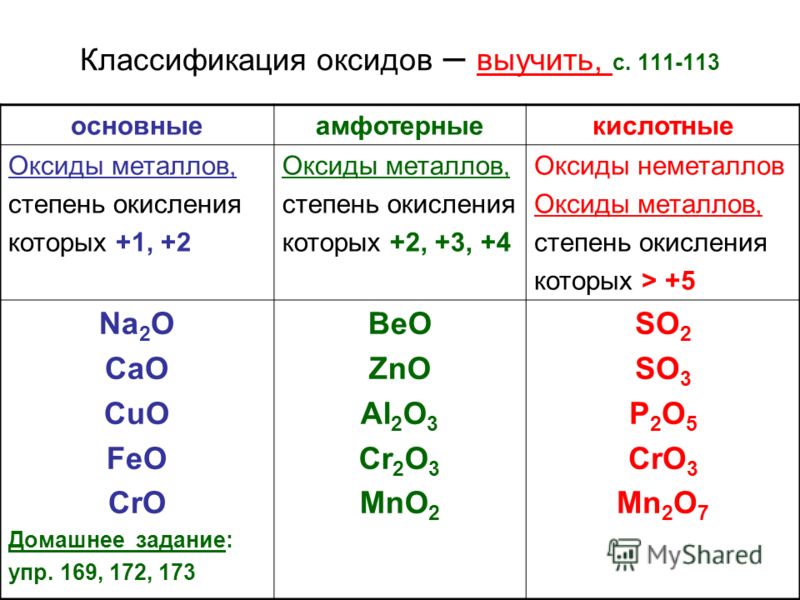
Оксид фосфора(III): Оксид фосфора(III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 – известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота:
\[P_4O_6 + 6H_2O \стрелка вправо 4H_3PO_3\]
Структура полностью протонированной кислоты показана ниже:
Протоны остаются связанными до тех пор, пока не будет добавлена вода; даже в этом случае, поскольку фосфористая кислота является слабой кислотой, несколько молекул кислоты депротонируются. Фосфористая кислота имеет pK a 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Оксид фосфора(III) вряд ли будет реагировать непосредственно с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а третий атом водорода — нет. Следовательно, есть две возможные реакции с основанием, таким как гидроксид натрия, в зависимости от количества добавленного основания:
\[ NaOH + H_3PO_3 \rightarrow NaH_2PO_3 + H_2O\]
\[ 2NaOH + H_3PO_3 \rightarrow Na_2HPO_3 + 2H_2O\]
В первой реакции только один из протонов реагирует с гидроксид-ионами основания. Во втором случае (при использовании вдвое большего количества гидроксида натрия) реагируют оба протона.
Во втором случае (при использовании вдвое большего количества гидроксида натрия) реагируют оба протона.
Если вместо оксида фосфора(III) реагировать непосредственно с раствором гидроксида натрия, возможны те же соли:
\[4NaOH + P_4O_6 + 2H_2O \rightarrow 4NaH_2PO_3\]
\[9NaOH + P_4O_6 \rightarrow 4Na_2HPO_3 + 2H_2O\]
Оксид фосфора(V): Оксид фосфора(V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которых зависит от условия реакции. Обычно рассматривается только одна кислота, фосфорная (V) кислота, H 3 PO 4 (также известная как фосфорная кислота или ортофосфорная кислота).
\[P_4O_{10} + 6H_2O \rightarrow 4H_3PO_4\]
На этот раз полностью протонированная кислота имеет следующую структуру:
Фосфорная(V) кислота – еще одна слабая кислота с pK a 2,15, что немного слабее фосфористой кислоты. Растворы каждой из этих кислот с концентрацией около 1 моль дм -3 имеют рН около 1.
Оксид фосфора (V) также вряд ли будет реагировать непосредственно с основанием, но рассматриваются гипотетические реакции. В кислотной форме молекула имеет три кислотные группы -OH, которые могут вызвать трехстадийную реакцию с гидроксидом натрия: 9(III) оксид, при непосредственном взаимодействии оксида фосфора(V) с раствором гидроксида натрия образуется та же возможная соль, что и на третьей стадии (и только эта соль):
\[12NaOH + P_4O_{10} \rightarrow 4Na_3PO_4 + 6H_2O\]
Оксиды серы
Рассматриваются два оксида: диоксид серы, SO 2 и триоксид серы, SO 3 .
Двуокись серы: Двуокись серы хорошо растворяется в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), H 2 SO 3 , как показано в приведенной ниже реакции. Этот вид существует только в растворе, и любая попытка выделить его выделяет диоксид серы.
\[ SO_2 + H_2O \rightarrow H_2SO_3\]
Протонированная кислота имеет следующую структуру:
Сернистая кислота также является относительно слабой кислотой с pK a около 1,8, но немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты имеет рН около 1.
Достаточно концентрированный раствор сернистой кислоты имеет рН около 1.
Диоксид серы также непосредственно реагирует с основаниями, такими как раствор гидроксида натрия. При барботировании диоксида серы через раствор гидроксида натрия сначала образуется раствор сульфита натрия, а затем раствор гидросульфита натрия, если диоксида серы в избытке.
\[ SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O\]
\[Na_2SO_3 + H_2O \rightarrow 2NaHSO_3\]
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (также известного как сульфат кальция). (IV)). Это один из важных методов удаления диоксида серы из дымовых газов на электростанциях.
\[CaO + SO_2 \rightarrow CaSO_3\]
Триоксид серы: Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты. 9{2-} (водн.)\]
Это полезно, если вы понимаете, почему серная кислота является более сильной кислотой, чем сернистая кислота. Вы можете применить те же рассуждения и к другим кислотам, которые вы найдете на этой странице.
Вы можете применить те же рассуждения и к другим кислотам, которые вы найдете на этой странице.
Серная кислота сильнее, чем серная кислота, потому что, когда ион водорода теряется из одной из -ОН-групп серной кислоты, отрицательный заряд, остающийся на кислороде, распределяется (делокализуется) по иону за счет взаимодействия с двойной связью атомы кислорода. Из этого следует, что большее количество атомов кислорода с двойными связями в ионе делает возможной большую делокализацию; большая делокализация приводит к большей стабильности, что снижает вероятность рекомбинации иона с ионом водорода и превращения в неионизированную кислоту.
Сернистая кислота имеет только одну двойную связь кислорода, тогда как серная кислота имеет две; дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, гораздо более стабильный ион и более сильную кислоту. Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
\[2NaOH +H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O\]
В принципе гидросульфат натрия можно получить, используя вдвое меньше гидроксида натрия; при этом удаляется только один из кислых атомов водорода.
Сам по себе триоксид серы также непосредственно реагирует с такими основаниями, как оксид кальция, с образованием сульфата кальция:
\[ CaO + SO_3 \rightarrow CaSO_4\]
Эта реакция аналогична реакции с диоксидом серы, рассмотренной выше.
Оксиды хлора
Хлор образует несколько оксидов, но только два из них (оксид хлора(VII), Cl 2 O 7 , и оксид хлора(I), Cl 2 O) рассматриваются здесь. Оксид хлора (VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора.
Оксид хлора(VII): Оксид хлора(VII) является высшим оксидом хлора — атом хлора находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, также известной как хлорная кислота.
\[ Cl_2O_7 + H_2O \rightarrow 2HClO_4\]
Как и в серной кислоте, рН типичных растворов хлорной кислоты около 0. Нейтральная хлорная(VII) кислота имеет следующую структуру:
Нейтральная хлорная(VII) кислота имеет следующую структуру:
Когда ион хлората(VII) (перхлорат-ион) образуется в результате потери протона (например, в реакции с водой), заряд делокализуется по каждому атому кислорода в ионе. Это делает ион очень стабильным, что делает хлорную (VII) кислоту очень сильной.
Хлорная(VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия(VII):
\[ NaOH + HClO_4 \rightarrow NaClO_4 + h3O\]
Сам оксид хлора(VII) также непосредственно реагирует с натрием раствор гидроксида с получением того же продукта: 9-\), также известный как хлорноватистая кислота.
\[ Cl_2O + H_2O \rightleftharpoons 2HOCl\]
Структура хлористоводородной кислоты (I) точно соответствует ее формуле HOCl. В нем нет кислорода с двойными связями и нет способа делокализации заряда отрицательного иона, образованного в результате потери водорода. Поэтому образующийся отрицательный ион не очень стабилен и легко отбирает свой протон, чтобы вернуться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43) и реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия):
Хлорная (I) кислота очень слабая (pK a = 7,43) и реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия):
\[ NaOH + HOCl \rightarrow NaOCl + H_2O\]
Оксид хлора(I) также непосредственно реагирует с гидроксидом натрия с образованием того же продукта:
\[2NaOH + Cl_2O \rightarrow 2NaOCl + H_2O\]
Участник
Эта страница под заголовком «Кислотно-щелочное поведение оксидов» распространяется под лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- оксид алюминия
- оксиды хлора
- Оксид магния
- Оксиды
- Оксиды фосфора
- диоксид кремния
- Оксид натрия
- Оксиды серы
Период 3 Оксиды
Промышленное стекло содержит около 70% диоксида кремния и 15% оксида натрия. Эти два оксида являются обычными примерами оксидов периода 3, которые образуются в результате реакции между элементом периода 3 и кислородом.
Эта статья посвящена оксидам периода 3 в неорганической химии. Мы начнем с рассмотрения связи в оксидах периода 3. Затем мы увидим, как это влияет на некоторые их свойства, такие как температура плавления и электропроводность, а также как степень окисления. После этого мы рассмотрим их реакции с водой, кислотами и основаниями. Это потребует рассмотрения их кислотно-щелочного поведения. Наконец, мы также исследуем некоторые другие соединения периода 3, а именно гидроксиды и хлориды периода 3.
После этого мы рассмотрим их реакции с водой, кислотами и основаниями. Это потребует рассмотрения их кислотно-щелочного поведения. Наконец, мы также исследуем некоторые другие соединения периода 3, а именно гидроксиды и хлориды периода 3.
Связывание в оксидах периода 3
Для начала рассмотрим связывание оксидов периода 3. Это поможет нам понять, когда мы будем исследовать свойства и реакции оксидов периода 3 позже.
Существует множество различных оксидов периода 3, но в этой статье мы ограничим наше исследование только Na2O, MgO, Al2O3, SiO2, P4O10, SO2 и SO3. Чтобы упростить жизнь, мы разделили их на две группы: оксиды металлов (Na2O, MgO и Al2O3) и оксиды неметаллов (SiO2, P4O10, SO2 и SO3). Если вы хотите узнать, как эти оксиды сделал, проверьте «Элементы периода 3», чтобы взглянуть на различные реакции.
Как правило, при движении слева направо по периоду связь в оксидах периода 3 меняется с ионной на ковалентную. Это связано с разницей в электроотрицательности между элементом периода 3 и кислородом.
Na2O и MgO являются ионными соединениями. Это связано с тем, что существует большая разница электроотрицательностей между металлом и кислородом. Они состоят из гигантской решетки чередующихся положительных ионов металла и отрицательных ионов кислорода.
Al2O3 также является ионным, но имеет ковалентный характер. Хотя разница электроотрицательностей между алюминием и кислородом достаточно велика для переноса электронов, образующих ионную связь, ион алюминия довольно мал и имеет высокую плотность заряда. Это означает, что он частично способен притягивать одну из пар электронов иона кислорода, искажая электронное облако иона кислорода. Электронная пара начинает действовать как общая пара электронов.
Оксиды неметаллов SiO2 представляет собой гигантскую ковалентную макромолекулу. Разница в электроотрицательности между кремнием и кислородом не так велика, поэтому SiO2 связывается ковалентно.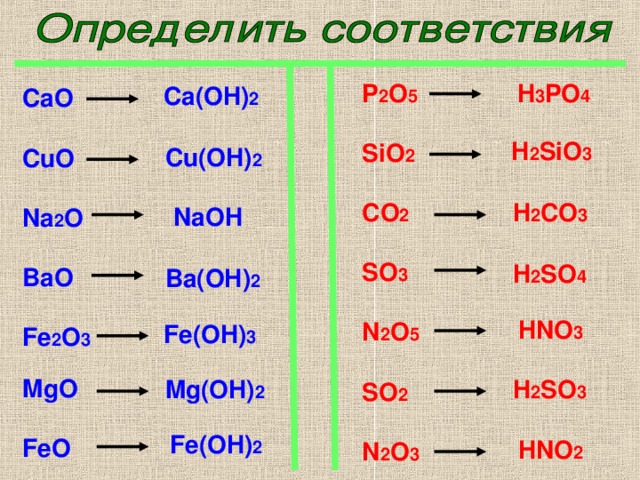 Он состоит из гигантской решетки атомов кремния и кислорода, соединенных ковалентными связями.
Он состоит из гигантской решетки атомов кремния и кислорода, соединенных ковалентными связями.
P4O10, SO2 и SO3 также связаны ковалентно. Однако вместо гигантской ковалентной макромолекулы они образуют простые ковалентные молекулы.
Электроотрицательность в периодической таблице
Свойства оксидов периода 3
Точка плавления оксидов периода 3Оксиды металлов периода 3 имеют высокие температуры плавления, в то время как простые ковалентные оксиды имеют низкие температуры плавления. Однако гигантская макромолекула SiO2 имеет очень высокую температуру плавления.
Na2O, MgO и Al2O3 имеют высокие температуры плавления. Это потому, что они представляют собой ионные соединения, удерживаемые вместе как твердое тело за счет сильного электростатического притяжения между их положительными ионами металлов и отрицательными ионами кислорода. MgO и Al2O3 имеют более высокую температуру плавления, чем Na2O, потому что они содержат ионы металлов с более высоким зарядом.
SiO2 имеет очень высокую температуру плавления, потому что это гигантская ковалентная макромолекула. Он состоит из решетки атомов кремния и кислорода, вытянутых во всех направлениях, скрепленных сильными ковалентными связями. Плавление SiO2 включает преодоление этих ковалентных связей, что требует много энергии.
P4O10, SO2 и SO3 имеют низкие температуры плавления. Это потому, что они представляют собой простые ковалентные молекулы. Хотя внутри молекул существуют прочные ковалентные связи, единственными силами, удерживающими молекулы вместе как твердое тело, являются слабые межмолекулярные силы, для преодоления которых не требуется много энергии. P4O10 имеет более высокую температуру плавления, чем SO3, который, в свою очередь, имеет более высокую температуру плавления, чем SO2, из-за того, что это более крупная молекула.
Ознакомьтесь с разделом «Физические свойства склеивания», чтобы узнать больше по этой теме.
Электропроводность В твердом состоянии ни один из оксидов периода 3 не может проводить электричество. Однако это меняется в других состояниях. Оксиды металлов Оксиды металлов периода 3 (Na2O, MgO и Al2O3) могут проводить электричество в расплавленном или водном состоянии. Помните, что оксиды металлов состоят из ионной решетки положительных ионов металла и отрицательных ионов кислорода. В твердом теле эти ионы прочно удерживаются на месте за счет сильного электростатического притяжения, поэтому в них нет свободно перемещающихся заряженных частиц. Однако в расплавленном или водном растворе электростатическое притяжение частично преодолевается, и ионы могут перемещаться и нести заряд. электричество в любом состоянии. Это связано с тем, что они не содержат заряженных частиц, которые могут нести заряд. Состояние окисления Теперь давайте рассмотрим степени окисления оксидов периода 3. Степени окисления, также известные как степени окисления, показывают количество электронов в элементе. должен терять или приобретать по сравнению с его несвязанным состоянием. Ранее в этой статье мы рассмотрели относительную электроотрицательность кислорода и элементов периода 3.
Однако это меняется в других состояниях. Оксиды металлов Оксиды металлов периода 3 (Na2O, MgO и Al2O3) могут проводить электричество в расплавленном или водном состоянии. Помните, что оксиды металлов состоят из ионной решетки положительных ионов металла и отрицательных ионов кислорода. В твердом теле эти ионы прочно удерживаются на месте за счет сильного электростатического притяжения, поэтому в них нет свободно перемещающихся заряженных частиц. Однако в расплавленном или водном растворе электростатическое притяжение частично преодолевается, и ионы могут перемещаться и нести заряд. электричество в любом состоянии. Это связано с тем, что они не содержат заряженных частиц, которые могут нести заряд. Состояние окисления Теперь давайте рассмотрим степени окисления оксидов периода 3. Степени окисления, также известные как степени окисления, показывают количество электронов в элементе. должен терять или приобретать по сравнению с его несвязанным состоянием. Ранее в этой статье мы рассмотрели относительную электроотрицательность кислорода и элементов периода 3. Кислород более электроотрицателен, чем все они. Это означает, что когда дело доходит до оксидов периода 3, кислород всегда принимает более низкую степень окисления. В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю, поэтому, используя это знание, мы можем определить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
Кислород более электроотрицателен, чем все они. Это означает, что когда дело доходит до оксидов периода 3, кислород всегда принимает более низкую степень окисления. В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю, поэтому, используя это знание, мы можем определить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
Реакции оксидов периода 3 Оксиды периода 3 имеют одну общую черту: все они содержат кислород. Однако это не означает, что они реагируют одинаково. В следующем разделе мы рассмотрим, как оксиды периода 3 реагируют с кислородом, кислотами и основаниями. Это включает в себя рассмотрение их кислотно-щелочной природы. Кислота является донором протона, а основание — акцептором протона.
Перейдите к разделу «Кислоты и щелочи», если вы впервые освещаете такого рода соединения.
Оксиды металлов слева от периода 3 имеют тенденцию быть основными по своей природе, тогда как оксиды неметаллов имеют кислотную природу. Al2O3 находится посередине и является амфотерным. Реакции оксидов 3-го периода с водой. Обычно оксиды металлов 3-го периода являются основными по своей природе. Это означает, что они реагируют с водой с образованием гидроксида, образуя основной раствор. С другой стороны, оксиды неметаллов периода 3 имеют кислотную природу. Они реагируют с водой, образуя кислоту.
Al2O3 находится посередине и является амфотерным. Реакции оксидов 3-го периода с водой. Обычно оксиды металлов 3-го периода являются основными по своей природе. Это означает, что они реагируют с водой с образованием гидроксида, образуя основной раствор. С другой стороны, оксиды неметаллов периода 3 имеют кислотную природу. Они реагируют с водой, образуя кислоту.
Na2O и MgO реагируют с водой с образованием гидроксидов. Они делают это из-за их ионной связи. Они содержат сильноосновные оксидные ионы (O2-) благодаря большой разнице электроотрицательностей между металлом и кислородом. Ион кислорода может принять ион водорода из раствора, действуя как основание.
Na2O реагирует с водой с образованием NaOH, который диссоциирует на ионы Na+ и OH-. MgO реагирует с водой с образованием Mg(OH)2, который малорастворим и частично диссоциирует на ионы Mg2+ и OH-.
Вот уравнения:
С другой стороны, Al2O3 не растворяется в воде и, следовательно, никак не реагирует.
P4O10, SO2 и SO3 реагируют с водой с образованием кислот. Поскольку они связаны ковалентно, они не содержат ионов кислорода и поэтому не могут действовать как основания. Вместо этого они способны отдавать ион водорода в растворе, что означает, что они действуют как кислота. P4O10 реагирует с водой с образованием h4PO4, который частично диссоциирует на ионы H+ и h3PO4-. SO2 реагирует с водой, образуя h3SO3 (сернистую кислоту). , который частично диссоциирует на ионы H+ и HSO3-. SO3 реагирует с водой с образованием h3SO4 (серная кислота), которая полностью диссоциирует на ионы H+ и HSO4-. Вам необходимо знать уравнения: Как и Al2O3, SiO2 нерастворим в воде. . В воде он никак не прореагирует. Не путайте серосодержащие кислоты.
Вот структуры серной кислоты, h3SO3, и серной кислоты, h3SO4. Серная и серная кислоты
Реакция оксидов периода 3 с кислотами и основаниями Теперь мы знаем, что два из трех оксидов металлов периода 3 являются основными по своей природе. Поэтому они реагируют с кислотами. Напротив, оксиды неметаллов периода 3 имеют кислотную природу и поэтому реагируют с основаниями. Al2O3 находится между двумя группами и является амфотерным по своей природе. Оксиды металлов
Напротив, оксиды неметаллов периода 3 имеют кислотную природу и поэтому реагируют с основаниями. Al2O3 находится между двумя группами и является амфотерным по своей природе. Оксиды металлов
Na2O и MgO действуют как основания, реагируя с кислотами с образованием соли и воды. Это потому, что они связываются ионно. Например:
Реакция Na2O с HCl дает NaCl и h3O. Реакция MgO с HCl дает MgCl2 и h3O.
Уравнения представлены ниже:
Al2O3 немного отличается – он амфотерный. Это означает, что он может вести себя и как кислота, и как основание. Как и другие оксиды металлов периода 3, он действует как основание, реагируя с кислотой с образованием соли и воды благодаря ионной связи. Здесь ион алюминия имеет положительный заряд. Но он также может действовать как кислота, реагируя с основаниями благодаря своему ковалентному характеру. В этом случае мы образуем алюминат, соединение, в котором ион алюминия имеет отрицательный заряд. Например:
Реакция Al2O3 с HCl дает AlCl3 и h3O. Реакция Al2O3 с NaOH дает различные алюминаты, в зависимости от условий, одним из которых может быть NaAl(OH)4.
Реакция Al2O3 с NaOH дает различные алюминаты, в зависимости от условий, одним из которых может быть NaAl(OH)4.
Вот уравнения:
SiO2, P4O10, SO2 и SO3 действуют как кислоты, реагируя с основаниями с образованием соли и воды. Это связано с тем, что они связаны ковалентно. Например:
Реакция SiO2 с NaOH дает NaSiO3 и h3O. Реакция P4O10 с NaOH аналогична реакции фосфорной кислоты с NaOH. Он производит смесь солей, включая Na3PO4, а также h3O. Реакция SO2 с NaOH аналогична реакции сернистой кислоты с NaOH. В целом получается Na2SO3 и h3O. Реакция SO3 с NaOH аналогична реакции серной кислоты с NaOH. В целом он производит Na2SO4 и h3O.
И снова мы предоставили вам уравнения:
Сводка реакций оксидов периода 3
В завершение этого раздела приведем полезную таблицу, в которой резюмируются реакции оксидов периода 3 и их кислот- базовые натуры.
Реакции оксидов периода 3
Гидроксиды периода 3
Еще один тип соединения периода 3, о котором вам может понадобиться знать, — это гидроксиды периода 3. В этом разделе мы рассмотрим реакции трех гидроксидов периода 3 — NaOH, Mg(OH)2 и Al(OH)3 — с кислотами и основаниями.
В этом разделе мы рассмотрим реакции трех гидроксидов периода 3 — NaOH, Mg(OH)2 и Al(OH)3 — с кислотами и основаниями.
Проверьте, входят ли в вашу спецификацию гидроксиды периода 3.
Реакции с кислотами и основаниямиКак NaOH, так и Mg(OH)2 действуют как типичные основания. Они реагируют с кислотами с образованием соли и воды. Например:
Реакция NaOH с HCl дает NaCl и h3O. Реакция Mg(OH)2 с HCl дает MgCl2 и h3O.
Вот уравнения:
Al(OH)3 ведет себя немного иначе – он амфотерный. Он действует как основание, реагируя с кислотой с образованием соли и воды. Но он также действует как кислота, реагируя с основаниями с образованием алюмината. Например:
Реакция Al(OH)3 с HCl дает AlCl3 и h3O. Реакция Al(OH)3 с NaOH дает NaAl(OH)4.
Уравнения для этих реакций приведены ниже:
Хлориды периода 3
Последнее, что у нас сегодня на повестке дня, это хлориды периода 3. Мы посмотрим на их температуру плавления, степень окисления и их реакцию с водой.
Обычно хлориды металлов периода 3 имеют высокие температуры плавления, тогда как хлориды неметаллов периода 3 имеют низкие температуры плавления. AlCl3 является аномалией: несмотря на то, что он является хлоридом металла, он имеет низкую температуру плавления.
И NaCl, и MgCl2 имеют высокие температуры плавления. Это потому, что они являются ионными соединениями. Благодаря большой разнице в электроотрицательности между металлом и хлором они способны связываться ионно, а твердое тело удерживается вместе за счет сильного электростатического притяжения между противоположно заряженными ионами.
AlCl3 немного отличается. При комнатной температуре и давлении он связывается ионами, поэтому можно ожидать, что он будет иметь высокую температуру плавления. Но при повышении температуры она превращается из ионной решетки в простые молекулы Al2Cl6, которые в конечном итоге распадаются на более мелкие молекулы AlCl3. Это оба примера простых ковалентных молекул. Они удерживаются вместе как твердое тело слабыми межмолекулярными силами, для преодоления которых не требуется много энергии, поэтому AlCl3 на самом деле имеет низкую температуру плавления.
Они удерживаются вместе как твердое тело слабыми межмолекулярными силами, для преодоления которых не требуется много энергии, поэтому AlCl3 на самом деле имеет низкую температуру плавления.
SiCl4, PCl5, SCl2 и S2Cl2 имеют низкие температуры плавления. Это потому, что они представляют собой простые ковалентные молекулы. Единственные силы, удерживающие их вместе как твердое тело, — это слабые межмолекулярные силы, для преодоления которых не требуется много энергии.
Степень окисленияВо всех хлоридах периода 3 хлор принимает отрицательную степень окисления -1. Это потому, что он более электроотрицательный, чем элемент периода 3, с которым он связан. Сумма степеней окисления атомов в нейтральном соединении всегда равна нулю, и исходя из этого вы можете определить степень окисления элемента периода 3. Запомнить довольно просто – за исключением SCl2 и S2Cl2 степень окисления соответствует номеру группы элемента.
В следующей таблице собрана информация для вас. Степени окисления хлоридов периода 3
Степени окисления хлоридов периода 3
Реакция с водойНаконец, мы исследуем реакции хлоридов периода 3 с водой, в том числе взглянем на рН образующегося раствора. Обычно хлориды металлов просто растворяются в воде, тогда как хлориды неметаллов реагируют более энергично. Опять же, AlCl3 нарушает тенденцию, реагируя как хлорид неметалла.
NaCl и MgCl2 растворяются в воде. Они делают это благодаря своей ионной связи. NaCl образует нейтральный раствор ионов Na+ и Cl- с pH 7, тогда как MgCl2 образует слабокислый раствор ионов Mg2+ и Cl- с pH около 6.
AlCl3 действует иначе благодаря своему ковалентному характеру. Он реагирует с водой, образуя кислый раствор с pH около 3, выделяя пары HCl.
Другие хлориды неметаллов реагируют так же, как AlCl3, благодаря их ковалентной связи. Они реагируют с водой с образованием кислых растворов, каждый из которых имеет рН около 2. Во всех реакциях выделяются паровые пары HCl.
Существуют четкие тенденции во всех различных свойствах и реакциях. Знание некоторых ключевых фактов, таких как тип связи, присутствующей в каждом соединении, должно помочь вам, когда речь идет об оксидах, гидроксидах и хлоридах периода 3.
Знание некоторых ключевых фактов, таких как тип связи, присутствующей в каждом соединении, должно помочь вам, когда речь идет об оксидах, гидроксидах и хлоридах периода 3.
Оксиды периода 3 – основные выводы Оксиды периода 3 представляют собой соединения, состоящие из элемента периода 3 и кислорода. Связь в оксидах периода 3 меняется с ионной на ковалентную по мере продвижения по периоду. Оксиды металлов имеют тенденцию быть ионными, тогда как оксиды неметаллов являются ковалентными. Оксид металла Al2O3 является ионным, но проявляет ковалентный характер. Оксиды металлов периода 3, как правило, имеют высокие температуры плавления, в то время как оксиды неметаллов имеют низкие температуры плавления. Оксид неметалла SiO2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления. Оксиды металлов периода 3 имеют тенденцию быть основными по своей природе, в то время как оксиды неметаллов периода 3 являются кислотными. Оксид металла Al2O3 находится в середине и является амфотерным. Гидроксиды металлов периода 3, как правило, являются основными по своей природе. Однако гидроксид металла Al(OH)3 является амфотерным. Хлориды металлов периода 3, как правило, имеют высокие температуры плавления, в то время как хлориды неметаллов имеют низкие температуры плавления. Хлорид металла AlCl3 является аномалией и имеет низкую температуру плавления. Хлориды металлов периода 3 имеют тенденцию растворяться в воде, в то время как хлориды неметаллов реагируют более энергично. Хлорид металла AlCl3 снова ведет себя больше как хлорид неметалла и бурно реагирует.
Гидроксиды металлов периода 3, как правило, являются основными по своей природе. Однако гидроксид металла Al(OH)3 является амфотерным. Хлориды металлов периода 3, как правило, имеют высокие температуры плавления, в то время как хлориды неметаллов имеют низкие температуры плавления. Хлорид металла AlCl3 является аномалией и имеет низкую температуру плавления. Хлориды металлов периода 3 имеют тенденцию растворяться в воде, в то время как хлориды неметаллов реагируют более энергично. Хлорид металла AlCl3 снова ведет себя больше как хлорид неметалла и бурно реагирует.
Оксиды периода 3
Какой оксид является самым основным в периоде 3?
Na2O является наиболее основным оксидом периода 3.
Какой элемент периода 3 является амфотерным?
Al2O3 является амфотерным. Это означает, что он может действовать и как кислота, и как основание.
Как оксиды периода 3 реагируют с водой?
Оксиды металлов периода 3 реагируют с водой с образованием гидроксида, в то время как гидроксиды неметаллов периода 3 реагируют с водой с образованием кислоты.


Leave A Comment