4. Валентность. Степень окисления химических элементов
Тема № 4. Валентность химических элементов. Степень окисления химических элементов Рекомендованные видеоуроки Валентность химических элементов Степень окисления Валентные возможности углерода Валентные возможности азота Дополнительные видеоуроки, рекомендованные к просмотру Валентные возможности атомов химических элементов Теоретический материал Валентность химических элементов Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле. Валентные возможности атома определяются числом: — неспаренных электронов; — неподеленных электронных пар; — вакантных валентных орбиталей. Правила определения валентности элементов в соединениях 1. 2. Кислород в своих соединениях всегда проявляет валентность II. 3. Высшая валентность равна номеру группы. 4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — № группы. 5. Валентность может быть постоянной или переменной. 6. Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы). Валентность элементов не имеет знака. У металлов, находящихся в главных подгруппах, валентность равна номеру группы. У неметаллов в основном проявляются две валентности: высшая и низшая. Пример.
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор (P) проявляет валентности V и III. Запомни!!! В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. НО!!! СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2 HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5 Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II. N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2. H2I, N2III, O2II, F2I, Cl2I, Br2I, I2I, а степени окисления равны 0. Степень окисления химических элементов Степень окисления – это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд. Различие понятий степень окисления и валентность Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов. В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления. Определение степени окисления конкретного химического элемента Степень окисления простых веществ всегда равна нулю!!! Элементы с постоянной степенью окисления Степень окисления = +№ группы I группа главная подгруппа степень окисления +1. II группа главная подгруппа степень окисления +2. III группа главная подгруппа (бор, алюминий) степень окисления равна +3. Исключения: 1. Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si+4H4—, B2+3H6—, B+3H3—, где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1 (Na+H—, Ca+2h3—). 2. 3. Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе). 4. Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе). 5. Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Все остальные элементы (за исключением VIII группы главной подгруппы). Для элементов главных подгрупп: Высшая степень окисления: +№ группы. Низшая степень окисления: +№ группы — 8. Промежуточная степень окисления: +№ группы — 2. Пример: Фосфор (P): Высшая степень окисления: +5. Низшая степень окисления: -3 Промежуточная степень окисления: +3 Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю. Примеры определения степеней окисления в сложных веществах Пример: Задание. Решение. В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0. Пример: Задание. Определите степени окисления всех элементов в соединение Na2SO4. Решение. Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать. Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Пример: Задание. Определите степени окисления всех элементов в соединение K2Cr2O7. Решение. Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать. Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6. Использованные интернет-источники https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no12-valentnost-himiceskih-elementov http://kakimenno.ru/obrazovanie-i-nauka/srednee-obrazovanie/2607-kak-opredelit-stepen-okisleniya-elementa. http://www.tutoronline.ru/blog/chto-takoe-valentnost |
Валентность и степень окисления, подготовка к ЕГЭ по химии
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном
состоянии.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.
Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.
Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т. д. На представленных формулах валентности веществ равны:
д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — III (в угарном газе CO, так как одна связь образована по донорно-акцепторному механизму), IV (в углекислом газе CO
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток - получает знак «+».
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2
 Ниже вы найдете решение этой задачи.
Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
11.1: Числа окисления — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 58844
Результаты обучения
Числа окисления
Число окисления — это положительное или отрицательное число, которое присваивается атому для обозначения его степени окисления или восстановления . Термин степень окисления часто используется взаимозаменяемо со степенью окисления. Частичный перенос электрона — это сдвиг электронной плотности вблизи атома в результате изменения других атомов, с которыми он ковалентно связан. Этот сдвиг заряда основан на относительной электроотрицательности атомов, участвующих в связи.
Термин степень окисления часто используется взаимозаменяемо со степенью окисления. Частичный перенос электрона — это сдвиг электронной плотности вблизи атома в результате изменения других атомов, с которыми он ковалентно связан. Этот сдвиг заряда основан на относительной электроотрицательности атомов, участвующих в связи.
В целом степень окисления атома в молекуле представляет собой заряд, который атом имел бы, если бы все полярные ковалентные и ионные связи приводили к полному переносу электронов от менее электроотрицательного атома к более электроотрицательному. Номера окисления могут быть присвоены с использованием набора правил, изложенных ниже.
- Степень окисления атома нейтрального свободного элемента равна нулю. Свободным элементом считается любой элемент в несвязанном состоянии, будь то одноатомный или многоатомный. Например, степень окисления каждого атома в \(\ce{Fe}\), \(\ce{Li}\), \(\ce{N_2}\), \(\ce{Ar}\), и \(\ce{P_4}\) равно нулю. 9{3+}}\) равны \(+1\), \(-2\) и \(+3\) соответственно.

- Степень окисления кислорода в большинстве соединений равна \(-2\).
- Степень окисления водорода в большинстве соединений равна \(+1\).
- Степень окисления фтора во всех соединениях равна \(-1\). Другие галогены обычно имеют степень окисления \(-1\) в бинарных соединениях, но могут иметь переменную степень окисления в зависимости от среды связывания.
- В нейтральной молекуле сумма степеней окисления всех атомов равна нулю. Например, в \(\ce{H_2O}\) степени окисления \(\ce{H}\) и \(\ce{O}\) равны \(+1\) и \(-2\ ), соответственно. Поскольку в формуле два атома водорода, сумма всех степеней окисления в \(\ce{H_2O}\) равна \(2 \left( +1 \right) + 1 \left(-2 \right) = 0\). 9{2-}}\), степени окисления \(\ce{S}\) и \(\ce{O}\) равны \(+6\) и \(-2\) соответственно. Сумма всех степеней окисления сульфат-иона будет равна \(1\влево(+6\вправо) + 4\влево(-2\вправо) = -2\), что является зарядом иона.
Изучение правил присвоения степеней окисления показывает, что существует много элементов, для которых нет конкретных правил, таких как азот, сера и хлор. Эти элементы, как и некоторые другие, могут иметь различные степени окисления в зависимости от других атомов, с которыми они ковалентно связаны в молекулярном соединении. Полезно проанализировать несколько молекул, чтобы понять, какой стратегии следует придерживаться при присвоении степеней окисления другим атомам.
Эти элементы, как и некоторые другие, могут иметь различные степени окисления в зависимости от других атомов, с которыми они ковалентно связаны в молекулярном соединении. Полезно проанализировать несколько молекул, чтобы понять, какой стратегии следует придерживаться при присвоении степеней окисления другим атомам.
Числа окисления атомов в бинарном ионном соединении легко определить, поскольку они равны заряду иона (правило 2). В \(\ce{FeCl_3}\) степень окисления железа равна \(+3\), а степень окисления хлора равна \(-1\). В \(\ce{Ca_3P_2}\) кальций равен \(+2\), а фосфор равен \(-3\). Это связано с тем, что ионное соединение имеет форму кристаллической решетки, которая на самом деле состоит из этих ионов.
Присвоить степень окисления молекулярным соединениям сложнее. Главное — помнить правило 6: сумма всех степеней окисления для любых нейтральных частиц должна быть равна нулю. Обязательно учитывайте все индексы, которые появляются в формуле. В качестве примера рассмотрим соединение азотной кислоты \(\ce{HNO_3}\). Согласно правилу 4 степень окисления водорода равна \(+1\). Согласно правилу 3 степень окисления кислорода равна \(-2\). В отношении азота нет правил, но его степень окисления можно рассчитать следующим образом.
Согласно правилу 4 степень окисления водорода равна \(+1\). Согласно правилу 3 степень окисления кислорода равна \(-2\). В отношении азота нет правил, но его степень окисления можно рассчитать следующим образом.
\[1 \left( +1 \right) + x + 3 \left( -2 \right) = 0, \: \text{где} \: x \: \text{степень окисления азота} \]
\[\text{Решение:} \: x = 0 — 1 — \left( -6 \right) = +5\]
Степень окисления атома азота в \(\ce{HNO_3} \) равно \(+5\). Часто при присвоении степеней окисления удобно писать их над символом внутри формулы.
\[\overset{+1}{\ce{H}} \overset{+5}{\ce{N}} \overset{-2}{\ce{O_3}}\]
Вы можете задаться вопросом если есть ограничения на значения степеней окисления. Ключевым моментом, который следует учитывать, является правило октетов. Поскольку азот имеет 5 валентных электронов, то самое большее, что он может «потерять» при образовании связей в молекуле, равно 5, поэтому его максимально возможная степень окисления равна \(+5\). В качестве альтернативы он может получить до 3 электронов, поэтому его самая низкая (самая отрицательная) возможная степень окисления равна \(-3\). Точно так же хлор может иметь степени окисления в диапазоне от \(-1\) до \(+7\). 9{2-}}\). Натрий не является частью ковалентно связанного многоатомного иона, поэтому его степень окисления такая же, как и в бинарном ионном соединении \(+1\). Сера — это атом, степень окисления которого не подпадает ни под одно из правил. Степень окисления серы присваивается переменной \(х\) в следующем расчете. Помните, что сумма степеней окисления всех элементов должна равняться нулю, потому что \(\ce{Na_2S_2O_3}\) является нейтральным соединением.
Точно так же хлор может иметь степени окисления в диапазоне от \(-1\) до \(+7\). 9{2-}}\). Натрий не является частью ковалентно связанного многоатомного иона, поэтому его степень окисления такая же, как и в бинарном ионном соединении \(+1\). Сера — это атом, степень окисления которого не подпадает ни под одно из правил. Степень окисления серы присваивается переменной \(х\) в следующем расчете. Помните, что сумма степеней окисления всех элементов должна равняться нулю, потому что \(\ce{Na_2S_2O_3}\) является нейтральным соединением.
\[ \begin{align}2 \left( +1 \right) + 2 \left( x \right) + 3 \left( -2 \ right) &= 0 \\[5pt] 2 + 2x -6 &=0 \\[5pt] -4 + 2x &= 0 \\[5pt] 2x &= +4 \\[5pt] x &= +2 \end{align}\] 9{2-}}\).
\[ \begin{align} 2 \left( x \right) + 3 \left( -2 \right) &= -2 \\[5pt] 2x — 6 &= -2 \\[5pt] 2x & = +4 \\[5pt] x &= +2 \end{align}\]
Авторы и авторство
Эта страница под названием 11.1: Oxidation Numbers распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- степени окисления
Число окисления
Число окисленияНомера окисления
Часто полезно следить за химическими реакциями, наблюдая за изменениями в окислении
числа атомов в каждом соединении во время реакции. Окислительные числа также играют важную роль.
важную роль в систематической номенклатуре химических соединений. По определению окисление
Число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
Окислительные числа также играют важную роль.
важную роль в систематической номенклатуре химических соединений. По определению окисление
Число атома — это заряд, который атом имел бы, если бы соединение состояло из
ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. только одного элемента. Так, атомы в O 2 , O 3 , P 4 , S 8 , и металлический алюминий имеют степень окисления 0,
.2. Степень окисления простых ионов равна заряду иона. Окисление количество натрия в Na 9Например, ион 0163 + равен +1, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он соединяется с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он соединяется с металлом как
дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы группы IA образуют соединения (такие как Li 3 N и Na 2 S) в котором атом металла имеет степень окисления +1.
6. Элементы группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключение составляют молекулы и многоатомные ионы, содержащие связи O-O, такие как O 2 , О 3 , Н 2 О 2 , и ион O 2 2-.
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
Н 2 О: 2(+1) + (-2) = 0
10. Сумма степеней окисления в многоатомном ионе равна заряду на
ион. Степень окисления атома серы в SO 4 2- ионное сусло
быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна
равно -2.
SO 4 2- : (+6) + 4(-2) = -2
11. Элементы в нижнем левом углу периодической таблицы. с большей вероятностью имеют положительные степени окисления, чем те, которые расположены в правом верхнем углу угол стола. Сера имеет положительную степень окисления в SO 2 , для Например, потому что он ниже кислорода в периодической таблице.
ТАК 2 : (+4) + 2(-2) = 0
| Практическая задача 6: Назовите следующие ионные соединения. (а) Fe(NO 3 ) 3 (б) SrCO 3 (в) Na 2 SO 3 (г) Ca(ClO) 2 Нажмите здесь, чтобы проверить свой ответ на практическое задание 6 |
| Практическая задача 7: Присвойте степени окисления
атомов в следующих соединениях. |

 Валентность водорода принимают за I (единицу).
Валентность водорода принимают за I (единицу). 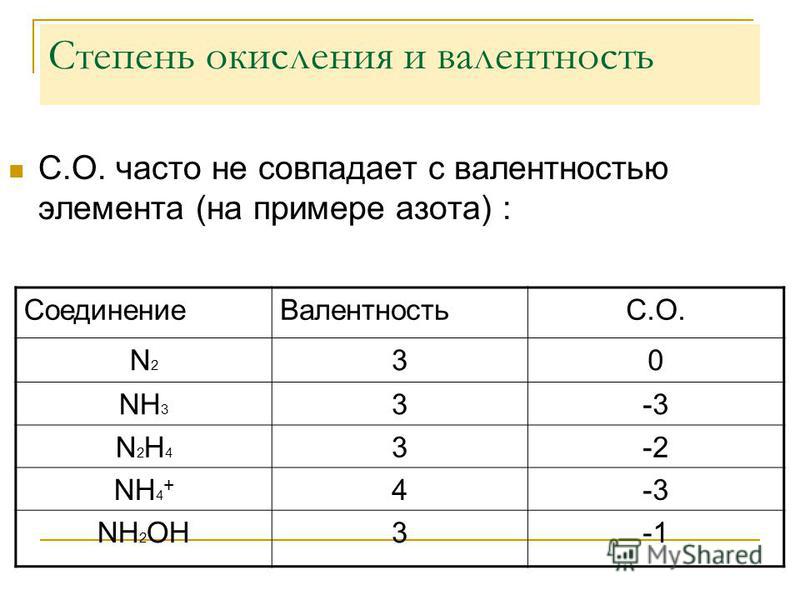


 Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—.
Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—.
 Определите степени окисления всех элементов в соединение N2O5
Определите степени окисления всех элементов в соединение N2O5 Отсюда х = +6.
Отсюда х = +6.  html
html

Leave A Comment