Вопрос 4 § 4-6 Химия 9 класс Рудзитис, Фельдман Помогите подобрать сокращенное уравнение. – Рамблер/класс
Вопрос 4 § 4-6 Химия 9 класс Рудзитис, Фельдман Помогите подобрать сокращенное уравнение. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Уравнение химической реакции, схема которой
К2СО3
1) H++OH- = H2O
2) СO32- + 2Н+ = Н2O + CO2↑
3) Н2O + СO2→ 2Н++ СО32-
4) К2СO3→ 2К+ + СО32-
ответы
Уравнение химической реакции, схема которой
К2СО3 + HNO3 → KNO3 + Н2O + СO2↑
можно изобразить в виде сокращенного ионного
уравнения:
2) СO32- + 2Н+ = Н2O + CO2
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Центр дистанционного обучения ГБУ ДППО ЦПКС «Информационно-методический центр» Красногвардейского района Санкт-Петербурга
Перейти к основному содержанию
Пропустить новости сайта
Новости сайта
Пропустить курсы
Курсы
Развернуть всё
Пропустить Календарь
Нет событий, Среда 1 Март 1 | Нет событий, Четверг 2 Март 2 Нет событий, Четверг 2 Март 2 | Нет событий, Пятница 3 Март 3 Нет событий, Пятница 3 Март 3 | Нет событий, Суббота 4 Март 4 Нет событий, Суббота 4 Март 4 | Нет событий, Воскресенье 5 Март 5 Нет событий, Воскресенье 5 Март 5 | ||
Нет событий, Понедельник 6 Март 6 Нет событий, Понедельник 6 Март 6 | Нет событий, Вторник 7 Март 7 Нет событий, Вторник 7 Март 7 | Нет событий, Среда 8 Март 8 Нет событий, Среда 8 Март 8 | Нет событий, Четверг 9 Март 9 Нет событий, Четверг 9 Март 9 | Нет событий, Пятница 10 Март 10 Нет событий, Пятница 10 Март 10 | Нет событий, Суббота 11 Март 11 Нет событий, Суббота 11 Март 11 | Нет событий, Воскресенье 12 Март 12 Нет событий, Воскресенье 12 Март 12 |
Нет событий, Понедельник 13 Март 13 Нет событий, Понедельник 13 Март 13 | Нет событий, Вторник 14 Март 14 Нет событий, Вторник 14 Март 14 | Нет событий, Среда 15 Март 15 Нет событий, Среда 15 Март 15 | Нет событий, Четверг 16 Март 16 Нет событий, Четверг 16 Март 16 | Нет событий, Пятница 17 Март 17 Нет событий, Пятница 17 Март 17 | Нет событий, Суббота 18 Март 18 Нет событий, Суббота 18 Март 18 | Нет событий, Воскресенье 19 Март 19 Нет событий, Воскресенье 19 Март 19 |
Нет событий, Понедельник 20 Март 20 Нет событий, Понедельник 20 Март 20 | Нет событий, Вторник 21 Март 21 Нет событий, Вторник 21 Март 21 | Нет событий, Среда 22 Март 22 Нет событий, Среда 22 Март 22 | Нет событий, Четверг 23 Март 23 Нет событий, Четверг 23 Март 23 | Нет событий, Пятница 24 Март 24 Нет событий, Пятница 24 Март 24 | Нет событий, Суббота 25 Март 25 Нет событий, Суббота 25 Март 25 | Нет событий, Воскресенье 26 Март 26 Нет событий, Воскресенье 26 Март 26 |
Нет событий, Понедельник 27 Март 27 Нет событий, Понедельник 27 Март 27 | Нет событий, Вторник 28 Март 28 Нет событий, Вторник 28 Март 28 | Нет событий, Среда 29 Март 29 Нет событий, Среда 29 Март 29 | Нет событий, Четверг 30 Март 30 Нет событий, Четверг 30 Март 30 | Нет событий, Пятница 31 Март 31 Нет событий, Пятница 31 Март 31 |
Нет пользователей на сайте (последние 5 минут)
Пропустить Основное меню Пропустить Навигация Пропустить Последние объявления19 мар 09:50
Сидорова Екатерина
Сайт размещен на другом хостинге с 10 мая 2017 года
Четкое объяснение химической реакции карбоната калия с водородом
Карбонат калия (K2CO3) представляет собой белую соль, растворимую в воде (нерастворимую в этаноле) и образующую сильнощелочной раствор. Его можно получить как продукт эндотермической реакции гидроксида калия и диоксида углерода. Он обеспечивает отличную способность впитывать влагу.
Его можно получить как продукт эндотермической реакции гидроксида калия и диоксида углерода. Он обеспечивает отличную способность впитывать влагу.
Водород — самый легкий элемент. При стандартных условиях водород представляет собой газ, состоящий из двухатомных молекул формулы h3. Он бесцветный, без запаха, без вкуса, нетоксичен и легко воспламеняется. Водород — самое распространенное химическое вещество во Вселенной, составляющее примерно 75% всех обычных соединений.
Карбонат калия:
Карбонат калия представляет собой неорганическое соединение с химической формулой K2CO3. Это белая соль, которая растворяется в воде. Он расплывается и часто появляется в виде влажного или влажного твердого вещества. Мыло и очки являются наиболее распространенным применением карбоната калия.
Карбонат калия является основным компонентом поташа и более очищенной жемчужной золы или соли битартрата калия. Жемчужная зола была получена путем сжигания поташа в печи для удаления примесей. Жемчужный пепел был мелким белым порошком, который остался. Первый патент, выданный Патентным ведомством США, был выдан Сэмюэлю Хопкинсу в 179 г.0 за усовершенствованный процесс производства поташа и жемчужной золы.
Жемчужный пепел был мелким белым порошком, который остался. Первый патент, выданный Патентным ведомством США, был выдан Сэмюэлю Хопкинсу в 179 г.0 за усовершенствованный процесс производства поташа и жемчужной золы.
В Северной Америке в конце 18 века жемчужная зола использовалась в качестве разрыхлителя для быстрого хлеба до того, как был разработан разрыхлитель.
Водород:
Водород (H) представляет собой бесцветное, не имеющее запаха и вкуса, легковоспламеняющееся газообразное вещество и является простейшим членом семейства химических элементов. Атом водорода имеет ядро, состоящее из протонов, несущих единицу положительного заряда. Также это ядро связано с электроном, который несет единичный отрицательный заряд. При нормальных условиях газообразный водород представляет собой рыхлую сборку молекул водорода, каждая из которых состоит из пары атомов, двухатомной молекулы и h3. Самая ранняя известная и важная химия водорода заключается в том, что он сгорает с кислородом с образованием воды, h3O. Фактически, название «водород» происходит от греческого слова «создатель воды».
Фактически, название «водород» происходит от греческого слова «создатель воды».
Водород является самым распространенным элементом во Вселенной (в три раза более распространенным, чем гелий, второй по распространенности элемент), но он составляет всего около 0,14 процента веса земной коры. Однако он был обнаружен в больших количествах в составе океанов, паковых льдов, рек, озер и воды в атмосфере. Водород присутствует во всех животных и растительных тканях, а не только в нефти, как компонент бесчисленных соединений углерода. Часто говорят, что соединений углерода известно больше, чем любого другого элемента, но на самом деле водород присутствует почти во всех соединениях углерода и всех других элементах (кроме некоторых благородных газов). увеличивать. Может быть большое количество соединений водорода.
Химическая реактивность карбоната калия с водородом:
Для определения объективной скорости разложения KHCO3 был использован метод ТГА с медленно возрастающей постоянной температурой на небольших тонко измельченных образцах.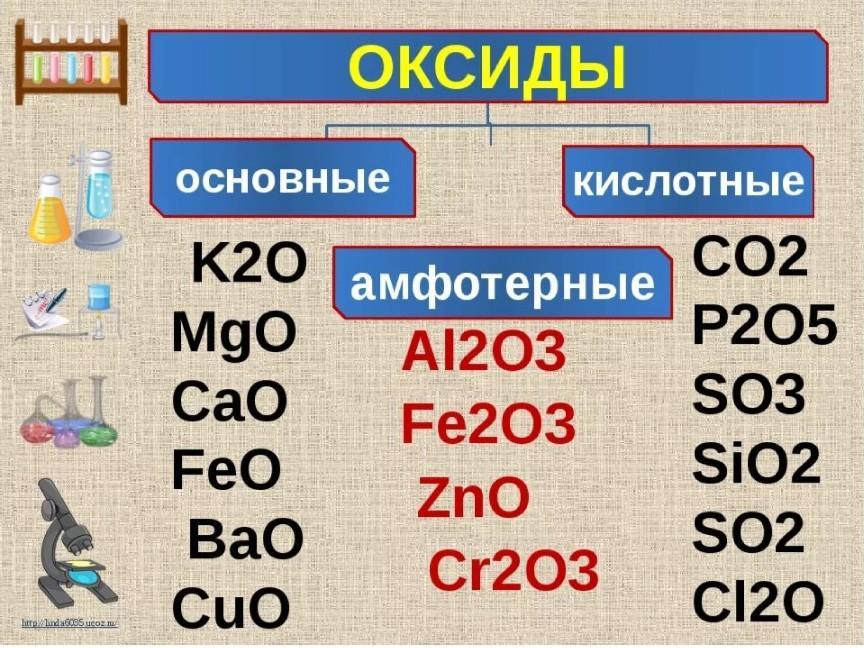 Такие реакции обеспечивают новый пористый и реактивный адсорбент для вредных и/или зловонных газов. Бикарбонат начинает разлагаться при 364К и достигает максимальной скорости реакции 5,73×10-41/с при 421,9К. Зависимость типа Аррениуса создается интегральным методом с использованием функции Шромильха. Энергия активации достигает 141,3 кДж/моль, а порядок реакции равен 1,145. Объем пор (0,2309см3/г), полученного прокаливанием, колеблется от 403 до 503 К и не зависит от температуры, но средний размер пор и размер частиц увеличиваются с повышением температуры. Представленные графики позволяют удобно прогнозировать условия достижения почти полной конверсии бикарбоната и минимизации нежелательного спекания образующегося карбоната.
Такие реакции обеспечивают новый пористый и реактивный адсорбент для вредных и/или зловонных газов. Бикарбонат начинает разлагаться при 364К и достигает максимальной скорости реакции 5,73×10-41/с при 421,9К. Зависимость типа Аррениуса создается интегральным методом с использованием функции Шромильха. Энергия активации достигает 141,3 кДж/моль, а порядок реакции равен 1,145. Объем пор (0,2309см3/г), полученного прокаливанием, колеблется от 403 до 503 К и не зависит от температуры, но средний размер пор и размер частиц увеличиваются с повышением температуры. Представленные графики позволяют удобно прогнозировать условия достижения почти полной конверсии бикарбоната и минимизации нежелательного спекания образующегося карбоната.
Неорганическое соединение бикарбонат калия (название IUPAC: гидрокарбонат калия, часто известное как карбонат калия) имеет химическую формулу KHCO3. Это сплошной белый цвет.
Структура карбоната калия:
Калиевая соль, представляющая собой двухкалиевую соль угольной кислоты.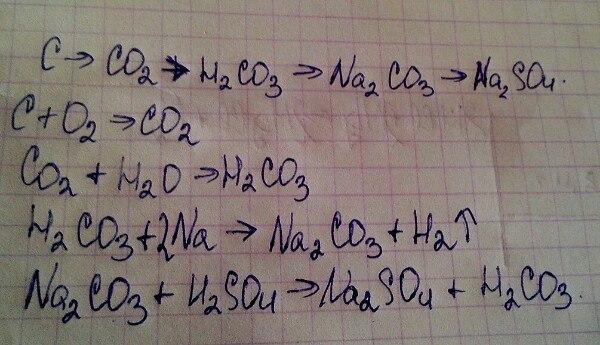
Заключение:
Карбонат калия реагирует с соляной кислотой. Эта серия показывает добавление твердого карбоната калия (K2CO3) в химический стакан, содержащий 0,5 М соляную кислоту. Реакция HCl + K2CO3→ KCl + CO2 + h3O приводит к образованию пузырьков углекислого газа. Это пример реакции карбоновой кислоты, которая сама по себе является реакцией двойного обмена, за которой следует реакция разложения.
Соляная кислота и карбонат калия реагируют в соответствии со следующими сбалансированными химическими уравнениями с образованием жидкой воды, газообразного диоксида углерода и водного раствора хлорида калия. 2 HCl (водн.) + K2CO3 (водн.) → h3O (ж) + CO2 (г) + 2 KCl (водн.) Всего на воде собирается 15,3 мл газа. Атмосферное давление 776 мм рт.ст., температура воды 30,0 °С. Давление паров воды при 30,0 °С равно 31,86 мм рт.ст.
Полное ионное уравнение и результирующее ионное уравнение для химическая реакция Рассмотрим реакцию нейтрализации калия карбонат, K2CO3, и бромистоводородная кислота, HBrHBr, образуя соль бромид калия, углекислый газ KBr, CO2 и вода, h3O.
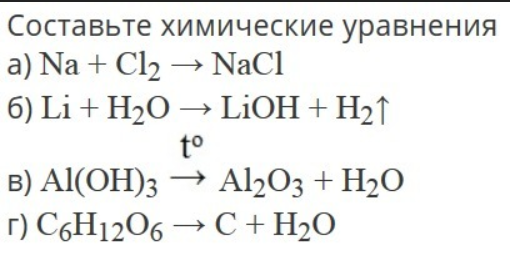 сбалансированное химическое уравнение реакции
K2CO3(водн.)+2HBr(водн.)→2KBr(водн.)+CO2(г)+h3O(ж)
В реакции K2CO3, HBr и KBr являются сильными электролитами, поэтому
эти соединения полностью диссоциируют в воде с образованием
соответствующие ионы. Полное ионное уравнение
2K+(водн.) + CO32-(водн.) + 2H+(водн.) + 2Br-(водн.)→2K+(водн.) + 2Br-(водн.) +
CO2(г) + h3O(л)
Для получения суммарного ионного уравнения ионы-спектаторы K+ и CO32−(водн.)+2H+(водн.)→CO2(г)+h3O(ж)
При написании химических уравнений в мастеринге укажите
физические состояния с использованием аббревиатуры (s), (l) или (g) для твердого тела,
жидкость или газ соответственно. Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон. Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой.
сбалансированное химическое уравнение реакции
K2CO3(водн.)+2HBr(водн.)→2KBr(водн.)+CO2(г)+h3O(ж)
В реакции K2CO3, HBr и KBr являются сильными электролитами, поэтому
эти соединения полностью диссоциируют в воде с образованием
соответствующие ионы. Полное ионное уравнение
2K+(водн.) + CO32-(водн.) + 2H+(водн.) + 2Br-(водн.)→2K+(водн.) + 2Br-(водн.) +
CO2(г) + h3O(л)
Для получения суммарного ионного уравнения ионы-спектаторы K+ и CO32−(водн.)+2H+(водн.)→CO2(г)+h3O(ж)
При написании химических уравнений в мастеринге укажите
физические состояния с использованием аббревиатуры (s), (l) или (g) для твердого тела,
жидкость или газ соответственно. Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон. Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой. Nh5+(водн.)+OH-(водн.)+H+(водн.)+Cl-(водн.)→Nh5+(водн.)+Cl-(водн.)+h3O(ж)
Напишите краткое ионное уравнение реакции
в части А.
Оформите ответ в виде химического уравнения.
Nh5+(водн.)+OH-(водн.)+H+(водн.)+Cl-(водн.)→Nh5+(водн.)+Cl-(водн.)+h3O(ж)
Напишите краткое ионное уравнение реакции
в части А.
Оформите ответ в виде химического уравнения. Полное ионное уравнение и результирующее ионное уравнение для
химическая реакция
Рассмотрим реакцию нейтрализации калия
карбонат, K2CO3, и бромистоводородная кислота, HBrHBr, образуя соль
бромид калия, углекислый газ KBr, CO2 и вода, h3O.
сбалансированное химическое уравнение реакции
K2CO3(водн.)+2HBr(водн.)→2KBr(водн.)+CO2(г)+h3O(ж)
В реакции K2CO3, HBr и KBr являются сильными электролитами, поэтому
эти соединения полностью диссоциируют в воде с образованием
соответствующие ионы. Полное ионное уравнение
2K+(водн.) + CO32-(водн.) + 2H+(водн.) + 2Br-(водн.)→2K+(водн.) + 2Br-(водн.) +
CO2(г) + h3O(л)
Для получения суммарного ионного уравнения ионы-спектаторы K+ и
Br-удалены:
CO32−(водн.)+2H+(водн.)→CO2(г)+h3O(ж)
При написании химических уравнений в мастеринге укажите
физические состояния с использованием аббревиатуры (s), (l) или (g) для твердого тела,
жидкость или газ соответственно. Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон.
ЧАСТЬ А:
Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой.
Nh5+(водн.)+OH-(водн.)+H+(водн.)+Cl-(водн.)→Nh5+(водн.)+Cl-(водн.)+h3O(ж)
ВОПРОС: Напишите суммарное ионное уравнение реакции
в части А.
Оформите ответ в виде химического уравнения.
Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон.
ЧАСТЬ А:
Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой.
Nh5+(водн.)+OH-(водн.)+H+(водн.)+Cl-(водн.)→Nh5+(водн.)+Cl-(водн.)+h3O(ж)
ВОПРОС: Напишите суммарное ионное уравнение реакции
в части А.
Оформите ответ в виде химического уравнения.
Вопрос о наилучшем совпадении
Пошаговые ответы
Полное ионное уравнение и результирующее ионное уравнение для
химическая реакция
Рассмотрим реакцию нейтрализации калия
карбонат, K2CO3, и бромистоводородная кислота, HBrHBr, образуя соль
бромид калия, углекислый газ KBr, CO2 и вода, h3O.
сбалансированное химическое уравнение реакции
K2CO3(водн. )+2HBr(водн.)→2KBr(водн.)+CO2(г)+h3O(ж)
В реакции K2CO3, HBr и KBr являются сильными электролитами, поэтому
эти соединения полностью диссоциируют в воде с образованием
соответствующие ионы. Полное ионное уравнение
2K+(водн.) + CO32-(водн.) + 2H+(водн.) + 2Br-(водн.)→2K+(водн.) + 2Br-(водн.) +
CO2(г) + h3O(л)
Для получения суммарного ионного уравнения ионы-спектаторы K+ и
Br-удалены:
CO32−(водн.)+2H+(водн.)→CO2(г)+h3O(ж)
При написании химических уравнений в мастеринге укажите
физические состояния с использованием аббревиатуры (s), (l) или (g) для твердого тела,
жидкость или газ соответственно. Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон.
ЧАСТЬ А:
Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой.
)+2HBr(водн.)→2KBr(водн.)+CO2(г)+h3O(ж)
В реакции K2CO3, HBr и KBr являются сильными электролитами, поэтому
эти соединения полностью диссоциируют в воде с образованием
соответствующие ионы. Полное ионное уравнение
2K+(водн.) + CO32-(водн.) + 2H+(водн.) + 2Br-(водн.)→2K+(водн.) + 2Br-(водн.) +
CO2(г) + h3O(л)
Для получения суммарного ионного уравнения ионы-спектаторы K+ и
Br-удалены:
CO32−(водн.)+2H+(водн.)→CO2(г)+h3O(ж)
При написании химических уравнений в мастеринге укажите
физические состояния с использованием аббревиатуры (s), (l) или (g) для твердого тела,
жидкость или газ соответственно. Используйте (aq) для водного раствора. Использовать
шаблон форматирования при вводе нижних индексов, надстрочных индексов или
дроби, щелкнув , а затем выберите соответствующую
шаблон.
ЧАСТЬ А:
Учитывая реагентную часть полного ионного уравнения для
реакция нейтрализации гидроксида аммония (Nh5OH) с
соляной кислоты (HCl), напишите полное ионное уравнение (также известное
как полное ионное уравнение), вводя как реагент, так и
виды продукта, разделенные реакционной стрелкой.

Leave A Comment