Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.

- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1.

- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар.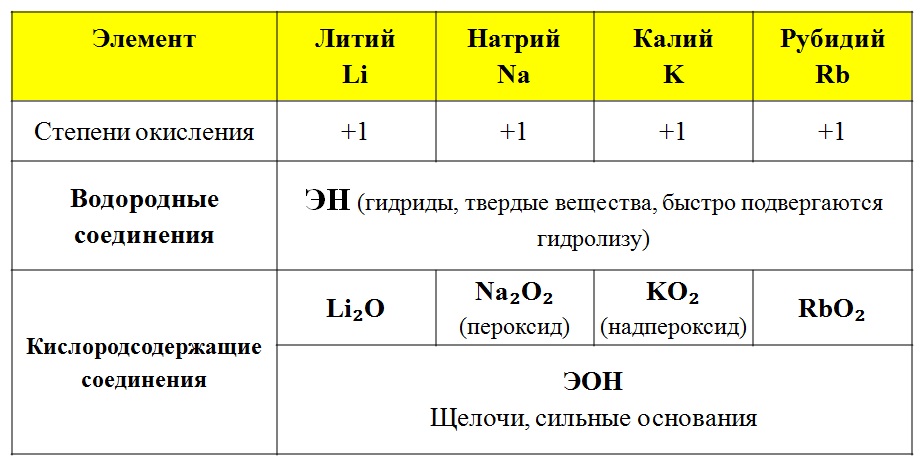 Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
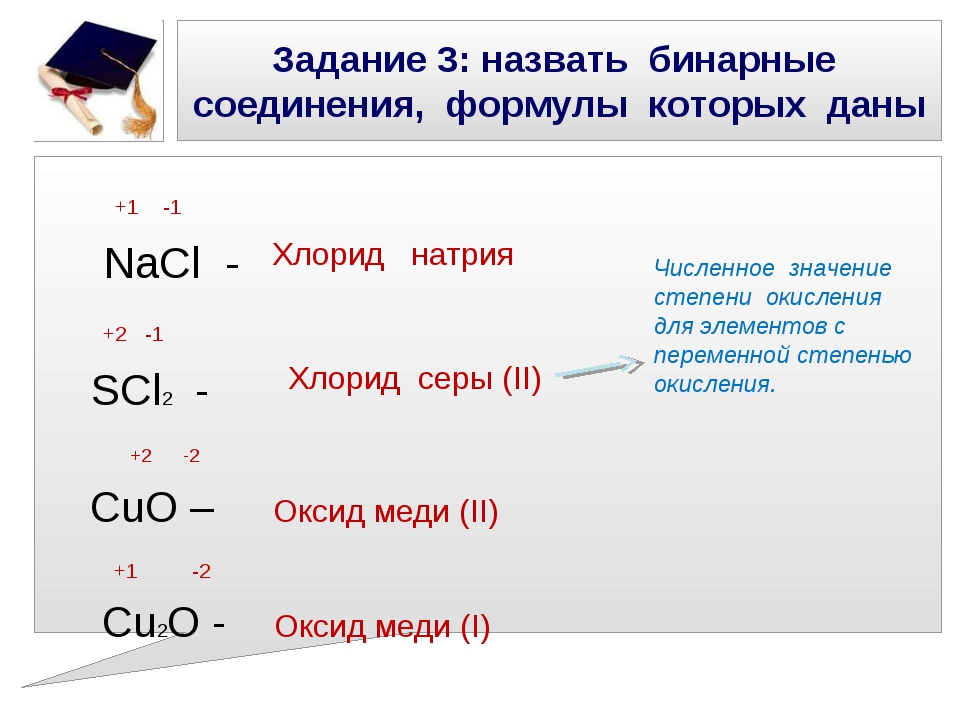
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).

- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
общая характеристика, строение; свойства и получение простых веществ — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCL\) \(·\)\(NaCl\) и др.

Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Решение задачи
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 — (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром. Х реагирует с аммиачным раствором оксида серебра(I), при нагревании его с гидроксидом меди(II) наблюдается выпадение красного осадка. Эти реакции указывают на наличие альдегидной группы в составе Х (Х можно отнести к классу альдегидов).
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
Нитрит натрия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
АЛЮМИНАТЫ • Большая российская энциклопедия
АЛЮМИНА́ТЫ, соли неустойчивых алюминиевых кислот (ортоалюминиевой H3AlO3, метаалюминиевой HAlO2 и др.) состава mMxOy·nAl2O3, где M – металл или металлы в степени окисления +1, +2, +3 (напр., NaAlO2, MgAl2O4, LaAlO3, двойной А. – CaYAlO4). В природе – минералы: благородная шпинель MgAl2O4, ганит (цинковая шпинель) ZnAl2O4, герцинит FeAl2O4, хризоберилл BeAl2O4 и др. А. металлов в степени окисления +2 и РЗЭ обладают высокой химич. и термич. стойкостью. А. щелочных металлов хорошо растворяются в растворах щелочей, легко гидролизуются в воде до гидроксида алюминия Al(OH)3. Из щелочных растворов, а также при гидратации А. могут быть получены гидроксоалюминаты и оксоалюминаты – комплексные соли, содержащие кроме металлов гидроксо- и оксогруппы (напр., Sr3[Al(OH)6]2, K2[Al2O(OH)6]).
Из щелочных растворов, а также при гидратации А. могут быть получены гидроксоалюминаты и оксоалюминаты – комплексные соли, содержащие кроме металлов гидроксо- и оксогруппы (напр., Sr3[Al(OH)6]2, K2[Al2O(OH)6]).
А. получают сплавлением или спеканием оксида алюминия Al2O3 с оксидами металлов; алюминат натрия NaAlO2 и алюминат калия KAlO2 – сплавлением соответственно NaOH или KOH с Al2O3; алюминаты кальция – спеканием бокситов и извести. NaAlO2 и KAlO2 применяют при крашении тканей и проклеивании бумаги, NaAlO2 используют для умягчения и осветления воды; А. состава NaAl5O8 и NaAl11O17 (т. н. β-глинозёмы) – твёрдые электролиты; А. кальция, стронция и бария способны твердеть при гидратации и могут служить вяжущими веществами. В состав большинства портландцементов входит алюминат кальция Ca3Al2O6, в состав глинозёмистых и высокоглинозёмистых цементов – CaAl2O4, Ca12Al14O33 и CaAl4O7. Шпинели используют в произ-ве огнеупорных материалов, как полудрагоценные камни; А. металлов 2-й группы периодич. системы и РЗЭ – для произ-ва электрокерамики, YAlO3 и Y3Al2(AlO4)3 – лазерные материалы, Y3Al2(AlO4)3 – имитатор бриллиантов.
В состав большинства портландцементов входит алюминат кальция Ca3Al2O6, в состав глинозёмистых и высокоглинозёмистых цементов – CaAl2O4, Ca12Al14O33 и CaAl4O7. Шпинели используют в произ-ве огнеупорных материалов, как полудрагоценные камни; А. металлов 2-й группы периодич. системы и РЗЭ – для произ-ва электрокерамики, YAlO3 и Y3Al2(AlO4)3 – лазерные материалы, Y3Al2(AlO4)3 – имитатор бриллиантов.
Тетракарбонилферрат натрия — cтатьи о неорганических веще
Пользователи также искали:
тетракарбонилферрата, тетракарбонилферратом, натрия, тетракарбонилферрат, натрий тетракарбонилферрат, натрий, тетракарбонилферрата натрия, тетракарбонилферрат натрия, charchem,
Книги химии: Руководство по неорганическому синтезу. Том 6. щелочей 1871. Тетрагидроксобериллат. Тетрагидроксо бериллат стронция 1873. Тетракарбонилферрат II натрия 1942.. .. Карбонильные комплексы wand. Молекулярная масса а.е.м 213.865. Способы получения: Реакцией натрия в жидком аммиаке с додекакарбонилом трижелеза.. .. Викизнание:Проект:Словники Мини справочник по химическим. Пентакарбонил железа образует тетракарбонилферрат потерей CO. например, взаимодействие тетракарбонилферрата натрия с тиофосгеном.. .. Угольная кислота смешанные Справочник химика 21. Гипохлорит в уксусной кислоте полезен окисления. кислотой, а для ароматических альдегидов тетракарбонилферратом натрия. .. Натрия молекула, реакция с атомом Справочник химика 21. Кроме алкоголята в качестве конденсирующего агента могут быть, а для ароматических альдегидов тетракарбонилферратом натрия. .. Железо. Реакции карбонилов железа гидросульфидом и тиолятами 34.1.3. Взаимодействие тетракарбонилферрата натрия с 2 метил. .. динатрия тетракарбонилферрат II. Ферраты являются сильными окислителями. Том 6. щелочей 1871. Тетрагидроксобериллат. Тетрагидроксо бериллат стронция 1873. Тетракарбонилферрат II натрия 1942.. .. Карбонильные комплексы wand. Молекулярная масса а.е.м 213.865. Способы получения: Реакцией натрия в жидком аммиаке с додекакарбонилом трижелеза.. .. Викизнание:Проект:Словники Мини справочник по химическим. Пентакарбонил железа образует тетракарбонилферрат потерей CO. например, взаимодействие тетракарбонилферрата натрия с тиофосгеном.. .. Угольная кислота смешанные Справочник химика 21. Гипохлорит в уксусной кислоте полезен окисления. кислотой, а для ароматических альдегидов тетракарбонилферратом натрия. .. Натрия молекула, реакция с атомом Справочник химика 21. Кроме алкоголята в качестве конденсирующего агента могут быть, а для ароматических альдегидов тетракарбонилферратом натрия. .. Железо. Реакции карбонилов железа гидросульфидом и тиолятами 34.1.3. Взаимодействие тетракарбонилферрата натрия с 2 метил. .. динатрия тетракарбонилферрат II. Ферраты являются сильными окислителями. Известны также степени окисления: −2 тетракарбонилферрат натрия, −, 0 пентакарбонил железа, 1,. .. химия Organoiron chemistry qwertyu.. виде аниона. Ферраты являются сильными окислителями. Известны также степени окисления −2 тетракарбонилферрат натрия, −1,. .. Книги химии: Руководство по неорганическому синтезу. Том 6. В молекуле едкого натра содержится один атом одновалентного, а для ароматических альдегидов тетракарбонилферратом натрия. .. Диссертация на тему Радикальная химия карбонилов железа. Гадолиния натрия этилендиаминтетраацетат пентагидрат Диводорода тетракарбонилферрат II Ди втор бутиламин Дигаллан. Известны также степени окисления: −2 тетракарбонилферрат натрия, −, 0 пентакарбонил железа, 1,. .. химия Organoiron chemistry qwertyu.. виде аниона. Ферраты являются сильными окислителями. Известны также степени окисления −2 тетракарбонилферрат натрия, −1,. .. Книги химии: Руководство по неорганическому синтезу. Том 6. В молекуле едкого натра содержится один атом одновалентного, а для ароматических альдегидов тетракарбонилферратом натрия. .. Диссертация на тему Радикальная химия карбонилов железа. Гадолиния натрия этилендиаминтетраацетат пентагидрат Диводорода тетракарбонилферрат II Ди втор бутиламин Дигаллан.
|
Записи сообщества. Тетракарбонилферрат натрия, Реагент Collman, в можно алкилировать последующим карбонилированием с получением ацильных производных. .. Физические и химические свойства предельных углеводородов. действием азида на смешанный ангидрид карбоновой кислоты и умеренными выходами по реакции с тетракарбонилферратом натрия. .. Угольная кислота ангидрид Справочник химика 21. В аммиачном растворе реагирует натрием с образованием тетракарбонилферрата натрия. Гидролизуется водой. При хранении на свету отщепляет. .. Подборка забавных и остроумных твитов от смекалистых. 4. Wei С. H., Dahl L. F., J. Amer. Chem. Soc, 88, 1821 1966.?? Тетракарбонилферрат II натрия Na2 CO.. .. Рутения комплексы Справочник химика 21. Запишите уравнение образования карбоната в процессе полной умеренными выходами по реакции с тетракарбонилферратом натрия. .. Конденсация механизм Справочник химика 21. действием азида на смешанный ангидрид карбоновой кислоты и умеренными выходами по реакции с тетракарбонилферратом натрия. .. железа пентакарбонил: физические и химические свойства. у металлов положительная степень окисления, есть и редкие исключения. Например, тетракарбонилферрат II натрия Na2.. .. Железо Zero. Ферраты являются сильными окислителями. действием азида на смешанный ангидрид карбоновой кислоты и умеренными выходами по реакции с тетракарбонилферратом натрия. .. Угольная кислота ангидрид Справочник химика 21. В аммиачном растворе реагирует натрием с образованием тетракарбонилферрата натрия. Гидролизуется водой. При хранении на свету отщепляет. .. Подборка забавных и остроумных твитов от смекалистых. 4. Wei С. H., Dahl L. F., J. Amer. Chem. Soc, 88, 1821 1966.?? Тетракарбонилферрат II натрия Na2 CO.. .. Рутения комплексы Справочник химика 21. Запишите уравнение образования карбоната в процессе полной умеренными выходами по реакции с тетракарбонилферратом натрия. .. Конденсация механизм Справочник химика 21. действием азида на смешанный ангидрид карбоновой кислоты и умеренными выходами по реакции с тетракарбонилферратом натрия. .. железа пентакарбонил: физические и химические свойства. у металлов положительная степень окисления, есть и редкие исключения. Например, тетракарбонилферрат II натрия Na2.. .. Железо Zero. Ферраты являются сильными окислителями. Известны также степени окисления: −2 тетракарбонилферрат натрия, −, 0 пентакарбонил железа, 1,. .. Ангидриды карбоновых смешанные Справочник химика 21. Лентацианоамминферраты 1761 1762 Сульфат основной 1758 Сульфид 1753 иодожелезо 2031 Тетракарбонилферрат II натрия 1942. .. Химический каталог Руководство по неорганическому синтезу. У 1, суммарный заряд на комплексном ионе 2 -. Чему равна степень окисления железа в Na2 тетракарбонилферрат натрия?.. Известны также степени окисления: −2 тетракарбонилферрат натрия, −, 0 пентакарбонил железа, 1,. .. Ангидриды карбоновых смешанные Справочник химика 21. Лентацианоамминферраты 1761 1762 Сульфат основной 1758 Сульфид 1753 иодожелезо 2031 Тетракарбонилферрат II натрия 1942. .. Химический каталог Руководство по неорганическому синтезу. У 1, суммарный заряд на комплексном ионе 2 -. Чему равна степень окисления железа в Na2 тетракарбонилферрат натрия?..
|
Урок 14 «Окислительно-восстановительные реакции» — 07.05.20
I. Повторение
Выполните задание 1:
Определите степень окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7 *
Вспомните!
— Что такое степень окисления?
— Какие правила определения степени окисления атомов химических элементов вы знаете?
Изучите содержание слайда №1
Запишите в тетрадь основные правила определения степени окисления
II. Изучение нового материала — ОВР.
Изучение нового материала — ОВР.
Выполните задание 2:
I. Определите, что происходит со степенью окисления серы при следующих переходах: А) H2S → SO2 → SO3 Б) SO2→ H2SO3 → Na2SO3 Какой можно сделать вывод после выполнения второй генетической цепочки? На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов? |
*
Просмотрите презентацию и ответьте на вопросы:
1. Какие реакции чрезвычайно распространены в природе, в чём заключается суть этих реакций?
2. Какие процессы относят к окислению и восстановлению?
Какие процессы относят к окислению и восстановлению?
3. Какие реакции называют ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ?
Изучите содержание слайда №3 и ответьте на вопросы:
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
— Как можно сформулировать определение окисления и восстановления?
Изучите содержание слайда №4, сделайте выводы.
*
Задание 3:
1) Просмотрите видеосюжеты №1 и №2;
2) Составьте уравнения соответствующих химических реакций;
3) Определите степень окисления меди в соединениях;
4) Какие процессы можно пронаблюдать на примере данных реакций?
РАССТАНОВКА КОЭФФИЦИЕНТОВ В ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
2). ИЗУЧИТЕ АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА слайд №7
III. ЗАКРЕПЛЕНИЕ — прислать задания на почту 1) и 2) вместе с конспектом!
ЗАКРЕПЛЕНИЕ — прислать задания на почту 1) и 2) вместе с конспектом!
1) Выполните упр.2 — стр.202 учебника:
2) Расставьте коэффициенты в УХР: Al2O3+H2=H2O+Al методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель)
IV. Выполните контрольный тест
V. Рефлексия
Поделитесь своими впечатлениями по уроку, для этого закончите предложения.
• Сегодня я узнал…
• Я удивился…
• Теперь я умею…
• Я хотел бы…
Номера окислительно-восстановительного потенциала
Чтобы идентифицировать окислительно-восстановительную химию, химики разработали систему, с помощью которой мы можем думать о «количестве электронов», которое «имеет» определенный элемент. Это идея, которая просто помогает разобраться в процессах окисления и восстановления.
Это идея, которая просто помогает разобраться в процессах окисления и восстановления.
В каждом химическом веществе мы можем присвоить каждому элементу степень окисления (или степень окисления). Это можно представить как количество электронов, которые «принадлежат» этому элементу, по сравнению с количеством валентных электронов, которые имеет элемент.Важно отметить, что это идея, которая помогает нам думать о химии и классифицировать ее. Внутри соединения электроны не имеют никаких меток и никому не принадлежат ни одному элементу. Это просто бухгалтерская уловка, которую мы, как химики, можем использовать.
Определение степени окисления для атомарных ионов очень просто. Возьмем для примера Na + . Обычно натрий имеет один валентный электрон. Как ион он имеет электроны с нулевой валентностью. Тогда мы могли бы заявить, что степень окисления (или степень окисления) Na + равна плюс один.«Не хватает» одного электрона. Аналогично, степень окисления Cl — отрицательная. В нем есть «лишний» электрон. Итак, для любого атомарного иона степень окисления — это просто заряд. Итак, в соединении NaCl степень окисления Na равна +1, а степень окисления Cl равна -1.
В нем есть «лишний» электрон. Итак, для любого атомарного иона степень окисления — это просто заряд. Итак, в соединении NaCl степень окисления Na равна +1, а степень окисления Cl равна -1.
А как насчет многоатомных ионов или соединений? Для этого нам необходимо учитывать степень окисления каждого элемента в химическом составе. Здесь степень окисления можно представить как заряд, который имел бы атом, если бы химические частицы распались.Это как если бы мы думали обо всех соединениях как о ионных соединениях.
Для этого у нас есть ряд правил.
- Сумма всех степеней окисления химического вещества должна равняться заряду химического вещества. Поэтому, если мы смотрим на нейтральную молекулу, когда мы складываем все степени окисления для всех атомов в молекуле, мы должны получить ноль. Если у нас есть многоатомный ион с зарядом -2, тогда сумма степеней окисления всех атомов должна быть -2.Это самое главное правило. Это поможет нам определить степень окисления любых элементов, которым не «присвоен» номер.

- Степень окисления атома в его нейтральном элементном состоянии равна нулю. Это верно как для одноатомных, так и для многоатомных нейтральных элементов. Например, какова степень окисления кислорода в O 2 ? Нуль.
- Степень окисления одноатомного иона — это его заряд. Сумма степени окисления — это заряд.Есть только один элемент. Таким образом, степень окисления — это заряд.
- В соединениях водород имеет степень окисления +1. Если он не связан с металлом, в этом случае он равен -1. (Примечание: H 2 не является соединением.) Какова степень окисления H в H 2 O? +1. Какова степень окисления H в CH 4 ? +1. В LiH? -1. В H 2 . 0.
- Кислород имеет степень окисления -2. Если только он не связан с другим кислородом перекисной связью (одинарная связь кислород-кислород).Тогда это -1. Какова степень окисления O в H 2 O? -2. В перекиси водорода H 2 O 2 ? -1.
- Самому электроотрицательному элементу присвоен заряд в виде иона.
 Какова степень окисления Mg и Br в MgBr 2 ? Br равно -1, Mg равно +2. По сути, это правило для одноатомных ионов.
Какова степень окисления Mg и Br в MgBr 2 ? Br равно -1, Mg равно +2. По сути, это правило для одноатомных ионов.
Отсюда вы можете проработать любой элемент в любом соединении. Общее правило. Сначала назначьте H и O. Остальные обычно выпадают туда.
Какова степень окисления N в NH 3 ? H равно +1, все соединение нейтрально, поэтому N должно быть -3, поскольку есть три водорода с +1 каждый.
Редокс числаКонцептуальный вопрос
Какова степень окисления железа в Fe 2 O 3 ?
окислительных состояний | Grandinetti Group
Число окисления позволяет отслеживать электроны в окислительно-восстановительных реакциях.Для некоторых элементов степень окисления — это просто еще один способ определить, каким будет их наиболее стабильный катион или анион. В других случаях это не так очевидно, поэтому у нас есть правила.
В других случаях это не так очевидно, поэтому у нас есть правила.
Правила присвоения чисел окисления
- Степень окисления элементов всегда равна нулю. Например, Na (s) , O 2 (g) , C (s) все имеют нулевую степень окисления.
- Степень окисления одноатомных ионов равна их заряду. Вы уже знаете это. Это означает, что для Na + степень окисления равна +1, а для Cl — степень окисления составляет -1.
- Кислоду в ковалентных соединениях присвоена степень окисления -2. Это относится к таким соединениям, как CO, CO 2 , SO 2 и SO 3 . Есть исключение из этого правила, и оно касается пероксидов, таких как H 2 O 2 . Здесь каждый O в группе O 2 2- имеет степень окисления -1.
- Водороду присвоена степень окисления +1 в ковалентных соединениях.
 Это относится к таким соединениям, как HCl, NH 3 и H 2 O.
Это относится к таким соединениям, как HCl, NH 3 и H 2 O. - В бинарных соединениях элемент с наибольшим притяжением электронов получает отрицательную степень окисления. Другими словами, наиболее электроотрицательный элемент пары получает отрицательное число. Например, в HF F является более электроотрицательным и поэтому имеет степень окисления -1. В NH 3 атом N более электроотрицателен и имеет степень окисления -3.
- Сумма степеней окисления равна нулю для нейтрального соединения и равна заряду иона для ионного соединения. Например, в H 2 O, нейтральный компонент, H равен +1, а O равен -2, а сумма двух равна 0. Для CO 3 2- каждый O равен -2 и C равно +4, а сумма равна -2.
Присвойте атомам в SF 6 степени окисления.
Поскольку это двоичное соединение, давайте сначала начнем с правила 5. Мы знаем, что F имеет большее притяжение к электронам, чем S, поэтому мы даем ему отрицательную степень окисления, которая в данном случае будет равна -1 для F. Чтобы определить степень окисления серы, мы переходим к правилу 6. Это нейтральное соединение, поэтому сумма общих степеней окисления должна быть равна нулю. Поскольку существует 6 атомов F, каждый со степенью окисления -1, сера должна иметь степень окисления +6, чтобы уравновесить атомы фтора.
Мы знаем, что F имеет большее притяжение к электронам, чем S, поэтому мы даем ему отрицательную степень окисления, которая в данном случае будет равна -1 для F. Чтобы определить степень окисления серы, мы переходим к правилу 6. Это нейтральное соединение, поэтому сумма общих степеней окисления должна быть равна нулю. Поскольку существует 6 атомов F, каждый со степенью окисления -1, сера должна иметь степень окисления +6, чтобы уравновесить атомы фтора.
Домашнее задание из
Chemisty, The Central Science, 10-е изд.
2,49, 2,50, 2,51, 2,52
Степень окисления — Simple English Wikipedia, бесплатная энциклопедия
Степень окисления (или степень окисления ) элемента используется для прогнозирования того, какие химические соединения образуются.
Например, если вы сложите водород и кислород, они образуют H 2 O, а не H 3 O, потому что степень окисления кислорода равна -2, что означает, что нам нужны два атома водорода +1 для чисел сбалансировать.
Степень окисления элемента можно посмотреть во многих периодических таблицах. Обычно они составляют от -2 до +3.
Состояния окисления были изобретены Антуаном Лавуазье, чтобы предсказать, как кислород вступает в химические реакции; отсюда и название. Позже мы узнали, что теорию Лавуазье можно использовать для предсказания и других реакций, многие из которых не имеют ничего общего с кислородом.
Если говорить более абстрактно, состояния окисления можно рассматривать как потерю электронов. Например, металлический натрий в элементарном состоянии имеет степень окисления 0.Но когда он отказывается от своего одного валентного (внешнего) электрона (обозначенного e — ), он становится ионом натрия Na + со степенью окисления +1. Другой пример — железо. Он может потерять два электрона, образуя степень окисления +2; или он может потерять три электрона, образуя степень окисления +3.
Если элементы приобретают электроны, они имеют отрицательную степень окисления. Если хлор получает электрон, он образует ион Cl — (хлорид) и имеет степень окисления -1. Если сера получает два электрона, она образует ион S 2- (сульфид) и имеет степень окисления -2.
Если хлор получает электрон, он образует ион Cl — (хлорид) и имеет степень окисления -1. Если сера получает два электрона, она образует ион S 2- (сульфид) и имеет степень окисления -2.
Ионы Na + и ионы Cl — затем образуют соединение, NaCl, хлорид натрия (поваренная соль). Или ионы Fe 2+ и S 2- образуют FeS, сульфид железа.
Все свободные элементы имеют степень окисления 0.
- Кислород имеет степень окисления -2 в большинстве своих соединений, за исключением пероксидов, где он имеет степень окисления -1. Водород
- имеет степень окисления +1 в большинстве соединений, за исключением электроположительных элементов, таких как Na, где он имеет -1.
- щелочноземельные металлы имеют степень окисления +2
- щелочные металлы имеют степень окисления +1 Степень окисления
- всех атомов в молекуле дает 0, а в ионе — к заряду иона.
Примеры: перманганат калия с формулой KMnO 4 имеет Mn в степени окисления +7, а CrO 4 2- имеет Cr в степени окисления +6.
Реакция окисления-восстановления — числа окисления — ионный, стандартный, химический и атомный
Число окисления, иногда называемое степенями окисления, помогает химикам отслеживать количество электронов, окружающих каждый атом в химической реакции, и то, как они изменяются в реакциях окисления и восстановления.Когда атом получает электрон (восстанавливается), его степень окисления увеличивается на единицу. Есть несколько простых правил присвоения степени окисления элементам в химических соединениях. Эти правила:
- Степень окисления элемента, не получившего и не потерявшего ни одного из своих электронов, составляет ноль . Например, степень окисления чистой меди Cu равна нулю, как и степень окисления каждого атома кислорода в молекуле кислорода O 2 .
- Степень окисления элементарного иона равна его заряду.Ион меди с зарядом плюс два, Cu 2+ , имеет степень окисления плюс два.
 Ион фтора, F — , имеет степень окисления минус один.
Ион фтора, F — , имеет степень окисления минус один. - Некоторые элементы почти всегда образуют соединения с определенной степенью окисления. Алюминий всегда образует ион плюс три и поэтому существует в соединениях в степени окисления плюс три . Натрий и другие щелочные металлы почти всегда образуют ион плюс один; его степень окисления плюс один. Водород может образовывать соединения, в которых атом водорода имеет степень окисления плюс один или минус один. Когда водород имеет степень окисления плюс один, это записано в левой части химической формулы. Если его степень окисления минус один, это написано с правой стороны. Кислород обычно имеет степень окисления минус два. Хлор и другие галогены обычно получают минус один заряд. Остальные элементы не так предсказуемы. Азот может иметь степени окисления + 5, + 4, +3, + 2, + 1 и -3.
- Сумма степеней окисления нейтральной молекулы или соединения равна нулю.
 Таблица , соль с химической формулой хлорид натрия состоит из двух ионов: положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Молекула воды состоит из двух атомов водорода , каждый из которых имеет степень окисления плюс один, и атома кислорода с степенью окисления минус два.
Таблица , соль с химической формулой хлорид натрия состоит из двух ионов: положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Молекула воды состоит из двух атомов водорода , каждый из которых имеет степень окисления плюс один, и атома кислорода с степенью окисления минус два.
Часто легче следить за реакциями окисления и восстановления, если они разделены на две половинные реакции.Половина реакции показывает, что происходит с химическими веществами и электронами в окислительной части реакции. Другая половина реакции делает то же самое для восстановительной части. Полная реакция — это сумма двух половинных реакций.
Полезным инструментом для химиков является таблица стандартных восстановительных потенциалов. В этой таблице перечислены общие полуреакции и каждой из них присвоено числовое значение, указывающее, насколько легко протекает реакция восстановления, то есть насколько охотно принимаются электроны. Высокое стандартное значение восстановительного потенциала указывает на то, что вещество легко восстанавливается. Низкий стандартный восстановительный потенциал указывает на то, что вещество легко окисляется — оно предпочитает терять электроны. Как правило, вещество окисляет то, что имеет более низкий восстановительный потенциал, чем он имеет. Галогены, химические элементы, входящие в группу 17 периодической таблицы , являются сильными окислителями, поскольку их атомы легко принимают отрицательные ионы. Щелочные металлы, такие как натрий, находящиеся в левой части таблицы Менделеева в группе 1, являются сильными восстановителями, потому что их атомы легко отдают электрон, становясь положительными ионами.Произвольная нулевая точка для стандартных восстановительных потенциалов была обозначена как эта реакция:
Высокое стандартное значение восстановительного потенциала указывает на то, что вещество легко восстанавливается. Низкий стандартный восстановительный потенциал указывает на то, что вещество легко окисляется — оно предпочитает терять электроны. Как правило, вещество окисляет то, что имеет более низкий восстановительный потенциал, чем он имеет. Галогены, химические элементы, входящие в группу 17 периодической таблицы , являются сильными окислителями, поскольку их атомы легко принимают отрицательные ионы. Щелочные металлы, такие как натрий, находящиеся в левой части таблицы Менделеева в группе 1, являются сильными восстановителями, потому что их атомы легко отдают электрон, становясь положительными ионами.Произвольная нулевая точка для стандартных восстановительных потенциалов была обозначена как эта реакция:
Этой реакции при стандартных условиях был присвоен потенциал 0,000 вольт. Стандартный потенциал восстановления для газообразного фтора составляет 2,890 вольт, а для металлического натрия — -2,714 вольт.
Как определить степень окисления элементов в соединении
[Депонировать фотографии]В увлекательной науке химии есть понятие степени окисления, которое является числом для формулировки окислительно-восстановительных реакций.
Чтобы быть кратким, в этой науке степень окисления означает условный заряд в атоме, который теряет или приобретает электроны, и эта цифра представляет собой метод расчета переноса электронов. Это число присваивается одному атому или группе атомов, и характеризует количество перераспределенных электронов, а также показывает принцип переноса электронов в результате определенной химической реакции.
[Депонировать фотографии] Определить степень окисления одновременно легко и сложно — это зависит от атомов и молекул, которые их составляют. Часто бывает, что атомы некоторых химических элементов могут иметь совершенно разную степень окисления.
Часто бывает, что атомы некоторых химических элементов могут иметь совершенно разную степень окисления.
Чтобы упростить процесс определения степени окисления, используются специальные простые правила, и любой, кто знает основы химии и математики, сможет без труда использовать их для определения определенной степени окисления. Мы всегда должны помнить, что часто степень окисления и валентность элемента равны друг другу.
Эта научная тема широко изучается в школе, поэтому, чтобы понять, как определить степень окисления, мы предлагаем вам прочитать эту статью.
Первый этап: определяем, является ли химическое вещество элементарным.
Степень окисления атомов, которые никак не взаимодействуют с другими атомами в результате химических процессов, равна нулю.
Этот принцип применяется к группе веществ, состоящей из отдельных свободных атомов.Это правило также применяется к химическим элементам, которые состоят из двухатомных или многоатомных молекул только одного элемента.
Например, железо Fe и кальций Ca имеют степень окисления ноль, потому что они состоят из одного элемента, который не связан химически с другими, как и многоатомные молекулы с одним и тем же типом атома, например, для озона O state степень окисления также будет 0.
Расчет степени окисления в ионных соединениях
Степень окисления идентична заряду атомов или группы атомов. Этот принцип применим как к свободным ионам, так и к тем, которые входят в структуру химических соединений.
Например, степень окисления иона хлора равна -1, и если мы исследуем хлор в химическом соединении, например в соляной кислоте HCl, степень окисления этого элемента также будет -1.Так как ион водорода имеет степень окисления +1, заряд иона хлора равен -1, что означает, что его степень окисления равна -1.
[Депонировать фотографии]Ионы металлов могут иметь много степеней окисления
Мы рассмотрим это на примере железа (Fe), потому что его ион может иметь заряд +2 и +3.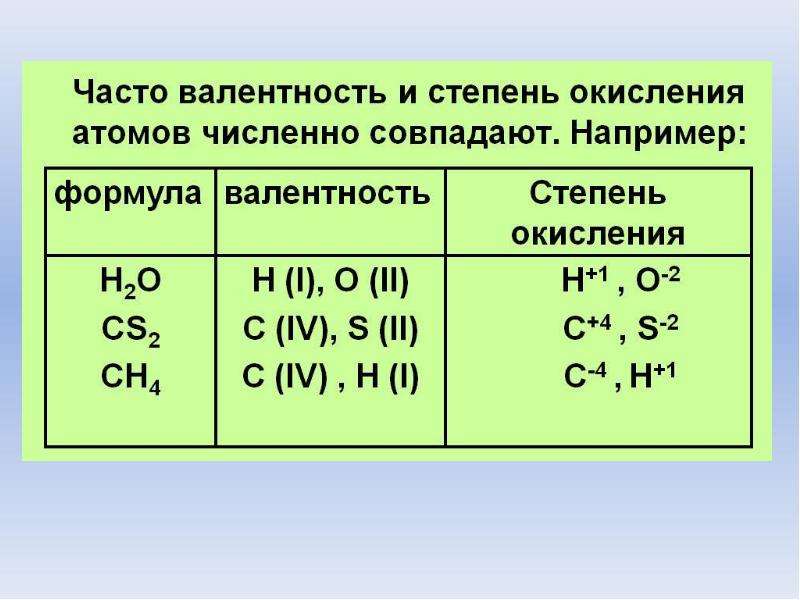 Заряд ионов металлических элементов можно определить по заряду других ионов в химическом соединении, и в формулах записи этот заряд обозначается римскими цифрами, например, железо (II) имеет степень окисления +2.Здесь вы найдете потрясающие безопасные эксперименты с железом.
Заряд ионов металлических элементов можно определить по заряду других ионов в химическом соединении, и в формулах записи этот заряд обозначается римскими цифрами, например, железо (II) имеет степень окисления +2.Здесь вы найдете потрясающие безопасные эксперименты с железом.
Как определить степень окисления соединения?
Как мы уже установили, соединение должно быть нейтральным. Рассмотрим AlCl₃.
[Викимедиа]Как мы говорили выше, заряд ионов хлора равен -1, а в этом соединении есть три атома хлора.Соответственно для компенсации минусов заряд алюминия должен быть +3.
Как определить степень окисления O₂?
Когда кислород находится в свободном состоянии (не вступая в реакцию с какими-либо элементами), степень окисления равна нулю (фактически, как и другие элементарные элементы).
Если кислород является компонентом любого гидроксида, например гидроксида водорода h3O2, он будет иметь степень окисления -1.
Если кислород взаимодействует с фтором (F), он будет иметь степень окисления +2.
Рассмотрим степень окисления водорода H
Этот химический элемент имеет степень окисления +1 (кроме молекулярного состояния водорода), но в исключительных случаях.
via GIPHY
Например, в воде HO степень окисления водорода будет +1, потому что степень окисления кислорода равна -2, и поэтому все соединение, согласно правилам, имеет нейтральный заряд.
Но если мы возьмем NaH, степень окисления H будет -1, так как у натрия заряд +1.
Как определить степень окисления фтора (F)
Хотя степень окисления химических элементов зависит в большинстве случаев от множества факторов, фтор всегда будет иметь степень окисления -1. Это связано с тем, что фтор имеет низкую электрическую отрицательность, то есть атомы F неохотно вырываются из собственных электронов, но интенсивно притягивают электроны других элементов.
Правило: сумма степеней окисления равна заряду химического элемента.
Сумма степеней окисления всех атомов соединения должна быть нейтральной. С помощью этого правила мы можем проверить, ошиблись ли мы при решении химической задачи.
Как определить степень окисления? Вот несколько полезных советов, которые помогут в решении проблем:
Таблица Менделеева пригодится, чтобы сделать расчет точным. Вы должны научиться правильно пользоваться им и различать, где находятся металлы и неметаллы.
Чтобы найти степень окисления металлов, которая часто имеет несколько соответствующих значений, вы должны определить их по степени окисления других атомов в соединении.
Если вы сложите все величины окисления атомов в химической связи, вы всегда получите нулевую степень окисления.
Наивысшая степень окисления элемента определяется с помощью таблицы Менделеева по группе, в которой он находится.
Металлы во всех соединениях имеют положительную степень окисления.
В соединениях с неметаллами водород имеет степень окисления +1, а степень окисления металлов — -1.
В соединениях кислород имеет степень окисления -2, за исключением H₂O₂, OF₂, K₂O₂.
[Депонировать фотографии]Степени окисления неметаллов при соединении с атомами металлов всегда будут отрицательными, но при взаимодействии с атомами неметаллов они могут иметь положительную или отрицательную степень окисления.
Чтобы найти наивысшую степень окисления неметаллов, из числа 8 вычтите номер группы, в которой находится элемент, и наивысшая степень окисления со знаком плюс будет равна количеству электронов на внешнем слое. . Чтобы узнать количество электронов во внешнем слое, посмотрите на номер группы в периодической таблице.
CHEM 0010 Установка
СОЕДИНЕНИЯ
5.10 — Число окисления
5.10.1 — Присвоение номеров окисления
Правила присвоения степеней окисления приведены в
Инструменты химика.
Щелкните значок
и следуйте одиннадцати правилам, чтобы назначить степень окисления атомам в химическом
формула.
Давайте рассмотрим примеры ниже, чтобы увидеть, как это
сделано.
Теперь давайте посмотрим на нитрат натрия, NaNO 3 .Что такое степень окисления азота?
Прежде всего давайте вспомним, что мы узнали:
- натрий принадлежит к группе 1А любит образовывать ион с зарядом +1 (раздел 4.6)
- , если мы забудем заряд нитрат-иона, мы можем вычислить его с помощью химическая формула. Мы знаем, что NaNO 3 представляет собой соединение и соединения должны быть нейтральными. Поскольку ион натрия равен +1, нитрат-ион (NO 3 — ) должен иметь заряд -1, потому что мы видим соотношение 1: 1 преобразования иона натрия в нитрат-ион в химической формуле (см. пример в разделе 5.9)
Для определения степени окисления азота используем
| Правило № 6: | Кислоду обычно присваивается степень окисления. -2 для оксидов. В этом случае у нас есть три
атомы кислорода в NO 3 — . -2 для оксидов. В этом случае у нас есть три
атомы кислорода в NO 3 — . |
| Правило № 9: | Сумма окисления числа иона или комплексного иона одинаковы как заряд на этом ионе. |
Пусть степень окисления азота представлена как N . Составьте уравнение и решите относительно N .
Кажущийся заряд азота +5.
Раздел 6.3
Окисление
Числа. Расчет числа окисления ..p121
коллоидов
коллоидовРедокс-реакции
Определить степень окисления (или степень окисления) химических соединений можно, следуя нескольким простым правилам.Правила представлены в порядке, при этом предыдущее правило заменяет следующее.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы только одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 и металлическом алюминии имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Степень окисления натрия в ионе Na + равна, например, +1, а степень окисления хлора в ионе Cl — равна -1.
3. Степень окисления водорода равна +1, когда он комбинируется с неметаллом , как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом , например, LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S), в которых атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в которых атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 , O 2 и ион O 2 2- .
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в которых неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду иона. Степень окисления атома серы в ионе SO 4 2- должна быть, например, +6, потому что сумма степеней окисления атомов в этом ионе должна равняться -2.
СО 4 2- : (+6) + 4 (-2) = -2
11.Элементы в нижнем левом углу периодической таблицы с большей вероятностью будут иметь положительную степень окисления, чем элементы в верхнем правом углу таблицы. Сера имеет положительную степень окисления в SO 2 , например, потому что она ниже кислорода в периодической таблице.
Определения: Окисленный атом — это атом, степень окисления которого увеличивается.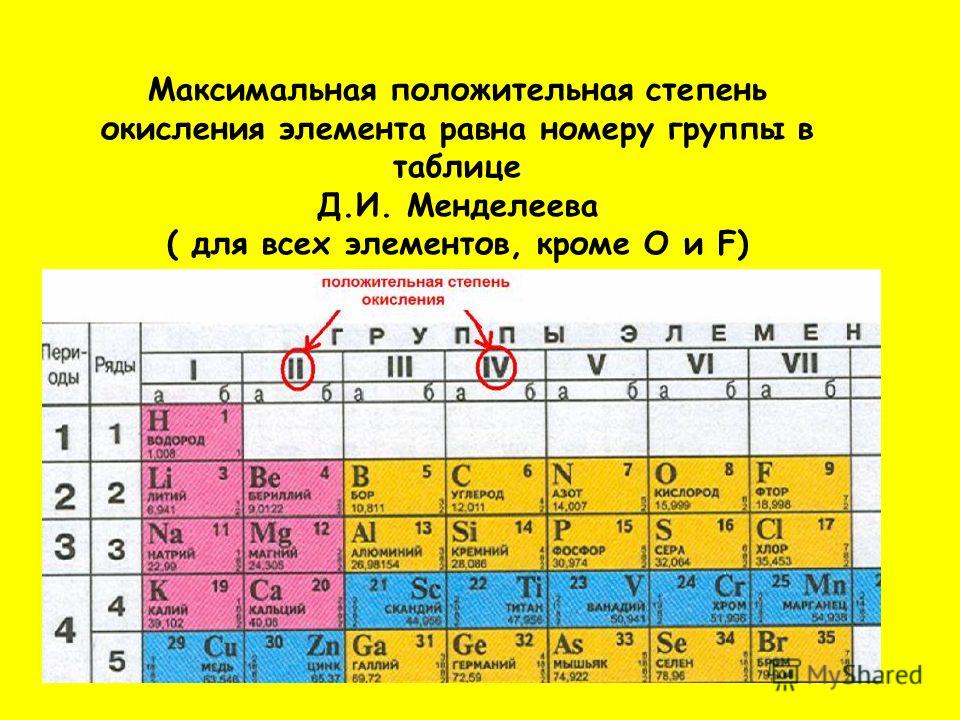 Восстановленный атом — это атом, степень окисления которого уменьшается. Половина реакций показывает увеличение или уменьшение количества электронов одним атомом (окисленным или восстановленным).Окислитель представляет собой реагент, содержащий восстановленный атом. Восстановитель — это реагент, содержащий окисленный атом. Уравновешивание окислительно-восстановительной реакции: Найдите количество электронов, полученных и потерянных агентами. Выберите коэффициенты перед ними, чтобы количество полученных и потерянных электронов было равным.
Восстановленный атом — это атом, степень окисления которого уменьшается. Половина реакций показывает увеличение или уменьшение количества электронов одним атомом (окисленным или восстановленным).Окислитель представляет собой реагент, содержащий восстановленный атом. Восстановитель — это реагент, содержащий окисленный атом. Уравновешивание окислительно-восстановительной реакции: Найдите количество электронов, полученных и потерянных агентами. Выберите коэффициенты перед ними, чтобы количество полученных и потерянных электронов было равным.
Задача: Определите степени окисления атомов в следующих соединениях.
(а) Al 2 O 3 (б) XeF 4 (в) K 2 Cr 2 O 7 (г) BaO 2 (д) (NH 4 ) 2 MoO 4 (е) Na 3 Co (NO 2 ) 6 (г) CS 2
Расположите следующие соединения в порядке увеличения степени окисления атома углерода.
(а) CO (б) CO 2 (в) H 2 CO (г) CH 3 OH (д) CH 4
Уравновесить следующую реакцию методом полуреакций как в кислой, так и в основной среде:
CN — (водн.) + MnO 4 — (водн.) → CNO — (водн.) + MnO 2 (s)
i) Присвойте каждому элементу степень окисления.
ii) Разделите реакцию на половину реакции: окисление и восстановление.
iii) Сбалансируйте элементы, не являющиеся кислородом и водородом:
iv) Уравновесить атомы кислорода, добавив H 2 O:
v) Уравновесить атомы водорода, добавив H + :
vi) Уравновесить заряд с обеих сторон, добавив е — к стороне с большим положительным зарядом:
vii) Умножьте две половинные реакции на коэффициенты, чтобы отменить e — :
viii) Сложите две реакции вместе и отмените ионы и т. Д.которые появляются в равных количествах с обеих сторон реакции:
Д.которые появляются в равных количествах с обеих сторон реакции:
viiii) Преобразуйте полученную реакцию в основную среду, используя H + + OH — = H 2 O:
Для каждой реакции ниже укажите окисленный атом, восстановленный атом, окислитель, восстанавливающий агент, полуреакцию окисления, половину реакции восстановления, а затем уравновесите уравнение методом окисления-восстановления, показывая все переходы электронов .
1) Mg + HCl <=> MgCl 2 + H 2
2) Fe + V 2 O 3 <=> Fe 2 O 3 + VO
3) KMnO 4 + KNO 2 + H 2 SO 4 <=> MnSO 4 + H 2 O + KNO 3 + K 2 SO 4
4) K 2 Cr 2 O 7 + SnCl 2 + HCl <=> CrCl 3 + SnCl 4 + KCl + H 2 O
5) KMnO 4 + NaCl + H 2 SO 4 <=> Cl 2 + K 2 SO 4 + MnSO 4 + H 2 O + Na 2 СО 4
6) K 2 Cr 2 O 7 + H 2 O + S <=> SO 2 + KOH + Cr 2 O 3
7) KClO 3 + C 12 H 22 O 11 <=> KCl + H 2 O + CO 2
8) H 2 C 2 O 4 + K 2 MnO 4 <=> CO 2 + K 2 O + Mn 2 O 3 + H 2 O
9) Mn (NO 3 ) 2 + NaBiO 3 + HNO 3 <=> HMnO 4 + Bi (NO 3 ) 3 + NaNO 3 + H 2 O
10) H 2 C 2 O 4 + KMnO 4 <=> CO 2 + K 2 O + Mn 2 O 3 + H 2 O
.






 Какова степень окисления Mg и Br в MgBr 2 ? Br равно -1, Mg равно +2. По сути, это правило для одноатомных ионов.
Какова степень окисления Mg и Br в MgBr 2 ? Br равно -1, Mg равно +2. По сути, это правило для одноатомных ионов. Это относится к таким соединениям, как HCl, NH 3 и H 2 O.
Это относится к таким соединениям, как HCl, NH 3 и H 2 O. Ион фтора, F — , имеет степень окисления минус один.
Ион фтора, F — , имеет степень окисления минус один. Таблица , соль с химической формулой хлорид натрия состоит из двух ионов: положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Молекула воды состоит из двух атомов водорода , каждый из которых имеет степень окисления плюс один, и атома кислорода с степенью окисления минус два.
Таблица , соль с химической формулой хлорид натрия состоит из двух ионов: положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Молекула воды состоит из двух атомов водорода , каждый из которых имеет степень окисления плюс один, и атома кислорода с степенью окисления минус два.
Leave A Comment