Формула летучего водородного соединения углерода имеет вид . Это вещество органической природы, называется метан и является простейшим представителем класса предельных углеводородов.
В виде простого вещества метан представляет собой бесцветный горючий легкий газ, не имеющий запаха и почти не растворимый в воде, довольно часто встречающийся в природе. Он является основной составной частью природного газа газовых месторождений (97%), в значительном количестве содержится в попутном нефтяном газе (выделяется при добыче нефти), а также в коксовом газе.
Для того, чтобы решить указанную задачу, сначала запишем уравнение реакции нитрования метана:
.
Найдем молярную массу метана (). Значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел:
;
.
Тогда количество вещества метана равно:
;
Согласно уравнению реакции,
, т.е.
.
А масса нитрометана (молярная масса — ) будет равна:
;
.
Летучее водородное соединение углерода
Летучее водородное соединение углерода – это метан. Его эмпирическая формула имеет вид .
Метан – простейший представитель класса предельных углеводородов. Он представляет собой бесцветный горючий легкий газ, не имеющий запаха и почти не растворимый в воде. Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (97%), в значительном количестве содержится в попутном нефтяном газе (выделяется при добыче нефти), а также в коксовом газе.
Рассчитать массовые доли водорода и углерода, входящих в состав метана, можно при помощи следующей формулы (записана в общем виде для элемента Х в молекуле состава НХ):
.
Найдем молекулярную массу метана (). Значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел:
;
.
Теперь найдем массовые доли углерода и водорода в составе метана:
;
.
;
.
Летучие водородные соединения. — Студопедия

В ПС внизу есть горизонтальная строка «Летучие водородные соединения».
Там перечислены формулы: Rh5 Rh4 Rh3 RH
Каждая формула относится к своей группе.
Например, написать формулу летучего водородного соединения N(азот).
Находим его в ПС и смотрим, какая формула записана под V группой.
Там Rh4. Вместо R подставляем элемент азот, получается аммиак Nh4.
Так как до «8» азоту нужно 3 электрона он оттягивает их у трёх водородов степень окисления у азота -3 , а у водорода +
Sih5 – силан бесцветный газ с неприятным запахом
Ph4 – фосфин ядовитый газ с запахом гнилой рыбы
AsH3 – арсин ядовитый газ с чесночным запахом
h3S — сероводород ядовитый газ с запахом тухлых яиц
HCl – хлороводород газ с резким запахом, дымящий в воздухе, его раствор в воде называют соляной кислотой. В малых концентрациях содержится в желудочном соке.
Nh4 аммиак газ с резким раздражающим запахом.
Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве которых неметалл имеет низшую степень окисления.
Среди приведенных веществ много тех, свойства, применение и получение которых вы изучали ранее: метан СН4, аммиак Nh4, вода Н2O, сероводород h3S, хлоро-водород НСl.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т. е. синтезом:
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Боран (моноборан) Вh3 в индивидуальном состоянии не выявлен. Известны другие бораны: предельные и непредельные. Метан и силан — простейшие водородные соединения углерода и кремния.
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — гидрат аммиака Nh4 • Н2O.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: h3S, h3Se, Н2Те, HF, НСl, HBr, HI.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например 2-го (Nh3, Н2O, HF) или 3-го (РН3, h3S, НСL), то можно сделать вывод о закономерном усилении их кислотных свойств и соответственно ослаблении основных. Это связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов HF, НСl, HBr, HI прочность связи Э—Н уменьшается, так как увеличивается длина связи. В растворах НСl, HBr, HI диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от HF к HI. При этом HF относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей:
Н—F. . .Н—F .
Атомы водорода Н связаны с атомами фтора F не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
Летучие водородные соединения. — Студопедия
Бинарные соединения.
«Би»- означает два. Бинарные соединения состоят из атомов двух ХЭ.
Оксиды.
Бинарные соединения, состоящие из двух ХЭ, один из которых кислород в степени окисления — 2 («минус» два) называются оксидами.
Оксиды —очень распространённый тип соединений, содержащихся в земной коре и во Вселенной.
Названия оксидов образуются по схеме:
Название оксида = «оксид» + название элемента в родительном падеже + (степень окисления- римская цифра), если переменная, если постоянная , то не ставим.
Примеры оксидов. У некоторых есть тривиальное (историческое)название.
1. H2O — оксид водорода вода
CO2 — оксид углерода (IV) углекислый газ ( диоксид углерода)
CO –оксид углерода(II) угарный газ (монооксид углерода)
Na2O — оксид натрия
Al2O3 — оксид алюминия глинозём
CuO — оксид меди(II)
FeO — оксид железа(II)
Fe2О3 — оксид железа(III) гематит (красный железняк)
Cl2O7 — оксид хлора(VII)
Cl2O5 — оксид хлора(V)
Cl2O— оксид хлора(I)
SO2 — оксид серы (IV) сернистый газ
SO3 — оксид серы(VI)
CaO — оксид кальция негашёная известь
SiO2 — оксид кремния песок (кремнезём)
MnO — оксид марганца(II)
N2O— оксид азота (I) «веселящий газ»
NO— оксид азота (II)
N2O3— оксид азота (III)
NO2— оксид азота (IV) «лисий хвост»
N2O5— оксид азота (V)
Индексы в формуле расставляем с учётом степени окисления ХЭ:
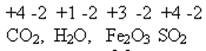
Записать оксиды, расставить степени окисления ХЭ. Уметь по названию составлять
Другие бинарные соединения.
Летучие водородные соединения.

В ПС внизу есть горизонтальная строка «Летучие водородные соединения».
Там перечислены формулы: Rh5 Rh4 Rh3 RH
Каждая формула относится к своей группе.
Например, написать формулу летучего водородного соединения N(азот).
Находим его в ПС и смотрим, какая формула записана под V группой.
Там Rh4. Вместо R подставляем элемент азот, получается аммиак Nh4.
Так как до «8» азоту нужно 3 электрона он оттягивает их у трёх водородов степень окисления у азота -3 , а у водорода +
Sih5 – силан бесцветный газ с неприятным запахом
Ph4 – фосфин ядовитый газ с запахом гнилой рыбы
AsH3 – арсин ядовитый газ с чесночным запахом
h3S — сероводород ядовитый газ с запахом тухлых яиц
HCl – хлороводород газ с резким запахом, дымящий в воздухе, его раствор в воде называют соляной кислотой. В малых концентрациях содержится в желудочном соке.
Nh4 аммиак газ с резким раздражающим запахом.
Его раствор в воде называется нашатырным спиртом.
Гидриды металлов.

Дома : параграф 19 , упр. 3,4 письменно. Формулы, как они образуются, названия бинарных соединений из конспекта знать.

| Химический символ | Название | Относительная атомная масса | Формула высшего оксида | Формула высшего гидроксида | Формула летучего водородного соединения |
|---|---|---|---|---|---|
| H | Водород | 1 | H2O | H2O | |
| He | Гелий | 4 | |||
| Li | Литий | 7 | Li2O (основный) |
LiOH (основный) |
|
| Be | Бериллий | 9 | BeO (амфотерный) |
Be(OH)2 (амфотерный) |
|
| B | Бор | 11 | B2O3 (кислотный) |
H3BO3 (кислотный) |
BH3 |
| C | Углерод | 12 | CO2 (кислотный) |
H2CO3 (кислотный) |
CH4 |
| N | Азот | 14 | N2O5 (кислотный) |
HNO3 (кислотный) |
NH3 |
| O | Кислород | 16 | H2O | ||
| F | Фтор | 19 | HF | ||
| Ne | Неон | 20 | |||
| Na | Натрий | 23 | Na2O (основный) |
NaOH (основный) |
|
| Mg | Магний | 24 | MgO (основный) |
Mg(OH)2 (основный) |
|
| Al | Алюминий | 27 | Al2O3 (амфотерный) |
Al(OH)3 (амфотерный) |
|
| Si | Кремний | 28 | SiO2 (кислотный) |
H2SiO3 (кислотный) |
SiH4 |
| P | Фосфор | 31 | P2O5 (кислотный) |
H3PO4 (кислотный) |
PH3 |
| S | Сера | 32 | SO3 (кислотный) |
H2SO4 (кислотный) |
H2S |
| Cl | Хлор | 35.5 | Cl2O7 (кислотный) |
HClO4 (кислотный) |
HCl |
| Ar | Аргон | 40 | |||
| K | Калий | 39 | K2O (основный) |
KOH (основный) |
|
| Ca | Кальций | 40 | CaO (основный) |
Ca(OH)2 (основный) |
Объяснение несоответствия относительных атомных масс аргона и калия.
Относительные атомные массы химических элементов это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе.
Содержание в природе изотопа 39K значительно больше, чем изотопа 40K, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа 40Ar значительно больше, чем изотопа 39Ar, поэтому среднее значение относительной атомной массы аргона приближается к 40.
Калий является щелочным металлом, а аргон – инертным газом, поэтому аргон был расположен перед калием, т. е. в VIIIА группе, а калий – в IА группе.
На этой странице:
Обзор
Органические химические соединения1 повсеместно используются как в помещениях, так и на открытом воздухе, поскольку они стали незаменимыми ингредиентами во многих продуктах и материалах.
- На открытом воздухе летучие вещества испаряются или выделяются в воздух в основном при производстве или использовании повседневных продуктов и материалов.
- В помещениях летучие органические соединения в основном выделяются в воздух при использовании продуктов и материалов, содержащих летучие органические соединения.
ЛОС вызывают озабоченность как загрязнители воздуха внутри помещений, так и загрязнители воздуха вне помещений. Тем не менее, акцент этой проблемы на открытом воздухе отличается от в помещении. Основная проблема в помещении — это потенциальная возможность того, что ЛОС могут негативно повлиять на здоровье людей, подвергающихся воздействию. В то время как ЛОС также могут вызывать проблемы со здоровьем на открытом воздухе, EPA регулирует ЛОС на открытом воздухе в основном из-за их способности создавать фотохимический смог при определенных условиях.
Хотя один и тот же термин «ЛОС» используется как для качества воздуха в помещениях, так и на открытом воздухе, этот термин определяется по-разному, чтобы отразить его преобладающую озабоченность в каждом контексте.Это создало недопонимание на рынке и в сообществе по защите окружающей среды. Кроме того, измеренное количество и состав ЛОС в воздухе могут значительно различаться в зависимости от используемых методов измерения, что вызывает дополнительную путаницу.
Начало страницы
Общее определение и классификация
Летучие органические соединения (ЛОС) означают любое соединение углерода, кроме моноксида углерода, диоксида углерода, углекислоты, карбидов или карбонатов металлов и карбоната аммония, которое участвует в атмосферных фотохимических реакциях, за исключением тех, которые обозначены EPA как имеющие незначительную фотохимическую реактивность 2 .
Летучие органические соединения или ЛОС — это органические химические соединения, состав которых позволяет им испаряться при нормальных условиях в помещении с температурой и давлением 3 . Это общее определение ЛОС, которое используется в научной литературе и согласуется с определением качества воздуха в помещениях. Поскольку летучесть 4 соединения, как правило, тем выше, чем ниже температура его кипения, летучесть органических соединений иногда определяют и классифицируют по их точкам кипения.
Например, Европейский союз использует точку кипения, а не свою волатильность в своем определении ЛОС.
ЛОС — это любое органическое соединение, имеющее начальную температуру кипения, меньшую или равную 250 ° С, измеренную при стандартном атмосферном давлении 101,3 кПа. 5, 6, 7
ЛОС иногда классифицируются по легкости, с которой они будут выбрасываться. Например, Всемирная организация здравоохранения (ВОЗ) классифицирует органические загрязнители в помещении как:
- Очень летучие органические соединения (VVOCs)
- Летучие органические соединения (ЛОС)
- Полулетучие органические соединения (SVOCs)
Чем выше летучесть (ниже температура кипения), тем больше вероятность того, что соединение будет выделяться из продукта или поверхности в воздух.Очень летучие органические соединения настолько изменчивы, что их трудно измерить, и они почти полностью обнаруживаются в виде газов в воздухе, а не в материалах или на поверхностях. Наименее летучие соединения, содержащиеся в воздухе, составляют гораздо меньшую долю от общего количества присутствующего в помещении, в то время как большинство будет находиться в твердых или жидких средах, которые их содержат, или на поверхностях, включая пыль, предметы интерьера и строительные материалы.
Классификация неорганических органических загрязнителей (адаптировано из ВОЗ 8 )
| Описание | Аббревиатура | Диапазон температур кипения (° C) | Пример соединений |
|---|---|---|---|
| Очень летучие (газообразные) органические соединения | VVOC | <0 до 50-100 | пропан, бутан, метилхлорид |
| Летучие органические соединения | VOC | 50-100-240-260 | Формальдегид, д-лимонен, толуол, ацетон, этанол (этиловый спирт) 2-пропанол (изопропиловый спирт), гексанал |
| Полулетучие органические соединения | SVOC | 240-260 до 380-400 | Пестициды (ДДТ, хлордан, пластификаторы (фталаты), антипирены (ПХБ, ПББ)) |
Начало страницы
EPA Нормативное определение ЛОС, которые влияют на фотохимическое окисление в наружном воздухе
Справочная информация
В Соединенных Штатах выбросы летучих органических соединений в окружающую среду регулируются EPA, главным образом, для предотвращения образования озона, составляющего фотохимический смог.Многие ЛОС образуют приземный озон, «реагируя» с источниками молекул кислорода, такими как оксиды азота (NOx) и оксид углерода (CO) в атмосфере в присутствии солнечного света. Однако только некоторые ЛОС считаются достаточно «реактивными», чтобы вызывать беспокойство. ЛОС, которые не реагируют или имеют незначительную реакционную способность для образования озона в этих условиях, освобождаются от определения ЛОС, используемых EPA при его регулировании. Со времени первого составления списка освобожденных соединений в 1977 году EPA добавило несколько к списку, и часто имеет несколько петиций для дополнительных соединений, находящихся на рассмотрении.Кроме того, некоторые штаты имеют свои собственные определения и списки исключенных соединений. Таким образом, для целей регулирования конкретное определение ЛОС на открытом воздухе может измениться на то, что исключено из этого определения.
Непонимание и путаница в отношении ЛОС
EPA ранее определял регулируемые органические соединения в наружном воздухе как «Реактивные органические газы» (ROG). Эта терминология прояснила его значение как ограниченное химически активными химическими веществами. Однако позже EPA изменило эту терминологию на «VOC».К сожалению, использование термина «VOC» вместо «ROG» привело к недоразумению применительно к качеству воздуха в помещениях. Многие частные лица и организации, в том числе производители строительных материалов и изделий, а также сторонние сертификационные организации стали считать ЛОС «только теми, которые регулируются EPA для наружного воздуха», и применяют то же определение для целей внутреннего воздуха.
В той степени, в которой некоторые освобожденные соединения влияют на здоровье людей, находящихся в помещении, определение ЛОС, регулируемых для наружного воздуха, может привести к серьезным заблуждениям относительно качества воздуха в помещениях, поэтому такие ЛОС не следует исключать из рассмотрения для воздуха в помещениях.Например, метиленхлорид (средство для снятия краски) и перхлорэтилен (жидкость для сухой чистки) являются исключительными соединениями для наружного регулирования, но они могут представлять серьезную опасность для здоровья людей, подвергающихся воздействию, если они присутствуют в помещении. Первое перечислено Международным агентством по исследованию рака (IARC) как потенциальный канцероген для человека, а второе занесено в список вероятного канцерогена для человека. Внутренние ЛОС реагируют с внутренним озоном 9 даже в концентрациях, ниже стандартов общественного здравоохранения.Химические реакции производят частицы субмикронного размера и вредные побочные продукты, которые могут быть связаны с неблагоприятными последствиями для здоровья в некоторых чувствительных группах населения.
Начало страницы
Классификация ЛОС
При обсуждении условий внутри помещений все органические химические соединения, которые могут испаряться при нормальных условиях в помещении, таких как температура и давление, являются ЛОС. Хотя разграничительная линия между классификациями летучих органических соединений (VVOC), летучих органических соединений (VOC) и полулетучих органических соединений (SVOC) (см. Таблицу выше) является несколько произвольной, она показывает широкий диапазон летучести среди органических соединений. Все три классификации важны для воздуха внутри помещений, и считается, что они подпадают под широкое определение летучих органических соединений внутри помещений. Кроме волатильности (или точки кипения) никакие другие критерии не используются для определения ЛОС в помещении.
Измерение содержания летучих органических соединений в воздухе помещений
Знания о ЛОС, которые присутствуют в низких концентрациях, обычно присутствующих в воздухе помещений. в любой конкретной ситуации сильно зависит от того, как они измеряются.Все доступные методы измерения избирательны в том, что они могут измерять и количественно определять, и ни один из них не способен измерить все присутствующие ЛОС. Например, бензол и толуол измеряются другим методом, чем формальдегид и другие подобные соединения. Диапазон методов измерения и аналитических инструментов велик и будет определять чувствительность измерений, а также их селективность или отклонения. Вот почему любое утверждение о ЛОС, которые присутствуют в данной среде, должно сопровождаться описанием того, как были измерены ЛОС, чтобы профессионал мог правильно интерпретировать результаты.В отсутствие такого описания заявление имело бы ограниченный практический смысл.
Маркировка продукции
Важно, чтобы потребители понимали, что информация на этикетках или в другой литературе по продукту с широкими заявлениями о воздействии на окружающую среду с использованием таких терминов, как «зеленый» или «экологически чистый», может включать или не включать некоторые ЛОС, выделяемые из продукта, и поэтому иначе не может учитывать их вредное воздействие на здоровье.
Существуют, однако, национальные и международные программы, которые сертифицируют и маркируют продукты и материалы на основе их воздействия на качество воздуха в помещении, такого как различные воздействия на здоровье человека и комфорт, включая запах, раздражение, хроническую токсичность или канцерогенность.Такие программы, вероятно, будут включать рассмотрение, по крайней мере, некоторых из летучих органических соединений, вызывающих озабоченность в отношении воздуха в помещениях. Тем не менее, нормы и требования, используемые в настоящее время в отрасли маркировки и сертификации продукции для внутренних продуктов, не стандартизированы. Правительство или сторонняя организация еще не установили основные правила для разработки последовательных, защитных стандартных методов испытаний для оценки и сравнения продуктов и материалов. Отсутствие стандартизации затрудняет понимание потребителем полного понимания того, что означают этикетки и сертификаты в большинстве случаев.
Некоторые этикетки или программы сертификации ЛОС основаны на ЛОС, выделяемых из продукта в окружающую среду, и возможных связанных с этим последствиях для здоровья. Однако некоторые из них основаны на содержании ЛОС, которые регулируются для контроля образования фотохимического смога на открытом воздухе. Поэтому этикетки и программы сертификации ЛОС могут не обеспечивать надлежащую оценку всех ЛОС, выделяемых из продукта, включая некоторые химические соединения, которые могут иметь отношение к качеству воздуха в помещениях. Это особенно верно для большинства влажных продуктов, таких как краски или клеи, которые могут быть помечены как «с низким содержанием ЛОС» или «с нулевым содержанием ЛОС».
Начало страницы
Заключение
Снижение концентрации ЛОС в помещениях и на открытом воздухе является важной задачей в области здравоохранения и окружающей среды. Тем не менее, важно понимать, что существуют ЛОС, вызывающие озабоченность в помещении и на открытом воздухе, которые не влияют на фотохимическое окисление и, следовательно, не регулируются EPA (42 США, §7401 et seq. (1970)). Важно проводить и понимать это различие при защите или использовании стратегий по улучшению качества воздуха в помещениях.Для качества воздуха в помещениях ВСЕ органические химические соединения, состав которых дает им возможность испаряться при нормальных атмосферных условиях, считаются ЛОС и должны учитываться при любой оценке воздействия на качество воздуха в помещении.
Начало страницы
Список литературы
- Органическое соединение — это любой из большого класса химических соединений, молекулы которого содержат углерод. По историческим причинам несколько типов соединений, таких как карбонаты, простые оксиды углерода и цианиды, а также аллотропы углерода, считаются неорганическими.Разделение между «органическими» и «неорганическими» углеродными соединениями является полезным, но может считаться несколько произвольным.
- Кодекса федеральных правил, 40: Глава 1, Подраздел C, Часть 51, Подраздел F, 51100. Выход осуществлен 8 февраля 2009 года, а также Глоссарий, аббревиатуры и сокращения EPA.
- Используемые здесь нормальные условия температуры и давления в помещении относятся к диапазону условий, обычно встречающихся в зданиях, населенных людьми. Таким образом, в зависимости от типа здания и его географического положения, температура может составлять от середины 30-х годов (в градусах Фаренгейта) до диапазона 90 ° F, а давление может быть от уровня моря до высоты гор, где могут находиться здания. расположен.Это не следует путать со «Стандартными температурой и давлением», которые часто используются при анализе и представлении научных исследований, но по-разному определяются различными органами. Наиболее используемые, хотя и не общепринятые, определения — это определения Международного союза теоретической и прикладной химии (IUPAC) и Национального института стандартов и технологий (NIST). Стандарт IUPAC — это температура 0 ° C (273, 15 К, 32 ° F) и абсолютное давление 100 кПа (14,504 фунтов на кв. Дюйм), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм).
- Летучесть указывается давлением паров вещества. Это тенденция вещества испаряться или скорость, с которой оно испаряется. Вещества с более высоким давлением паров будут легче испаряться при данной температуре, чем вещества с более низким давлением паров.
- «Директива 2004/42 / CE Европейского парламента и Совета» EUR-Lex. Публикации Европейского Союза. Получено 2007-09-27.
- 101,3 кПа = 1 атмосфера, нормальное давление на уровне моря.
- 250 ° C = 482 ° F
- Всемирная организация здравоохранения, 1989 г. «Качество воздуха в помещениях: органические загрязнители». Отчет о совещании ВОЗ, Берлин, 23-27 августа 1987 г. Отчеты и исследования ЕВРО 111. Копенгаген, Европейское региональное бюро Всемирной организации здравоохранения.
- На концентрацию озона в помещении может влиять количество озона, испускаемого внутри помещения офисным оборудованием, таким как фотокопии и лазерные принтеры, а также наружный озон, попадающий в помещение в результате инфильтрации или воздуха.
Начало страницы
,Группа активированного угля Жулин является ведущим поставщиком в Китае с более чем 12-летним опытом работы в отрасли активированного угля, и мы работаем в Германии, Великобритании, Испании, Америке, Канаде, Венесуле, Судан, Африка более 28 стран с высочайшим качеством продукции.
Летучие органические соединения VOC Адсорбция газа Активированный уголь
Преимущества сырья
Активированный уголь для обработки газа выбирает активированный уголь в качестве сырья, его сырье путем дробления, дробления очистка и другой строгий процесс от обработки.С большой площадью поверхности, развитой структурой пор, отверстие было разумным, сильная адсорбционная способность, опубликованные однородные частицы, износостойкая прочность и так далее.
Заявка подана
Широко используется для очистки газа химического сырья, газа химического синтеза, газа фармацевтической промышленности, газа углекислого газа для напитков и водорода, азота, хлора, хлористого водорода, этана, этана, крэк, инертный газ и тд. Также используется для удаления загрязнений из воздуха, а также для разделения и очистки смешанного газа.
Преимущество продукта
(1) Преимущество материала
1. Использование в качестве сырья антрацита и превосходящего угля
2. Это , изготовлено и усовершенствовано в процессе производства черное цилиндрическое зерно.
(2) Характеристика
1. Высоко развитая пористая структура
2. Удельная площадь поверхности
3.Высокая адсорбционная способность
4. Высокая механическая прочность Широко используется для очистки ядовитых газов, химической очистки сточных вод, очистки промышленных и живых вод, извлечения растворителей и т. Д.
Летучие органические соединения VOC Адсорбция газа Активированный уголь
Спецификация активированного угля
Изделие | Индекс активированного угля | |||
Размер (мм) | 9 мм, 1,5 мм, 2 мм, 3 мм, 4 мм, 5 мм, 8-12 мм | |||
Поглощение йода (мг / г) | ≥700 | ≥800 | ≥900 | ≥1000 |
Удельная площадь поверхности (мг / г) | 900 | 1000 9 995 5000 | 1200 | |
CTC (%) | ≥45 | ≥50 | 9555 9556 9555 9555 5000 65 | |
Твердость (%) | ≥90 | ≥92 | 90 005 ≥95 | ≥95 |
Влага (%) | ≤8 | ≤8 | 9895 999 999 9009 989 000 | ≤8 |
Зола (%) | ≤12 | ≤12 | | |
Плотность нагрузки (г / л) | 580-620 | 550-570 | 540-550 | |
Летучие органические соединения VOC Адсорбция газа Активированный уголь
,
На земле встречаются бесчисленные виды растений и животных, которые отличаются друг от друга по форме, размеру и структуре. Все они в основном состоят из углерода, азота, кислорода и водорода. Животные получают эти элементы только от природы. Такие процессы, как образование и распад, рост и разложение обычно происходят в природе. В результате этих процессов в природе происходят различные циклы. Благодаря этим циклам растения, животные и их окружение связаны друг с другом, и между ними устанавливается баланс.
Углеродный цикл
Углерод является неотъемлемым элементом всех живых существ. Растения и животные получают этот элемент из углекислого газа, присутствующего в атмосфере. Растения берут углекислый газ из воздуха, и в присутствии воды и солнечного света они производят пищу в процессе фотосинтеза. Растения потребляются другими животными в пищу. Таким образом они получают соединения углерода. Энергия производится путем переваривания этих соединений углерода. Плотоядные животные получают углерод из мяса травоядных.Всеядные люди, подобные человеку, получают углерод как от растений, так и от животных. Углеродный цикл показывает, что все животные поглощают углекислый газ непосредственно из атмосферы или растений. Животные превращают углерод в диоксид углерода во время дыхания или окисления, и снова этот диоксид углерода выделяется в воздух. Углекислый газ также выделяется при гниении растений и животных и сжигании топлива, которое попадает в атмосферу и завершает углеродный цикл.
Азотный цикл
В азотном цикле азот непрерывно циркулирует через почву, воду, воздух и живые существа.Все живые существа нуждаются в азоте. Он содержится в белках и нуклеиновых кислотах. Хотя 80% воздуха — это азот, большинство растений и животных не могут использовать его в газообразном состоянии. Он используется растениями или животными в форме нескольких соединений, таких как аммиак или аминокислоты. Многие почвенные бактерии, такие как азотобактер и клостридий, превращают атмосферный азот в азотистые соединения, которые могут поглощаться растениями. Многие маленькие клубеньки присутствуют в корнях бобовых растений, которые содержат бактерии, называемые Rhizobium leguminosarum.Эти бактерии превращают атмосферный азот в нитраты. Растения поглощают соли нитратов через свои корни и синтезируют белки в своих клетках. Азот поступает в организм животных, когда они поедают эти растения. Бактерии и грибы разлагают трупы на земле. Бактерии Nitrosomonas превращают аммиак в нитриты, а нитробактерии превращают нитриты в нитраты. Таким образом, растения снова поглощают нитраты. Некоторые другие бактерии, такие как Thiobacillus denitrificans и micrococcus dinitrificans, превращают нитраты и аммиак почвы в газообразный азот.Помимо этого, доля азота в атмосфере превращается в азотную кислоту во время молнии, которая образует нитраты с дождевой водой в почве, которая поглощается растениями. Таким образом, атмосферный азот проходит через множество пищевых цепочек и снова попадает в воздух через цикл. Хотя этот процесс занимает миллиарды лет, но каждый атом азота возвращается в воздух.
Кислородный цикл
Жизнь невозможна без кислорода. Около 20% воздуха — это кислород. Все живые существа на земле нуждаются в кислороде для дыхания.Кислород необходим для горения. Вы будете думать, что постоянное использование кислорода из атмосферы когда-нибудь закончится. В природе постоянно происходит цикл кислорода, и не происходит никаких нарушений баланса этого газа. Этот цикл подобно азотному циклу является непрерывным. Зеленые растения поглощают углекислый газ, образуют атмосферу фотосинтеза. Днем все деревья и растения выделяют кислород и поглощают углекислый газ. Ночью они выделяют углекислый газ. Таким образом, количество кислорода в атмосфере остается стабильным.
Водородный цикл
Вода очень важна для всех растений и животных. Гидросфера получает свой самый распространенный элемент, водород, только из воды. Вода образуется в результате сочетания кислорода и водорода. Во время фотосинтеза водород образуется при диссоциации воды, которая образует глюкозу после слияния с углекислым газом. Растения дают пищу травоядным, и эти животные получают глюкозу и белки только из растений. Водород образует углеводы, которые являются важным источником энергии для живого существа.Мы принимаем эти углеводы в форме пищи. Это помогает нашему жизненному циклу продолжаться.
,Поделиться на
Углерод и соединения — одна из важнейших глав для экзаменационной комиссии по 10 классу! Вот упрощенная версия этой главы, которая поможет вам в подготовке доски.
Введение:
• Элементный углерод неметаллический. Его символ — C.
• Углерод — универсальный элемент, присутствующий в земной коре в форме минерала —
0.02% и атмосфера как CO 2 составляет 0,03%.
• Все живые существа, растения и животные состоят из углеродных соединений
.
Углерод всегда образует ковалентные связи:
Атомный номер углерода равен 6.
Электронная конфигурация:
K L
2 4 C (6)
Как углерод достигает конфигурации благородного газа?
(i) Углерод является четырехвалентным, он не образует ионную связь, теряя четыре
электронов (C 4+ ) или четыре электрона (C 4 ).Трудно удерживать
четырех дополнительных электронов и потребуется большое количество энергии для удаления
четырех электронов. Таким образом, углерод может образовывать связь, делясь своими электронами с
электронами другого атома углерода или с другим элементом и достигать благородной газовой конфигурации
.
(ii) Атомы других элементов, таких как водород, кислород и азот,
хлора также образуют связи путем обмена электронами.
(iii) Связь, образованная разделением электронов между одинаковыми или разными атомами
, представляет собой ковалентную связь.
Физические свойства ковалентных соединений
(а) Ковалентные соединения имеют низкие температуры плавления и кипения, поскольку они имеют
слабую межмолекулярную силу.
(b) Они обычно являются плохим проводником электричества, поскольку электроны распределяются между атомами
, и заряженные частицы не образуются.
Универсальный характер углерода
Два характерных свойства углеродного элемента, которые приводят к образованию большого количества соединений:
(i) Catenation : Углерод может связываться с атомами углерода посредством ковалентных связей
с образованием длинных цепей, разветвленных цепей и замкнутого кольца.Соединение
Атомы углерода могут быть связаны одинарной, двойной или тройной связью.
( ii) Тетравалентность : Углерод имеет 4 валентных электрона. Углерод может связываться с
четырьмя атомами углерода, одновалентными атомами, кислородом, азотом и серой.
Соединения с насыщенным и ненасыщенным углеродом
Соединения, состоящие из водорода и углерода, называются углеводородами.
Эти три вышеуказанных соединения имеют одинаковую молекулярную формулу, но разные структуры
называются структурными изомерами, а явление — структурной изомерией.
Функциональные группы
• В углеводородной цепи один или несколько атомов водорода заменены другими
атомами в соответствии с их значениями. Это гетероатом.
• Эти гетероатомы или группы атомов, которые делают соединение углерода
реакционноспособным и определяют его свойства, называются функциональными группами.
Образец бумаги Экзамен 10 класса — Наука
Гомологичная серия
Это серия соединений, в которых некоторая функциональная группа заменяет
водород в углеродной цепи.
Например, спирты — CH 3 OH, C 2 H 5 OH, C 3 H 7 OH, C 4 H 9 OH
• Имеют одинаковую общую формулу.
• Любые два гомолога отличаются по группе CH 2 , а разница в молекулярной массе
составляет 14 мкм.
• Обладают такими же химическими свойствами, но демонстрируют постепенное изменение физических свойств
.
Номенклатура углеродных соединений
(i) Определите количество атомов углерода в соединениях.
(ii) Функциональная группа указывается суффиксом или префиксом.
Как набрать 99% баллов в экзамене 10 класса
Химические свойства углеродных соединений
(a) Сжигание
• Углерод и его соединения используются в качестве топлива, поскольку они сгорают в воздухе
, выделяя много тепловой энергии.
• Насыщенные углеводороды, как правило, горят на воздухе с синим пламенем
, не содержащим сажи.
• Ненасыщенный углеводород сгорает в воздухе с желтым сажным пламенем, потому что
процентов углерода выше, чем насыщенный углеводород, который не дает
полностью окисляться на воздухе.
(b) Окисление
Спирты можно превратить в карбоновую кислоту в присутствии окислителя
щелочной KMnO4 (перманганат калия) или кислый дихромат калия.
Ненасыщенный углеводород добавляют в присутствии водорода в присутствии катализатора палладия
или никеля.С помощью этого процесса растительные масла превращаются в растительное топленое масло. Это
также называют гидрогенизацией ветеринарных масел.
(d) Реакция замещения:
Важные углеродные соединения: этанол и этановая кислота
Физические свойства этано l
• Бесцветный, приятный запах и жгучий вкус. • Растворим в воде.
• Летучая жидкость с низкой температурой кипения 351 К.
• Нейтральное соединение.
Химические свойства
(i) Реакция с натрием:
2Na + CH 3 CH 2 OH → 2CH 3 CH 2 ONa + + H 2
(этоксид натрия)
Эта реакция используется в качестве теста на этанол при выделении газа h3 (Burn с поп-звуком
)
(ii) Обезвоживание
Стратегия подготовки к экзамену 10 класса по науке
Физические свойства этановой кислоты
• Бесцветная жидкость с кислым вкусом и запахом уксуса.
• Точка кипения составляет 391 К.
• При замерзании чистого Ch4COOH он образует бесцветный лед, как твердое вещество. Так это
называется ледяной уксусной кислотой.
Химические свойства
(i) Этерификация:
(ii) Реакция с основанием:
NaOH + CH 3 COOH → CH 3 COONa + H 2 O
(натрий ацетат) (iii) Реакция с (iii) Реакция с карбонаты и гидрокарбонаты:
2CH 3 COOH + Na 2 CO3 → 2CH 3 COONa + H 2 O + CO 2
CH 3 COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2
(Sod.ацетат)
Мыло и моющие средства
• Мыло представляет собой натриевую или калиевую соль карбоновой кислоты с длинной цепью. Например,
C 17 H 35 COONa +
• Мыла эффективны только в мягкой воде.
• Моющими средствами являются аммониевая или сульфонатная соль длинной цепи карбоновой кислоты
.
• Моющие средства эффективны как в жесткой, так и в мягкой воде.
Молекула мыла имеет:
(i) Ионная (гидрофильная) часть
(ii) Длинная углеводородная цепь (гидрофобная) часть
Очищающее действие мыла
• Большая часть грязи имеет маслянистую природу, а гидрофобный конец прилипает к грязи
, а ионный конец окружен молекулой воды.Это приводит к образованию в
году радиальной структуры, называемой мицеллами.
• Мыльные мицеллы помогают растворять грязь и жир в воде, а ткань очищается.
• Соли магния и кальция, присутствующие в жесткой воде, реагируют с молекулой мыла
с образованием нерастворимого продукта, называемого накипью. Эта нечисть создает
трудностей в очищающем действии.
• При использовании моющего средства нерастворимая накипь не образуется с жесткой водой, а ткани
эффективно очищаются.
ТАКЖЕ СМОТРИТЕ:
Металлы и неметаллы
Спасибо за подписку! Пожалуйста, проверьте свою электронную почту для дальнейших инструкций.

Leave A Comment