Степень окисления азота (N), формула и примеры
Общие сведения о степени окисления азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg+23N-32, B+3N-3), самым известным из которых является аммиак (N-3H+13).
Степень окисления (-2) азот проявляет в соединениях перикисного типа – пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) – N-22H2.
В соединении под названием гидроксиламин – N-1H2OH–азот проявляет степень окисления (-1).
Наиболее устойчивые положительные степени окисления азота – это (+3) и (+5). Первую из них он проявляет во фториде (N
Азот также проявляет степени окисления (+1) – N+12O, (+2) – N+2
Примеры решения задач
ru.solverbook.com
Степень окисления азота — учимся разбираться
Азот – едва ли не самый распространенный химический элемент во всей Солнечной Системе. Если быть конкретнее, то азот занимает 4 место по распространенности. Азот в природе – инертный газ.

Этот газ не имеет ни цвета, ни запаха, его очень трудно растворить в воде. Однако соли-нитраты имеют свойство очень хорошо реагировать с водой. Азот имеет малую плотность.
Азот – удивительный элемент. Есть предположение, что свое название он получил из древнегреческого языка, что в переводе с него значит «безжизненный, испорченный». Отчего же такое негативное отношение к азоту? Ведь нам известно, что он входит в состав белков, а дыхание без него практически невозможно. Азот играет важную роль в природе. Но в атмосфере этот газ инертен. Если его взять таким, какой он есть в первозданном виде, то возможно множество побочных эффектов. Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.
При обычных условиях такой газ реагирует только с литием, образовывая такое соединение, как нитрид лития Li3N. Как мы видим, степень окисления азота в таком соединении равна -3. С остальными металлами и веществами азот, конечно же, реагирует тоже, однако лишь при нагревании или при использовании различных катализаторов. К слову говоря, -3 – низшая степень окисления азота, так как только 3 электрона нужны для полного заполнения внешнего энергетического уровня.
Этот показатель имеет разнообразные значения. Каждая степень окисления азота имеет свое соединение. Такие соединения лучше просто запомнить.
Итак, степень окисления -3 может быть у нитридов. Степень окисления азота в аммиаке также равна -3, как бы это ни звучало парадоксально. Аммиак представляет собой бесцветный газ с очень резким запахом. Вспомните нашатырный спирт. В его состав также входит аммиак Nh4. Выпускают даже лекарственные препараты с содержанием аммиака. В основном они показаны при обмороках, головокружениях, сильных алкогольных опьянениях. Резкий запах быстро приводит в чувства в пострадавшего. Еще бы, ведь он готов сделать что угодно, лишь бы от него убрали эту «вонючку».

Редко встречаются такие степени окисления азота, как -1 и -2. Первая встречается в так называемых пернитридах, среди которых особенно стоит отметить N2h3. Последняя степень окисления встречается в соединении Nh3OH. Такое сложное вещество представляет собой очень слабое неустойчивое основание. Применяется в основном в органическом синтезе.
Перейдем к высшим степеням окисления азота, коих тоже очень даже немало. Степень окисления азота +1 встречается в таком соединении, как веселящий газ (N2O). При малом количестве такого газа практически не наблюдается никаких побочных воздействий. Нередко он используется в малых дозах для наркоза. Однако если время вдыхания этого газа является достаточно длительным, то возможна смерть от удушения.
Степень окисления +2 встречается в соединении NO. Степень окисления +3 – в оксиде N2O3. Степень окисления +4 – в оксиде NO2. Такой газ имеет красно-бурый оттенок и острый запах. Является кислотным оксидом.
+5 – высшая степень окисления у азота. Встречается в азотной кислоте и во всех солях-нитратах.
fb.ru
NO2, степень окисления азота и кислорода в нем
Общие сведения об оксиде азота (IV) и степени окисления в NO2
Плотность – 2,0527 г/л (н.у.). Брутто-формула – NO2. Молярная масса – 46,01 г/моль. Электронное и пространственное строение молекулы диоксида азота представлено на рис. 1.
Хорошо растворяется в холодной воде (насыщенный раствор ярко-зеленого цвета), полностью реагируя с ней.
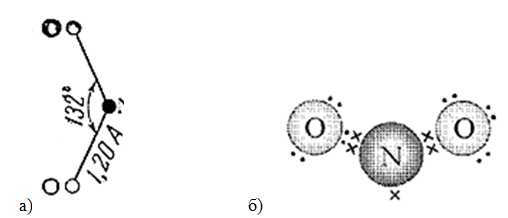
В ОВР проявляет свойства очень сильного окислителя. Вызывает коррозию металлов.
NO2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав диоксида азота, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0;
x — 4 = 0;
x = +4.
Значит степень окисления азота в оксиде азота (IV) равна (+4):
N+4O-22.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Какая степень окисления у азота?
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Рассмотрим более подробно каждую из приведенных реакций:
здесь происходит изменение степени окисления азота с (-3) до 0, значит азот окисляется;
здесь происходит изменение степени окисления азота с (+5) до (+2), значит азот восстанавливается;
здесь происходит изменение степени окисления азота с (+3) до (+5), значит азот окисляется;
здесь происходит изменение степени окисления азота с (+4) до (+3), значит азот восстанавливается.
ru.solverbook.com
почему у азота не совпадает степень окисления и валентность?
валентность и степень окисления (по модулю) не совпадают только если: 1) наличие неполярной ковалентной связи, например N2 (валентность 3, степень окисления 0) 2) наличие донорно-акцепторной связи, например HNO3 (валентность 4, степень окисления +5) Это несовпадение понимается при разборе определений валентности и степени окисления.. . Валентность — количество обобществленных электронных пар (связей) , у азота их может быть не более 4, т. к. имеется 3 неспаренных электрона и одна неподеленная электронная пара, т. е. 3 связи образуется по обычному механизму и 1 — по донорно-акцепторному — всего 4… Степень окисления — условный заряд, расчитывающийся из предположения, что атом полностью отдает или полностью принимает электроны.. . У азота на валентном уровне их 5 (как мы уже писали — 2 спаренных и 3 неспаренных) , если азот полностью их «отдаст» кислороду, то приобретет заряд +5 …
Вообще-то степень окисления – означает, сколько электронов принял или отдал атом входящий в соединение, а валентность – рассказывает о количестве связей, которые образует атом в соединении. Т. е. как видно, связи между этими двумя понятиями нет. Обрати внимание на то, что степень окисления имеет значения и + и – и 0. Валентность же имеет только положительные целые значения. Т. е. в огромном количестве соединений валентность и степень окисления не совпадают. Бывают конечно численные совпадения, но не более того, чем совпадения.
touch.otvet.mail.ru
Nh5NO3, степень окисления азота и др элементов
Общие сведения о нитрате аммония и степени окисления в Nh5NO3
Рис. 1. Нитрат аммония. Внешний вид.
Хорошо растворим в воде (гидролизуется по катиону). Кристаллогидратов не образует. Разлагается концентрированными щелочами. В ОВР может проявлять свойства слабого окислителя и восстановителя.
Nh5NO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав нитрата аммония, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Известно, что суммарная степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав кислоты и записывается со знаком минус. Нитраты – это соли азотной кислоты, брутто-формула, которой имеет вид HNO
Степень окисления кислорода в составе неорганических кислот, а, значит и их кислотных остатков, всегда равна (-2). Для нахождения степени окисления азота в нитрат-ионе примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(-2) = -1;
x — 6 = -1;
x = +5.
Значит степень окисления азота в составе нитрат-иона равна (+5).
Катион NH4+ является производным аммиака (гидрид водорода), степень окисления водорода, в составе которого равна (+1). Определим степень окисления азота из иона аммония аналогичным образом:
y + 4×(+1) + (+5) + 3×(-2) = 0;
y + 4 + 5 – 6 = 0;
y + 3 = 0;
y = -3.
Следовательно, степень окисления азота равна (-3):
N-3H+14N+5O-23.
Примеры решения задач
ru.solverbook.com
Какая степень окисления у обоих атомов АЗОТА в нитрате аммония? Nh5NO3
нет конечно нитрат аммония — Nh5+ NO3- следовательно у первого 3- у второго 5+
Рассмотри ионы Nh5+ — у азота (-3) (-3 + 4 = +1) и NO3- — у азота (+5) (+5 — (3*2) = -1)
Люди, вы путаете Нитрат с Нитритом, зачем подсказываете тогда, Нитрат Аммония Nh5NO3 (-3), (+5) Нитрит Аммония Nh5NO2 (-3), (+3) ….Тоже мне ученые, ВНИМАТЕЛЬНЕЙ МЛЯ
touch.otvet.mail.ru

Leave A Comment