Тест 5. Биология. 10 класс. Химический состав клетки – белки, нуклеиновые кислоты и АТФ.
α-спираль, прошитая водородными связями
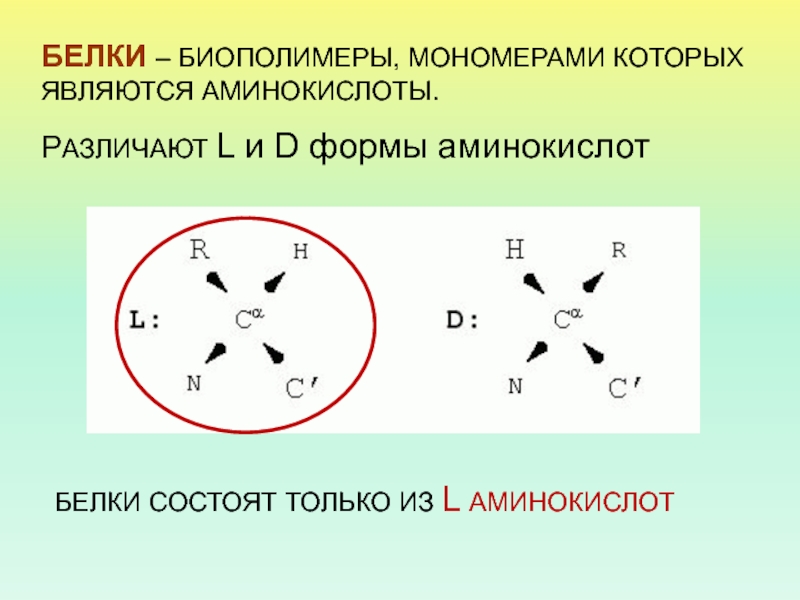
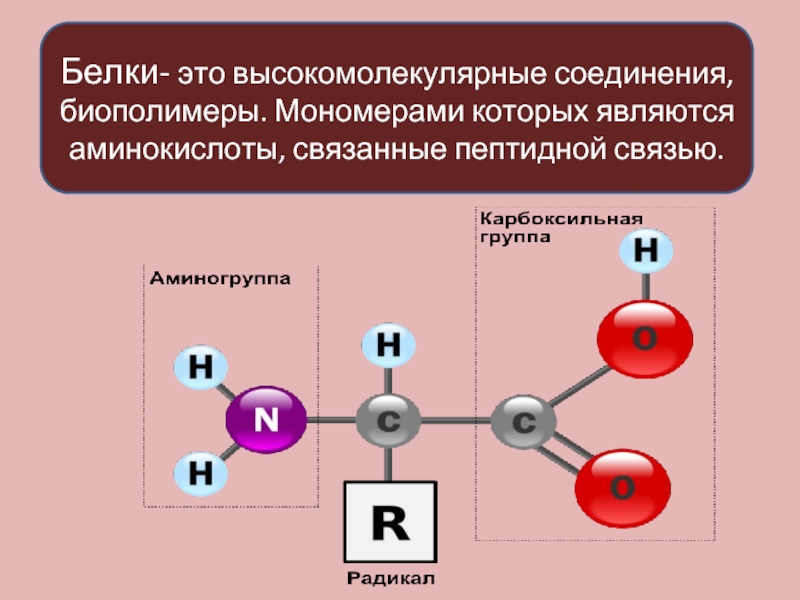
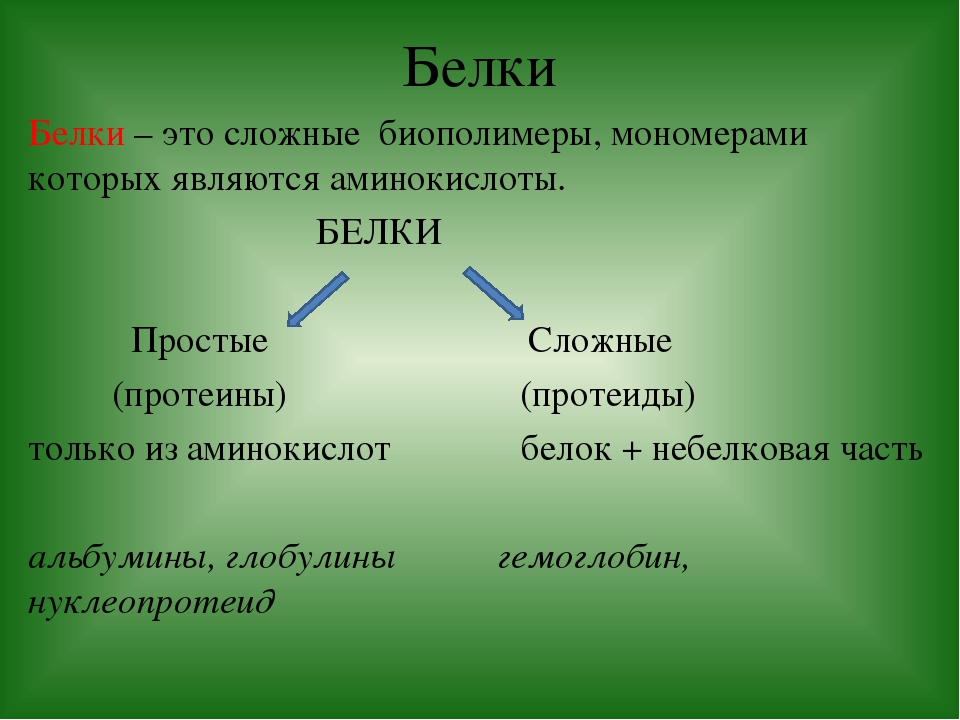
последовательность аминокислотных остатков в полипептидной цепи
взаимное расположение нескольких белковых цепей
Тест по теме «Белки»
ТЕСТ ПО ТЕМЕ «БЕЛКИ»
Вариант 1
Если утверждение верное, учащиеся ставят “+”; если неверное “–“
1.
2. Аминокислоты –амфотерные соединения.
3.Основными аминокислотами называют аминокислоты, содержащие более чем одну группу
-СООН
4.В состав гемоглобина, кроме атомов С.Н,О,N входит Mg.
5.Три аминокислоты, соединяясь друг с другом, образуют дипептид.
6.Незаменимые аминокислоты синтезируются в организме.
7. Пептидная связь характерна для первичной структуры белка.
8.Третичная структура белка поддерживается гидрофобными взаимодействиями.
9. Инсулин имеет четвертичную структуру.
10.Процесс восстановления естественной структуры белка называется ренатурацией.
11.Гемоглобин-сложный белок.
12.Коллаген выполняет транспортную функцию.
13.Интерферон подавляет работу вирусов.
14.Соматотропин-гормон щитовидной железы.
15.Ферменты-это биокатализаторы.
16.Актин входит в состав костей.
17.Фибриноген участвует в свертываемости крови.
17.При расщеплении 1 г. белков выделяется 17,6 кДж энергии.
18.Ферменты обладают специфичностью.
Тест с правильным одним ответом
Вторичная структура белка поддерживается
а — Пептидными связями б — Водородными связями в — Дисульфидными ковалентными связями
2. Наиболее энергоемкими являются:
а – Жиры б — Нуклеиновые кислоты в – Белки г- углеводы
3. Первичная структура белка зависит от:
а — Количества аминокислотных остатков
б — Последовательности аминокислотных остатков и их количества
в — От видов аминокислот и их количества
4. Фермент:
а- ускоряет сразу несколько типов реакций
г- может работать только при определенном значении рН среды.
5. При выработке иммунитета в крови образуются:
а- антитела б- антигены в- гемоглобин г- инсулин
6. Функции углеводов в животных клетках:
а- каталитическая б- энергетическая в- транспортная. г- регуляторная
7. Клетчатка и хитин — это примеры:
а- полисахаридов б- моносахаридов в- дисахаридов.
8. Мономеры белков – это:
а- аминокислоты б- моносахариды в- нуклеотиды. г- глицерин и д жирные кислоты
9. Водородные связи не встречаются в:
а- белках б- нуклеиновых кислотах в- липидах.
10. Некоторые белки вырабатывают антитела. Тем самым они выполняют функцию:
а — каталитическую; б — сократительную; в- иммунную;г- пластическую.
ТЕСТ ПО ТЕМЕ «БЕЛКИ»
Вариант 2
Если утверждение верное, учащиеся ставят “+”; если неверное “–“
1. Макромолекула, образованная мономерами, называется полимером.
Макромолекула, образованная мономерами, называется полимером.
2. Аминокислоты –амфотерные соединения.
3.Основными аминокислотами называют аминокислоты, содержащие более чем одну группу
-СООН
4.В состав гемоглобина, кроме атомов С.Н,О,N входит Mg.
5.Три аминокислоты, соединяясь друг с другом, образуют дипептид.
6.Незаменимые аминокислоты синтезируются в организме.
7. Пептидная связь характерна для первичной структуры белка.
8.Третичная структура белка поддерживается гидрофобными взаимодействиями.
9. Инсулин имеет четвертичную структуру.
10.Процесс восстановления естественной структуры белка называется ренатурацией.
11.Гемоглобин-сложный белок.
12.Коллаген выполняет транспортную функцию.
13.Интерферон подавляет работу вирусов.
14.Соматотропин-гормон щитовидной железы.
15.Ферменты-это биокатализаторы.
16.Актин входит в состав костей.
17.Фибриноген участвует в свертываемости крови.
17.При расщеплении 1 г. белков выделяется 17,6 кДж энергии.
18.Ферменты обладают специфичностью.
Выбери один ответ:
1. Какие связи стабилизируют первичную структуру?
1- пептидные 2- гидрофобные 3- водородные 4- дисульфидные
2. В процессе биохимических реакций ферменты:
1- ускоряют реакции и сами при этом не изменяются
2- ускоряют реакции и сами изменяются
3- замедляют химические реакции, не изменяясь
4- замедляют реакции , а сами изменяясь.
3. Молекулы белков отличаются друг от друга:
1- последовательностью чередования аминокислот
2- количеством аминокислот
3- структурой
4-все ответы верны
4. Какое из соединений построено из аминокислот?
1- целлюлоза 2- гликоген 3- инсулин 4- хитин
5. Изменяемыми частями аминокислот являются:
Изменяемыми частями аминокислот являются:
1- аминогруппа и карбоксильная группа 2- радикал
3- карбоксильная группа 4 — радикал и карбоксильная группа.
6. Строительный углевод растительных клеток
1- хитин 2- крахмал 3- целлюлоза 4 — гликоген
7. Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
1 — гемоглобин 2- инсулин 3 — антитела 4 — гликоген
8. Биологические катализаторы – это:
1- антигены 2 — антитела 3 — ферменты
9. Укажите элементарный состав белков:
1 — С, Н; 2 — С, Н, О, N, S, P; 3- C, H, N, O; 4- вся таблица Менделеева.
10. Какая структура белковой молекулы определяет специфическую биологическую активность белка?
а) Четвертичная; б) третичная; в) вторичная; г) первичная.
Тест «Строение и функции белков»
Тест №4. Белки.
1.Определите признак по которому все нижеперечисленные соединения , кроме одного , объединены в одну группу. Укажите «лишнее» среди них соединение
А)пепсин б)кератин в)коллаген г)хитин д)каталаза е)гемоглобин
2.Четыре химических элемента встречаются в клетке в наибольшем количестве. На их долю приходится 98% . Укажите химический элемент, НЕ относящийся к ним
А) О б) Р в)С г) Н
3.Укажите изображение пептидной связи между двумя аминокислотами в молекуле белка
А) N-N б) HN-CO в) CO-RH г) O=O
4.Назовите белок, выполняющий ферментативную функцию
А)гормон роста б)инсулин в)фибрин г)актин д)пепсин
5. В каком ответе все названные химические соединения относятся к аминокислотам
В каком ответе все названные химические соединения относятся к аминокислотам
А)тубулин, коллаген, лизоцим б)лизин, триптофан, аланин
В)Валин, мальтаза, кератин г)сахароза, лактоза, глицин
6.Назовите химические соединения, которые содержатся в клетке в наибольшем количестве
А)углеводы б)липиды в)белки г)нуклеиновые кислоты д)низкомолекулярные вещества
7.Назовите функциональные группы соседних аминокислот , между которыми образуется пептидная связь
А)радикалы б)карбоксильная группа и аминогруппа в)радикал и ион водорода
Г)карбоксильные группы д)карбоксильная группа и радикал е)аминогруппа и радикал
8.Назовите белок, выполняющий регуляторную функцию
А)коллаген б)фибрин в)гемоглобин г)инсулин
9. Назовите белок в основном выполняющий строительную (структурную) функцию
Назовите белок в основном выполняющий строительную (структурную) функцию
А)кератин б)каталаза в)нуклеаза г)липаза д)гормон роста
10. Назовите белок, выполняющий транспортную функцию
А)коллаген б)кератин в)фибрин г)гемоглобин
11.Назовите основную функцию, которую выполняет белок кератин
А)двигательная Б)защитная в)ферментативная г)транспортная д)строительная
12.В каком ответе все названные химические соединения являются белками
А)сахароза, инсулин, урацил б)глюкоза, фруктоза, гликоген
В) рибоза, тимин, актин г)каталаза, амилаза, адреналин
13.Назовите свойство , присущее аминокислотам , благодаря наличию в них амино- и карбоксильной групп
А)комплементарность б)гидрофобность в)амфотерность г)амфицельность
14. Назовите белок , выполняющий ферментативную функцию
Назовите белок , выполняющий ферментативную функцию
А)каталаза б)протромбин в) тубулин г)глюкагон д)кератин
15. Назовите белок, выполняющий защитную функцию
А) кератин б)каталаза в)гемоглобин г)актин д)антитела
16.Назовите белок волос
А)кератин б)тубулин в)миозин г)коллаген д)актин д)фибрин
17. Какова кислотность внутренней среды клетки
А)нейтральная б) слабощелочная в)слабокислая
18.Что является мономером белка
А)глюкоза б)нуклеотид в)аминокислота г)нуклеиновая кислота г)азотистое основание
19.Сколько видов аминокислот входит в состав природных белков
А)10 б)15 в)20 г)25 д)46 е)64
20.Назовите белок, из которого состоят рога, копыта, когти, перья и волосы
А)коллаген б)кератин в)тубулин г)миозин
21. Назовите все химические группировки, входящие в состав природных белков
Назовите все химические группировки, входящие в состав природных белков
А)только аминогруппа и карбоксильная группа б)водород и радикал
В) водород, аминогруппа и карбоксильная группа г) аминогруппа и карбоксильная группа ,радикал
22.Каким термином называется потеря белком своей естественной пространственной структуры
А) спирализация б)конденсация в)денатурация г) дисперсия д)репарация е)дегенерация
23.Какие химические соединения в обязательном порядке имеют следующие химические группировки: аминогруппу и карбоксильную группу
А)азотистые основания б)нуклеотиды в)нуклеиновые кислоты г)аминокислоты
Д)жирные кислоты е)полисахариды
24.К какому виду химических связей относится пептидная связь
А)ионные б)водородные в)ковалентные г)гидрофобные
25. Назовите химический элемент, который входит в состав хлорофилла
Назовите химический элемент, который входит в состав хлорофилла
a) Mg б) Fe в)Са г)К д)Р
26. Как называется структура белка , представляющая собой спираль, в которую свернута цепочка аминокислот
А)первичная б)вторичная в)третичная г)четвертичная
27. К какой группе химических соединений относится валин, аланин, лизин, триптофан
А)азотистые основания б)нуклеотиды в)нуклеиновые кислоты г)аминокислоты
28.Назовите белки –гормоны , выполняющие регуляторную функцию
А)пепсин, трипсин б)гемоглобин, миоглобин в)инсулин, адреналин г)актин, миозин
29.Назовите в молекуле аминокислот химическую группировку, которая придает аминокислотам кислотные свойства
А)аминогруппа б)радикал в)карбоксильная группа г)гидроксильная группа
30. Назовите белки . выполняющие транспортную функцию
Назовите белки . выполняющие транспортную функцию
А)пепси, трипсин б)гемоглобин в)инсулин г)коллаген д) актин
31.Как называется структура белка, которая представляет собой цепь из аминокислот, с помощью ковалентных связей соединенных друг с другом в определенной последовательности
А)первичная б)вторичная в)третичная г)четвертичная
32. Назовите в молекуле аминокислот химическую группировку, которая придает всем аминокислотам основные(щелочные) свойства
А)аминогруппа б)радикал в)карбоксильная группа г)гидроксильная группа
33.Назовите белок-фермент, который расщепляет другие белки
А)пепсин б)гемоглобин в)инсулин г)коллаген д) липаза
34. Какие химические связи принимают участие в формировании вторичной структуры белка
А)ковалентные б)водородные в)ионные г)гидрофобные
35. Какие химические связи принимают непосредственное участие в формировании его первичной структуры
Какие химические связи принимают непосредственное участие в формировании его первичной структуры
А)ковалентные б)водородные в)ионные г)гидрофобные
36.Как называется структура белка, которая представляет собой спиральную нить , сложенную в клубок
А)первичная б)вторичная в)третичная г)четвертичная
37.Как называется процесс восстановления утраченной природной структуры белка
А)денатурация б)редупликация в)репарация г)диссимиляция д)ренатурация
38.Назовите белки ,входящие в состав скелетных мышечных волокон
А)липаза,мальтаза б)гемоглобин, карбоангидраза в)тубулин, диненин
Г)коллаген, кератин д)актин, миозин
Тест к теме «Биосинтез белка» биология 10 класс | Тест по биологии (10 класс) по теме:
Тестовые задания к презентации «Биосинтез белка»
БЛОК 1:
1. Что является мономерами белков:
Что является мономерами белков:
А) нуклеотиды; Б) моносахариды;
В) аминокислоты; Г) карбоновые кислоты.
2. Какие особые связи образуются между аминокислотами в первичной структуре белка:
А) пептидные; Б) водородные;
В) дисульфидные; Г) сложноэфирные.
3. Где хранится информация о структуре белка:
А) в АТФ; Б) в ДНК; В) в РНК; Г) в цитоплазме.
4. Какие органические вещества могут ускорять процесс синтеза белка:
А) гормоны; Б) антитела; В) гены; Г) ферменты.
5. Какую основную функцию выполняют белки в клетке:
А) энергетическую; Б) защитную;
В) двигательную; Г) строительную.
БЛОК 2:
1. Материальным носителем наследственной информации в эукариотической клетке является:
1)иРНК 3) ДНК
2) тРНК 4) хромосома
2. В гене закодирована информация о:
В гене закодирована информация о:
1) строении белков, жиров и углеводов
2) первичной структуре белка
3) последовательности нуклеотидов в ДНК
4) последовательности аминокислот в 2-х и более молекулах белков
3. Репликация ДНК сопровождается разрывом химических связей:
1) пептидных, между аминокислотами
2) ковалентных, между углеводом и фосфатом
3) водородных, между азотистыми основаниями
4) ионных, внутри структуры молекулы
4. Сколько новых одинарных нитей синтезируется при удвоении одной молекулы ДНК:
1) четыре 2) одна 3) две 4) три
5. При репликации молекулы ДНК образуется:
1) нить, распавшаяся на отдельные фрагменты дочерних молекул
2) молекула, состоящая из двух новых цепей ДНК
3) молекула, половина которой состоит из нити иРНК
4) дочерняя молекула, состоящая из одной старой и одной новой цепи ДНК
БЛОК 3:
1. Если нуклеотидный состав ДНК — АТТ-ГЦГ-ТАТ, то нуклеотидный состав иРНК:
1) ТАА-ЦГЦ-УТА 3) УАА-ЦГЦ-АУА
2) ТАА-ГЦГ-УТУ 4) УАА-ЦГЦ-АТА
2. Если аминокислота кодируется кодоном УГГ, то в ДНК ему соответствует триплет:
Если аминокислота кодируется кодоном УГГ, то в ДНК ему соответствует триплет:
1)ТЦЦ 2)АГГ 3)УЦЦ 4)АЦЦ
3. Один триплет ДНК несет информацию о:
1) последовательности аминокислот в молекуле белка
2) месте определенной аминокислоты в белковой цепи
3) признаке конкретного организма
4) аминокислоте, включаемой в белковую цепь
4. Код ДНК вырожден потому, что:
1) один код он кодирует одну аминокислоту
2) один кодон кодирует несколько аминокислот
3) между кодонами есть знаки препинания
4) одна аминокислота кодируется несколькими кодонами
5. Эволюционное значение генетического кода заключается в том, что он:
1) триплетен 2) индивидуален 3) универсален 4) вырожден
БЛОК 4:
1. Синтез иРНК начинается с:
1) разъединения ДНК на две нити
2) взаимодействия фермента РНК — полимеразы и гена
3) удвоения гена
4) распада гена на нуклеотиды
2. Транскрипция — это процесс:
1) репликации ДНК 2) синтеза иРНК 3) синтеза белка
4) присоединения тРНК к аминокислоте
3. Матрицей для синтеза молекулы иРНК при транскрипции служит:
Матрицей для синтеза молекулы иРНК при транскрипции служит:
1) вся молекула ДНК
2) полностью одна из цепей молекулы ДНК
3) участок одной из цепей ДНК
4) в одних случаях одна из цепей молекулы ДНК, в других– вся молекула ДНК.
4. Транскрипция происходит:
1) в ядре 2) на рибосомах 3) в цитоплазме 4) на каналах гладкой ЭПС
5. Определи последовательность нуклеотидов иРНК, если известна
последовательность нуклеотидов ДНК
ДНК РНК
А – Т ?
Т – А ?
Г — Ц ?
Ц – Г ?
Ц – Г ?
Г – Ц ?
БЛОК 5:
1. Соотнесите вещества и структуры, участвующие в синтезе белка с их функциями.
ВЕЩЕСТВА И СТРУКТУРЫ | ФУНКЦИИ |
1) Участок ДНК 2) иРНК 3) РНК — полимераза 4) Рибосома 5) Полисома 6)АТФ 7) Аминокислота | А) Переносит информацию на рибосомы Б) Место синтеза белка В) Фермент, обеспечивающий синтез иРНК Г) Источник энергии для реакций Д) Мономер белка Е) Ген, кодирующий информацию о белке Ж) Место сборки одинаковых белков |
КОНТРОЛЬНЫЙ ТЕСТ:
1. Выберите три правильно названных свойства генетического кода.
Выберите три правильно названных свойства генетического кода.
A) Код характерен только для эукариотических клеток и бактерий
Б) Код универсален для эукариотических клеток, бактерий и вирусов
B) Один триплет кодирует последовательность аминокислот в молекуле белка
Г) Код вырожден, так аминокислоты могут кодироваться несколькими кодонами
Д) Код избыточен. Может кодировать более 20 аминокислот
Е) Код характерен только для эукариотических клеток
2. Постройте последовательность реакций биосинтеза белка.
A) Снятие информации с ДНК
Б) Узнавание антикодоном тРНК своего кодона на иРНК
B) Отщепление аминокислоты от тРНК
Г) Поступление иРНК на рибосомы
Д) Присоединение аминокислоты к белковой цепи с помощью фермента
3. Постройте последовательность реакций трансляции.
A) Присоединение аминокислоты к тРНК
Б) Начало синтеза полипептидной цепи на рибосоме
B) Присоединение иРНК к рибосоме
Г) Окончание синтеза белка
Д) Удлинение полипептидной цепи
4. Найдите ошибки в приведенном тексте.
Найдите ошибки в приведенном тексте.
1. Генетическая информация заключена в последовательности нуклеотидов в молекулах нуклеиновых кислот. 2. Она передается от иРНК к ДНК. 3. Генетический код записан на «языке «РНК». 4. Код состоит из четырех нуклеотидов. 5. Почти каждая аминокислота шифруется более чем одним кодоном. 6. Каждый кодон шифрует только одну аминокислоту. 7. У каждого живого организма свой генетический код.
Ответы:
Блок1- 1В 2А 3Б 4Г 5Г
Блок2- 1-3 2-2 3-3 4-3 5-4
Блок3- 1-3 2-4 3-4 4-4 5-3
Блок4 1-2 2-2 3-3 4-1 5-А
У
Г
Ц
Ц
Г
Блок5 1-Е 2-А 3-В 4-Б 5-Ж 6-Г 7-Д
Контрольный тест: 1-БГД 2-АГБВД 3-ВАБДГ 4- 2,4,7
Тест по биологии по теме «Белки», 10 класс
Просмотр содержимого документа
«Тест по биологии по теме «Белки», 10 класс»
Биология 10 класс. Тема: Белки.
Тема: Белки.
1..Живое отличается от неживого:
А) составом неорганических веществ
Б) наличием катализаторов
В) обменом веществ
Г) взаимодействием молекул друг с другом
2 Белки — это:
А) мономеры; Б) биополимеры; В) моносахариды; Г) полисахариды.
3. Мономерами белка являются:
А) нуклеотиды; Б)аминокислоты; В) азотистые основания.
4. Аминокислоты различаются:
А)аминогруппой, Б) карбоксильной группой; В)радикалом.
5. В состав молекул белков входят:
А) только аминокислоты
Б) аминокислоты и иногда ионы металлов
В) аминокислоты и иногда молекулы липидов
Г) аминокислоты и иногда молекулы углеводов
6. Структура молекулы белка, которую определяет последовательность аминокислотных остатков: А) первичная; Б) вторичная; В) третичная; Г) четвертичная.
7.Вторичная структура белка поддерживается связями:
А) только пептидными;
Б) только водородными;
В) дисульфидные и водородными;
Г) водородными и пептидными;
8. Третичная структура белка образована связями
Третичная структура белка образована связями
А – водородными, пептидными, гидрофобными
Б – пептидными, гидрофобными, ионными
В – водородными, гидрофобными, ионными.
9. Наименее прочными структурами белка является:
А) первичная и вторичная
Б) вторичная и троичная
В) третичная и четвертичная
Г) четвертичная и вторичная
10. Ферменты выполняют следующие функции:
А) являются основным источником энергии;
Б) ускоряют биохимические реакции;
В) транспортируют кислород;
Г) участвуют в химической реакции, превращаясь в другие вещества.
11. Биологическую активность белка определяет структура:
А) только первичная;
Б) только вторичная;
В) всегда четвертичная;
Г) четвертичная, иногда третичная.
Почему из 200 аминокислот в состав белка входит только 20?
Процесс денатурации — это…?
Тест Белки (10 класс) по биологии онлайн
Сложность: знаток. Последний раз тест пройден 24 часа назад.
Последний раз тест пройден 24 часа назад.
Материал подготовлен совместно с учителем высшей категории, кандидатом биологических наук
Опыт работы учителем биологии — более 31 года.
Вопрос 1 из 10
Какие соединения являются мономерами молекул белка?
- Правильный ответ
- Неправильный ответ
- Пояснение: Молекулы белков представляют собой полипептидные цепочки, составленные из отдельных аминокислот.
- Вы и еще 90% ответили правильно
- 90% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 10
Сколько из известных аминокислот участвуют в синтезе белка?
- Правильный ответ
- Неправильный ответ
- Пояснение: На данный момент учеными открыто около 500! соединений, считающихся аминокислотами.
 Из них 20 непосредственно участвуют в образовании белка в живых организмах.
Из них 20 непосредственно участвуют в образовании белка в живых организмах. - Вы и еще 84% ответили правильно
- 84% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 10
Какая часть молекул аминокислот отличает их друг от друга?
- Правильный ответ
- Неправильный ответ
- Пояснение: Отличает радикал. Общими для всех является аминогруппа и карбоксильная группа.
- Вы и еще 59% ответили правильно
- 59% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 10
Посредством какой химической связи соединены между собой аминокислоты в молекуле белка первичной структуры?
- Правильный ответ
- Неправильный ответ
- Пояснение: Аминокислоты в молекуле белка соединяются между собой посредством пептидной связи.

- Вы и еще 79% ответили правильно
- 79% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 10
В каких органеллах клетки синтезируются белки?
- Правильный ответ
- Неправильный ответ
- Пояснение: Синтезируются нужные белки в клетках организма на органеллах – рибосомах. Для синтеза белков используются аминокислоты.
- Вы и еще 69% ответили правильно
- 69% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 6 из 10
Где находятся рибосомы?
- Правильный ответ
- Неправильный ответ
- Пояснение: Рибосома — важнейшая немембранная органелла всех живых клеток.
 В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети. - Вы и еще 77% ответили правильно
- 77% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 7 из 10
Какие структуры молекул белка способны нарушаться при денатурации, а затем вновь восстанавливаются?
- Правильный ответ
- Неправильный ответ
- Пояснение: При денатурации белков происходят изменения во вторичной и третичной структурах белка, а первичная структура сохраняется. Первичная структура можкт сохраняться, но если она разрушиться, то восстановится не может!!! Восстанавливаются третичная и четвертичная структуры. Противоречие между вопросом и ответом!
- Вы ответили лучше 56% участников
- 44% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 8 из 10
Сколько энергии освобождается при расщеплении 1 г углевода (глюкозы)?
- Правильный ответ
- Неправильный ответ
- Пояснение: При расщеплении 1 грамма глюкозы выделяется 17,6 кДж (килоджоуль) энергии.

- Вы и еще 69% ответили правильно
- 69% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 9 из 10
Каковы отличия ферментов от других белков?
- Правильный ответ
- Неправильный ответ
- Пояснение: Фермент и белок – это два типа биомолекул, которые находятся в организме и выполняют важные функции организма. Главное отличие между ферментом и белком является то, что фермент является биологическим катализатором: каждый фермент, свернутый в определенную структуру, ускоряет соответствующую химическую реакцию.
- Вы и еще 60% ответили правильно
- 60% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 10 из 10
Заменимая аминокислота:
- Правильный ответ
- Неправильный ответ
- Пояснение: Заменимые аминокислоты – это такие аминокислоты, которые могут поступать в наш организм с белковой пищей либо же образовываться в организме из других аминокислот.
 Из предложенного списка заменимой аминокислотой является глицин.
Из предложенного списка заменимой аминокислотой является глицин. - Вы и еще 59% ответили правильно
- 59% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
ТОП-3 тестакоторые проходят вместе с этимРейтинг теста
Средняя оценка: 4. Всего получено оценок: 2212.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
белки — урок. Биология, Общие биологические закономерности (9–11 класс).
Белки (протеины, полипептиды) — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты, которые (имея в своём составе карбоксильную и аминогруппы) обладают свойствами кислоты и основания (амфотерны).
Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры, и их называют макромолекулами.
Структура белковой молекулы
Под структурой белковой молекулы понимают её аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего \(20\) видов различных аминокислот, и огромное разнообразие белков создаётся за счёт различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка. Она уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты).
 Эта спираль — вторичная структура белка.
Эта спираль — вторичная структура белка. - Третичная структура белка — трёхмерная пространственная «упаковка» полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S–S связями).
- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остаётся в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией.
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть ещё и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки — ферменты — способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция — одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин — хрящи и сухожилия).

- Транспортная функция — белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).
- Сигнальная функция. Приём сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция — обеспечивается сократительными белками — актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов).
- Защитная функция — антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.

- Регуляторная функция присуща белкам — гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция — при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источники:
http://ours-nature.ru/lib/b/book/1063747118/348
2.9: Белки — Biology LibreTexts
Белки представляют собой полимеры аминокислот
Белки обеспечивают большую часть структурной и функциональной способности клеток. Белки состоят из мономеров, называемых аминокислотами. Аминокислоты — это углеводороды, которые имеют аминогруппу (-NH 2 ) и кислотную карбоксильную группу (-COOH). Группа R представляет собой углеводородную цепь с модификацией, изменяющей свойства аминокислоты. Для построения белков используются 20 универсальных аминокислот.Разнообразие функциональных групп в аминокислотной цепи приводит к функциональному разнообразию белков.
Аминокислоты — это углеводороды, которые имеют аминогруппу (-NH 2 ) и кислотную карбоксильную группу (-COOH). Группа R представляет собой углеводородную цепь с модификацией, изменяющей свойства аминокислоты. Для построения белков используются 20 универсальных аминокислот.Разнообразие функциональных групп в аминокислотной цепи приводит к функциональному разнообразию белков.
20 аминокислот и их свойства. 21-я аминокислота в этой таблице представляет собой селеноцистеин, который встречается не везде.
Мономеры связываются вместе посредством реакции синтеза дегидратации между соседними амино- и карбоксильными группами с образованием пептидной связи .
Три аминокислоты связаны в трипептид.
Как аминокислоты взаимодействуют друг с другом и с окружающей средой
Используйте следующую симуляцию, чтобы проверить, как складывается полипептидная цепь, в зависимости от типа раствора и состава аминокислот.
Уровни структуры
- Первичная структура (1 °) : последовательность аминокислот, считываемая от амино- или N-концевого конца молекулы до карбоксильного или C-концевого конца.
- Tyr-Cys-Arg-Phe-Leu-Val-….
- Вторичная структура (2 °) : локальные трехмерные структуры, которые образуются в результате взаимодействия аминокислот, например водородных связей.
- Alpha Helix — спирали, образующиеся из H-связей между группами N-H и C = O вдоль основной цепи белка
Вид сбоку α-спирали, иллюстрирующий Н-связи пурпурного цвета между карбоксилом кислород (красный) и амин азот (синий)
Вид α-спирали сверху вниз
Вид сбоку ленточной диаграммы α-спиралей, пересекающих мембрану.
- Бета-листы — боковые соединенные нити или листы аминокислот, происходящие из Н-связей между группами N-H и C = O вдоль основной цепи белка
Ленточная схема β-листов
- Третичная структура (3 °) : общая трехмерная структура пептидной цепи
- Четвертичная структура (4 °) : мультимерная белковая структура из сборки нескольких пептидных субъединиц
youtube.com/embed/wvTv8TqWC48?feature=oembed»/>
Разнообразие белков
Узнайте больше о сложности белковых структур в Protein Data Bank.
Обнаружение белка (активность)
Теория обнаружения белков:
Белки могут быть обнаружены с помощью теста Biuret . В частности, пептидные связи (связи C-N) в белках образуют комплекс с Cu 2+ в реагенте Биурета и дают фиолетовый цвет. Cu 2+ должен образовывать комплекс с четырьмя-шестью пептидными связями для получения цвета; следовательно, свободные аминокислоты не реагируют положительно. Длинные полипептиды (белки) имеют много пептидных связей и вызывают положительную реакцию на реагент. Биуретовый реагент представляет собой щелочной раствор 1% CuSO 4 , сульфат меди. Фиолетовый цвет является положительным тестом на присутствие белка, а интенсивность цвета пропорциональна количеству пептидных связей в растворе.
Биуретовый тест
- Изучите приведенную ниже таблицу. Укажите, является ли образец отрицательным контролем, положительным контролем или экспериментальным.
- Предскажите изменение цвета раствора.
- Сформулируйте гипотезу о составляющих эксперимента.
- Возьмите 6 пробирок и пронумеруйте их от 1 до 6.
- Добавьте материалы, указанные в таблице.
- Добавьте 3 капли реагента Биурета (1,0% CuSO 4 с NaOH) в каждую пробирку и перемешайте.
- Запишите цвет содержимого тюбиков в таблицу.
Заключение об образцах мочи
Можем ли мы сделать какие-либо выводы на основании результатов теста Бенедикта и теста Биурета?
Сравнение биологических макромолекул | Биология для майоров I
Обсудить биологические макромолекулы и различия между четырьмя классами
Как мы узнали, существует четыре основных класса биологических макромолекул:
- Белки (полимеры аминокислот)
- Углеводы (полимеры сахаров)
- Липиды (полимеры липидных мономеров)
- Нуклеиновые кислоты (ДНК и РНК; полимеры нуклеотидов)
Давайте подробнее рассмотрим различия между классами различия.
Цели обучения
- Определите термин «макромолекула»
- Различают 4 класса макромолекул
Теперь, когда мы обсудили четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), давайте поговорим о макромолекулах в целом. Каждый из них является важным компонентом ячейки и выполняет широкий спектр функций. Вместе эти молекулы составляют большую часть сухой массы клетки (напомним, что вода составляет большую часть ее полной массы).Биологические макромолекулы являются органическими, то есть содержат углерод. Кроме того, они могут содержать водород, кислород, азот и дополнительные второстепенные элементы.
Ты то, что ешь
Сравнение биологических макромолекул
| Макромолекула | Базовая формула, основные характеристики | Мономер | Примеры | использует |
|---|---|---|---|---|
| Белки | ЧОН -NH 2 + -COOH + R группа | Аминокислоты | Ферменты, некоторые гормоны | Хранение; Сигналы; Структурный; Сократительный; Оборонительный; Фермент; Транспорт; Рецепторы |
| Липиды | C: H: O Более 2: 1 H: O (карбоксильная группа) | Жирные кислоты и глицерин | Сливочное масло, масло, холестерин, пчелиный воск | Накопитель энергии; Защита; Химические посланники; Отталкивать воду |
| Углеводы | C: H: O 1: 2: 1 | Моносахариды | Глюкоза, фруктоза, крахмал, гликоген, целлюлоза | Накопитель энергии; Структура |
| Нуклеиновые кислоты | ЧОНП пентоза, азотистое основание, фосфат | Нуклеотиды | ДНК, РНК | Генетическая информация |
Синтез дегидратации
Большинство макромолекул состоит из отдельных субъединиц или строительных блоков, называемых мономерами .Мономеры соединяются друг с другом с помощью ковалентных связей с образованием более крупных молекул, известных как полимеры . При этом мономеры выделяют молекулы воды в качестве побочных продуктов. Этот тип реакции известен как синтез дегидратации , что означает «объединить, теряя воду».
Рис. 1. В реакции синтеза дегидратации, изображенной выше, две молекулы глюкозы соединяются вместе с образованием дисахарида мальтозы. В процессе образуется молекула воды.
В реакции синтеза дегидратации (рис. 1) водород одного мономера соединяется с гидроксильной группой другого мономера, высвобождая молекулу воды.В то же время мономеры разделяют электроны и образуют ковалентные связи. По мере присоединения дополнительных мономеров эта цепочка повторяющихся мономеров образует полимер. Различные типы мономеров могут сочетаться во многих конфигурациях, давая начало разнообразной группе макромолекул. Даже один вид мономера может сочетаться различными способами с образованием нескольких различных полимеров: например, мономеры глюкозы являются составляющими крахмала, гликогена и целлюлозы.
Гидролиз
Полимеры распадаются на мономеры в процессе, известном как гидролиз, что означает «расщепление воды», реакция, в которой молекула воды используется во время разложения (рис. 2).Во время этих реакций полимер распадается на два компонента: одна часть получает атом водорода (H +), а другая — молекулу гидроксила (OH–) из расщепленной молекулы воды.
Рис. 2. В реакции гидролиза, показанной здесь, дисахарид мальтоза расщепляется с образованием двух мономеров глюкозы с добавлением молекулы воды. Обратите внимание, что эта реакция является обратной реакцией синтеза, показанной на рисунке 1.
реакций дегидратации и гидролиза катализируются или «ускоряются» специфическими ферментами; реакции дегидратации включают образование новых связей, требующих энергии, в то время как реакции гидролиза разрывают связи и высвобождают энергию.Эти реакции аналогичны для большинства макромолекул, но реакция каждого мономера и полимера специфична для своего класса. Например, в нашем организме пища гидролизуется или расщепляется на более мелкие молекулы каталитическими ферментами в пищеварительной системе. Это позволяет легко усваивать питательные вещества клетками кишечника. Каждая макромолекула расщепляется определенным ферментом. Например, углеводы расщепляются амилазой, сахарозой, лактазой или мальтазой. Белки расщепляются ферментами пепсин и пептидаза, а также соляной кислотой.Липиды расщепляются липазами. Распад этих макромолекул дает энергию для клеточной деятельности.
Посетите этот сайт, чтобы увидеть визуальные представления синтеза и гидролиза при дегидратации.Вкратце: Сравнение биологических макромолекул
Белки, углеводы, нуклеиновые кислоты и липиды — это четыре основных класса биологических макромолекул — больших молекул, необходимых для жизни, которые построены из более мелких органических молекул. Макромолекулы состоят из отдельных звеньев, известных как мономеры, которые связаны ковалентными связями с образованием более крупных полимеров.Полимер — это больше, чем просто сумма его частей: он приобретает новые характеристики и приводит к осмотическому давлению, которое намного ниже того, которое создается его ингредиентами; это важное преимущество в поддержании осмотических условий клетки. Мономер соединяется с другим мономером с высвобождением молекулы воды, что приводит к образованию ковалентной связи. Эти типы реакций известны как реакции дегидратации или конденсации. Когда полимеры распадаются на более мелкие звенья (мономеры), молекула воды используется для каждой связи, разорванной в этих реакциях; такие реакции известны как реакции гидролиза.Реакции дегидратации и гидролиза аналогичны для всех макромолекул, но реакция каждого мономера и полимера специфична для своего класса. Реакции дегидратации обычно требуют затрат энергии для образования новых связей, в то время как реакции гидролиза обычно высвобождают энергию за счет разрыва связей.
Проверьте свое пониманиеОтветьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе. В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
различных типов биологических макромолекул
Результаты обучения
- Определите термин «макромолекула»
- Различают 4 класса макромолекул
Теперь, когда мы обсудили четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), давайте поговорим о макромолекулах в целом.Каждый из них является важным компонентом ячейки и выполняет широкий спектр функций. Вместе эти молекулы составляют большую часть сухой массы клетки (напомним, что вода составляет большую часть ее полной массы). Биологические макромолекулы являются органическими, то есть содержат углерод. Кроме того, они могут содержать водород, кислород, азот и дополнительные второстепенные элементы.
Ты то, что ешь
Сравнение биологических макромолекул
| Макромолекула | Базовая формула, основные характеристики | Мономер | Примеры | использует |
|---|---|---|---|---|
| Белки | ЧОН -NH 2 + -COOH + R группа | Аминокислоты | Ферменты, некоторые гормоны | Хранение; Сигналы; Структурный; Сократительный; Оборонительный; Фермент; Транспорт; Рецепторы |
| Липиды | C: H: O Более 2: 1 H: O (карбоксильная группа) | Жирные кислоты и глицерин | Сливочное масло, масло, холестерин, пчелиный воск | Накопитель энергии; Защита; Химические посланники; Отталкивать воду |
| Углеводы | C: H: O 1: 2: 1 | Моносахариды | Глюкоза, фруктоза, крахмал, гликоген, целлюлоза | Накопитель энергии; Структура |
| Нуклеиновые кислоты | ЧОНП пентоза, азотистое основание, фосфат | Нуклеотиды | ДНК, РНК | Генетическая информация |
Синтез дегидратации
Большинство макромолекул состоит из отдельных субъединиц или строительных блоков, называемых мономерами .Мономеры соединяются друг с другом с помощью ковалентных связей с образованием более крупных молекул, известных как полимеры . При этом мономеры выделяют молекулы воды в качестве побочных продуктов. Этот тип реакции известен как синтез дегидратации , что означает «объединить, теряя воду».
Рис. 1. В реакции синтеза дегидратации, изображенной выше, две молекулы глюкозы соединяются вместе с образованием дисахарида мальтозы. В процессе образуется молекула воды.
В реакции синтеза дегидратации (рис. 1) водород одного мономера соединяется с гидроксильной группой другого мономера, высвобождая молекулу воды.В то же время мономеры разделяют электроны и образуют ковалентные связи. По мере присоединения дополнительных мономеров эта цепочка повторяющихся мономеров образует полимер. Различные типы мономеров могут сочетаться во многих конфигурациях, давая начало разнообразной группе макромолекул. Даже один вид мономера может сочетаться различными способами с образованием нескольких различных полимеров: например, мономеры глюкозы являются составляющими крахмала, гликогена и целлюлозы.
Гидролиз
Полимеры распадаются на мономеры в процессе, известном как гидролиз, что означает «расщепление воды», реакция, в которой молекула воды используется во время разложения (рис. 2).Во время этих реакций полимер распадается на два компонента: одна часть получает атом водорода (H +), а другая — молекулу гидроксила (OH–) из расщепленной молекулы воды.
Рис. 2. В реакции гидролиза, показанной здесь, дисахарид мальтоза расщепляется с образованием двух мономеров глюкозы с добавлением молекулы воды. Обратите внимание, что эта реакция является обратной реакцией синтеза, показанной на рисунке 1.
реакций дегидратации и гидролиза катализируются или «ускоряются» специфическими ферментами; реакции дегидратации включают образование новых связей, требующих энергии, в то время как реакции гидролиза разрывают связи и высвобождают энергию.Эти реакции аналогичны для большинства макромолекул, но реакция каждого мономера и полимера специфична для своего класса. Например, в нашем организме пища гидролизуется или расщепляется на более мелкие молекулы каталитическими ферментами в пищеварительной системе. Это позволяет легко усваивать питательные вещества клетками кишечника. Каждая макромолекула расщепляется определенным ферментом. Например, углеводы расщепляются амилазой, сахарозой, лактазой или мальтазой. Белки расщепляются ферментами пепсин и пептидаза, а также соляной кислотой.Липиды расщепляются липазами. Распад этих макромолекул дает энергию для клеточной деятельности.
Посетите этот сайт, чтобы увидеть визуальные представления синтеза и гидролиза при дегидратации.Вкратце: различные типы биологических макромолекул
Белки, углеводы, нуклеиновые кислоты и липиды — это четыре основных класса биологических макромолекул — больших молекул, необходимых для жизни, которые построены из более мелких органических молекул. Макромолекулы состоят из отдельных звеньев, известных как мономеры, которые связаны ковалентными связями с образованием более крупных полимеров.Полимер — это больше, чем просто сумма его частей: он приобретает новые характеристики и приводит к осмотическому давлению, которое намного ниже того, которое создается его ингредиентами; это важное преимущество в поддержании осмотических условий клетки. Мономер соединяется с другим мономером с высвобождением молекулы воды, что приводит к образованию ковалентной связи. Эти типы реакций известны как реакции дегидратации или конденсации. Когда полимеры распадаются на более мелкие звенья (мономеры), молекула воды используется для каждой связи, разорванной в этих реакциях; такие реакции известны как реакции гидролиза.Реакции дегидратации и гидролиза аналогичны для всех макромолекул, но реакция каждого мономера и полимера специфична для своего класса. Реакции дегидратации обычно требуют затрат энергии для образования новых связей, в то время как реакции гидролиза обычно высвобождают энергию за счет разрыва связей.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
мономеров: типы и примеры — видео и стенограмма урока
Моносахариды
Моносахарид является мономером углевода.Углеводы, такие как сахар и крахмал, хранят энергию. Другие, такие как целлюлоза и хитин, имеют структурную природу.
Некоторые моносахариды являются изомерами . Это означает, что они имеют одинаковую химическую формулу, но другое расположение атомов. Примером такой пары изомеров является глюкоза и фруктоза. У них обоих есть формула C6 h22 O6, но у глюкозы есть кольцо с пятью атомами углерода и одним кислородом, а у фруктозы есть кольцо с четырьмя атомами углерода и одним кислородом.
Глюкоза — обычный источник энергии для живых существ.Он легко разрушается большинством клеток в процессе, называемом гликолизом . Многие клетки разрушают его дальше во время аэробного дыхания . Мономеры глюкозы можно соединить вместе, чтобы получить крахмал и гликоген. Растения хранят энергию в виде крахмала, а животные — в виде гликогена. Структурные углеводы, такие как целлюлоза в стенках растительных клеток и хитин в экзоскелете насекомых, также состоят из мономеров глюкозы.
Фруктоза, которая, как мы уже узнали, является изомером глюкозы, представляет собой простой сахар, придающий фруктам и овощам сладкий вкус.Иногда одна глюкоза и одна фруктоза объединяются с образованием сахарозы или обычного столового сахара, который представляет собой дисахарид , или сахар, состоящий из двух моносахаридов.
Глицерин и жирные кислоты
Глицерин и жирные кислоты являются мономерами липидов. Липиды включают воски, масла и жиры. Некоторые используются для хранения энергии. Другие смягчают костные части тела. Воски могут защитить поверхность растений или животных от обезвоживания. Липиды также являются важным компонентом клеточной мембраны.
Глицерин — это молекула со сладким вкусом, которая применяется в пищевой и фармацевтической промышленности. Это также основа триглицеридов, которые представляют собой тип жира, который содержится в нашей крови.
Существует три основных типа жирных кислот — насыщенные, мононенасыщенные и полиненасыщенные — в зависимости от количества присутствующих атомов водорода. Давайте кратко рассмотрим, как состоят жирные кислоты. Жирная кислота состоит из карбоксильной группы с присоединенной цепью атомов углерода. Когда углеродная цепь не имеет двойных или тройных связей, она называется насыщенной.Это означает, что каждый углерод связан с двумя атомами водорода, за исключением последнего, который связан с тремя. В ненасыщенном жире есть одна или несколько жирных кислот, которые имеют одну или несколько двойных или тройных связей. Эти связи образуются между последовательными атомами углерода.
Нуклеотиды
Нуклеотид является мономером нуклеиновых кислот, таких как ДНК и РНК. Каждый нуклеотид состоит из сахара, фосфатной группы и азотистого основания .В РНК сахар представляет собой рибозу . В ДНК сахар дезоксирибоза .
Азотистые основания соответствуют генетическому алфавиту. В ДНК это A, G, C и T. В РНК это A, G, C и U. Буквы соответствуют аденину и гуанину (пурины) и цитозину, тимину и урацилу (пиримидин). Пурины имеют несколько более крупную молекулярную структуру с пиримидиновым кольцом, конденсированным с имидазольным кольцом. Пиримидины имеют только пиримидиновое кольцо.
Вместе эти мономеры образуют ДНК, молекулу, которая содержит генетический материал и кодирует белки, а также различные формы РНК, которые участвуют в реальном производстве белка.
Аминокислоты
Аминокислоты являются мономерами белков. Аминокислоты имеют положительно заряженную аминогруппу с одной стороны и отрицательно заряженную карбоксильную группу с другой. К центральному углероду присоединена переменная группа, называемая группой «R». Эта группа различна для каждой аминокислоты. В клетках человека 20 аминокислот.
Аминокислоты соединены вместе в определенной последовательности для каждого белка. Последовательность определяет, какой белок сделан.
Резюме урока
Мономеры являются основными строительными блоками более крупных органических молекул. Моносахариды — это мономеры, из которых состоят углеводы. Глюкоза является примером моносахарида. Глицерин и жирные кислоты являются мономерами, из которых состоят липиды. Нуклеотиды — это мономеры, из которых состоят нуклеиновые кислоты. Аминокислоты — это мономеры, из которых состоят белки. Последовательности соединенных вместе мономеров образуют полимеры.
Результаты обучения
Убедитесь, что вы можете выполнить эти действия, когда смотрели урок о мономерах:
- Распознать мономер по определению
- Перечислить четыре мономера органических групп
- Обсудить функции моносахаридов
- Напишите три основных вида жирных кислот
- Охарактеризовать нуклеотиды и аминокислоты
2.3 Биологические молекулы — Концепции биологии — 1-е канадское издание
К концу этого раздела вы сможете:
- Опишите, почему углерод имеет решающее значение для жизни
- Объясните влияние незначительных изменений аминокислот на организмы
- Опишите четыре основных типа биологических молекул
- Понимать функции четырех основных типов молекул
Посмотрите видео о белках и белковых ферментах.
Большие молекулы, необходимые для жизни, которые состоят из более мелких органических молекул, называются биологическими макромолекулами . Существует четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), каждый из которых является важным компонентом клетки и выполняет широкий спектр функций. Вместе эти молекулы составляют большую часть массы клетки. Биологические макромолекулы являются органическими, что означает, что они содержат углерод. Кроме того, они могут содержать водород, кислород, азот, фосфор, серу и дополнительные второстепенные элементы.
Часто говорят, что жизнь «основана на углероде». Это означает, что атомы углерода, связанные с другими атомами углерода или другими элементами, образуют фундаментальные компоненты многих, если не большинства, молекул, уникальных для живых существ. Другие элементы играют важную роль в биологических молекулах, но углерод определенно квалифицируется как элемент «фундамент» для молекул в живых существах. Это связывающие свойства атомов углерода, которые ответственны за его важную роль.
Углерод содержит четыре электрона в своей внешней оболочке.Следовательно, он может образовывать четыре ковалентные связи с другими атомами или молекулами. Простейшая молекула органического углерода — метан (CH 4 ), в котором четыре атома водорода связаны с атомом углерода.
Рис. 2.12. Углерод может образовывать четыре ковалентные связи, образуя органическую молекулу. Самая простая молекула углерода — это метан (Ch5), изображенный здесь.Однако более сложные конструкции изготавливаются с использованием углерода. Любой из атомов водорода может быть заменен другим атомом углерода, ковалентно связанным с первым атомом углерода.Таким образом могут быть образованы длинные и разветвленные цепи углеродных соединений (рис. 2.13 a ). Атомы углерода могут связываться с атомами других элементов, таких как азот, кислород и фосфор (рис. 2.13 b ). Молекулы также могут образовывать кольца, которые сами могут связываться с другими кольцами (рис. 2.13 c ). Это разнообразие молекулярных форм объясняет разнообразие функций биологических макромолекул и в значительной степени основано на способности углерода образовывать множественные связи с самим собой и другими атомами.
Рис. 2.13. Эти примеры показывают три молекулы (обнаруженные в живых организмах), которые содержат атомы углерода, различным образом связанные с другими атомами углерода и атомами других элементов. (а) Эта молекула стеариновой кислоты имеет длинную цепочку атомов углерода. (б) Глицин, компонент белков, содержит атомы углерода, азота, кислорода и водорода. (c) Глюкоза, сахар, имеет кольцо из атомов углерода и один атом кислорода.Углеводы — это макромолекулы, с которыми большинство потребителей в некоторой степени знакомо.Чтобы похудеть, некоторые люди придерживаются «низкоуглеводной» диеты. Спортсмены, напротив, часто «нагружают углеводы» перед важными соревнованиями, чтобы убедиться, что у них достаточно энергии для соревнований на высоком уровне. Фактически, углеводы являются неотъемлемой частью нашего рациона; злаки, фрукты и овощи — все это естественные источники углеводов. Углеводы обеспечивают организм энергией, особенно через глюкозу, простой сахар. Углеводы также выполняют другие важные функции у людей, животных и растений.
Углеводы можно представить формулой (CH 2 O) n , где n — количество атомов углерода в молекуле. Другими словами, соотношение углерода, водорода и кислорода в молекулах углеводов составляет 1: 2: 1. Углеводы подразделяются на три подтипа: моносахариды, дисахариды и полисахариды.
Моносахариды (моно- = «один»; sacchar- = «сладкий») представляют собой простые сахара, наиболее распространенным из которых является глюкоза.В моносахаридах количество атомов углерода обычно составляет от трех до шести. Большинство названий моносахаридов оканчиваются суффиксом -ose. В зависимости от количества атомов углерода в сахаре они могут быть известны как триозы (три атома углерода), пентозы (пять атомов углерода) и гексозы (шесть атомов углерода).
Моносахариды могут существовать в виде линейной цепи или кольцевых молекул; в водных растворах они обычно находятся в кольцевой форме.
Химическая формула глюкозы: C 6 H 12 O 6 .У большинства живых существ глюкоза является важным источником энергии. Во время клеточного дыхания из глюкозы выделяется энергия, которая используется для выработки аденозинтрифосфата (АТФ). Растения синтезируют глюкозу, используя углекислый газ и воду в процессе фотосинтеза, а глюкоза, в свою очередь, используется для удовлетворения потребностей растений в энергии. Избыток синтезированной глюкозы часто хранится в виде крахмала, который расщепляется другими организмами, питающимися растениями.
Галактоза (входит в состав лактозы или молочного сахара) и фруктоза (содержится во фруктах) — другие распространенные моносахариды.Хотя глюкоза, галактоза и фруктоза имеют одинаковую химическую формулу (C 6 H 12 O 6 ), они различаются структурно и химически (и известны как изомеры) из-за разного расположения атомов в углеродной цепи. .
Рис. 2.14. Глюкоза, галактоза и фруктоза — изомерные моносахариды, что означает, что они имеют одинаковую химическую формулу, но немного разные структуры.Дисахариды (ди- = «два») образуются, когда два моносахарида подвергаются реакции дегидратации (реакция, при которой происходит удаление молекулы воды).Во время этого процесса гидроксильная группа (–OH) одного моносахарида соединяется с атомом водорода другого моносахарида, высвобождая молекулу воды (H 2 O) и образуя ковалентную связь между атомами в двух молекулах сахара.
Общие дисахариды включают лактозу, мальтозу и сахарозу. Лактоза — это дисахарид, состоящий из мономеров глюкозы и галактозы. Он содержится в молоке. Мальтоза, или солодовый сахар, представляет собой дисахарид, образующийся в результате реакции дегидратации между двумя молекулами глюкозы.Наиболее распространенным дисахаридом является сахароза или столовый сахар, который состоит из мономеров глюкозы и фруктозы.
Длинная цепь моносахаридов, связанных ковалентными связями, известна как полисахарид (поли- = «много»). Цепь может быть разветвленной или неразветвленной, и она может содержать разные типы моносахаридов. Полисахариды могут быть очень большими молекулами. Крахмал, гликоген, целлюлоза и хитин являются примерами полисахаридов.
Крахмал — это хранимая в растениях форма сахаров, состоящая из амилозы и амилопектина (оба полимера глюкозы).Растения способны синтезировать глюкозу, а избыток глюкозы откладывается в виде крахмала в различных частях растений, включая корни и семена. Крахмал, который потребляется животными, расщепляется на более мелкие молекулы, такие как глюкоза. Затем клетки могут поглощать глюкозу.
Гликоген — это форма хранения глюкозы в организме человека и других позвоночных, состоящая из мономеров глюкозы. Гликоген является животным эквивалентом крахмала и представляет собой сильно разветвленную молекулу, обычно хранящуюся в клетках печени и мышц.Когда уровень глюкозы снижается, гликоген расщепляется с высвобождением глюкозы.
Целлюлоза — один из самых распространенных природных биополимеров. Клеточные стенки растений в основном состоят из целлюлозы, которая обеспечивает структурную поддержку клетки. Дерево и бумага в основном целлюлозные по своей природе. Целлюлоза состоит из мономеров глюкозы, которые связаны связями между определенными атомами углерода в молекуле глюкозы.
Каждый второй мономер глюкозы в целлюлозе переворачивается и плотно упаковывается в виде вытянутых длинных цепей.Это придает целлюлозе жесткость и высокую прочность на разрыв, что так важно для растительных клеток. Целлюлоза, проходящая через нашу пищеварительную систему, называется пищевыми волокнами. Хотя связи глюкозы и глюкозы в целлюлозе не могут быть разрушены пищеварительными ферментами человека, травоядные животные, такие как коровы, буйволы и лошади, способны переваривать траву, богатую целлюлозой, и использовать ее в качестве источника пищи. У этих животных определенные виды бактерий обитают в рубце (часть пищеварительной системы травоядных) и секретируют фермент целлюлазу.В аппендиксе также содержатся бактерии, которые расщепляют целлюлозу, что придает ей важную роль в пищеварительной системе жвачных животных. Целлюлазы могут расщеплять целлюлозу на мономеры глюкозы, которые могут использоваться животным в качестве источника энергии.
Углеводы выполняют другие функции у разных животных. У членистоногих, таких как насекомые, пауки и крабы, есть внешний скелет, называемый экзоскелетом, который защищает их внутренние части тела. Этот экзоскелет состоит из биологической макромолекулы , хитина , азотистого углевода.Он состоит из повторяющихся единиц модифицированного сахара, содержащего азот.
Таким образом, из-за различий в молекулярной структуре углеводы могут выполнять самые разные функции хранения энергии (крахмал и гликоген), а также структурной поддержки и защиты (целлюлоза и хитин).
Рис. 2.15. Хотя их структура и функции различаются, все полисахаридные углеводы состоят из моносахаридов и имеют химическую формулу (Ch3O) n.зарегистрированный диетолог: ожирение является проблемой для здоровья во всем мире, и многие болезни, такие как диабет и болезни сердца, становятся все более распространенными из-за ожирения.Это одна из причин, почему к зарегистрированным диетологам все чаще обращаются за советом. Зарегистрированные диетологи помогают планировать пищевые продукты и программы питания для людей в различных условиях. Они часто работают с пациентами в медицинских учреждениях, разрабатывая планы питания для профилактики и лечения заболеваний. Например, диетологи могут научить пациента с диабетом контролировать уровень сахара в крови, употребляя в пищу правильные типы и количества углеводов. Диетологи также могут работать в домах престарелых, школах и частных клиниках.
Чтобы стать дипломированным диетологом, нужно получить как минимум степень бакалавра в области диетологии, питания, пищевых технологий или в смежных областях. Кроме того, дипломированные диетологи должны пройти программу стажировки под руководством и сдать национальный экзамен. Те, кто занимается диетологией, проходят курсы по питанию, химии, биохимии, биологии, микробиологии и физиологии человека. Диетологи должны стать экспертами в химии и функциях пищи (белков, углеводов и жиров).
Через призму коренных народов (Сюзанна Вилкерсон и Чарльз Мольнар)
Я работаю в колледже Камосун, расположенном в красивой Виктории, Британская Колумбия, с кампусами на традиционных территориях народов леквунгенов и васаней. Подземная луковица для хранения цветка камас, показанная ниже, была важным источником пищи для многих коренных народов острова Ванкувер и всей западной части Северной Америки. Луковицы камас по-прежнему употребляются в пищу как традиционный источник пищи, и приготовление луковиц камас относится к этому текстовому разделу об углеводах.
Рис. 2.16 Изображение синего цветка камас и насекомого-опылителя. Подземная лампочка камаса запекается в костре. Тепло действует как фермент панкреатическая амилаза и расщепляет длинные цепи неперевариваемого инулина на усвояемые моно- и дисахариды.Чаще всего растения вырабатывают крахмал как запасенную форму углеводов. Некоторые растения, например камас, создают инулин. Инулин используется в качестве пищевых волокон, однако он не усваивается людьми. Если бы вы откусили сырую луковицу камаса, она была бы горькой и имела липкую консистенцию.Метод, используемый коренными народами для приготовления удобоваримых и вкусных камас, заключается в медленном запекании луковиц в течение длительного периода в подземной чаше для костра, покрытой особыми листьями и почвой. Тепло действует как фермент амилаза поджелудочной железы и расщепляет длинные цепи инулина на легкоусвояемые моно- и дисахариды.
Правильно запеченные луковицы камас по вкусу напоминают сочетание печеной груши и вареного инжира. Важно отметить, что, хотя синие камы являются источником пищи, их не следует путать с белыми камасами смерти, которые особенно токсичны и смертельны.Цветки выглядят по-разному, но луковицы очень похожи.
Липиды включают разнообразную группу соединений, объединенных общим признаком. Липиды гидрофобны («водобоязненные») или нерастворимы в воде, потому что они неполярные молекулы. Это потому, что они являются углеводородами, которые включают только неполярные углерод-углеродные или углерод-водородные связи. Липиды выполняют в клетке множество различных функций. Клетки хранят энергию для длительного использования в виде липидов, называемых , жиров .Липиды также обеспечивают изоляцию растений и животных от окружающей среды. Например, они помогают водным птицам и млекопитающим оставаться сухими из-за их водоотталкивающих свойств. Липиды также являются строительными блоками многих гормонов и важной составляющей плазматической мембраны. Липиды включают жиры, масла, воски, фосфолипиды и стероиды.
Рис. 2.17. Гидрофобные липиды в мехе водных млекопитающих, таких как речная выдра, защищают их от непогоды.Молекула жира, такая как триглицерид, состоит из двух основных компонентов — глицерина и жирных кислот.Глицерин — это органическое соединение с тремя атомами углерода, пятью атомами водорода и тремя гидроксильными (–OH) группами. Жирные кислоты имеют длинную цепь углеводородов, к которой присоединена кислая карбоксильная группа, отсюда и название «жирная кислота». Количество атомов углерода в жирной кислоте может составлять от 4 до 36; наиболее распространены те, которые содержат 12–18 атомов углерода. В молекуле жира жирная кислота присоединена к каждому из трех атомов кислорода в -ОН-группах молекулы глицерина ковалентной связью.
Фигура 2.18 Липиды включают жиры, такие как триглицериды, которые состоят из жирных кислот и глицерина, фосфолипидов и стероидов.Во время образования этой ковалентной связи высвобождаются три молекулы воды. Три жирные кислоты в жире могут быть похожими или разными. Эти жиры также называют триглицеридами , потому что они содержат три жирные кислоты. Некоторые жирные кислоты имеют общие названия, указывающие на их происхождение. Например, пальмитиновая кислота, насыщенная жирная кислота, получают из пальмы.Арахидовая кислота получена из Arachis hypogaea , научного названия арахиса.
Жирные кислоты могут быть насыщенными и ненасыщенными. В цепи жирной кислоты, если есть только одинарные связи между соседними атомами углерода в углеводородной цепи, жирная кислота является насыщенной. Насыщенные жирные кислоты насыщены водородом; другими словами, количество атомов водорода, прикрепленных к углеродному скелету, максимально.
Когда углеводородная цепь содержит двойную связь, жирная кислота представляет собой ненасыщенную жирную кислоту .
Большинство ненасыщенных жиров являются жидкими при комнатной температуре и называются маслами . Если в молекуле есть одна двойная связь, то он известен как мононенасыщенный жир (например, оливковое масло), а если имеется более одной двойной связи, то он известен как полиненасыщенный жир (например, масло канолы).
Насыщенные жиры плотно упаковываются и остаются твердыми при комнатной температуре. Животные жиры со стеариновой кислотой и пальмитиновой кислотой, содержащиеся в мясе, и жир с масляной кислотой, содержащиеся в масле, являются примерами насыщенных жиров.Млекопитающие хранят жиры в специализированных клетках, называемых адипоцитами, где жировые шарики занимают большую часть клетки. У растений жир или масло хранятся в семенах и используются в качестве источника энергии во время эмбрионального развития.
Ненасыщенные жиры или масла обычно растительного происхождения и содержат ненасыщенные жирные кислоты. Двойная связь вызывает изгиб или «перегиб», который препятствует плотной упаковке жирных кислот, сохраняя их жидкими при комнатной температуре. Оливковое масло, кукурузное масло, масло канолы и жир печени трески являются примерами ненасыщенных жиров.Ненасыщенные жиры помогают повысить уровень холестерина в крови, тогда как насыщенные жиры способствуют образованию бляшек в артериях, что увеличивает риск сердечного приступа.
В пищевой промышленности масла искусственно гидрогенизируются для придания им полутвердого состояния, что приводит к меньшей порче и увеличению срока хранения. Проще говоря, газообразный водород пропускают через масла, чтобы отвердить их. Во время этого процесса гидрирования двойные связи цис -конформации в углеводородной цепи могут быть преобразованы в двойные связи в транс -конформации.Это образует транс -жир из цис- -жира. Ориентация двойных связей влияет на химические свойства жира.
Рис. 2.19. В процессе гидрогенизации ориентация двойных связей изменяется, в результате чего из цис-жира образуется трансжир. Это изменяет химические свойства молекулы.Маргарин, некоторые виды арахисового масла и шортенинг являются примерами искусственно гидрогенизированных трансжиров транс . Недавние исследования показали, что увеличение содержания транс -жиров в рационе человека может привести к увеличению уровня липопротеинов низкой плотности (ЛПНП) или «плохого» холестерина, что, в свою очередь, может привести к отложению бляшек в организме человека. артерии, что приводит к болезни сердца.Многие рестораны быстрого питания недавно отказались от использования жиров транс и , а на этикетках пищевых продуктов в США теперь требуется указывать содержание жира транс .
Незаменимые жирные кислоты — это жирные кислоты, которые необходимы, но не синтезируются человеческим организмом. Следовательно, их необходимо дополнять с помощью диеты. Омега-3 жирные кислоты попадают в эту категорию и являются одной из двух известных незаменимых жирных кислот для человека (другая — омега-6 жирные кислоты).Они представляют собой тип полиненасыщенных жиров и называются омега-3 жирными кислотами, потому что третий углерод на конце жирной кислоты участвует в двойной связи.
Лосось, форель и тунец являются хорошими источниками жирных кислот омега-3. Жирные кислоты омега-3 важны для работы мозга, нормального роста и развития. Они также могут предотвратить сердечные заболевания и снизить риск рака.
Как и углеводы, жиры получили широкую огласку. Это правда, что чрезмерное употребление жареной и другой «жирной» пищи приводит к увеличению веса.Однако жиры выполняют важные функции. Жиры служат долгосрочным накопителем энергии. Они также обеспечивают изоляцию тела. Поэтому «здоровые» ненасыщенные жиры в умеренных количествах следует употреблять регулярно.
Фосфолипиды являются основным компонентом плазматической мембраны. Как и жиры, они состоят из цепей жирных кислот, прикрепленных к глицерину или подобной основной цепи. Однако вместо трех жирных кислот есть две жирные кислоты, а третий углерод глицериновой цепи связан с фосфатной группой.Фосфатная группа модифицируется добавлением спирта.
Фосфолипид имеет как гидрофобные, так и гидрофильные участки. Цепи жирных кислот гидрофобны и исключают себя из воды, тогда как фосфат гидрофильный и взаимодействует с водой.
Клетки окружены мембраной, которая имеет бислой фосфолипидов. Жирные кислоты фосфолипидов обращены внутрь, вдали от воды, тогда как фосфатная группа может быть обращена либо к внешней среде, либо к внутренней части клетки, которые оба являются водными.
Взгляд коренных народов
Для первых народов Тихоокеанского Северо-Запада богатый жиром рыбный оолиган с 20% жира от веса тела был важной частью рациона нескольких коренных народов. Почему? Поскольку жир является наиболее калорийной пищей, и наличие компактного высококалорийного источника энергии, способного хранить, было бы важным для выживания. Характер жира также сделал его важным товаром. Как и лосось, оолиган возвращается в свое русло после долгих лет в море. Его прибытие ранней весной сделало его первым свежим продуктом в году.В цимшианских языках прибытие оолигана… традиционно объявлялось криком «Хлаа ат’иксши халимутхв!»… Что означало: «Наш Спаситель только что прибыл!»
Рис. 2.20 Изображение приготовленного оолигана. Эта жирная рыба с содержанием жира 20% от веса тела является важной частью диеты коренных народов.Как вы уже узнали, все жиры гидрофобны (ненавидят воду). Чтобы отделить жир, рыбу отваривают, а плавающий жир снимают. Жировой состав улигана состоит из 30% насыщенных жиров (например, сливочного масла) и 55% мононенасыщенных жиров (например, растительных масел).Важно отметить, что это твердая смазка при комнатной температуре. Поскольку в нем мало полиненасыщенных жиров (которые быстро окисляются и портятся), его можно хранить для дальнейшего использования и использовать в качестве предмета торговли. Считается, что его состав делает его таким же полезным, как оливковое масло, или лучше, поскольку он содержит жирные кислоты омега-3, которые снижают риск диабета и инсульта. Он также богат тремя жирорастворимыми витаминами A, E и K.
Стероиды и воски
В отличие от фосфолипидов и жиров, рассмотренных ранее, стероиды имеют кольцевую структуру.Хотя они не похожи на другие липиды, они сгруппированы с ними, потому что они также гидрофобны. Все стероиды имеют четыре связанных углеродных кольца, а некоторые из них, как и холестерин, имеют короткий хвост.
Холестерин — стероид. Холестерин в основном синтезируется в печени и является предшественником многих стероидных гормонов, таких как тестостерон и эстрадиол. Он также является предшественником витаминов Е и К. Холестерин является предшественником солей желчных кислот, которые помогают в расщеплении жиров и их последующем усвоении клетками.Хотя о холестерине часто говорят отрицательно, он необходим для правильного функционирования организма. Это ключевой компонент плазматических мембран клеток животных.
Воски состоят из углеводородной цепи со спиртовой (–OH) группой и жирной кислотой. Примеры восков животного происхождения включают пчелиный воск и ланолин. У растений также есть воск, например покрытие на листьях, которое помогает предотвратить их высыхание.
Концепция в действии
Чтобы получить дополнительную информацию о липидах, изучите «Биомолекулы: Липиды» с помощью этой интерактивной анимации.
Белки являются одной из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Функции белков очень разнообразны, потому что существует 20 различных химически различных аминокислот, которые образуют длинные цепи, и аминокислоты могут быть в любом порядке. Например, белки могут функционировать как ферменты или гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно являются белками. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Ферменты могут разрушать молекулярные связи, переупорядочивать связи или образовывать новые связи.Примером фермента является амилаза слюны, которая расщепляет амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно белки или стероиды, секретируемые эндокринной железой или группой эндокринных клеток, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который поддерживает уровень глюкозы в крови.
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу.Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации (более подробно это будет обсуждаться позже). Все белки состоят из 20 одних и тех же аминокислот по-разному.
Аминокислоты — это мономеры, из которых состоят белки.Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, связанного с аминогруппой (–NH 2 ), карбоксильной группы (–COOH) и атома водорода. Каждая аминокислота также имеет другой вариабельный атом или группу атомов, связанных с центральным атомом углерода, известную как группа R. Группа R — единственное различие в структуре между 20 аминокислотами; в остальном аминокислоты идентичны.
Рис. 2.21. Аминокислоты состоят из центрального углерода, связанного с аминогруппой (–Nh3), карбоксильной группой (–COOH) и атомом водорода.Четвертая связь центрального углерода варьируется среди различных аминокислот, как видно из этих примеров аланина, валина, лизина и аспарагиновой кислоты.Химическая природа группы R определяет химическую природу аминокислоты в ее белке (то есть, является ли она кислотной, основной, полярной или неполярной).
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации.Карбоксильная группа одной аминокислоты и аминогруппа второй аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь.
Продукты, образованные такой связью, называются полипептидами . Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, имеют различную форму и имеют уникальную функцию.
Эволюция в действии
Эволюционное значение цитохрома c Цитохром c является важным компонентом молекулярного механизма, который собирает энергию из глюкозы. Поскольку роль этого белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительное сходство последовательностей между молекулами цитохрома с разных видов; эволюционные отношения можно оценить путем измерения сходства или различий между белковыми последовательностями различных видов.
Например, ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с, которая к настоящему времени была секвенирована у разных организмов, 37 из этих аминокислот находятся в одном и том же положении в каждом цитохроме с. Это указывает на то, что все эти организмы произошли от общего предка. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. При сравнении последовательностей человека и макаки-резуса было обнаружено единственное различие в одной аминокислоте.Напротив, сравнение человека и дрожжей показывает разницу в 44 аминокислотах, предполагая, что люди и шимпанзе имеют более недавнего общего предка, чем люди и макака-резус или люди и дрожжи.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный .
Уникальная последовательность и количество аминокислот в полипептидной цепи — это ее первичная структура. Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Любое изменение в последовательности гена может привести к добавлению другой аминокислоты к полипептидной цепи, вызывая изменение структуры и функции белка. При серповидно-клеточной анемии β-цепь гемоглобина имеет единственную аминокислотную замену, вызывающую изменение как структуры, так и функции белка.Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Таким образом, молекула содержит около 600 аминокислот. Структурное различие между нормальной молекулой гемоглобина и молекулой серповидных клеток, которое резко снижает продолжительность жизни у пораженных людей, состоит в одной из 600 аминокислот.
Из-за этого изменения одной аминокислоты в цепи обычно двояковогнутые или дискообразные эритроциты принимают форму полумесяца или «серпа», что закупоривает артерии.Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Образцы сворачивания, возникающие в результате взаимодействий между частями аминокислот, не относящихся к R-группам, приводят к вторичной структуре белка. Наиболее распространены альфа (α) -спиральные и бета (β) -пластинчатые листовые структуры. Обе структуры удерживаются в форме водородными связями. В альфа-спирали связи образуются между каждой четвертой аминокислотой и вызывают поворот аминокислотной цепи.
В β-складчатом листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки. Гофрированные сегменты выровнены параллельно друг другу, а водородные связи образуются между одинаковыми парами атомов на каждой из выровненных аминокислот. Структуры α-спирали и β-складчатых листов обнаруживаются во многих глобулярных и волокнистых белках.
Уникальная трехмерная структура полипептида известна как его третичная структура.Эта структура вызвана химическим взаимодействием между различными аминокислотами и участками полипептида. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Могут быть ионные связи, образованные между группами R на разных аминокислотах, или водородные связи, помимо тех, которые участвуют во вторичной структуре. Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи.Первые типы взаимодействий также известны как гидрофобные взаимодействия.
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, гемоглобин представляет собой комбинацию четырех полипептидных субъединиц.
Рис. 2.22 На этих иллюстрациях можно увидеть четыре уровня белковой структуры.Каждый белок имеет свою уникальную последовательность и форму, удерживаемую химическими взаимодействиями.Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв свою форму в результате так называемой денатурации , как обсуждалось ранее. Денатурация часто обратима, поскольку первичная структура сохраняется, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Один из примеров денатурации белка можно увидеть, когда яйцо жарят или варят.Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду, превращаясь из прозрачного вещества в непрозрачное белое вещество. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, которые адаптированы для работы при этих температурах.
Концепция в действии
Чтобы получить дополнительную информацию о белках, изучите «Биомолекулы: Белки» с помощью этой интерактивной анимации.
Нуклеиновые кислоты являются ключевыми макромолекулами в непрерывности жизни.Они несут генетический план клетки и несут инструкции для функционирования клетки.
Двумя основными типами нуклеиновых кислот являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК) . ДНК — это генетический материал, содержащийся во всех живых организмах, от одноклеточных бактерий до многоклеточных млекопитающих.
Другой тип нуклеиновой кислоты, РНК, в основном участвует в синтезе белка. Молекулы ДНК никогда не покидают ядро, а вместо этого используют посредника РНК для связи с остальной частью клетки.Другие типы РНК также участвуют в синтезе белка и его регуляции.
ДНК и РНК состоят из мономеров, известных как нуклеотидов . Нуклеотиды объединяются друг с другом с образованием полинуклеотида, ДНК или РНК. Каждый нуклеотид состоит из трех компонентов: азотистого основания, пентозного (пятиуглеродного) сахара и фосфатной группы. Каждое азотистое основание в нуклеотиде присоединено к молекуле сахара, которая присоединена к фосфатной группе.
Рис. 2.23. Нуклеотид состоит из трех компонентов: азотистого основания, пентозного сахара и фосфатной группы. ДНКимеет двойную спиральную структуру. Он состоит из двух цепей или полимеров нуклеотидов. Нити образованы связями между фосфатными и сахарными группами соседних нуклеотидов. Нити связаны друг с другом в своих основаниях водородными связями, и нити наматываются друг на друга по своей длине, отсюда и описание «двойной спирали», что означает двойную спираль.
Рис. 2.24. Химическая структура ДНК с цветной меткой, обозначающей четыре основания, а также фосфатный и дезоксирибозный компоненты основной цепи.Чередующиеся сахарные и фосфатные группы лежат на внешней стороне каждой цепи, образуя основу ДНК. Азотистые основания сложены внутри, как ступени лестницы, и эти основания соединяются в пару; пары связаны друг с другом водородными связями. Основания спариваются таким образом, чтобы расстояние между скелетами двух цепей было одинаковым по всей длине молекулы. Правило состоит в том, что нуклеотид A соединяется с нуклеотидом T, а G — с C, см. Раздел 9.1 для более подробной информации.
Живые существа основаны на углероде, потому что углерод играет такую важную роль в химии живых существ. Четыре позиции ковалентной связи атома углерода могут дать начало широкому разнообразию соединений с множеством функций, что объясняет важность углерода для живых существ. Углеводы — это группа макромолекул, которые являются жизненно важным источником энергии для клетки, обеспечивают структурную поддержку многих организмов и могут быть обнаружены на поверхности клетки в качестве рецепторов или для распознавания клеток.Углеводы классифицируются как моносахариды, дисахариды и полисахариды, в зависимости от количества мономеров в молекуле.
Липиды — это класс макромолекул, которые по своей природе неполярны и гидрофобны. Основные типы включают жиры и масла, воски, фосфолипиды и стероиды. Жиры и масла являются запасенной формой энергии и могут включать триглицериды. Жиры и масла обычно состоят из жирных кислот и глицерина.
Белки — это класс макромолекул, которые могут выполнять широкий спектр функций для клетки.Они помогают метаболизму, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков являются аминокислоты. Белки организованы на четырех уровнях: первичный, вторичный, третичный и четвертичный. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры, pH или химического воздействия, может привести к денатурации белка и потере функции.
Нуклеиновые кислоты — это молекулы, состоящие из повторяющихся единиц нуклеотидов, которые управляют клеточной деятельностью, такой как деление клеток и синтез белка.Каждый нуклеотид состоит из пентозного сахара, азотистого основания и фосфатной группы. Есть два типа нуклеиновых кислот: ДНК и РНК.
аминокислота: мономер протеина
углевод: биологическая макромолекула, в которой соотношение углерода, водорода и кислорода составляет 1: 2: 1; углеводы служат источниками энергии и структурной поддержкой в клетках
целлюлоза: полисахарид, который составляет клеточные стенки растений и обеспечивает структурную поддержку клетки
хитин: вид углеводов, образующих внешний скелет членистоногих, таких как насекомые и ракообразные, и клеточные стенки грибов.
денатурация: потеря формы белка в результате изменений температуры, pH или воздействия химических веществ
дезоксирибонуклеиновая кислота (ДНК): двухцепочечный полимер нуклеотидов, несущий наследственную информацию клетки
дисахарид: два мономера сахара, которые связаны между собой пептидной связью
фермент : катализатор биохимической реакции, который обычно представляет собой сложный или конъюгированный белок
жир: липидная молекула, состоящая из трех жирных кислот и глицерина (триглицерида), которая обычно существует в твердой форме при комнатной температуре
гликоген: запасной углевод у животных
гормон: химическая сигнальная молекула, обычно белок или стероид, секретируемая эндокринной железой или группой эндокринных клеток; действия по контролю или регулированию определенных физиологических процессов
липиды: класс макромолекул, неполярных и нерастворимых в воде
Макромолекула : большая молекула, часто образованная полимеризацией более мелких мономеров
моносахарид: отдельная единица или мономер углеводов
нуклеиновая кислота: биологическая макромолекула, которая несет генетическую информацию клетки и несет инструкции для функционирования клетки
нуклеотид: мономер нуклеиновой кислоты; содержит пентозный сахар, фосфатную группу и азотистое основание
масло: ненасыщенный жир, являющийся жидкостью при комнатной температуре
фосфолипид: основной компонент мембран клеток; состоит из двух жирных кислот и фосфатной группы, присоединенной к основной цепи глицерина
полипептид: длинная цепь аминокислот, связанных пептидными связями
полисахарид: длинная цепь моносахаридов; могут быть разветвленными и неразветвленными
белок: биологическая макромолекула, состоящая из одной или нескольких цепочек аминокислот
рибонуклеиновая кислота (РНК): одноцепочечный полимер нуклеотидов, участвующий в синтезе белка
насыщенная жирная кислота: длинноцепочечный углеводород с одинарными ковалентными связями в углеродной цепи; количество атомов водорода, прикрепленных к углеродному скелету, максимально
крахмал: запасной углевод в растениях
стероид: тип липида, состоящего из четырех конденсированных углеводородных колец
транс-жиры: форма ненасыщенного жира с атомами водорода, соседствующими с двойной связью напротив друг друга, а не на одной стороне двойной связи
триглицерид: молекула жира; состоит из трех жирных кислот, связанных с молекулой глицерина
ненасыщенная жирная кислота: длинноцепочечный углеводород, имеющий одну или несколько двойных связей в углеводородной цепи
Атрибуция в СМИ
Конструирование белковых ансамблей с аллостерическим контролем посредством кратковременного переключения мономеров
Марш, Дж. А. и Тайхманн, С. А. Структура, динамика, сборка и эволюция белковых комплексов. Annu. Rev. Biochem. 84 , 551–575 (2015).
CAS PubMed Статья Google Scholar
Раманатан, А., Савол, А., Бургер, В., Ченнубхотла, С. С. и Агарвал, П. К. Конформационные популяции белков и функционально значимые подсостояния. В соотв. Chem. Res. 47 , 149–156 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Matthews, J. M. & Sunde, M. Димеры, олигомеры, повсюду. Adv. Exp. Med. Биол. 747 , 1–18 (2012).
CAS PubMed Статья Google Scholar
Леви, Э. Д., Перейра-Леал, Дж. Б., Чотиа, К. и Тейхманн, С. А. Трехмерный комплекс: структурная классификация белковых комплексов. PLoS Comput. Биол. 2 , e155 (2006).
ADS PubMed PubMed Central Статья CAS Google Scholar
Луо, К., Хоу, К., Бай, Ю., Ван, Р., Лю, Дж. Сборка белка: универсальные подходы к созданию высокоупорядоченных наноструктур. Chem. Ред. 116 , 13571–13632 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Питерс, Б. Дж., Ван Элдейк, М. Б., Нолте, Р. Дж. И Мецинович, Дж. Природные супрамолекулярные белковые сборки. Chem. Soc. Ред. 45 , 24–39 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Liu, J. et al. Катушка с семью спиралями. Proc. Natl Acad. Sci. США 103 , 15457–15462 (2006).
ADS CAS PubMed Статья Google Scholar
Лай, Ю. Т., Касио, Д. и Йейтс, Т. О. Структура клетки размером 16 нм, сконструированной с использованием белковых олигомеров. Наука 336 , 1129 (2012).
ADS CAS PubMed Статья Google Scholar
Sciore, A. et al. Гибкий, ориентированный на симметрию подход к сборке белковых клеток. Proc. Natl Acad. Sci. США 113 , 8681–8686 (2016).
CAS PubMed Статья Google Scholar
Lai, Y. T. et al. Проектирование и определение динамических наноустройств белковой клетки в растворе. Sci. Adv. 2 , e1501855 (2016).
ADS PubMed PubMed Central Статья CAS Google Scholar
Леви, Д. и Тейхманн, С. Структурные, эволюционные и сборочные принципы олигомеризации белков. Прог. Мол. Биол. Пер. Sci. 117 , 25–51 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Луо, Дж., Лю, З., Го, Й. и Ли, М. Структурное рассечение больших контактов упаковки белок-белковый кристалл. Sci. Отчет 5 , 14214 (2015).
ADS CAS PubMed PubMed Central Статья Google Scholar
Grueninger, D. et al.Сконструированная белок-белковая ассоциация. Наука 319 , 206–209 (2008).
ADS CAS PubMed Статья PubMed Central Google Scholar
Stranges, P. B., Machius, M., Miley, M. J., Tripathy, A. & Kuhlman, B. Вычислительный дизайн симметричного гомодимера с использованием сборки бета-цепей. Proc. Natl Acad. Sci. США 108 , 20562–20567 (2011).
ADS CAS PubMed Статья PubMed Central Google Scholar
Hsia, Y. et al. Конструкция гиперстабильного белкового икосаэдра из 60 субъединиц. Nature 535 , 136–139 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
King, N.P. et al. Точная конструкция совместной сборки многокомпонентных белковых наноматериалов. Природа 510 , 103–108 (2014).
ADS CAS PubMed PubMed Central Статья Google Scholar
Bale, J. B. et al. Точный дизайн двухкомпонентных икосаэдрических белковых комплексов мегадальтонного масштаба. Наука 353 , 389–394 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Votteler, J. et al. Сконструированные белки индуцируют образование внеклеточных везикул, содержащих наноклетку. Природа 540 , 292–295 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Бай, Ю., Луо, К. и Лю, Дж. Самосборка белка с помощью супрамолекулярных стратегий. Chem. Soc. Ред. 45 , 2756–2767 (2016).
CAS PubMed Статья Google Scholar
Хэмли, И. В. Белковые сборки: вдохновленные природой и созданные наноструктуры. Биомакромолекулы 20 , 1829–1848 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Brodin, J. D. et al. Металл-управляемая, химически настраиваемая сборка одно-, двух- и трехмерных массивов кристаллических белков. Нац. Chem. 4 , 375–382 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Salgado, E. N. et al. Металлический шаблон интерфейсов с белками. Proc. Natl Acad. Sci. США 107 , 1827–1832 (2010).
ADS CAS PubMed Статья PubMed Central Google Scholar
Carlson, J. C. et al. Химически контролируемая самосборка белковых наноколец. J. Am. Chem. Soc. 128 , 7630–7638 (2006).
CAS PubMed Статья PubMed Central Google Scholar
Медина-Моралес, А., Перес, А., Бродин, Дж. Д. и Тезкан, Ф. А. Самосборка Zn-связывающего белка криптанда in vitro и клеточная самосборка посредством шаблонных дисульфидных связей. J. Am. Chem. Soc. 135 , 12013–12022 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Bai, Y. et al. Высокоупорядоченные белковые нанокольца, созданные путем точного контроля самосборки глутатиона S -трансферазы. J. Am. Chem. Soc. 135 , 10966–10969 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Бродин, Дж. Д., Карр, Дж. Р., Сонц, П. А. и Тезкан, Ф. А. Исключительно стабильные, окислительно-восстановительные супрамолекулярные белковые сборки с эмерджентными свойствами. Proc. Natl Acad. Sci. США 111 , 2897–2902 (2014).
ADS CAS PubMed Статья PubMed Central Google Scholar
Хуард, Д. Дж., Кейн, К. М. и Тезкан, Ф. А. Реконструкция границ раздела белков дает индуцируемую медью ферритиновую клетку. Нац. Chem. Биол. 9 , 169 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Suzuki, Y. et al. Самосборка когерентно динамических ауксетических двумерных кристаллов белка. Природа 533 , 369 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Черчфилд, Л. А., Медина-Моралес, А., Бродин, Дж. Д., Перес, А. и Тезкан, Ф. А. Разработка de novo сборки аллостерических металлопротеинов с напряженными дисульфидными связями. J. Am. Chem. Soc. 138 , 13163–13166 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Черчфилд, Л. А., Альберштейн, Р. Г., Уильямсон, Л. М. и Тезкан, Ф. А. Определение структурной и энергетической основы аллостерии в созданной de novo сборке металлопротеинов. J. Am. Chem. Soc. 140 , 10043–10053 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Мурзин А.Г. Биохимия. Метаморфические белки. Наука 320 , 1725–1726 (2008).
CAS PubMed Статья PubMed Central Google Scholar
Брайан П. Н. и Орбан Дж.Белки, переключающие складки. Curr. Opin. Struct. Биол. 20 , 482–488 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Дишман, А. Ф. и Фолькман, Б. Ф. Раскрытие тайн белкового метаморфоза. ACS Chem. Биол. 13 , 1438–1446 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Mitrea, D. M. & Kriwacki, R. W. Регулирует разворачивание белков при передаче сигналов. FEBS Lett. 587 , 1081–1088 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Chang, Y. G. et al. Циркадные ритмы. Переключатель сворачивания белка присоединяет циркадный осциллятор к выходным часам у цианобактерий. Наука 349 , 324–328 (2015).
ADS CAS PubMed PubMed Central Статья Google Scholar
Tuinstra, R. L. et al. Взаимопревращение двух неродственных белковых складок в нативном состоянии лимфотактина. Proc. Natl Acad. Sci. США 105 , 5057–5062 (2008).
ADS CAS PubMed Статья PubMed Central Google Scholar
Ха, Дж. Х. и Ло, С. Н. Конформационные переключатели белков: от природы к дизайну. Химия 18 , 7984–7999 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Ха, Дж. Х., Карчин, Дж. М., Уокер-Копп, Н., Кастанеда, К. А. и Ло, С. Н. Сконструированная подмена домена в качестве переключателя включения / выключения функции белка. Chem. Биол. 22 , 1384–1393 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Джексон, С. Э. и Фершт, А. Р. Сворачивание ингибитора химотрипсина 2. 1. Доказательства перехода между двумя состояниями. Биохимия 30 , 10428–10435 (1991).
CAS PubMed Статья PubMed Central Google Scholar
Ефимов А.В. Структурные деревья суперсемейств белков. Белки 28 , 241–260 (1997).
CAS PubMed Статья PubMed Central Google Scholar
Макфален, К. А. и Джеймс, М. Н. Кристаллическая и молекулярная структура ингибитора сериновой протеиназы CI-2 из семян ячменя. Биохимия 26 , 261–269 (1987).
CAS PubMed Статья Google Scholar
Kulkarni, P. et al. Структурный метаморфизм и полиморфизм белков на грани термодинамической стабильности. Prot. Sci. 27 , 1557–1567 (2018).
CAS Статья Google Scholar
Портер, Л. и Лугер, Л.L. Существующие белки с переключением складок широко распространены. Proc. Natl Acad. Sci. США 201800168, https://doi.org/10.1073/pnas.1800168115 (2018).
CAS Статья Google Scholar
Ambroggio, X. I. & Kuhlman, B. Вычислительный дизайн единственной аминокислотной последовательности, которая может переключаться между двумя отдельными белковыми складками. J. Am. Chem. Soc. 128 , 1154–1161 (2006).
CAS PubMed Статья PubMed Central Google Scholar
Александр, П. А., Хе, Ю., Чен, Ю., Орбан, Дж. И Брайан, П. Н. Код минимальной последовательности для переключения структуры и функции белка. Proc. Natl Acad. Sci. США 106 , 21149–21154 (2009).
ADS CAS PubMed Статья Google Scholar
Муньос, В., Кампос, Л. А. и Садки, М. Ограниченная кооперативность в сворачивании белков. Curr. Opin. Struct. Биол. 36 , 58–66 (2016).
PubMed Статья CAS PubMed Central Google Scholar
Shen, Y. et al. Построение согласованной слепой структуры белка по данным химического сдвига ЯМР. Proc. Natl Acad. Sci. США 105 , 4685–4690 (2008).
ADS CAS PubMed Статья Google Scholar
Thorolfsson, M. et al. Связывание l-фенилаланина и организация домена в фенилаланингидроксилазе человека: исследование дифференциальной сканирующей калориметрии. Биохимия 41 , 7573–7585 (2002).
CAS PubMed Статья PubMed Central Google Scholar
Уидер, Г. и Вутрих, К. Спектроскопия ЯМР больших молекул и многомолекулярных ансамблей в растворе. Curr. Opin. Struct. Биол. 9 , 594–601 (1999).
CAS PubMed Статья Google Scholar
Hoersch, D., Roh, S.H., Chiu, W. & Kortemme, T. Перепрограммирование белковой машины, управляемой АТФ, в светозависимую наноклетку. Нац. Nanotechnol. 8 , 928–932 (2013).
ADS CAS PubMed PubMed Central Статья Google Scholar
Radisky, E. S., Lu, C. J., Kwan, G. & Koshland, D. E. Jr. Роль внутримолекулярной сети водородных связей в ингибирующей способности ингибитора химотрипсина 2. Биохимия 44 , 6823–6830 (2005).
CAS PubMed Статья PubMed Central Google Scholar
Муньос В. и Серрано Л. Предрасположенность аминокислот к внутренней вторичной структуре с использованием статистических матриц ϕ – ψ: сравнение с экспериментальными масштабами. Белки 20 , 301–311 (1994).
PubMed Статья PubMed Central Google Scholar
Рик В., Бергмейер Х.-У., Гауэн К., Лунд П. и Уильямсон Д. в «Методы ферментативного анализа» (изд. Бергмейер, Х.-У.) (Academic Press, 1974) .
Schuck, P. & Rossmanith, P. Определение распределения коэффициента седиментации с помощью моделирования границ методом наименьших квадратов. Биополимеры 54 , 328–341 (2000).
CAS PubMed Статья PubMed Central Google Scholar
Лауэ, Т. М., Шах, Б. Д., Риджуэй, Т. М. и Пеллетье С. Л. в Аналитическое ультрацентрифугирование в биохимии и науке о полимерах, (редакторы Harding, S. E., Rowe A. J. и Horton J. C.) (Королевское химическое общество, 1992).
Гарсиа де ла Торре, Дж., Льорка, О., Карраскоса, Дж. Л. и Валпуэста, Дж. М. ГИДРОМИКА: прогнозирование гидродинамических свойств жестких макромолекулярных структур, полученных из изображений электронной микроскопии. Eur. Биофиз. Дж. 30 , 457–462 (2001).
CAS PubMed Статья PubMed Central Google Scholar
Фолта-Стогнев, Э. и Уильямс, К. Р. Определение молекулярных масс белков в растворе: Внедрение эксклюзионной хроматографии ВЭЖХ и услуги по рассеянию лазерного света в основной лаборатории. J. Biomol. Tech. 10 , 51–63 (1999).
CAS PubMed PubMed Central Google Scholar
Холоденко В. и Фрейре Е. Простой метод измерения абсолютной теплоемкости белков. Анал. Biochem. 270 , 336–338 (1999).
CAS PubMed Статья PubMed Central Google Scholar
Бэтти, Т. Г., Контогианнис, Л., Джонсон, О., Пауэлл, Х. Р. и Лесли, А. Г. iMOSFLM: новый графический интерфейс для обработки дифракционных изображений с помощью MOSFLM. Acta Crystallogr.Д. 67 , 271–281 (2011).
CAS PubMed Статья PubMed Central Google Scholar
Эванс, П. Р. Введение в обработку данных: определение пространственных групп, масштабирование и статистика интенсивности. Acta Crystallogr. Д. 67 , 2011, 282–292.
CAS PubMed Статья PubMed Central Google Scholar
Вагин А. и Тепляков А. МОЛРЕП: автоматизированная программа для молекулярного замещения. J. Appl. Кристаллогр. 30 , 1022–1025 (1997).
CAS Статья Google Scholar
Муршудов Г. Н., Вагин А. А., Додсон Э. Дж. Уточнение макромолекулярных структур методом максимального правдоподобия. Acta Crystallogr. Д 53 , 240–255 (1997).
CAS PubMed Статья PubMed Central Google Scholar
Adams, P. D. et al. PHENIX: комплексная система на основе Python для решения макромолекулярных структур. Acta Crystallogr. Д. 66 , 213–221 (2010).
CAS PubMed Central Статья Google Scholar
Эмсли П., Локамп Б., Скотт В. Г. и Коутан К. Особенности и развитие Coot. Acta Crystallogr D. 66 , 486–501 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Li, X. et al. Подсчет электронов и коррекция движения, индуцированного пучком, позволяют получать крио-ЭМ одиночных частиц с разрешением, близким к атомному. Нац. Методы 10 , 584–590 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Роху, А. и Григорьев, Н. CTFFIND4: Быстрая и точная оценка расфокусировки по электронным микрофотографиям. J. Struct. Биол. 192 , 216–221 (2015).
PubMed PubMed Central Статья Google Scholar
De la Rosa-Trevin, J. M. et al. Scipion: программная среда для интеграции, воспроизводимости и валидации в трехмерной электронной микроскопии. J. Struct. Биол. 195 , 93–99 (2016).
PubMed Статья PubMed Central Google Scholar
Киманиус, Д., Форсберг, Б. О., Шерес, С. Х. и Линдал, Э. Ускоренное определение крио-ЭМ структуры с распараллеливанием с использованием графических процессоров в RELION-2. Элиф 5 , e18722 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Шерес, С. Х. РЕЛИОН: реализация байесовского подхода к определению крио-ЭМ структуры. J. Struct. Биол. 180 , 519–530 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Pettersen, E. F. et al. UCSF Chimera — система визуализации для поисковых исследований и анализа. J. Comput. Chem. 25 , 1605–1612 (2004).
CAS PubMed Статья PubMed Central Google Scholar
De la Rosa-Trevin, J. M. et al. Xmipp 3.0: улучшенный программный пакет для обработки изображений в электронной микроскопии. J. Struct. Биол. 184 , 321–328 (2013).
PubMed Статья PubMed Central Google Scholar
Delaglio, F. et al. NMRPipe: система многомерной спектральной обработки, основанная на конвейерах UNIX. J. Biomol. ЯМР 6 , 277–293 (1995).
CAS PubMed Статья PubMed Central Google Scholar
Гаррет, Д. С., Пауэрс, Р., Гроненборн, А. М. и Клор, Г. М. Подход, основанный на здравом смысле, к выделению пиков в двух-, трех- и четырехмерных спектрах с использованием автоматического компьютерного анализа контурных диаграмм. J. Magn. Res. 213 , 357–363 (2011).
ADS CAS Статья Google Scholar
Годдард Т. и Кнеллер Д. Г. SPARKY 3 (Калифорнийский университет, Сан-Франциско).
Долинский, Т. Дж., Нильсен, Дж. Э., Маккаммон, Дж. А. и Бейкер, Н. А. PDB2PQR: автоматизированный конвейер для установки электростатических расчетов Пуассона – Больцмана. Nucleic Acids Res. 32 , W665 – W667 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Пиана, С., Линдорф-Ларсен, К. и Шоу, Д. Э. Насколько надежны моделирование сворачивания белка в отношении параметризации силового поля? Biophys.J. 100 , L47 – L49 (2011).
CAS PubMed PubMed Central Статья Google Scholar
DiMaio, F. et al. Модели с атомной точностью по данным криоэлектронной микроскопии 4.5-A с итеративным локальным уточнением на основе плотности. Нац. Методы 12 , 361–365 (2015).
CAS PubMed PubMed Central Статья Google Scholar
ДиМайо Ф., Ливер-Фэй А., Брэдли П., Бейкер Д. и Андре И. Моделирование симметричных макромолекулярных структур в Rosetta3. PLoS ONE 6 , e20450 (2011).
ADS CAS PubMed PubMed Central Статья Google Scholar
Когда мономер не является мономером? Три основных способа олигомеризации вашего любимого флуоресцентного белка в клетках
Этот пост предоставил приглашенный блоггер Эрик Л.Снэпп.
Прекратите использовать EGFP / GFP для гибридных белков! Несмотря на многочисленные исследования, опубликованные в известных журнальных статьях, многие исследователи не знают, что EGFP / GFP склонен к образованию нековалентных димеров. Это свойство EGFP может приводить к значительным артефактам.
Если вы используете зеленый флуоресцентный белок или усиленный зеленый флуоресцентный белок (GFP / EGFP) для репортера транскрипции или в качестве общей цитоплазматической метки клеток, проблем нет. Ты в порядке. Однако, если вы объединяете интересующий белок (POI) с GFP для изучения поведения белка в клетках, растворе или чем-то промежуточном, вы используете тег с серьезным недостатком.Стандартная плазмида EGFP, которая раньше продавалась Clontech и находится в морозильной камере практически в каждой лаборатории в мире, не является инертной. Если серьезно, то EGFP / GFP имеет действительно нетривиальную склонность к нековалентной димеризации. Это означает, что ваш POI, слитый с GFP или другим флуоресцентным белком (FP), может образовывать димеры в клетках. Почему тебе должно быть до этого дело? Ниже перечислены три простых способа, которыми димерный FP может испортить вам день (и эксперимент). Ниже приведены решения, позволяющие избежать этих слишком распространенных проблем.
Это вопрос концентрации
Большинство FP в природе склонны к димеризации (т.е. EGFP) [1, 2] или даже образуют облигатные тетрамеры (т.е. DsRed) [3]. Это проблема гибридных белков. Одним из основных приложений FP является визуализация локализации, динамики и поведения POI. Как исследователь, вы хотите, чтобы тег слияния был инертным, чтобы в ваших экспериментах не возникали артефакты. Значительные усилия были направлены на то, чтобы сделать ФП мономерными, однако многие исследователи по-прежнему игнорируют димеризацию ФП. Не менее проблематично то, что некоторые мономерные FP, как сообщается, на самом деле не являются мономерными, по крайней мере, с практической точки зрения.Склонность конкретного типа молекулы к образованию димера зависит от его молекулярного сродства, называемого константой диссоциации, или K d , и его концентрации. Чем меньше K d , тем больше вероятность взаимодействия молекул определенного типа. Белок с наномолярным K d будет существовать в основном в виде димера в клетках, в то время как белок с высоким микромолярным или низким миллимолярным K d вряд ли будет образовывать димеры в клетке. K d EGFP составляет 0,11 мМ [2]. Следуя простой логике, изложенной выше, вы можете подумать, что EGFP вряд ли образует димеры в клетке. К сожалению, не все так просто.
Концентрация — это количество молекул в объеме. Во многих ситуациях биологических исследований релевантным объемом является клетка. Для точного предсказания физического поведения, связанного с концентрацией молекулы, предполагается, что молекулы равномерно распределены по всему объему и могут свободно опрокидываться под углом 720 °.Однако, если молекулы ограничены подобластью клетки и / или они не могут опрокинуться под углом 720 °, т.е. они находятся на мембране или в органелле, то их эффективная концентрация будет намного выше, чем если бы они были однородно распределены и подвижны. по всей камере. Если две копии молекулы являются частью одного слитого белка, как в биосенсоре FRET, то локальная концентрация FP вокруг этого слитого белка очень высока. Реальные примеры таких ситуаций в ячейках описаны ниже (см. Рисунок 1).
1. Трансмембранные флуоресцентные белки слияния
Трансмембранные белки, то есть рецепторы и переносчики, интегрированы в липидные бислои. Слияние FP с трансмембранным белком значительно увеличивает эффективную концентрацию FP. FP ограничен плоскостью и обычно вращается только на 360 °, увеличивая вероятность столкновения двух FP. Последствия могут быть драматичными. Для мембранного POI, локализованного в эндоплазматическом ретикулуме, обычно похожий на паутинку рисунок канальцев может быть сильно искажен в плотно уложенные друг на друга мембраны, называемые организованным гладким эндоплазматическим ретикулумом или OSER, если димеризующийся FP сливается с POI.Эти структуры большие (микроны), яркие, нефизиологические, и их трудно игнорировать [1, 2].
2. Слияние с облигатным димером или олигомером
Некоторые клеточные белки обычно самоассоциируются в гомодимеры или даже олигомеры более высокого порядка. К сожалению, димеризация FP в сочетании с димеризацией POI может привести к полимеризации слитого белка. Димерный слитый белок будет иметь два связывающих домена FP, образующих строительный блок, достаточный для образования зародыша полимера по мере увеличения концентрации слитого белка.Полимеризованные гибридные белки, которые образуются в результате, часто неправильно локализуются и могут неправильно функционировать.
3. Включение в биосенсор FRET
Биосенсор FRET — это репортер, который претерпевает конформационные изменения, чтобы сблизить или раздвинуть два FP на одном белке. Изменения расстояния изменяют способность одного FP безызлучательно передавать энергию второму FP, часто уменьшая флуоресцентный сигнал от первого FP и увеличивая сигнал от второго FP.Несколько ранних биосенсоров FRET были сделаны с CFP и YFP, голубыми и желтыми вариантами EGFP, одинаково способными к димеризации, как и EGFP. В результате димеры CFP и YFP могут образовываться в отсутствие изменений окружающей среды, которые биосенсор должен обнаруживать, что приводит к ложноположительным результатам [2, 4].
Решения полимерной проблемы
Есть несколько простых решений, доступных исследователям для решения всех этих проблем. Самое простое и лучшее решение — использовать действительно мономерные ФП.EGFP и другие члены семейства GFP (superfolder, Emerald, CFP, YFP, BFP, Cerulean, Turquoise, Venus и Citrine) могут быть мономеризованы с помощью мутации A206K [2]. Addgene имеет много таких конструкций, и они обозначаются как mGFP, mVenus и т. Д. Требуется предостережение, потому что FP, не производные от GFP, то есть красные FP, не обязательно являются мономерными, даже если они были описаны как мономерные в публикации. Золотым стандартом в анализах, используемых для определения мономерной принадлежности белка, является аналитическое ультрацентрифугирование седиментационного равновесия [2].Некоторые анализы аффинности, используемые в статьях, описывающих указанные выше FP, в том числе колонки для определения размеров молекул и нативные гели, не позволяют обнаружить димеризацию EGFP. Важно отметить, что все эти анализы выполняются in vitro . Анализы для обнаружения димеризации FP в in vivo клеточных контекстах , такие как анализ образования завитков CytERM, являются практическими измерениями потенциала димеризации в реальном мире, которые определяют, будет ли FP димеризоваться в экспериментально значимых обстоятельствах. Более подробное обсуждение см. В [5].
Задачи 1 и 2 зависят от концентрации белка. Неидеальное решение — ограничить визуализационный анализ клетками, экспрессирующими самые низкие уровни слитого белка. Это может уменьшить артефакты для умеренно димеризующихся FP, таких как EGFP, но не для облигатных олигомеров, таких как DsRed, или FP с высокой аффинностью, таких как TagRFP. Проблема 3 может быть решена в большинстве случаев с использованием мономерных FP или FP из разных семейств, которые не могут образовывать гетеродимеры (например, EGFP и mCherry). Эти простые стратегии могут помочь вам улучшить флуоресцентные репортеры слитого белка для ваших исследований и значительно снизить ваши шансы на обнаружение артефактических результатов.
Большое спасибо нашему гостевому блогеру Эрику Л. Снаппу!
Эрик Ли Снапп получил докторскую степень в области молекулярной микробиологии и иммунологии в Орегонском университете медицинских наук, стажировался в докторантуре у Дженнифер Липпинкотт-Шварц в Национальном институте здравоохранения и в настоящее время является доцентом в Медицинском колледже Альберта Эйнштейна. на кафедре анатомии и структурной биологии. Его интересы включают контроль качества секреторных белков в эндоплазматическом ретикулуме и методы визуализации живых клеток.Эрик также заядлый бегун на длинные дистанции, садовод и повар.
Список литературы
1. Snapp, E.L., et al., Формирование штабелированных цистерн ER за счет низкоаффинных белковых взаимодействий. J Cell Biol, 2003. 163 (2): стр. 257-69. PubMed PMID: 14581454. Центральный PMCID PubMed: PMC2173526.
2. Zacharias, D.A., et al., Разделение модифицированных липидами мономерных GFP на мембранные микродомены живых клеток. Science, 2002. 296 (5569): с. 913-6. PubMed PMID: 11988576.
3. Матц М.В. и др., Флуоресцентные белки небиолюминесцентных видов Anthozoa. Nat Biotechnol, 1999. 17 (10): p. 969-73. PubMed PMID: 10504696.
4. Ohashi, T., et al., Экспериментальное исследование FRET на основе GFP с применением к внутренне неструктурированным белкам. Protein Sci, 2007. 16 (7): стр. 1429-38. PubMed PMID: 17586775. Центральный PMCID PubMed: PMC2206698.
5. Costantini, L.M., et al., Оценка тенденции флуоресцентных белков к олигомеризации в физиологических условиях. Трафик, 2012. 13 (5): с. 643-9. PubMed PMID: 22289035. Центральный PMCID PubMed: PMC3324619.
Дополнительные ресурсы в блоге Addgene
Дополнительные ресурсы на Addgene.

 Из них 20 непосредственно участвуют в образовании белка в живых организмах.
Из них 20 непосредственно участвуют в образовании белка в живых организмах.
 В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети.
 Из предложенного списка заменимой аминокислотой является глицин.
Из предложенного списка заменимой аминокислотой является глицин. Эта спираль — вторичная структура белка.
Эта спираль — вторичная структура белка.

Leave A Comment