Сульфат железа (III)
Сульфат железа (III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула—Fe2(SO4)3.
Содержание
- 1 Физические свойства
- 2 Нахождение в природе
- 2.1 Марс
- 3 Получение
- 4 Химические свойства
- 5 Использование
Физические свойства
Безводный сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа (III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
- Кокимбит (англ.
 coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
Кристаллическая структура кокимбита
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
- 2FeS2 + 2NaCl + 😯2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
или растворяют оксид железа (III) в серной кислоте:
- Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2O
В лабораторной практике сульфат железа (III) можно получить из гидроокиси железа (III):
- 2Fe(OH)3 + 3H2SO4 ⟶ Fe2(SO4)3 + 6H2O
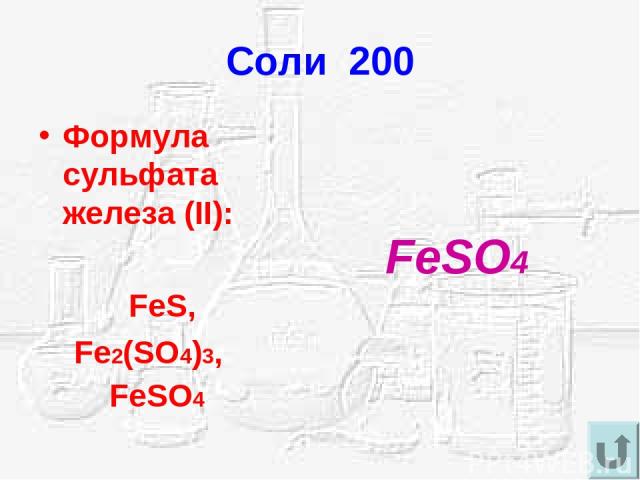
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
- 2FeSO4 + H2SO4 + 2 HNO3 ⟶ Fe2(SO4)3 + 2NO2 + 2H2O
также окисление можно провести кислородом или оксидом серы:
- 12FeSO4 + 3O2 ⟶ 4Fe2(SO4)3 + 2Fe2O3
- 2FeSO4 + 2SO3 ⟶ Fe2(SO4)3 + SO2
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
- 2FeS + H2SO4 + 18HNO3 ⟶ Fe2(SO4)3 + 18NO2↑ + 10H2O
Дисульфид железа можно окислить концентрированной серной кислотой:
- 2FeS2 + 14H2SO4 ⟶ Fe2(SO4)3 + 15SO2↑ + 14H2O
Сульфат-аммоний железа (II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
- 6Fe(NH4)2(SO4)2 + 7H2SO4 + K2Cr2O7 ⟶ Fe2(SO4)3 + Cr2(SO4)3 + 6(NH4)2SO4 + K2SO4 + 7H2O
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
- 6FeSO4 →T Fe2(SO4)3 + 2Fe2O3 + 3SO2
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
- 4K2FeO4 + 10H2SO4 → 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа (III):
- Fe2(SO4)3 ⋅ 5H2O →70−175oC Fe2(SO4)3 + 5H2O
Сульфат железа (II) можно окислить триоксидом ксенона:
- XeO3 + 3H2SO4 + 6FeSO4 ⟶ 3Fe2(SO4)3 + Xe↑ + 3H2O
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
- Fe[(H2O)6]3+ + H2O ⇄ Fe[(H2O)5(OH)]2+ + H3O+ ; pK = 2,17
- Fe[(H2O)5(OH)]2+ + H2O ⇄ Fe[(H2O)4(OH)2]+ + H3O+ ; pK = 3,26
- [2Fe(H2O)6]3+ + 2H2O ⇄ [Fe2(H2O)8(OH)2]4+ + 2H3O+ ; pK = 2,91
Горячая вода или пар разлагают сульфат железа (III):
- Fe2(SO4)3 + 2H2O →100oC 2FeSO4(OH)↓ + H2SO4
Безводный сульфат железа (III) при нагревании разлагается:
- Fe2(SO4)3 →500−700oC Fe2O3 + 3SO3
- 2Fe2(SO4)3 →900−1000oC 2Fe2O3 + 6SO2 + 3O2
Растворы щелочей разлагают сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
- Fe2(SO4)3 + 2NaOH ⟶ 2FeSO4(OH)↓ + Na2SO4
- Fe2(SO4)3 + 6NaOH ⟶ 2FeO(OH)↓ + 3Na2SO4 + 2H2O
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный оксид железа:
- Fe2(SO4)3 + FeSO4 + 8NaOH ⟶ Fe3O4↓ + 4Na2SO4 + 4H2O
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа (III):
- Fe2(SO4)3 + Fe ⟶ 3FeSO4
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа (III):
- CuS + Fe2(SO4)3 ⟶ 2FeSO4 + CuSO4 + S
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
- Fe2(SO4)3 + 2NaH2PO4 ⟶ Na2SO4 + 2H2SO4 + 2FePO4↓
Использование
- Как реактив при гидрометаллургической переработке медных руд.

- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.
Сульфат железа(III), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формула сульфата железа III — структура, свойства, применение и часто задаваемые вопросы
Сульфат железа (III) — это неорганическое соединение, которое также называют сульфатом железа. Его химическая формула Fe 2 (SO 4 ) 3 . В сульфате железа III каждый атом железа имеет ионную связь с сульфатом. Известны различные гидраты сульфата железа III, такие как нонагидрат, безводный моногидрат и т. д. Фактически, они представляют собой наиболее часто встречающуюся форму «сульфата железа III». Он мало растворим в воде и очень гигроскопичен. Умеренно растворим в спирте и незначительно растворим в ацетоне и этилацетате. Не растворяется в серной кислоте и аммиаке. Поскольку сульфат железа III нерастворим в серной кислоте, его используют для получения сульфата железа III. Он выделяет токсичные пары железа и оксида серы при нагревании до разложения. Это угроза для окружающей среды, и необходимо принять немедленные меры для контроля его распространения в окружающей среде. Он используется как коагулянт при очистке воды, как вяжущее средство и как кондиционер почвы. Он вызывает коррозию меди, медных сплавов, мягкой стали и оцинкованной стали.
Он используется как коагулянт при очистке воды, как вяжущее средство и как кондиционер почвы. Он вызывает коррозию меди, медных сплавов, мягкой стали и оцинкованной стали.
Структура сульфата железа (III)
Химическая формула сульфата железа (III) Fe 2 (SO 4 ) 3 , который содержит катионы Fe +3 и (SO4) -2 анионов, образующих кристаллическую соль с ромбовидной геометрией. Его молекулярная формула Fe 2 O 12 S 3 . Соотношение ионов железа и сульфата в сульфате железа III составляет 3:2.
Структура сульфата железа III
Получение сульфата железа (III)
Естественно, сульфаты железа встречаются в различных редких и не имеющих промышленного значения минералах. Однако сульфат железа III в основном содержится в таких минералах, как пирит и марказит. Как правило, сульфаты железа III используются в виде раствора, который получают из отходов железа. Хотя фактическая спецификация расплывчата, для его применения не требуются материалы высокой чистоты.
В больших масштабах сульфаты железа III получают обработкой серной кислоты горячим раствором сульфата железа (II) и окислителем. Перекись водорода, хлор и азотная кислота являются одними из типичных окислителей, используемых при получении сульфата железа III.
+ 2H 2 O2FESO 4 + H 2 SO 4 + H 2 O 2 → FE 2 (SO4) 3 + 2H 2 O
. может быть получен в промышленных масштабах путем введения газообразного хлора в раствор сульфата железа (II), в результате чего получается смесь сульфата железа (III) и хлорида железа (III).
3Cl 2 + 6FeSO 4 → 2Fe 2 (SO4) 3 + 2FeCl 3
Properties of Iron (III) Sulfate
| Chemical Formula | Fe 2 (SO 4 ) 3 |
|---|---|
| IUPAC name | Iron(III) sulfate |
| Внешний вид | желтое кристаллическое твердое вещество или серовато-белые кристаллы |
| Молярная масса/молекулярная масса | 399,88 г/моль (безводный) 489,96 г/моль (пентагидрат) 562 г/моль 562 г/моль0092 |
| Плотность | 3,097 г/см 3 (безводный) 1,898 г/см 3 (Пентагидрат) |
. | |
| Solubility in Water | Slightly Soluble |
| Refractive index | 1.814 (anhydrous) 1.552 (nonahydrate) |
Other Experimental Properties and Reactions
- При нагревании сульфата железа(III) до разложения образуется оксид железа(III), диоксид серы и кислород. Эта реакция протекает при температуре от 900 до 1000°С.
2Fe 2 (SO 4 ) 3 → 2Fe 2 O 3 + 6SO 2 + 3O 2
- Barium carbonate (BaCO3) reacts with iron III сульфаты с образованием белого осадка сульфата бария и карбоната железа.
3BaCO 3 + Fe 2 (SO 4 ) 3 → 3BaSO 4 + Fe 2 (CO 3 ) 3
- Iron III sulfate реагирует с сульфидом натрия (Na 2 S) с образованием сульфида железа, сульфата натрия и серы.

FE 2 (поэтому 4 ) 3 + 3NA 2 S → 2FES + 3NA 2 SO 4 + 2S
- При добавлении сульфата железа III к воде происходит следующая реакция.
FE 2 (SO 4 ) 3 + 3CA (HCO 3 ) 2 → 2AL (OH) 3 ↓ + 3CASO 4 ↓ + 777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777а 7777777777777777777777777777777777777777777777
Использование сульфата железа III
- Сульфат железа III в основном используется в качестве коагулянта при очистке воды и очистке сточных вод.
- Раствор сульфата железа применяют в качестве протравы при крашении и ситцевом набивном станке.
- Он также используется при получении солей железа и пигментов, в процессе выщелачивания солей трехвалентного железа, в кондиционерах почвы и в процессе переработки угля.

- Действует как дезинфицирующее средство, катализатор полимеризации и кровоостанавливающее средство для эндодонтической хирургии.
- Также используется для травления алюминия и травления нержавеющей стали и меди.
- Он также используется в качестве агента для удаления твердых частиц и окислителя.
Опасности
- Сульфат железа III представляет угрозу для окружающей среды, и необходимо принять немедленные меры для контроля его распространения в окружающей среде.
- Хотя сульфат железа III является стабильным, негорючим соединением, при нагревании до разложения он выделяет токсичные пары железа и оксида серы.
- Длительное воздействие сульфата железа III токсично для легких и слизистых оболочек и может привести к их повреждению.
- Контакт с ним вызывает раздражение кожи, а также может вызвать кожную аллергическую реакцию.
- Вдыхание его пыли раздражает нос и горло, а его проглатывание раздражает рот и желудок.

- Вреден для водных организмов с долгосрочными последствиями.
Часто задаваемые вопросы о формуле сульфата железа
Вопрос 1: Что такое сульфат железа III?
Ответ:
Сульфат железа III представляет собой неорганическое соединение, которое также называют сульфатом железа. Его химическая формула Fe 2 (SO 4 ) 3 . В сульфате железа III каждый атом железа имеет ионную связь с сульфатом. Он выделяет токсичные пары железа и оксида серы при нагревании до разложения. Сульфат железа III в основном используется в качестве коагулянта при очистке воды и очистке сточных вод.
Вопрос 2: Как получают сульфат железа III?
Ответ:
Сульфат железа III получают в больших масштабах путем обработки серной кислоты горячим раствором сульфата железа(II) и окислителем. Перекись водорода, хлор и азотная кислота являются одними из типичных окислителей, используемых при получении сульфата железа III.
2FeSO 4 + H 2 SO 4 + H 2 O 2 → Fe 2 (SO 4 ) 3 + 2H 2 O
Его также можно получить в промышленных масштабах путем введения газообразного хлора в раствор сульфата железа (II), в результате чего образуется смесь железа ( III) сульфат и хлорид железа(III).
3CL 2 + 6FESO 4 → 2FE 2 (SO 4 ) 3 + 2FECL 3
Вопрос 3: Упомяните некоторые свойства IRII SULFATE.
Ответ:
Сульфат железа III представляет собой неорганическую соль с химической формулой Fe 2 (SO 4 ) 3 . В сульфате железа III каждый атом железа имеет ионную связь с сульфатом. Он мало растворим в воде и очень гигроскопичен. Выглядит как серовато-белые кристаллы или желтый порошок без запаха.
Умеренно растворим в спирте и незначительно растворим в ацетоне и этилацетате. Не растворяется в серной кислоте и аммиаке.
Вопрос 4: Каково применение сульфата железа III?
Ответ:
- Сульфат железа III в основном используется в качестве коагулянта при очистке воды и очистке сточных вод.
- Раствор сульфата железа применяют в качестве протравы при крашении и ситцевом набивном станке.
- Он также используется при получении солей железа и пигментов, в процессе выщелачивания соли железа, в кондиционерах почвы и в процессе переработки угля.
- Действует как дезинфицирующее средство, катализатор полимеризации и кровоостанавливающее средство для эндодонтической хирургии.
Вопрос 5: Укажите некоторые опасности сульфата железа III.
Ответ:
- Сульфат железа III представляет угрозу для окружающей среды, и необходимо принять немедленные меры для контроля его распространения в окружающей среде.
- Хотя сульфат железа III является стабильным, негорючим соединением, при нагревании до разложения он выделяет токсичные пары железа и оксида серы.
- Длительное воздействие сульфата железа III токсично для легких и слизистых оболочек и может привести к их повреждению.
Вопрос 6: Напишите реакцию термического разложения сульфата железа(III).
Ответ:
При разложении сульфата железа(III) образуется оксид железа(III), диоксид серы и кислород. Эта реакция протекает при температуре от 900 до 1000°С.
2Fe 2 (ТАК 4 ) 3 → 2FE 2 O 3 + 6SO 2 + 3O 2
СОЗОЦИЯ ФРУЗА ) сернокислый, или в древности медный или зеленый стекловидный. Исторически медь использовалась для чернения кожи, в качестве фиксатора красителя в текстильной промышленности и в качестве компонента для чернил.
 Еще 700 лет назад получение серной кислоты (купоросного масла) включало перегонку зеленого купороса (1). Сегодня, конечно, нас больше волнуют современные применения этого универсального химического вещества. Итак, сначала давайте поговорим о составе, свойствах и использовании сульфата железа.
Еще 700 лет назад получение серной кислоты (купоросного масла) включало перегонку зеленого купороса (1). Сегодня, конечно, нас больше волнуют современные применения этого универсального химического вещества. Итак, сначала давайте поговорим о составе, свойствах и использовании сульфата железа.Химический состав
Сульфат железа — сине-зеленое химическое вещество, используемое во многих областях, включая медицину, производство чернил и красителей, а также сельское хозяйство. Его можно найти в различных состояниях гидратации, и несколько таких форм существуют в природе. Вот наиболее распространенные минеральные формы:
- FeSO 4 ·7H 2 O (Мелантерит, сине-зеленый)
- FeSO 4 ·4H 2 O (Розенит, белый, может быть продуктом дегидратации мелантерита)
Эти минеральные формы относительно редки:
- Сидеротил (FeSO 4 ·5H 2 O)
- Феррогексагидрит (FeSO 4 ·6H 2 O)
- Сомольнокит (FeSO 4 ·H 2 O)
| Химическая формула | FeSO 4 |
| Молярная масса | 151,91 г/моль (безводный) 169,93 г/моль (моногидрат) 241,99 г/моль (пентагидрат) 260,00 г/моль (гексагидрат) 278,02 г/моль (гептагидрат) |
| Внешний вид | Белые кристаллы (безводные) Бело-желтые кристаллы (моногидрат) Сине-зеленые кристаллы (гептагидрат) |
| Плотность | 3,65 г/см3 (безводный) 3 г/см3 (моногидрат) 2,15 г/см3 (пентагидрат) 1,934 г/см3 (гексагидрат) 1,895 г/см3 (гептагидрат) |
| Температура плавления | 680 ° C (1256 ° F, 953 K) (безводный) разлагается 300 ° C (572 ° F, 573 K) (моногидрат) разлагается 60–64 ° C (140–147 ° F, 333–337 K) (гептагидрат) разлагается |
| Растворимость в воде | Моногидрат: 44,69 г/100 мл (77 °C), 35,97 г/100 мл (90,1 °C) Гептагидрат: 15,65 г/100 мл (0°С), 20,5 г/100 мл (10°С), 29,51 г/100 мл (25°С), 39,89 г/100 мл (40,1°С), 51,35 г/100 мл мл (54 °С) |
| Растворимость | Незначительно в спирте |
| Магнитная восприимчивость (χ) | 1,24×10 −2 см 3 /моль (безводный) 1,05×10 −2 см 3 /моль (моногидрат) 1,12×10 −2 см 3 /моль (гептагидрат) +10 200×10 −6 см 3 /моль |
| Показатель преломления( n D ) | 1,591 (моногидрат) 1,526–1,528 (21 ° C, тетрагидрат) 1,513–1,515 (пентагидрат) 1,468 (гексагидрат) 1,471 (гептагидрат) |
| Стандартная энтальпия образования (Δ f H ⦵ 298 ) | -928,4 кДж/моль (безводный) −3016 кДж/моль (гептагидрат) |
Где сегодня используется сульфат железа?
Медицина
Дефицит железа является наиболее распространенным недостатком питания в Соединенных Штатах. Спортсмены, молодые женщины, вегетарианцы и пожилые люди, например, более склонны к дефициту железа, чем другие люди. (2) Вместе с другими соединениями железа сульфат железа обогащает продукты и лечит низкий уровень железа в крови, например, вызванный анемией или беременностью (3). Железо помогает крови переносить кислород по телу человека.
Спортсмены, молодые женщины, вегетарианцы и пожилые люди, например, более склонны к дефициту железа, чем другие люди. (2) Вместе с другими соединениями железа сульфат железа обогащает продукты и лечит низкий уровень железа в крови, например, вызванный анемией или беременностью (3). Железо помогает крови переносить кислород по телу человека.
Краситель
Сульфат железа использовался в производстве чернил, прежде всего железно-галловых чернил, которые использовались в средние века до конца восемнадцатого века. Химические тесты, проведенные на лахишских письмах (ок. 588–586 до н. э.), показали возможное присутствие железа. Более того, считается, что при изготовлении чернил для этих букв могли использоваться дубовые галлы и медь. Сульфат железа также находит применение при крашении шерсти в качестве протравы. Кроме того, хвойное дерево, материал, используемый в маркетри и паркете с 17 века, также изготавливается с использованием сульфата железа.
Два различных метода прямого нанесения красителя индиго были разработаны в Англии в восемнадцатом веке и использовались вплоть до девятнадцатого века. Например, один из них, известный как фарфоровый синий, содержал сульфат железа (II). После печати нерастворимой формы индиго на ткани индиго восстанавливали до лейко-индиго в ваннах с сульфатом железа (с повторным окислением до индиго на воздухе между погружениями). Процесс синего фарфора мог создавать четкие рисунки, но не мог создавать темные оттенки других методов (1).
Сульфат железа до сих пор используется, например, в качестве красителя в пищевых продуктах и красителях для тканей. Смешивается с (9):
- Гранат, чтобы получить темно-оливковый цвет
- Марена (евразийская трава) для придания темно-серовато-фиолетового цвета
- Танин для придания серо-фиолетового цвета
- Каштан для придания средне-серого цвета
- Cutch (краситель и дубитель) для придания насыщенного шоколадно-коричневого цвета
Рост растений
Подобно сульфату алюминия, сульфат железа используется в качестве почвенной добавки для снижения pH высокощелочной почвы, чтобы растения могли легче получать питательные вещества почвы.
В садоводстве используется для лечения хлороза железа, пожелтения листьев растений, вызванного дефицитом железа. Хотя он не так быстро действует, как ЭДТА железа, его эффекты более продолжительны. Садоводы и фермеры смешивают его с компостом и закапывают в почву, чтобы создать запас, которого хватит на долгие годы. Они также могут использовать его в качестве кондиционера для газонов и средства для уничтожения мха (1).
Удаление фосфора и обесцвечивание сточных вод
Сульфат железа является предпочтительным коагулянтом для очистки многих промышленных и бытовых сточных вод благодаря его высокой эффективности, действенности в осветлении и применению в качестве средства для обезвоживания осадка (4). Коагуляционная обработка — это процесс удаления взвешенных твердых частиц и цвета, в данном случае из воды. Несколько вещей, которые следует учитывать при очистке воды, это TSS, FOG, BOD и COD.
Удаление взвешенных частиц, тумана, БПК и ХПК
TSS
Общее количество взвешенных твердых частиц (TSS) относится к твердым частицам, взвешенным в воде. Он определяется как общее количество твердого вещества, взвешенного в воде, которое удерживается фильтром.
Он определяется как общее количество твердого вещества, взвешенного в воде, которое удерживается фильтром.
Загрязнитель воды, TSS включает как органические, так и неорганические вещества и может состоять из ряда материалов; песок, песок, металлические частицы, разлагающиеся растения или животные вещества могут внести свой вклад. (6)
FOG
Пищевая и молочная промышленность сталкиваются с потоком отходов жирных органических материалов от животных и овощей, которые нелегко утилизировать. В совокупности называемые жирами, маслами и смазками (FOG), они возникают в результате приготовления пищи и подлежат тщательному контролю со стороны муниципалитетов из-за их склонности вызывать серьезные засоры труб и канализации. Из-за серьезных штрафных санкций, применяемых многими местными органами власти и регулирующими органами, профессионалы в пищевой и молочной промышленности стремятся к технологическому решению, которое поможет им эффективно уменьшить количество загрязнения ВОГ в исходящих потоках отходов. (7)
(7)
БПК
Биохимическая потребность в кислороде (БПК) представляет собой количество кислорода, потребляемого бактериями и другими микроорганизмами, когда они разлагают органические вещества в аэробных (кислород присутствует) условиях при определенной температуре. Количество растворенного кислорода, присутствующего в воде, имеет решающее значение для поддержания водной жизни и эстетического качества ручьев и озер. (8)
ХПК
ХПК – это количество кислорода, потребляемого для химического окисления органических загрязнителей воды до неорганических конечных продуктов (5). Распространенными формами ХПК, обнаруженными в ливневых водах, являются остаточные пищевые отходы и напитки из банок / бутылок, антифриз, а также эмульгированные масла. Высокие уровни ХПК в воде часто коррелируют с угрозами для здоровья человека, в том числе токсичными бактериями, вызывающими цветение водорослей из органических отходов и загрязнением морепродуктов. (10)
Другое применение
Сульфат железа имеет множество применений, о которых вы, возможно, и не подозревали, например:
- Фотопроявитель для изображений процесса коллодия
- Добавляется в охлаждающую воду, протекающую по латунным трубкам конденсаторов турбин, для образования антикоррозионного защитного покрытия
- При аффинаже золота для осаждения металлического золота из растворов хлорида золота (золота, растворенного в растворе с царской водкой, смесью азотной и соляной кислот)
- Реагент для идентификации грибов
- В качестве железного каталитического компонента реагента Фентона, катализатора, используемого для окисления загрязняющих веществ или сточных вод
- Вспениватель для пива
- Иногда добавляют в консервированные маслины в качестве искусственного красителя
- Используется для окрашивания бетона и некоторых известняков и песчаников в желтоватый цвет ржавчины
- Мастера по дереву используют растворы сульфата железа, чтобы придать древесине клена серебристый оттенок.


 coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.




 Умеренно растворим в спирте и незначительно растворим в ацетоне и этилацетате. Не растворяется в серной кислоте и аммиаке.
Умеренно растворим в спирте и незначительно растворим в ацетоне и этилацетате. Не растворяется в серной кислоте и аммиаке.
Leave A Comment