Степень окисления азота (N), формула и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о степени окисления азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg+23N-32, B+3N-3), самым известным из которых является аммиак (N-3H+13).
Степень окисления (-2) азот проявляет в соединениях перикисного типа – пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) – N-22H2.
В соединении под названием гидроксиламин – N-1H2OH–азот проявляет степень окисления (-1).
Наиболее устойчивые положительные степени окисления азота – это (+3) и (+5). Первую из них он проявляет во фториде (N+3F-13), оксиде (N+32O-23), оксогалогенидах (N+3OCl, N+3OBr и т.д.), а также производных аниона NO2— (KN+3O2, NaN+3O2 и др.). Степень окисления (+5) азот проявляет в оксиде N+52O5, оксонитриде N+5ON, диоксофториде N+5O2F, а также в триоксонитрат (V) –ионе NO3— и динитридонитрат (V) –ионе NH2—.
Азот также проявляет степени окисления (+1) – N+12O, (+2) – N+2O и (+4)N+4O2 в своих соединениях, но значительно реже.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Степень окисленности азота | Задачи 611
Задача 611.
Указать, в каких из приведенных процессов происходит окисление азота, и в каких — восстановление, как изменяется в каждом случае степень окисленности азота:
Решение:
Окисление – процесс, при котором происходит потеря элементом электронов и наблюдается повышение степени окисленности его.
а) Окисление азота происходит в следующих процессах:
б) Восстановление азота происходит в следующих процессах:
Задача 612.
Какие из следующих реакций относятся к окислительно-восстановительным?
Решение:
Реакции, в к которых происходит изменение степеней окисленности элементов, называются окислительно-восстановительными.
В данной реакции водород повышает степень окисленности 0 до +1, т.е. отдаёт электроны, является восстановителем. Бром понижает свою степень окисленности от 0 до -1, т. е. принимает электроны, является окислителем.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Азот повышает степень окисленности от -3 до +1, т. е. является восстановителем. Азот иона нитрата понижает свою степень окисленности от +5 до +1, т. е. является окислителем. Данная реакция относится к окислительно-восстановительным.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Железо повышает свою степень окисленности от 0 до +2, является восстановителем; сера понижает свою степень окисленности от 0 до -2, т.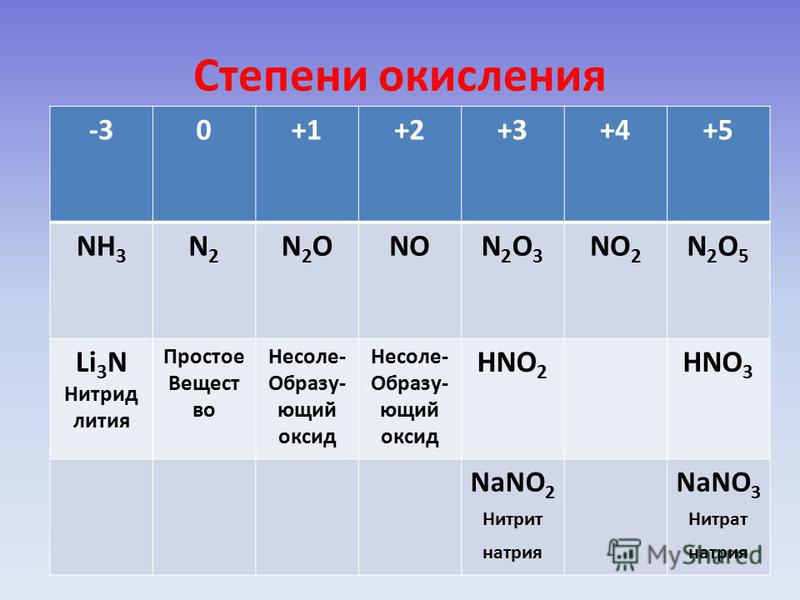 е. является окислителем. Таким образом, данная реакция является окислительно-восстановительной.
е. является окислителем. Таким образом, данная реакция является окислительно-восстановительной.
Ответ: а), в), е).
Задача 613.
Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей:
Решение:
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции оксид серы (IV) SO2 является восстановителем за счёт серы, которая отдаёт электроны и меняет степень окисленности от +4 до +6. Окислителем является бром Br2, в котором атомы брома присоединяют по одному электрону, меняя степень окисленности от 0 до -1.
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции окислителем является H2SO4, в которой атомы водорода, присоединяя по одному электрону, изменяют степень окисленности от +1 до 0. Магний является восстановителем, потому что его атомы, отдавая по два электрона, изменяют степень окисленности от 0 до +2.
Магний является восстановителем, потому что его атомы, отдавая по два электрона, изменяют степень окисленности от 0 до +2.
Уравнения ионно-молекулярного баланса:
Восстановитель процесс окисления;
Окислитель процесс восстановления.
В данной реакции окислителем является H2SO4, в котором атом серы изменяет степень окисленности от +6 до +4. Восстановителем в данной реакции является медь, атомы которой отдают по два электрона, изменяя степень окисленности от 0 до +2.
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции окислителем и восстановителем является иод I2, в котором атом иода, отдавая пять электронов, изменяет степень окисленности от 0 до +5, и, присоединяя один электрон, изменяет степень окисленности от 0 до -1. в этой реакции происходит одновременно и увеличение, и уменьшение степени окисленности атомов одного и того же элемента, значит, эта реакция относится к реакциям диспропорционирования (самоокисления-самовосстановления).
Какова роль N2 в этих двух реакциях, 3h3 + N2 —>2 Nh4 и O2 + N2 —> 2NO и почему?
Google ImageНихилеш Мукерджи
Нихилеш Мукерджи
Консультант — отвечает на основные вопросы
Опубликовано 24 ноября 2018 г.
+ Подписаться
Оба являются окислительно-восстановительными реакциями.
Это пример, когда одно и то же вещество действует как окислитель и восстановитель. N2 в реакции [1] является окислителем, а в реакции [2] восстановителем.
Резюме
Пять важных уроков
(1) Любая химическая реакция, в которой в качестве реагента принимает участие нейтральный элемент или молекула, образующая окислительно-восстановительный потенциал, является окислительно-восстановительным продуктом.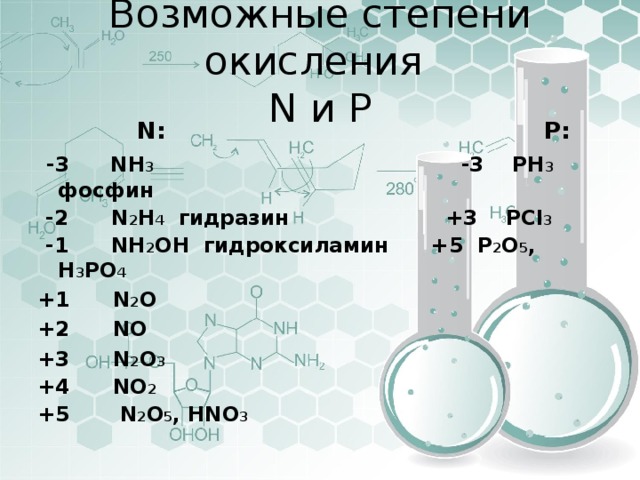
(2) Окислитель – это вещество, которое заставляет другие терять электроны и восстанавливать эти электроны. Восстановитель – это вещество, которое теряет электроны и окисляется.
(3) Относительная окислительная способность элемента зависит от его электроотрицательности.
(4) Несоединенный элемент имеет нулевую степень окисления. Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю . Когда несвязанный элемент принимает участие в химической реакции, его степень окисления изменяется . Окисление включает увеличение степени окисления, а восстановление включает уменьшение степени окисления.
(5) Вещество в присутствии более сильного донора электронов (сильного восстановителя) может действовать как окислитель. Это же вещество в присутствии более сильного акцептора электронов (сильного окислителя) может действовать как восстановитель.
Это же вещество в присутствии более сильного акцептора электронов (сильного окислителя) может действовать как восстановитель.
Все вышеперечисленные пять уроков применимы к этим двум простым реакциям.
Давайте посмотрим на эти две реакции:
3 h3 + N2 → 2 Nh4
Разобьем уравнение на две полуреакции.
3h3 = 6H+ + 6e Окислительная реакция
h3 – окислительная с повышением степени окисления
N2 + 6e = 2N — Реакция восстановления
N2 – восстановительная с понижением степени окисления.
В целом N2 является окислителем. Это заставляет h3 терять электроны, которые N2 приобретает и восстанавливает.
O2 + N2 — > 2NO
Разбейте уравнение на две полуреакции.
N2 = 2N ++ + 4e Реакция окисления
N2 окисляется с повышением степени окисления.
O2 + 4e = 2O — Реакция восстановления
O2 восстанавливается с уменьшением степени окисления.
В целом N2 является восстановителем. О2 является окислителем. O2 заставляет N2 терять электроны, которые он приобретает и восстанавливает.
Электроотрицательность H равна 2,2. N равно 3,04, а O равно 3,44 по шкале Полинга.
В первой реакции N2 является окислителем. N2 является более электроотрицательным или более сильным акцептором электронов, чем h3. h3 является более сильным донором электронов (восстановителем), чем N2. Во второй реакции N2 является восстановителем, а O2 является окислителем. O2 является более электроотрицательным или более сильным акцептором электронов, чем N2. N2 является более сильным донором электронов (восстановителем).
Обе эти реакции являются сложными реакциями, поскольку N2 является инертным газом. N2 состоит из двух атомов азота, соединенных тройной связью, для разрыва которой требуется очень большая энергия, поэтому известно, что N2 является инертным газом.
Какова степень окисления азота?
Дата последнего обновления: 14 апр 2023
•
Всего просмотров: 219,9 тыс.
•
Просмотров сегодня: 1,90 тыс.
Ответ
90,0003 Подтверждено просмотров Подсказка: Чтобы решить данную вопрос, мы должны знать о степени окисления и как их вычислить. Число окисления — это количество электронов, полученных или потерянных или общих для образования соединения из элемента.
Некоторые общие правила, которые следуют за степенью окисления, заключаются в том, что степень окисления свободного элемента всегда равна $ 0 $, степень окисления элемента группы $ 1 $ в соединении равна $ +1 $ , элемента группы $ 2 $ в соединении составляет $ +2 $, а сумма степеней окисления всех атомов в соединении равна общему заряду молекулы.
Полный пошаговый ответ:
Шаг-1:
Атом азота имеет разные степени окисления с разными атомами, образуя разное количество соединений.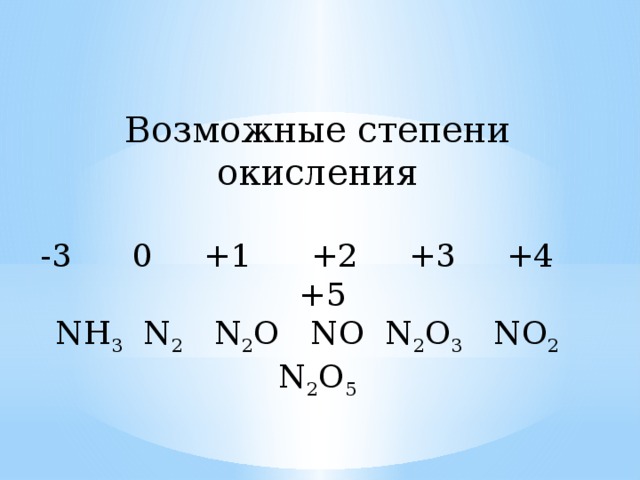

Leave A Comment