Один из атомов углерода имеет валентность IV, а степень окисления… . ГДЗ 11 класс химия Новошинский параграф № 17 задание 3 – Рамблер/класс
Один из атомов углерода имеет валентность IV, а степень окисления… . ГДЗ 11 класс химия Новошинский параграф № 17 задание 3 – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Очень жду вашей помощи в решении вот такого задания:
а) С3Н4 б) С2Н2 в) С3Н6 г) С3Н8
ответы
Тут даж сомневатся не стоит, это а) С3Н4
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Составьте уравнения § 30 № 4 ГДЗ Химия 9 класс Новошинский И. И.
И.
Составьте уравнения реакций в соответствии со схемой превра-
N2 → Nh4 → NO → NO2 → HNO3 → AgNO3 (Подробнее…)
ГДЗХимия9 классНовошинский И.И.
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 42 Вопрос 9 Найдите корень уравнения.
Привет…Не могу справиться с ответом на такой вопрос…может кто поможет, а?
Найдите корень уравнения 27-х = 100 ∙ 5x-7. (Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 42 Вопрос 10 Найдите корень уравнения.
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Найдите корень уравнения 2х ∙ 3х = 36x-4. (Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Упр 2. Вариант 3. Работа 1. Тема 3 Непредельные углеводороды. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
HELP! Дайте ответ на задачу по химии.
Дайте названия следующим углеводородам по номенклатуре ИЮПАК:
(Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
Определите, какие изобразительно выразительные средства языка использованы в приведенных ниже отрывках
1) Я вижу печальные оч, я слышу веселую речь. 2) Только слышно: на улице где то одинокая бродит гармонь 3) Принес он смертную (Подробнее…)
ГДЗУчебникиУчителя
Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95. 95
95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев
сайта.
19.1. Определение степени окисления углерода
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1. Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1.
- Для углерода, связанного с более электроотрицательным неметаллом X, таким как азот, кислород, сера или галогены, каждая связь C-X будет увеличивать степень окисления углерода на 1. (Некоторые неметаллы менее электроотрицательны, чем углерод , такие как фосфор, кремний или бор, но связи углерода с этими элементами встречаются гораздо реже.)
- Для углерода, связанного с другим углеродом, степень окисления не изменяется. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления.
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот некоторые примеры.
Вот некоторые примеры.
(Не забывайте, что это называется «формализм» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степень окисления углерода, мы готовы к следующему шагу: пониманию
Дополнительная литература
Лестница окисления
Ссылки
- http://www.masterorganicchemistry.co…e-of-a-carbon/
Авторы
- Джеймс Эшенхерст (MasterOrganicChemistry.com)
Окисление и восстановление органических соединений – обзор
Вы, несомненно, уже знакомы с общей идеей окисления и восстановления: из общей химии вы узнали, что при окислении соединение или атом теряет электроны, а при восстановлении приобретает электроны.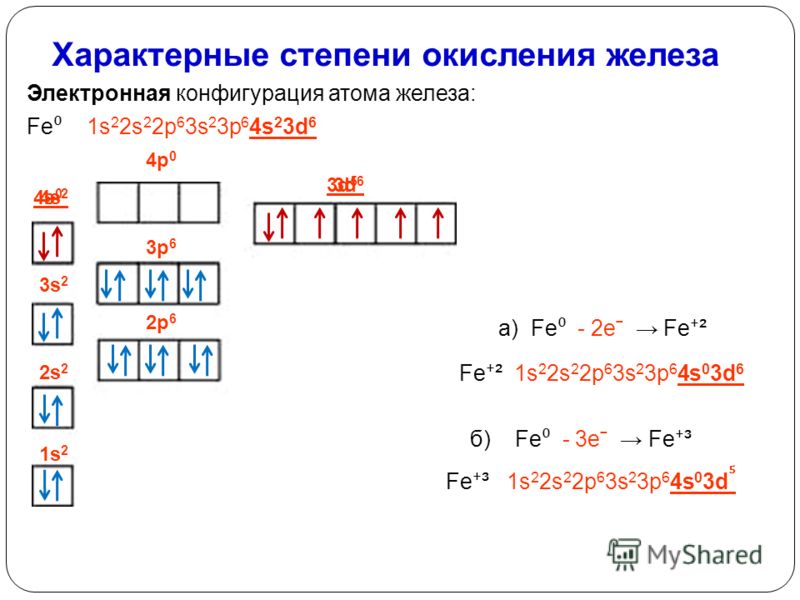
В органической химии окислительно-восстановительные реакции выглядят несколько иначе. Электроны в органической окислительно-восстановительной реакции часто передаются в виде гидрид-иона – протона и двух электронов. Поскольку они происходят вместе с переносом протона, их обычно называют реакциями гидрирования и дегидрирования : гидрид плюс протон образуют молекулу водорода (H 2 ). Будьте осторожны – не перепутайте термины hyd водород ионизация и дегидрирование дроген ионизация с гидратацией и дегидратацией – последние относятся к приросту и отщеплению молекулы воды (и являются , а не окислительно-восстановительными реакциями), а первые относятся к приросту и потеря молекулы водорода .
Когда атом углерода в органическом соединении теряет связь с водородом и приобретает новую связь с гетероатомом (или с другим углеродом), мы говорим, что соединение дегидрировано или окислено. Очень распространенным биохимическим примером является окисление спирта в кетон или альдегид:
Когда атом углерода теряет связь с водородом и приобретает связь с гетероатомом (или с другим атомом углерода), это считается окислительным процессом, поскольку водород из всех элементов является наименее электроотрицательным. Таким образом, в процессе дегидрирования атом углерода претерпевает общую потерю электронной плотности – а потеря электронов есть окисление.
И наоборот, когда атом углерода в органическом соединении получает связь с водородом и теряет связь с гетероатомом (или с другим атомом углерода), мы говорим, что соединение гидрировано или восстановлено. Гидрирование кетона в спирт, например, в целом является обратным дегидрированию спирта, показанному выше. Ниже проиллюстрирована другая распространенная возможность — гидрирование (восстановление) алкена до алкана.
Гидрирование приводит к более высокой электронной плотности на атоме(ах) углерода, и, таким образом, мы считаем процесс восстановлением органической молекулы.
Обратите внимание, что ни гидрирование, ни дегидрирование не связаны с приобретением или потерей атома кислорода . Реакции, которые — включают приобретение или потерю одного или нескольких атомов кислорода, обычно называют «оксигеназными» и «редуктазными» реакциями.
По большей части, говоря об окислительно-восстановительных реакциях в органической химии, мы имеем дело с небольшим набором хорошо узнаваемых превращений функциональных групп. Поэтому очень полезно ознакомиться с идеей «степеней окисления» применительно к органическим функциональным группам. Сравнивая относительное количество связей с атомами водорода, мы можем упорядочить знакомые функциональные группы по степени окисления. В качестве примера возьмем ряд одноуглеродных соединений. Метан с четырьмя углеродно-водородными связями сильно восстановлен. Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Далее в ряду идет метанол (на одну связь углерод-водород меньше, на одну связь углерод-кислород больше), за ним следуют формальдегид, формиат и, наконец, диоксид углерода на сильно окисленном конце группы.
Эта закономерность верна для соответствующих функциональных групп органических молекул с двумя или более атомами углерода:
Алканы сильно восстанавливаются, в то время как спирты, а также алкены, простые эфиры, амины, сульфиды и сложные эфиры фосфорной кислоты находятся на одну ступень выше по шкале окисления, за ними следуют альдегиды/кетоны/имины и эпоксиды и, наконец, производные карбоновых кислот ( двуокись углерода, находящаяся в верхней части списка окисления, характерна для одного ряда углерода).
Обратите внимание, что в приведенном выше ряду двухуглеродных соединений этанол и этен считаются находящимися в одной и той же степени окисления. Вы уже знаете, что спирты и алкены взаимопревращаются путем присоединения или отщепления воды (например, в разделе 10. 4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
4.). Когда спирт дегидратируется с образованием алкена, один из двух атомов углерода теряет связь С-Н и приобретает связь С-С и, таким образом, окисляется. Однако другой углерод теряет связь С-О и приобретает связь С-С и, таким образом, считается восстановленным. Таким образом, в целом степень окисления атомов углерода, рассматриваемых вместе, не меняется.
Вы должны научиться распознавать, когда реакция включает изменение степени окисления атомов углерода в органическом реагенте. Глядя, например, на следующее превращение, вы сможете быстро распознать, что это окисление: функциональная группа спирта превращается в кетон, что является одной ступенью вверх по лестнице окисления.
Аналогично, следующая реакция включает превращение производного карбоновой кислоты (тиоэфира) сначала в альдегид, а затем в спирт: это двойное восстановление , так как субстрат теряет две связи с гетероатомами и приобретает две связи с атомами водорода.
Реакция переноса ацила (например, превращение ацилфосфата в амид) , а не считается окислительно-восстановительной реакцией – степень окисления органической молекулы не изменяется по мере превращения субстрата в продукт, потому что связь к одному гетероатому (кислороду) просто обменяли на связь с другим гетероатомом (азот).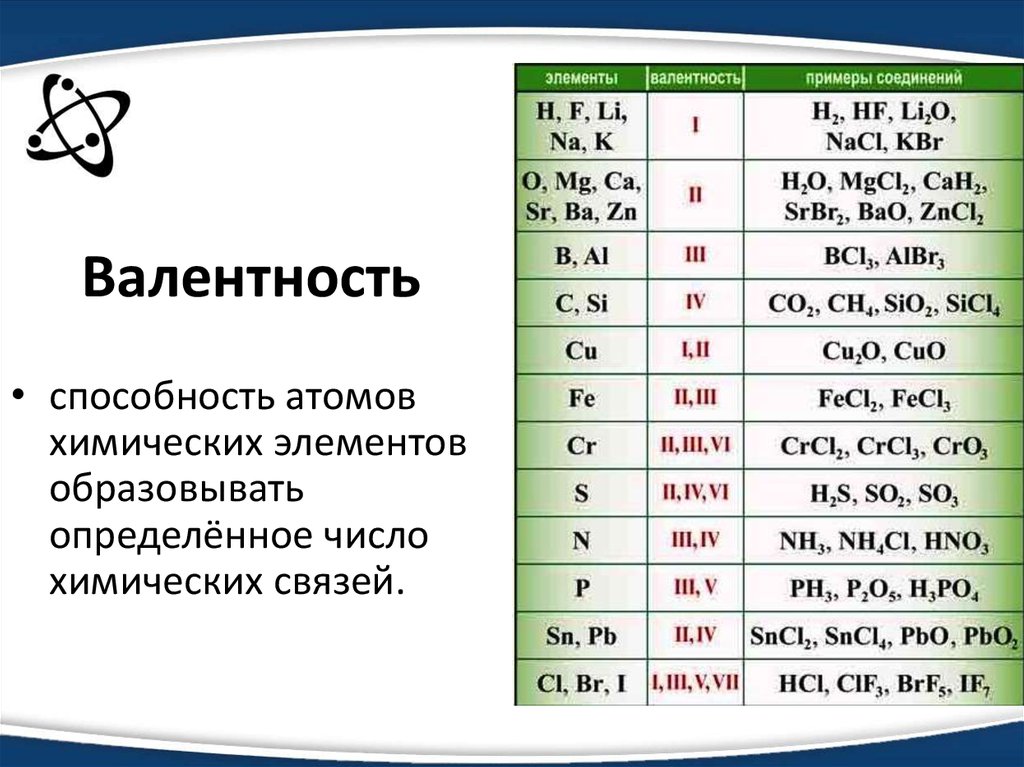
Важно уметь распознавать, когда органическая молекула окисляется или восстанавливается, потому что эта информация говорит вам искать участие соответствующего окислительно-восстановительного агента, который восстанавливается или окисляется — помните, окисление и восстановление всегда происходят в тандеме ! Вскоре мы подробно узнаем о наиболее важных биохимических и лабораторных окислительно-восстановительных агентах.
- Органическая химия с биологическим акцентом Тим Содерберг (Университет Миннесоты, Моррис)
Степени окисления органических молекул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15376
К концу поколения химии вычисление степеней окисления различных металлов должно быть довольно привычным делом.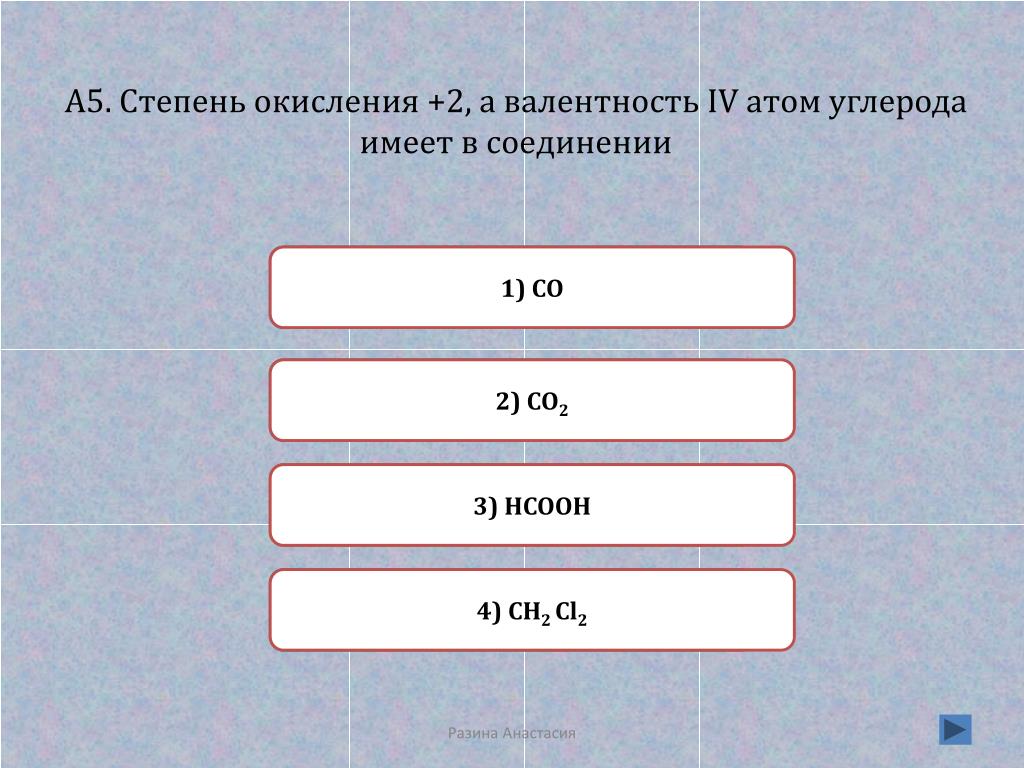 Вот что вы делаете. Возьмем типичное соединение, например, \(FeCl_3\). Рассматривайте каждую связь между металлом и другим атомом, как если бы это была ионная связь. Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Вот что вы делаете. Возьмем типичное соединение, например, \(FeCl_3\). Рассматривайте каждую связь между металлом и другим атомом, как если бы это была ионная связь. Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Если соединение является нейтральным, сумма степеней окисления также должна быть нейтральной. (Если соединение имеет заряд, вы соответственно корректируете степени окисления, чтобы их сумма равнялась заряду).
А теперь веселое упражнение. Попробуйте применить те же правила к углероду. Это будет немного странно. Почему? Потому что есть два ключевых отличия:
- Первый , углерод часто более электроотрицательный (2,5), чем некоторые из атомов, с которыми он связан (например, H, 2,2). Так что же делать в этом случае?
- Во-вторых, в отличие от связей металл-металл связи углерод-углерод распространены повсеместно.
 Итак, как вы справляетесь с ними?
Итак, как вы справляетесь с ними?
Два ответа.
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1. Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1, .
- Любые две связи между одним и тем же атомом не влияют на степень окисления (напомним, что степень окисления Cl в Cl-Cl (и H в H-H) равна нулю. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот некоторые примеры.
(Не забывайте, что это называется «формализм» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степени окисления углерода, мы готовы к следующему шагу: пониманию изменяет в степени окисления углерода посредством реакций, известных как окисления (где степень окисления увеличивается) и восстановления (где степень окисления уменьшается). Подробнее об этом в следующий раз.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.


 Итак, как вы справляетесь с ними?
Итак, как вы справляетесь с ними?
Leave A Comment