Химические свойства гидроксидов и кислот
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Характерные химические свойства оснований, и амфотерных гидроксидов. Характерные химические
свойства кислот.
1. Гидроксид калия взаимодействует с каждым из двух веществ
1) NH3 и HCl 2) CO2 и CuCl2 3) H2SO4 и NaNO3 4) MgO и HNO3
2. Разбавленная хлороводородная кислота взаимодействует с каждым из двух веществ
1) медью и гидроксидом натрия
2) магнием и нитратом серебра
3) железом и оксидом кремния (IV)
4) свинцом и нитратом калия
3. С соляной кислотой взаимодействует
1) NaHCO3 2)Hg 3) SiO2 4) S
4. Реакция нейтрализации происходит при взаимодействии
1) Fe2O3 и HCl
2) Fe(OH)3 и HCl
3) FeCl3 и NaNCS
5. Гидроксид железа (II) взаимодействует с
Гидроксид железа (II) взаимодействует с
1) азотной кислотой
2) оксидом кальция
3) сульфатом меди
4) аммиаком
6. Разбавленная серная кислота не взаимодействует с
1) гидроксидом кальция
2) оксидом меди (II)
3) цинком
4) оксидом углерода (IV)
7. С гидроксидом калия реагирует каждое из двух веществ
1) AlCl3 и H2S
2) CuO и Ba(OH)2
3) CaCO3 и NH3
4) K2SO4 и AlCl3
8. Гидроксид кальция реагирует с каждым из двух веществ
1) HCl и СО2
2) HNO3 и MgO
3) HCl и KOH
4) BaCl2 и NaOH
9. Гидроксид калия реагирует с
1) водой
2) щелочью
3) кислотой
4) кислотой и щелочью
10. Гидроксид кальция не взаимодействует
1) HCl 2) ZnS 3) CO2 4) HNO3
11. Гидроксид хрома (III) реагирует с каждым из двух веществ
Гидроксид хрома (III) реагирует с каждым из двух веществ
1) СО2 и HCl
2) SiO2 и Cu(OH)2
3) NO и NaNO3
4) H2SO4 и NaOH
12. Реакция нейтрализации происходит между
1) | цинком и соляной кислотой |
2) | серной кислотой и хлоридом бария |
3) | гидроксидом кальция и азотной кислотой |
4) | гидроксидом натрия и сульфатом меди |
13 . С раствором серной кислоты взаимодействует каждое из двух веществ:
1) | хлорид бария и оксид углерода (IV) |
2) | магний и хлорид бария |
3) | хлорид натрия и фосфорная кислота |
4) | медь и гидроксид калия |
14. Гидроксид кальция реагирует с
Гидроксид кальция реагирует с
1) | Ba(NO3)2 | 2) | KCl | 3) | NH3·H2O | 4) | Na3PO4 |
15. Концентрированная азотная кислота в обычных условиях не взаимодействует с
1) | магнием |
2) | гидроксидом натрия |
3) | железом |
4) | оксидом магния |
16. При сливании водных растворов уксусной кислоты и гидроксида калия образуется
При сливании водных растворов уксусной кислоты и гидроксида калия образуется
1) | ацетат калия и водород |
2) | карбонат калия и вода |
3) | ацетат калия и вода |
4) | карбид калия и углекислый газ |
17. Гидроксид натрия не реагирует с
1) | Al(OH)3 | 2) | 3) | H2SO4 | 4) | Ba(OH)2 |
18. Разбавленная серная кислота реагирует с каждым из двух веществ:
Разбавленная серная кислота реагирует с каждым из двух веществ:
1) | Na2SiO3 и HNO3 |
2) | Fe2O3 и KNO3 |
3) | Ag и Cu(OH)2 |
4) | Fe и Al2O3 |
19. Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
1) | CuO | 2) | H2SO4 | 3) | CO2 | 4) | NaOH |
20. Соляная кислота не взаимодействует ни с одним из двух веществ:
Соляная кислота не взаимодействует ни с одним из двух веществ:
1) | цинком и гидроксидом натрия |
2) | медью и оксидом меди (II) |
3) | ртутью и оксидом углерода (IV) |
4) | магнием и аммиаком |
21. С каждым из перечисленных веществ: H2S, KOH, Zn
взаимодействует
1) | Pb(NO3)2 | 2) | ZnSO4 | 3) | Na2CO3 | 4) | HCl |
22. Разбавленная серная кислота может реагировать с каждым из двух веществ:
Разбавленная серная кислота может реагировать с каждым из двух веществ:
1) | серой и магнием |
2) | оксидом железа (II) и оксидом кремния (IV) |
3) | гидроксидом калия и хлоридом калия |
4) | нитратом бария и гидроксидом меди (II) |
23. С раствором серной кислоты взаимодействует каждое из двух веществ:
1) | хлорид бария и оксид углерода (IV) |
2) | магний и хлорид бария |
3) | хлорид натрия и фосфорная кислота |
4) | медь и гидроксид калия |
24. Концентрированная азотная кислота в обычных условиях не взаимодействует с
Концентрированная азотная кислота в обычных условиях не взаимодействует с
1) | магнием |
2) | гидроксидом натрия |
3) | железом |
4) | оксидом магния |
25. Раствор гидроксида натрия реагирует с каждым из веществ, указанных попарно
1) | хлоридом железа (III) и углекислым газом |
2) | оксидом железа (II) и соляной кислотой |
3) | серной кислотой и карбонатом кальция |
4) | оксидом цинка и хлоридом калия |
26. Гидроксид натрия не реагирует с
Гидроксид натрия не реагирует с
1) | Al(OH)3 | 2) | ZnO | 3) | H2SO4 | 4) | Ba(OH)2 |
27. Разбавленная серная кислота реагирует с каждым из двух веществ:
1) | Na2SiO3 и HNO3 |
2) | Fe2O3 и KNO3 |
3) | Ag и Cu(OH)2 |
4) | Fe и Al2O3 |
28. Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
1) | CuO | 2) | H2SO4 | 3) | CO2 | 4) | NaOH |
29. Соляная кислота не взаимодействует ни с одним из двух веществ:
1) | цинком и гидроксидом натрия |
2) | медью и оксидом меди (II) |
3) | ртутью и оксидом углерода (IV) |
4) | магнием и аммиаком |
30. Раствор гидроксида натрия не взаимодействует с
Раствор гидроксида натрия не взаимодействует с
1) | СО2 | 2) | HСl | 3) | SO2 | 4) | MgO |
ОТВЕТЫ: 1-2, 2-2, 3-1, 4-2, 5-1, 6-4, 7-1, 8-1, 9-3, 10-2, 11-4, 12-3, 13-2, 14-4, 15-1, 16-3, 17-4, 18-4, 19-4, 20-3, 21-1, 22-4, 23-2, 24-3, 25-3, 26-4, 27-4, 28-4, 29-3, 30-4, 31-1.
что, как сбалансировать и часто задаваемые вопросы —
By Дебашрути Бандйопадхьяй
В реакции HCl + KOH участвуют соляная кислота (HCl) и гидроксид калия (KOH), сильное основание. Давайте изучим некоторые интересные факты о реакции HCl + KOH.
Соляная кислота представляет собой раствор хлористого водорода с водой и в основном существует в жидком виде. В воде диссоциирует на ионы H+ и Cl-. 36.458 г/моль — молярная масса HCl. Гидроксид калия является сильным основанием. Он растворяется и диссоциирует в воде как K+ и ОН– ионы и гигроскопический в природе.
В воде диссоциирует на ионы H+ и Cl-. 36.458 г/моль — молярная масса HCl. Гидроксид калия является сильным основанием. Он растворяется и диссоциирует в воде как K+ и ОН– ионы и гигроскопический в природе.
В этой статье мы изучим различные факты реакций «HCl + KOH», такие как продукт реакции, ионное уравнение и т. д.
Что является продуктом HCl и KOH?HCl и KOH реагируют друг с другом с образованием хлорида калия (KCl) и побочного продукта воды (H2O).
HCl + КОН = KCl + H2O
Какой тип реакции HCl + KOH?HCl + KOH представляет собой реакция нейтрализации. Потому что в этой реакции HCl (кислота) реагирует с KOH (основанием), образуя KCl, который является солью.
Как сбалансировать HCl + KOH?Компания HCl + КОН реакция является уравновешенной реакцией, поэтому ее не нужно уравновешивать. Число атомов в правой части реакции такое же, как и в левой.
Число атомов в правой части реакции такое же, как и в левой.
HCl + КОН = KCl + H2O
HCl + KOH титрованиеИспользуемый аппарат- бюретка,
- пипетка,
- Коническая колба,
- стакан,
- Мерный (градуированный) цилиндр,
- Воронка,
- подставка для бюреток,
- Стеклянный стержень
In HCl + КОН реакция, KOH – титрант, HCl – титр.
Используемый индикаторфенолфталеин можно использовать как индикатор. Для сильной кислоты против сильного основания титрование другие индикаторы, такие как метиловый оранжевыйи крезол красный также могут быть использованы в качестве индикаторов.
Обработка- Бюретка была заполнена КОН.

- В коническую колбу отбирали HCl и добавляли индикатор фенолфталеин.
- Затем из бюретки в коническую колбу по каплям добавляли КОН.
- Раствор из бесцветного станет бледно-розовым по достижении конечной точки.
- Показания записывали с бюретки для измерения количества КОН, израсходованного для нейтрализации реакции.
Общее ионное уравнение можно определить, выполнив следующие шаги:
- Реагенты должны диссоциировать на соответствующие ионы.
- диссоциация превращение реагентов в ионы даст полное ионное уравнение.
- Тогда зрительские ионы следует удалить из обеих частей уравнения, чтобы получить чистое ионное уравнение.
После выполнения вышеупомянутых шагов уравнение будет выглядеть так:Ионное уравнение
Сопряженные пары HCl + KOH- Сопряженное основание HCl = Cl– (КСl)
- Сопряженная кислота KOH = H+ (H2O).

- В HCl оба Лондонские дисперсионные силы и диполь-дипольные взаимодействия присутствуют в виде межмолекулярных сил.
- В KOH лондонские дисперсионные силы, диполь-дипольные силы и водородная связь присутствуют в виде межмолекулярных сил.
Компания энтальпия реакции HCl + KOH составляет -55.84 кДж. Энтальпия реакции рассчитывается следующим образом:
Энтальпия продуктов – Энтальпия реагентов = Энтальпия реакции
| Соединения | Энтальпия (кДж/моль) |
|---|---|
| HCl | -167.15 |
| KOH | -482.39 |
| KCI | -419. 55 55 |
| H2O | -285.83 |
HCl + KOH не является буферный раствор потому что буферный раствор представляет собой раствор слабой кислоты и сопряженного с ней основания.
Является ли HCl + KOH полной реакцией?HCl + KOH является полной реакцией, потому что оба реагента, HCl и KOH, расходуются полностью.
Реакция HCl + KOH экзотермическая или эндотермическая?Реакция HCl + KOH представляет собой экзотермическая реакция. Потому что реакция приводит к повышению температуры реакции.
Является ли HCl + KOH окислительно-восстановительной реакцией?Реакция HCl + KOH не является окислительно-восстановительная реакция. Так как в этой реакции окисление и восстановление не происходят одновременно.
Реакция HCl + KOH не является реакция осаждения, потому что в этой реакции не образуется нерастворимый продукт или осадок.
Является ли реакция HCl + KOH обратимой или необратимой?Реакция HCl + KOH является необратимой реакцией, поскольку в ней участвуют кислота и основание, что приводит к образованию соли, и оба реагента полностью расходуются.
Реакция замещения HCl + KOH?Реакция HCl + KOH представляет собой реакция двойного вытеснения потому что кл– ион вытесняется из HCl и соединяется с K+ с образованием KCl. Кроме того, ОХ– ион вытесняется из K+ и сочетается с H+ чтобы сформировать H2O.Двойная реакция смещения
Заключение
Реакция HCl + KOH является кислотно-щелочной реакцией нейтрализации. В этой реакции участвуют сильная кислота и сильное основание. Реакция HCl + KOH приводит к образованию соли (KCl) в качестве продукта, который находит свое применение в промышленности и лабораториях.
Реакция HCl + KOH приводит к образованию соли (KCl) в качестве продукта, который находит свое применение в промышленности и лабораториях.
Узнайте больше фактов о HCl:
Как прореагирует гидроксид калия с соляной кислотой?
Последняя обновленная дата: 12 марта 2023 г.
•
Общее представление: 235,5K
•
Просмотры сегодня: 3,16K
Ответ
Проверено
235.5K+ виды
HINT: 9003 кислоты и основания называют реакцией нейтрализации. Продукты, полученные после реакции, представляют собой соль и воду.
Полный пошаговый ответ: 9- }\]). При растворении хлороводорода в воде образуются ион водорода и ион хлора. Таким образом, хлористый водород является кислотой.
Это также очень сильная кислота из-за полной диссоциации, и ионы остаются в виде свободных ионов. В этом случае сильное основание вступает в реакцию с сильной кислотой. Таким образом, происходит реакция нейтрализации. Реакция записывается как
Реакция записывается как
$KOH(водн.) + HCl(водн.) \to KCl(водн.) + {H_2}O(л)$
Продуктами реакции являются \[KCl\](соль) которая остается в водной форма и вода. Наряду с этими продуктами в реакции выделяется также теплота нейтрализации. Реакция сильного основания и сильной кислоты обычно дает нейтральный раствор. Однако это зависит от прочности соответствующих растворов.
Примечание:
Происходит реакция нейтрализации, в результате которой образуется растворимая соль. Образовавшаяся таким образом растворимая соль образована комбинацией катиона основания и аниона кислоты.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
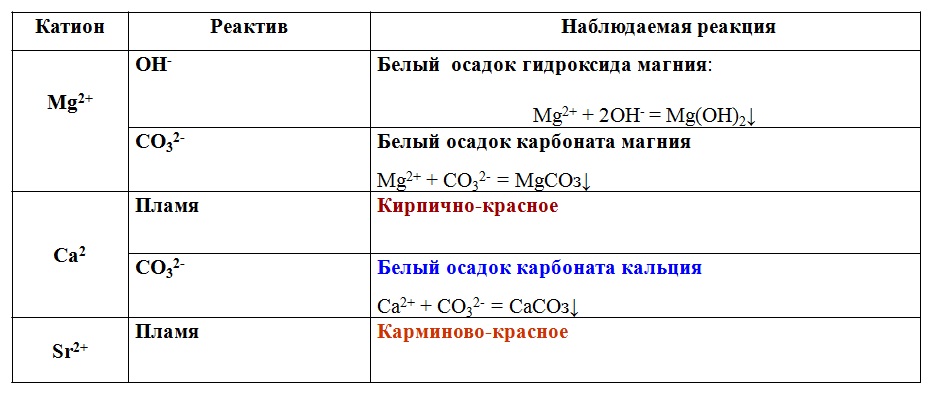
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 по химии JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 по химии JEE_Main
В Индии на по случаю брака фейерверк 12 класс химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класс химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 по химии JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 по химии JEE_Main
60659- Burette,
- Pipette,
- Conical flask,
- Beaker,
- Measuring (graduated) cylinder,
- Funnel,
- Burette stand,
- Glass rod
- Бюретка была заполнена КОН.
- HCl отбирали в коническую колбу и добавляли индикатор фенолфталеин.
- Затем из бюретки в коническую колбу по каплям добавляли КОН.
- При достижении конечной точки раствор из бесцветного станет бледно-розовым.
- Показания записывали с бюретки для измерения количества КОН, израсходованного для нейтрализации реакции.
- Реагенты должны диссоциировать на соответствующие ионы.
- Диссоциация реагентов на ионы дает полное ионное уравнение.

- Затем ионы-спектаторы должны быть удалены из обеих частей уравнения, чтобы получить результирующее ионное уравнение.
- Сопряженное основание HCl
- Сопряженная кислота KOH = H + (H 2 O).
- В HCl в виде межмолекулярных сил присутствуют как лондоновские дисперсионные силы, так и диполь-дипольные взаимодействия.
- В КОН лондонские дисперсионные силы, диполь-дипольные силы и водородные связи присутствуют как межмолекулярные силы.
Актуальные сомнения
Что, как сбалансировать и часто задаваемые вопросы —
Автор Debashruti Bandyopadhyay
В реакции HCl + KOH участвуют соляная кислота (HCl) и гидроксид калия (KOH), сильное основание. Давайте изучим некоторые интересные факты о реакции HCl + KOH.
Давайте изучим некоторые интересные факты о реакции HCl + KOH.
Соляная кислота представляет собой раствор хлороводорода в воде и в основном существует в жидкой форме. В воде диссоциирует на ионы H+ и Cl-. 36,458 г/моль — молярная масса HCl. Гидроксид калия является сильным основанием. Он растворяется и диссоциирует в воде в виде ионов K + и OH – и по своей природе гигроскопичен.
В этой статье мы изучим различные факты реакций «HCl + KOH», такие как продукт реакции, ионное уравнение и т. д.
Что является продуктом HCl и KOH?HCl и KOH реагируют друг с другом с образованием хлорида калия (KCl) и побочной воды (H 2 O).
HCl + KOH = KCl + H 2 O
Какой тип реакции HCl + KOH? HCl + KOH является реакцией нейтрализации. Потому что в этой реакции HCl (кислота) реагирует с KOH (основанием), образуя KCl, который является солью.
Реакция HCl + KOH является уравновешенной реакцией, поэтому ее не нужно уравновешивать. Число атомов в правой части реакции такое же, как и в левой.
HCl + KOH = KCl + H 2 O
HCl + KOH titration Apparatus UsedВ реакции HCl + KOH KOH является титрантом, а HCl является титром.
Используемый индикатор В качестве индикатора можно использовать фенолфталеин. Для титрования сильных кислот и сильных оснований в качестве индикаторов также можно использовать другие индикаторы, такие как метиловый оранжевый и крезоловый красный.
Для титрования сильных кислот и сильных оснований в качестве индикаторов также можно использовать другие индикаторы, такие как метиловый оранжевый и крезоловый красный.
Суммарное ионное уравнение можно определить, используя следующие шаги:
После выполнения вышеуказанных шагов уравнение будет выглядеть следующим образом: Ионное уравнение
Сопряженные пары HCl + KOH Энтальпия реакции HCl + KOH составляет -55,84 кДж. Энтальпия реакции рассчитывается следующим образом:
Энтальпия реакции рассчитывается следующим образом:
Энтальпия продуктов – Энтальпия реагентов = Энтальпия реакции
| Соединения | Энтальпия (кДж/моль) |
|---|---|
| HCl | -167.15 |
| KOH | -482.39 |
| KCl | -419.55 |
| H 2 O | -285.83 |
HCl + KOH не является буферным раствором, поскольку буферный раствор представляет собой раствор слабой кислоты и сопряженного с ней основания.
Является ли HCl + KOH полной реакцией? Реакция HCl + KOH является полной, поскольку оба реагента, HCl и KOH, расходуются полностью.
Реакция HCl + KOH является экзотермической реакцией. Потому что реакция приводит к повышению температуры реакции.
Является ли HCl + KOH окислительно-восстановительной реакцией?Реакция HCl + KOH не является окислительно-восстановительной реакцией. Так как в этой реакции окисление и восстановление не происходят одновременно.
Является ли HCl + KOH реакцией осаждения?Реакция HCl + KOH не является реакцией осаждения, поскольку в этой реакции не образуется нерастворимый продукт или осадок.
Является ли реакция HCl + KOH обратимой или необратимой? Реакция HCl + KOH является необратимой реакцией, поскольку в ней участвуют кислота и основание, что приводит к образованию соли, и оба реагента полностью расходуются.


Leave A Comment