Сколько валентных электронов имеет хлор (Cl)? Хлорная валентность.
Автор Alexander Stephenson На чтение 10 мин Просмотров 2.7к. Опубликовано
Хлор — элемент номер 17 в периодической таблице. Он также является частью группы-17. Его символ «Cl». Через свои валентные электроны хлор образует связи. В этой статье подробно обсуждаются элементы валентности хлора.
Это второй по легкости галоген. Он появляется между фтором и бромом в периодической таблице, и его свойства в основном находятся между ними. При комнатной температуре хлор представляет собой зеленовато-желтую жидкость. Дыхательная система и глаза поражаются токсичным, едким, желто-зеленым газообразным хлором. Это очень реакционноспособный элемент и окислитель. Он занимает третье место по электроотрицательности и сродству к электрону в пересмотренной шкале элементов Полинга.
Содержание
- История
- Приложения
- Положение хлора в периодической таблице
- биологическая роль
- Хлор влияет на здоровье
- изотопы
- естественное изобилие
- Воздействие хлора на окружающую среду
- Какова валентность элементов хлора?
- Какое количество электронов, нейтронов и протонов имеет хлор?
- Как найти число валентных нейтронов в атоме хлорофилла?
- Расчет общего числа электронов в хлоре
- Вам нужно будет выполнить электронную настройку хлора.

- Рассчитайте общее количество электронов и определите валентную оболочку.
- Образование соединений хлора (Cl)
- Сколько валентных электронов имеет ион хлора (Cl- )?
- Какова валентность хлора (Cl)?
- акты
- Рекомендации:
Поскольку хлор может соединяться почти со всеми элементами, он не встречается в природе без него. Карл Вильгельм Шееле, шведский ученый и химик, первым получил хлор. Он объединил минерал пиролюзит (MnO 2 ) с соляной кислотой (HCl) в 1774 году . Шееле считал, что полученный им газ содержит кислород. Однако сэр Хамфри Дэви в 1810 году показал, что это отдельный элемент. Электролиз водного хлорида натрия (NaCl) сегодня является основным методом производства большей части хлора.
Хлорсодержащие антисептики часто используются для очистки питьевой воды и обслуживания бассейнов. Во многих промышленных процессах используется большое количество хлора, включая производство бумаги и пластмассовых изделий.
Он убивает бактерии и используется в качестве дезинфицирующего средства. Применяется для дезинфекции бассейнов и питьевой воды. Его также можно использовать для производства сотен потребительских товаров, включая бумагу, краски, текстиль и инсектициды. В прошлом хлор использовался для изготовления анестетиков, таких как хлороформ и четыреххлористый углерод, в качестве растворителя для химической чистки. Оба химических вещества могут вызвать повреждение печени и в настоящее время строго контролируются.
Органическая химия – еще одно важное применение хлора. Он используется в реакциях замещения и в качестве окислителя. В какой-то момент производственного процесса 85% фармацевтических продуктов содержат хлор или одно из его соединений. ПВХ производится примерно из 20% произведенного хлора. Этот универсальный пластик используется для изготовления оконных рам, салонов автомобилей и изоляции электропроводки. Его также можно использовать для изготовления виниловых полов.
Положение хлора в периодической таблице
биологическая рольИон хлора играет жизненно важную роль в нашем существовании. Он в основном содержится в клеточных жидкостях в виде отрицательного иона, который уравновешивает положительные ионы (в основном калий). Его также можно найти во внеклеточной жидкости (например, в крови) для балансировки положительного (в основном натрия).
Большая часть необходимого нам хлорида поступает из соли. Среднесуточное потребление соли составляет 6 граммов. Тем не менее, мы могли бы легко обойтись половиной этой суммы.
Хлор влияет на здоровье
Высокореактивный газ – хлор. Это элемент природного происхождения. Компании, производящие дихлорид этилена, другие хлорированные растворители и поливинилхлоридные (ПВХ) смолы, хлорфторуглероды и диоксид пропилена, являются крупнейшими потребителями хлора. Чтобы отбелить бумагу, бумажные компании используют хлор. Для снижения уровня микроорганизмов в очистных сооружениях воды и сточных вод используется хлор.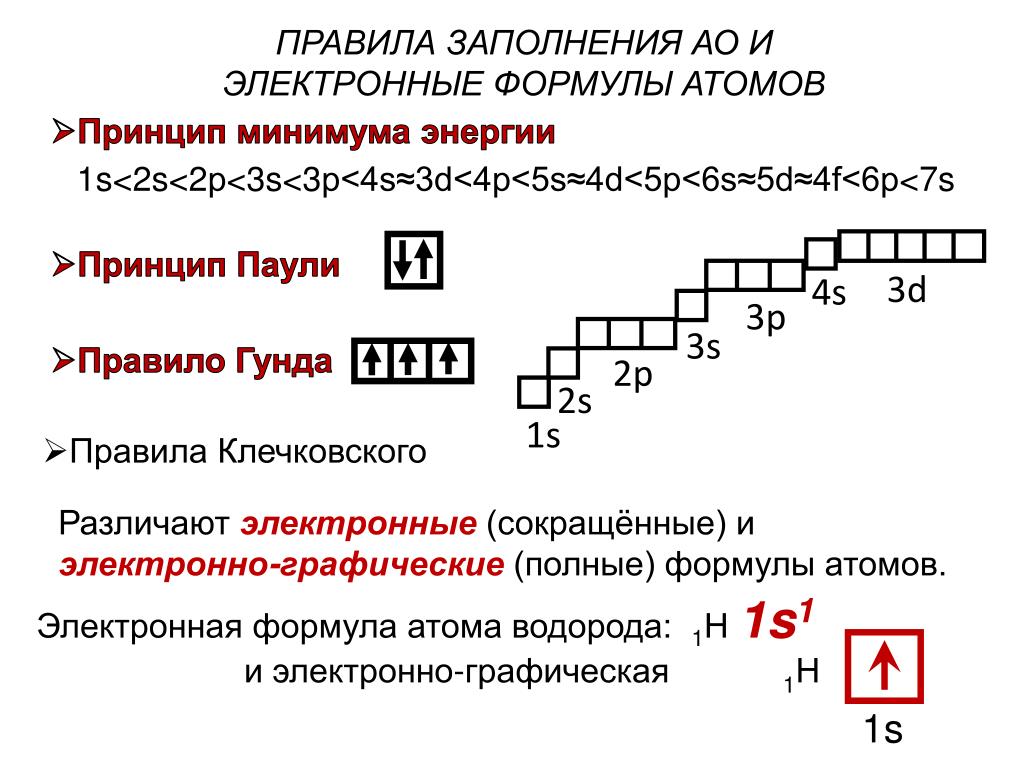 Это может привести к распространению болезней среди людей (дезинфекция).
Это может привести к распространению болезней среди людей (дезинфекция).
После контакта с водой, воздухом и почвой хлор может попасть в окружающую среду или на рабочее место. Люди, которые используют хлорсодержащие отбеливатели для стирки или химикаты для бассейнов, обычно не подвергаются воздействию хлора. В промышленных условиях хлор обычно содержится в небольших количествах.
изотопыДва стабильных изотопа хлора — Cl-35 и Cl-337. Смесь этих изотопов — это то, что вы найдете в природе в виде хлора.
| атомный номер | 17 |
|---|---|
| атомный вес | от 35 446 до 35 457 |
| Точка кипения | -34°C (-29°F) |
| температура плавления | -103°C (-153°F) |
| плотность (1 атм, 0 ° C или 32 ° F) | 3,214 г/л (0,429 унции/галлон) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | 1 секунда 2 2 секунды 2 2 стр. 6 3 стр. 2 3 стр. 5 6 3 стр. 2 3 стр. 5 |
В природе вы найдете хлор, смешанный с другими элементами. Основным минералом, используемым для извлечения хлора, является галит, также известный как хлорид натрия или «обычная морская соль». Соль хлорида натрия, которая хорошо растворяется, просачивалась в океаны на протяжении всей жизни Земли. Есть несколько соляных пластов или «озёр», которые можно найти в районах, где испарились древние моря. Они могут быть извлечены для извлечения хлорида.
Минералы карналлит, представляющий собой хлориды магния и калия, и сильвит, оба из которых богаты хлором, также содержат хлор.
Воздействие хлора на окружающую среду
При смешивании с водой хлор растворяется. При определенных условиях он может вырваться из воды и подняться в воздух. Окружающая среда несет основную тяжесть выбросов хлора непосредственно в атмосферу и поверхностные воды. Хлор вступает в реакцию с другими химическими веществами, когда он находится в воздухе или воде. Реагирует с водой с образованием хлористых солей.
Хлор вступает в реакцию с другими химическими веществами, когда он находится в воздухе или воде. Реагирует с водой с образованием хлористых солей.
Какова валентность элементов хлора?
Элемент-неметалл хлор также можно назвать элементом галогена. Общее количество электронов на последней орбите оболочки (валентных электронов) называется валентными электронами. Валентные электроны – это общее количество электронов внутри оболочки, которые были сформированы конфигурацией хлора. Свойства элемента определяются валентными электронами. Они также участвуют в тренировочных облигациях.
Какое количество электронов, нейтронов и протонов имеет хлор?
Ядро можно найти в середине атома. Ядро содержит протоны и нейтроны. Атомный номер хлора равен 17. Число протонов в веществе называется атомным номером. Количество протонов, обнаруженных в хлоре, равно 17. Ядро содержит электронную оболочку, равную протонам. Всего атом хлора может иметь 17 электронов.
Разница между числом атомных масс и числом атомов определяет количество нейтронов в элементе.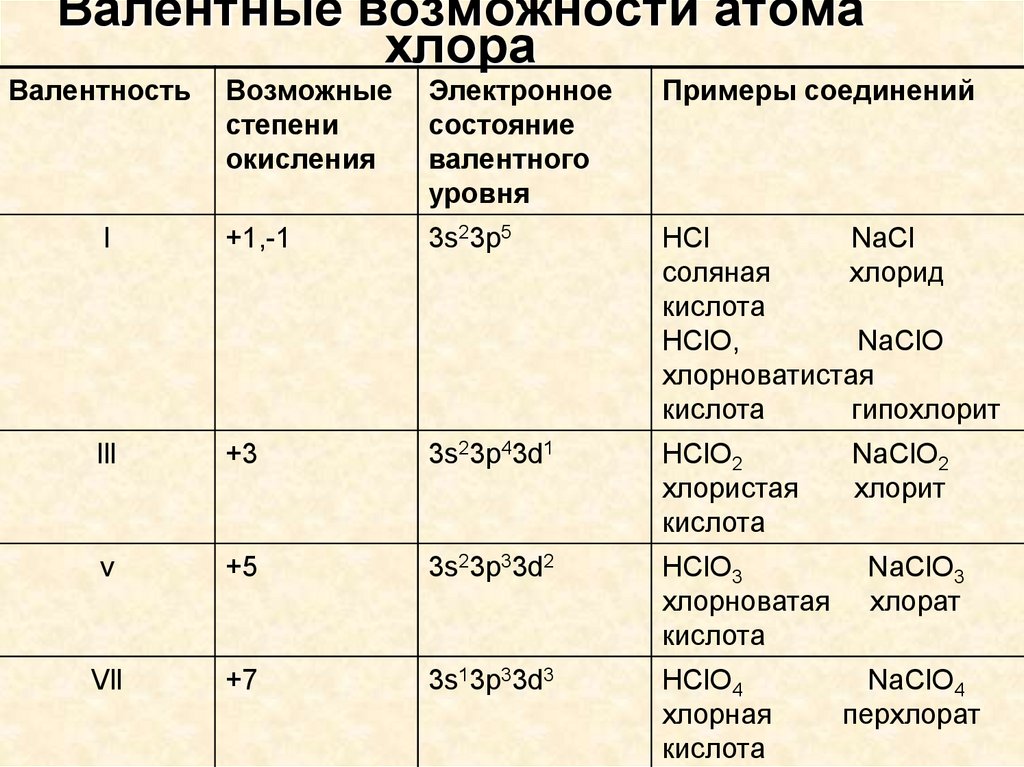 Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Мы знаем, что атомное количество хлора равно 17, а его атомная масса равна 35 (35,45 u). Нейтрон (n) = 35 – 17 = 18. Следовательно, количество нейтронов, обнаруженных в хлоре (Cl), равно 18.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначаются римскими цифрами (I, II, III, IV, V, VI, VII, VIII).
Как найти число валентных нейтронов в атоме хлорофилла?
Вот шаги для определения валентных электронов. Одним из них является электронная конфигурация. Без электронной конфигурации невозможно определить валентность электрона. Легко определить электронную конфигурацию всех элементов.
Легко определить электронную конфигурацию всех элементов.
Однако можно идентифицировать валентные электроны, размещая электроны в соответствии с принципом Бора. Теперь мы научимся определять валентный электрон хлора.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Оно может быть положительным или отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Расчет общего числа электронов в хлоре
Во-первых, мы должны знать число электронов, присутствующих в атоме хлора. Вам нужно знать, сколько протонов в хлоре, чтобы определить количество электронов. Чтобы найти число протонов в хлоре, необходимо также знать его атомный номер.
Периодическая таблица необходима для определения атомного номера. Периодическая таблица содержит атомные номера элементов хлора. Число протонов называется атомным номером. Ядро также содержит электроны, такие же, как протоны.
Число протонов называется атомным номером. Ядро также содержит электроны, такие же, как протоны.
Это означает, что теперь мы можем сказать, что число электронов в атоме хлора равно его атомному номеру. Атомный номер хлора по периодической таблице равен 17. Это означает, что общее число электронов в атоме хлора равно 17.
- Валентность – это числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам его бинарных соединений с водородом или кислородом.
Вам нужно будет выполнить электронную настройку хлора.
Важный шаг 2. Этот шаг включает в себя упорядочение электронов хлорида. Электронная конфигурация хлора такова, что внутри оболочки K находятся два электрона, внутри оболочки L восемь и внутри оболочки M семь. Электронная конфигурация хлора показывает, что первая оболочка содержит два электрона, а вторая оболочка имеет восемь электронов. Третья оболочка содержит семь электронов. По суборбитальной орбите электронная конфигурация хлора выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 5 .
Электронная конфигурация хлора показывает, что первая оболочка содержит два электрона, а вторая оболочка имеет восемь электронов. Третья оболочка содержит семь электронов. По суборбитальной орбите электронная конфигурация хлора выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 5 .
Рассчитайте общее количество электронов и определите валентную оболочку.
Третий шаг – определение валентности. Валентная оболочка является последней оболочкой после электронной конфигурации. Количество электронов, находящихся в валентной оболочке, известно как валентные электроны. Электронная конфигурация указывает на то, что последний слой хлора имеет семь электронов. Валентных электронов хлора (Cl) семь.
Образование соединений хлора (Cl)
Через свой валентный электрон хлор (Cl) участвует в образовании связи. Эти валентные электроны участвуют в образовании связи с другими элементами. Электронная конфигурация натрия указывает на то, что валентные элементы натрия существуют как одно целое. Атом натрия отдает свои валентные электроны, а хлор их получает.
Атом натрия отдает свои валентные электроны, а хлор их получает.
Таким образом приобретаются электронные конфигурации хлора и натрия. Путем обмена электронами атомы натрия и хлора образуют хлорид натрия (NaCl). Ионной связью является хлорид натрия (NaCl).
Сколько валентных электронов имеет ион хлора (Cl-
) ?При образовании связи элементы с 5, 6 или 7 электронами получают электроны от содержащей их оболочки. Анионы – это элементы, которые имеют электроны и могут образовывать связи. Последний слой хлора подвергается воздействию электрона во время образования связи и становится ионом хлора (Cl- ) . Вот почему хлор называют анионом.
Электронная конфигурация иона хлора (Cl- ) выглядит следующим образом : 1s 2 2s 2 2p 6 3s 2 3p 6 . Электронная конфигурация ионов хлора (Cl- ) показывает, что у иона хлора (Cl- ) есть три оболочки и что третья оболочка содержит восемь электронов. Эта электронная конфигурация указывает на то, что ион хлора теперь и имеет электронную конфигурацию аргона. В этом случае валентность ионов хлора равна -1. Валентные электроны ионов хлора (Cl- ) имеют восемь электронов на оболочке, содержащей последнюю оболочку ионов хлора.
Эта электронная конфигурация указывает на то, что ион хлора теперь и имеет электронную конфигурацию аргона. В этом случае валентность ионов хлора равна -1. Валентные электроны ионов хлора (Cl- ) имеют восемь электронов на оболочке, содержащей последнюю оболочку ионов хлора.
Какова валентность хлора (Cl)?
Валентность (или валентность) — это способность атома элемента связываться с другим атомом при образовании молекулы. Валентность — это количество неспаренных электронов, находящихся на последней орбите элемента. В основном состоянии правильной электронной конфигурацией для хлора (Cl) будет 1s 2 2s 2 2p 6 3s 2 3p x 2 3p y 2 3p z 1 .
Эта электронная конфигурация указывает на то, что последний атом хлора имеет неспаренный электрон (3p 1 ). Возбуждение может изменить степень окисления хлора. Степени окисления хлора от -1 до +1, +2, +3, +4, +5, +6, +7.
Таким образом, валентность хлора равна 1.
акты
- Третьим наиболее распространенным элементом в океанах Земли является хлор.
- Хлорид натрия или поваренная соль — наиболее распространенное природное соединение хлора.
- Атомы хлора составляют около 1,9% массы океанов.
- Хлор является 21-м наиболее распространенным элементом в почве Земли.
- Предпочтительным химическим оружием был газообразный хлор, который применялся в Первой мировой войне.
- Хлор в контейнерах можно обнаружить с помощью нашатырного спирта.
- Электролиз воды, содержащей растворенный хлорид натрия (соленая вода), используется для получения большей части газообразного хлора для промышленности.

- Хлор вступит в реакцию с аммиаком и создаст над утечкой белое облако.
- Левитин, Х; Бранском, Вт; Эпштейн, FH (декабрь 1958 г.). «Патогенез гипохлоремии при респираторном ацидозе». Дж. Клин. инвестировать _
- Генри М. Лестер, Герберт С. Кликштейн, Справочник по химии, 1400-1900 гг., (1969) Издательство Гарвардского университета.
- Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company.
- Антуан Лавуазье, Мемуары Королевской академии наук, 1783 г.
Сколько валентных электронов имеет хлор (Cl)? Хлорная валентность.
Автор Alexander Stephenson На чтение 10 мин Просмотров 330 Опубликовано
Хлор — 17-й элемент периодической таблицы. Он также входит в группу-17. Его символ «Cl». Через свои валентные электроны хлор образует связи. В этой статье будут подробно рассмотрены валентные элементы для хлора.
В этой статье будут подробно рассмотрены валентные элементы для хлора.
Это второй по легкости галоген. Он находится между фтором и бромом в периодической таблице, и его свойства в основном промежуточные. При комнатной температуре хлор представляет собой желто-зеленую жидкость. Дыхательная система и глаза поражаются токсичным, едким, желтовато-зеленым газообразным хлором. Это очень реакционноспособный элемент и окислитель. Он занимает третье место по электроотрицательности и сродству к электрону в пересмотренной шкале элементов Полинга.
Содержание
- История
- Использование
- Положение хлора в периодической таблице.
- Биологическая роль
- Хлор влияет на здоровье
- Изотопы
- Природное изобилие
- Воздействие хлора на окружающую среду
- Какова валентность элементов хлора?
- Каким числом электронов, нейтронов и протонов обладает хлор?
- Как узнать число валентных нейтронов в атоме хлорофилла?
- Расчет общего числа электронов в хлоре
- Вам нужно будет выполнить электронную конфигурацию хлора
- Рассчитайте общее количество электронов и определите валентную оболочку
- Образование соединения хлора (Cl)
- Сколько валентных электронов имеет ион хлора (Cl- )?
- Какова валентность хлора (Cl)?
- Факты
- Рекомендации:
Поскольку хлор может соединяться почти со всеми элементами, он не встречается в природе без него. Карл Вильгельм Шееле, шведский ученый и химик, первым получил хлор. Он объединил минерал пиролюзит (MnO2) с соляной кислотой (HCl) в 1774 году . Шееле считал, что полученный им газ содержит кислород. Однако сэр Хамфри Дэви доказал, что это отдельный элемент в 1810 году. Электролиз водного хлорида натрия (NaCl) является основным методом производства большей части хлора сегодня.
Карл Вильгельм Шееле, шведский ученый и химик, первым получил хлор. Он объединил минерал пиролюзит (MnO2) с соляной кислотой (HCl) в 1774 году . Шееле считал, что полученный им газ содержит кислород. Однако сэр Хамфри Дэви доказал, что это отдельный элемент в 1810 году. Электролиз водного хлорида натрия (NaCl) является основным методом производства большей части хлора сегодня.
Антисептический хлор часто используется при очистке питьевой воды и обслуживании бассейнов. Многие промышленные процессы используют большое количество хлора, включая производство бумажных изделий и пластмасс.
ИспользованиеОн убивает бактерии и используется в качестве дезинфицирующего средства. Он используется для дезинфекции плавательных бассейнов и питьевой воды. Его также можно использовать для производства сотен потребительских товаров, включая бумагу, краски, текстиль и инсектициды. В прошлом хлор использовался для изготовления анестетиков, таких как хлороформ и растворитель для химической чистки четыреххлористый углерод. Оба этих химических вещества могут вызвать повреждение печени и в настоящее время строго контролируются.
Оба этих химических вещества могут вызвать повреждение печени и в настоящее время строго контролируются.
Органическая химия – еще одно важное применение хлора. Он используется в реакциях замещения и в качестве окислителя. В какой-то момент производственного процесса 85% фармацевтических препаратов содержат хлор или одно из его соединений. ПВХ производится примерно из 20% произведенного хлора. Этот универсальный пластик используется для оконных рам, салонов автомобилей и изоляции электропроводки. Его также можно использовать для изготовления виниловых полов.
Положение хлора в периодической таблице.
Биологическая рольИон хлора играет жизненно важную роль в нашем существовании. Он в основном содержится в клеточных жидкостях в виде отрицательного иона, который уравновешивает положительные ионы (в основном калия). Его также можно найти во внеклеточной жидкости (например, в крови), чтобы сбалансировать положительное (в основном натрий).
Большая часть хлорида, который нам нужен, поступает из соли. Среднесуточное потребление соли составляет 6 граммов. Впрочем, мы могли бы легко обойтись и половиной этой суммы.
Хлор влияет на здоровье
Высокореактивным газом является хлор. Это природный элемент. Компании, производящие дихлорид этилена, другие хлорсодержащие растворители и поливинилхлоридные смолы (ПВХ), хлорфторуглероды и диоксид пропилена, являются крупнейшими потребителями хлора. Для отбеливания бумаги бумажные компании используют хлор. Для снижения уровня микроорганизмов в очистных сооружениях воды и сточных вод используется хлор. Это может заразить людей (дезинфекция).
После контакта с водой, воздухом и землей хлор может попасть в окружающую среду или на рабочем месте. Люди, которые используют хлорсодержащие отбеливатели для стирки или химикаты для плавательных бассейнов, обычно не подвергаются воздействию хлора. В промышленных условиях хлор обычно встречается в небольших количествах.
ИзотопыДва стабильных изотопа хлора — Cl-35 и Cl-337. Смесь этих изотопов — это то, что вы найдете в природе в виде хлора.
Смесь этих изотопов — это то, что вы найдете в природе в виде хлора.
| атомный номер | 17 |
|---|---|
| атомный вес | от 35,446 до 35,457 |
| точка кипения | −34 ° C (−29 ° F) |
| температура плавления | −103 ° C (−153 ° F) |
| плотность (1 атм, 0 ° C или 32 ° F) | 3,214 г/л (0,429 унции/галлон) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | 1 с 2 2 с 2 2 т 6 3 с 2 3 т 5 |
В природе вы найдете хлор, смешанный с другими элементами. Основным минералом, используемым для добычи хлора, является галит, также известный как хлорид натрия или «обычная морская соль». Соль хлорида натрия, которая хорошо растворяется, выщелачивалась в океаны на протяжении всей жизни Земли.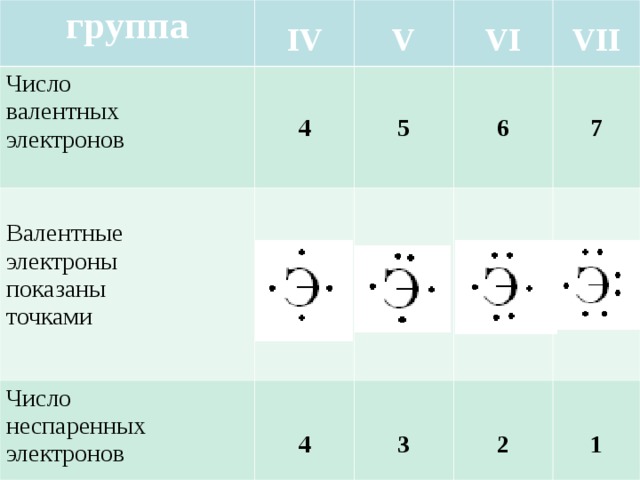 Есть несколько соляных пластов или «озёр», которые можно найти в районах, где испарились древние моря. Их можно добывать для извлечения хлорида.
Есть несколько соляных пластов или «озёр», которые можно найти в районах, где испарились древние моря. Их можно добывать для извлечения хлорида.
Минералы карналлит, представляющий собой хлорид магния и калия, и сильвит, богатые хлором, также содержат хлор.
Воздействие хлора на окружающую среду
При смешивании с водой хлор растворяется. При определенных условиях он может вырваться из воды и попасть в воздух. Окружающая среда больше всего страдает от хлора, непосредственно попадающего в атмосферу и поверхностные воды. Хлор вступает в реакцию с другими химическими веществами, когда он находится в воздухе или воде. Реагирует с водой с образованием хлористых солей.
Какова валентность элементов хлора?
Неметаллический элемент хлор также можно назвать галогенным элементом. Общее количество электронов на последней орбите оболочки (валентных электронов) называется валентными электронами. Валентные электроны — это общее количество электронов внутри оболочки, образованной конфигурацией хлора.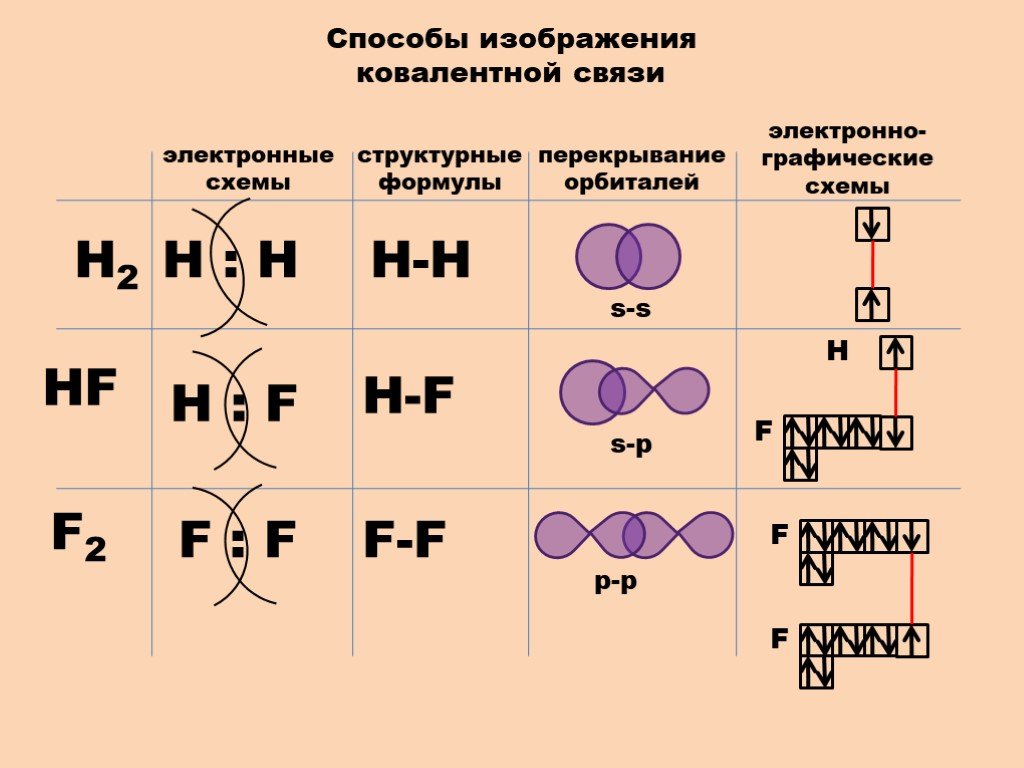 Свойства элемента определяются валентными электронами. Они также участвуют в образовании связей.
Свойства элемента определяются валентными электронами. Они также участвуют в образовании связей.
Каким числом электронов, нейтронов и протонов обладает хлор?
Ядро можно найти в середине атома. Ядро содержит протоны и нейтроны. Атомный номер хлора равен 17. Число протонов в веществе называется атомным номером. Число протонов, обнаруженных в хлоре, равно 17. Ядро содержит электронную оболочку, равную протонам. Всего атом хлора может иметь 17 электронов.
Разница между числом атомных масс и числом атомов определяет число нейтронов в элементе. Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Мы знаем, что атомное количество хлора равно 17, а его атомная масса равна 35 (35,45 u). Нейтрон (n) = 35 – 17 = 18. Следовательно, количество нейтронов в хлоре (Cl) равно 18.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами.
Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Как узнать число валентных нейтронов в атоме хлорофилла?
Это шаги для определения валентных электронов. Одной из них является электронная конфигурация. Без электронной конфигурации невозможно определить валентность электрона. Легко определить электронную конфигурацию всех элементов.
Однако можно идентифицировать валентные электроны, размещая электроны по принципу Бора. Теперь мы узнаем, как определить валентный электрон хлора.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным.
Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Расчет общего числа электронов в хлоре
Во-первых, мы должны знать число электронов, присутствующих в атоме хлора. Вам нужно знать, сколько протонов в хлоре, чтобы определить число электронов. Чтобы узнать количество протонов в хлоре, необходимо также знать его атомный номер.
Периодическая таблица необходима для определения атомного номера. Периодическая таблица содержит атомные номера элементов хлора. Число протонов называется атомным номером. Ядро также содержит электроны, равные протонам.
Это означает, что теперь мы можем сказать, что число электронов в атоме хлора равно его атомному номеру. Атомный номер хлора по периодической таблице равен 17. Это означает, что общее число электронов в атоме хлора равно 17.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Вам нужно будет выполнить электронную конфигурацию хлора
Важный шаг 2 Этот шаг включает в себя организацию электронов хлорида. Электронная конфигурация хлора такова, что внутри оболочки K два электрона, восемь внутри оболочки L и семь внутри оболочки M. Электронная конфигурация хлора показывает, что первая оболочка содержит два электрона, а вторая оболочка имеет восемь электронов. Третья оболочка содержит семь электронов. По суборбите электронная конфигурация хлора выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 5 .
Рассчитайте общее количество электронов и определите валентную оболочку
Третий шаг – определение валентности. Валентная оболочка является последней оболочкой после электронной конфигурации. Количество электронов, находящихся в валентной оболочке, известно как валентные электроны. Электронная конфигурация указывает на то, что последняя оболочка хлора имеет семь электронов. Валентных электронов хлора (Cl) семь.
Количество электронов, находящихся в валентной оболочке, известно как валентные электроны. Электронная конфигурация указывает на то, что последняя оболочка хлора имеет семь электронов. Валентных электронов хлора (Cl) семь.
Образование соединения хлора (Cl)
Через свой валентный электрон хлор (Cl) участвует в образовании связей. Эти валентные электроны участвуют в образовании связей с другими элементами. Электронная конфигурация натрия указывает на то, что валентные элементы натрия существуют как одно целое. Атом натрия отдает свои валентные электроны, а хлор их получает.
При этом приобретаются электронные конфигурации хлора и натрия. Путем электронного обмена атомы натрия и хлора образуют хлорид натрия (NaCl). Ионная связь – это хлорид натрия (NaCl).
Сколько валентных электронов имеет ион хлора (Cl-
) ?При образовании связи элементы с 5, 6 или 7 электронами получают электроны от содержащей их оболочки. Анионы – это элементы, которые имеют электроны и могут образовывать связи. Последняя оболочка хлора подвергается воздействию электрона при образовании связи и становится ионом хлора (Cl- ) . Вот почему хлор называют анионом.
Последняя оболочка хлора подвергается воздействию электрона при образовании связи и становится ионом хлора (Cl- ) . Вот почему хлор называют анионом.
Электронная конфигурация иона хлора (Cl – ) представляет собой 1s 2 2s 2 2p 6 3s 2 3p 6. Электронная конфигурация ионов хлора (Cl-) показывает, что для иона хлора (Cl- ) существует три оболочки , и что третья оболочка содержит восемь электронов. Эта электронная конфигурация указывает на то, что ион хлора теперь и имеет электронную конфигурацию аргона. В этом случае валентность ионов хлора равна -1. Валентные электроны ионов хлора (Cl- ) имеют восемь электронов на оболочке, содержащей последнюю оболочку иона хлора.
Какова валентность хлора (Cl)?
Валентность (или валентность) — это способность атома элемента присоединяться к другому атому при образовании молекулы. Валентность — это количество неспаренных электронов, находящихся на последней орбите элемента. В основном состоянии правильной электронной конфигурацией для хлора (Cl) будет 1s 2 2s 2 2p6 3s2 3px2 3py2 3pz1.
В основном состоянии правильной электронной конфигурацией для хлора (Cl) будет 1s 2 2s 2 2p6 3s2 3px2 3py2 3pz1.
Эта электронная конфигурация указывает на то, что последний атом оболочки хлора имеет неспаренный электрон (3p1). Возбуждение может изменить степень окисления хлора. Степени окисления хлора от -1 до +1, +2, +3, +4, +5, +6, +7.
Таким образом, валентность хлора равна 1.
Факты
- Третьим наиболее распространенным элементом в океанах Земли является хлор.
- Хлорид натрия, или поваренная соль, является наиболее распространенным природным соединением хлора.

- Атомы хлора составляют около 1,9% массы океанов.
- Хлор — 21 самый распространенный элемент в почве Земли.
- Предпочтительным химическим оружием был газообразный хлор, который использовался в Первой мировой войне.
- Хлор в контейнерах можно обнаружить с помощью нашатырного спирта.
- Электролиз воды, содержащей растворенный хлорид натрия (соленая вода), используется для производства большей части газообразного хлора для промышленности.
- Хлор вступит в реакцию с аммиаком и создаст над местом утечки белое облако.
- Левитин, Х; Бранском, Вт; Эпштейн, FH (декабрь 1958 г.). «Патогенез гипохлоремии при респираторном ацидозе». Дж. Клин. Инвестировать .
- Генри М. Лестер, Герберт С. Кликштейн, Справочник по химии, 1400-1900 гг., (1969) Издательство Гарвардского университета.
- Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company.

- Антуан Лавуазье, Мемуары Королевской академии наук, 1783 г.
Сколько валентных электронов у хлора (Cl)? [Валентность хлора]
Ричард — 0
Хлор , а химический элемент с символом Cl и атомным номером 17 является чрезвычайно реактивным элемент и сильнейший окислитель, так как обладает самым высоким сродством к электрону и третья по величине электроотрицательность по шкале Паули среди элементы.
Один из самых распространенные соединения в химической промышленности и составляющая реального потребления хлорид натрия (NaCl) содержит хлор. Применяется для санитарии, дезинфекции, антисептики, оружие времен Первой мировой войны и многое другое.
Вы здесь, чтобы знаете валентные электроны атома хлора, не так ли? Не волнуйтесь вместе с хлором валентных электронов мы объясним и его валентность. Но перед этим давайте некоторые основные идеи об этих двух терминах:
Разница между Валентные электроны и валентность
Валентные электроны
общее количество электронов, присутствующих на внешней оболочке атома
(т.
Валентность определена как общее количество электронов, которые атом может потерять, приобрести или разделить за это время. образования связи, чтобы получить стабильную электронную конфигурацию, т.е. октет. Валентность атома может быть разной в разных соединениях или химические реакции из-за различных условий соединения. Большую часть времени валентность меняется/изменяется из-за изменения степеней окисления и восстановления.
Хлор (Cl) Валентные электроны
Четыре простые шаги, чтобы узнать валентные электроны для атома хлора, которые:
Шаг 1: Найдите Атомный номер
Чтобы узнать
атомный номер хлора, мы можем использовать периодическую таблицу. С помощью
периодической таблицы, мы можем легко увидеть, что атомный номер хлора равен 17. Поскольку
его атомный номер 17, он имеет 17 протонов, а для нейтрального хлора
число протонов всегда равно числу электронов, т.е. имеет 17
электронов в его ядре.
Поскольку
его атомный номер 17, он имеет 17 протонов, а для нейтрального хлора
число протонов всегда равно числу электронов, т.е. имеет 17
электронов в его ядре.
Шаг 2: Напишите Электронная конфигурация
Электрон конфигурация – это расположение электронов на орбиталях. Хлор атом имеет в общей сложности 17 электронов, поэтому мы должны поместить 17 электронов на орбитали. Электроны будут располагаться на разных орбиталях в зависимости от энергии уровень: [1с, 2с, 2п, 3с, 3п, 4с, 3д, 4п, 5с, 4д, 5п, 6с, 4ж, 5д, 6п, 7с, 5ф]. Сейчас
Электрон хлора конфигурация Cl (17) = 1s 2 2s 2 2p 6 3s 2 3p 5 (полный конфигурация).
= [Ne] 3s²3p⁵(сокращенная конфигурация).
Шаг 3: Определить Valence Shell
Как известно,
валентную оболочку атома можно найти по наибольшему числу принципиальных
квантовые числа, которые выражаются через n и [Ne]3s²3p⁵,
наибольшее значение n равно 3, так что валентная оболочка хлора равна 3s²3p⁵.
Шаг 4: Найдите Валентные электроны
Общее количество электроны, находящиеся на валентной оболочке атома, называются валентными электронами, а всего на валентной оболочке хлора находится семь электронов. (3с²3п⁵). Таким образом, хлор имеет семь валентных электронов .
Читайте также:
- Валентность Электроны и валентность водорода (H).
- Валентность Электроны и валентность кислорода (O).
- Валентные электроны и валентность кремния (Si).
Валентность хлора (Кл)
Есть много различные способы узнать валентность атома, которая отражает способность атом для связи с другими атомами. Валентность описывает, насколько легко атом или свободный радикал может сочетаться с другими химическими видами. Валентность атома определяется на основе количества электронов, потерянных, полученных или разделенных с другого атома в момент образования связи.
Говорят, что атом
быть стабильным, когда его самые внешние оболочки имеют восемь электронов (кроме H и He).
Элементы, подобные хлору может достичь стабильного состояния (ближайшая конфигурация инертного газа: Ar), получив один электрон. Так что валентность хлора равна 1.
Математически электронная конфигурация хлора 2, 8, 7. А как мы знаем, если электроны во внешней оболочке больше 4, его надо вычесть из 8. Итак,
Электрон Конфигурация хлора (Cl) = 2, 8, 7
Мы можем видеть внешний большая часть оболочки хлора имеет 7 электронов, поэтому ее нужно вычесть из 8,9.0005
8 – 7 = 1
Вот почему валентность
хлора равно 1.
Примечание. Обычно хлор имеет стабильную степень окисления -1 большую часть времени, но может отличаться некоторые соединения со значениями 0 (Cl2), +1 (NaClO), +3 (NaClO2), +4 (ClO3), +5 (NaClO3), +7 (NaClO4). Не путайте с -1 или чем-то другим (+1, +3, +4 и т. д.) с положительными или отрицательными знаками, это просто степень окисления, которая может варьироваться от соединения к соединению. Но его валентность в любом случае всегда равна 1.
В другом смысле атом хлора может образовывать максимум одну ковалентную связь в химической связи (для пример: HCl, CCl4, CaCl2 и др.), и то, какая валентность, максимальная способность образовывать связи с атомами во время химической связи.
Мы также можем найти валентность хлора с помощью таблицы Менделеева. Как хлор принадлежит к группе 17 (17A или VIIA) вместе с фтором (F), бромом (Br) и йодом (I) и астат (At). Эти элементы группы также называются галогенами . Все эти элементы имеют валентность один.
Как найти валентные электроны для хлора (Cl)?
17-й элемент периодической таблицы — хлор, а также элемент 17-й группы. Его символ — «Cl». Хлор образует связи через свои валентные электроны.
Его символ — «Cl». Хлор образует связи через свои валентные электроны.
В этой статье подробно обсуждается, как легко рассчитать количество валентных электронов в хлоре. Надеюсь, прочитав эту статью, вы узнаете об этом подробно.
Сколько электронов, протонов и нейтронов имеет хлор?
Ядро расположено в центре атома. Протоны и нейтроны находятся в ядре. Атомный номер хлора — 17. Атомный номер — это число протонов.
То есть число протонов в хлоре равно семнадцати. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть у атома хлора всего семнадцать электронов.
Число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомный номер (Z)
Мы знаем, что атомный номер хлора равен 17, а атомное массовое число составляет около 35 (35,45u). Нейтрон (n) = 35 – 17 = 18. Следовательно, число нейтронов в хлоре равно 18.
Каковы валентные электроны хлора?
Хлор является неметаллическим элементом, а также галогенным элементом. Валентные электроны — это общее количество электронов на последней орбите (оболочке). Общее количество электронов в последней оболочке после электронной конфигурации хлора называется валентными электронами хлора.
Валентные электроны — это общее количество электронов на последней орбите (оболочке). Общее количество электронов в последней оболочке после электронной конфигурации хлора называется валентными электронами хлора.
Валентные электроны определяют свойства элемента и участвуют в образовании связей.
Валентные электроны хлораКак рассчитать количество валентных электронов в атоме хлора?
Валентные электроны необходимо определить, выполнив несколько шагов. Электронная конфигурация является одной из них. Невозможно определить валентный электрон без электронной конфигурации. Зная правильно электронную конфигурацию, очень легко определить валентные электроны всех элементов.
Однако валентные электроны можно легко идентифицировать, расположив электроны в соответствии с принципом Бора. Теперь мы научимся определять валентный электрон хлора.
Шаг-1: Определение общего количества электронов в хлоре
1-й нам нужно знать общее количество электронов в атоме хлора. Чтобы узнать количество электронов, нужно знать количество протонов в хлоре.
Чтобы узнать количество электронов, нужно знать количество протонов в хлоре.
А чтобы узнать количество протонов, нужно знать атомный номер элемента хлора. Чтобы узнать атомный номер, нам нужно воспользоваться периодической таблицей.
Необходимо знать атомный номер элемента хлора из таблицы Менделеева. Атомный номер — это количество протонов. А электроны, равные протонам, находятся вне ядра.
Положение хлора(Cl) в таблице МенделееваТо есть окончательно можно сказать, что в атоме хлора есть электроны, равные атомному номеру. Из таблицы Менделеева мы видим, что атомный номер хлора равен 17. То есть атом хлора имеет всего семнадцать электронов.
Шаг 2: Необходимо определить электронную конфигурацию хлора
Шаг 2 очень важен. На этом этапе электроны хлора должны быть организованы. Электронная конфигурация хлора показывает, что в К-оболочке два электрона, восемь в L-оболочке и семь в М-оболочке.
Электронная конфигурация хлора То есть первая оболочка хлора имеет два электрона, вторая оболочка имеет восемь электронов и 3-я оболочка имеет семь электронов.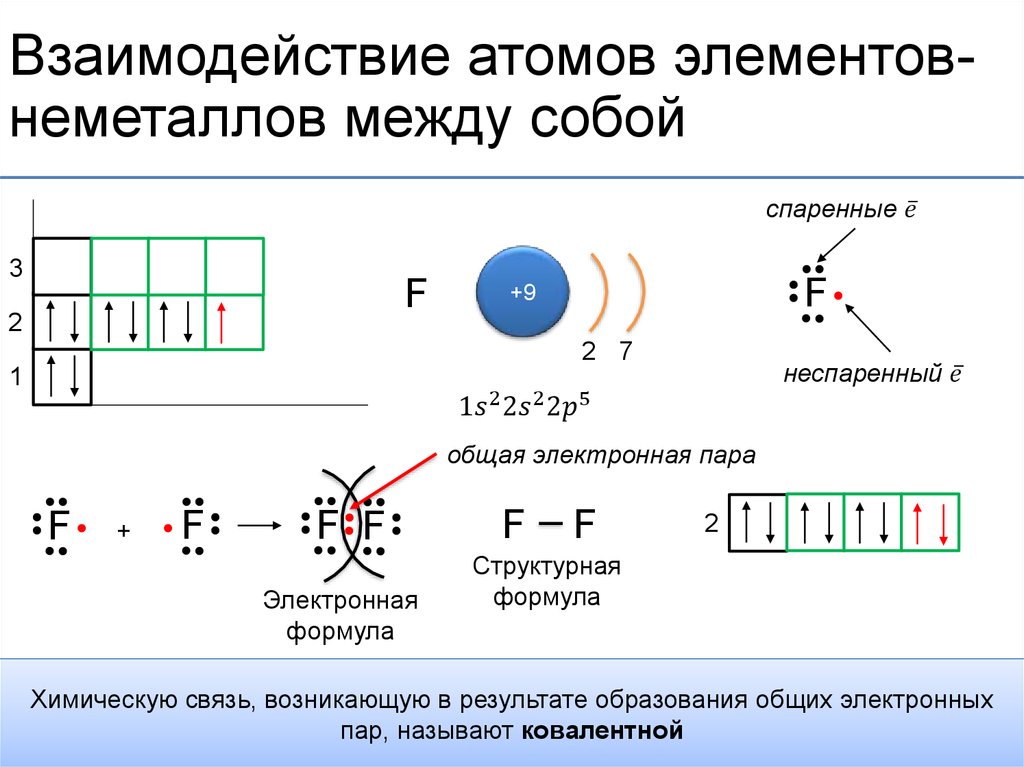
Шаг 3: Определить валентную оболочку и рассчитать общее количество электронов
Третий шаг – диагностика валентной оболочки. Последняя оболочка после электронной конфигурации называется валентной оболочкой. Общее число электронов в валентной оболочке называется валентными электронами.
Электронная конфигурация показывает, что последняя оболочка хлора имеет семь электронов. Следовательно, валентных электронов хлора семь.
Валентность электронов для хлораКакова валентность хлора?
Способность одного атома элемента присоединяться к другому атому при образовании молекулы называется валентностью (валентностью). Число неспаренных электронов на последней орбите элемента является валентностью этого элемента.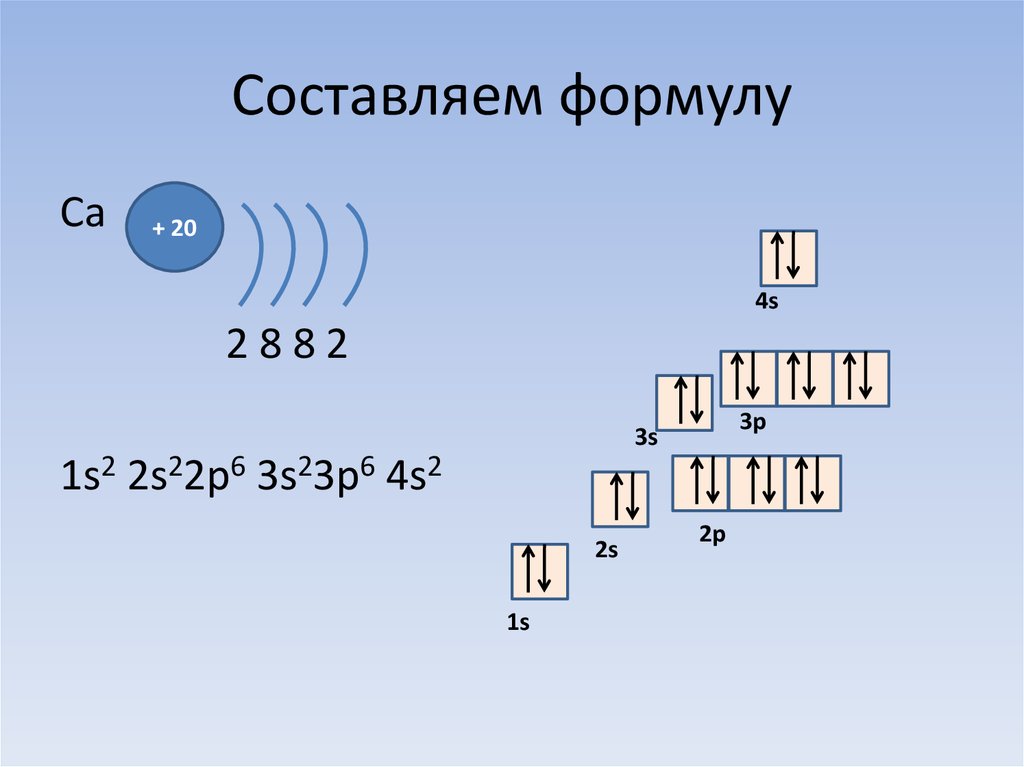
The correct electron configuration of chlorine(Cl) in ground state will be 1s 2 2s 2 2p 6 3s 2 3p x 2 3p y 2 3p z 1 .
Эта электронная конфигурация показывает, что последняя оболочка атома хлора имеет неспаренный электрон (3p z 1 ). Таким образом, валентность хлора равна 1.
Степени окисления хлора изменяются в зависимости от возбуждения. Степени окисления хлора: -1, +1, +2, +3, +4, +5, +6, +7.
Валентность и валентные электроны хлора (Cl)Сколько валентных электронов имеет ион хлорида (Cl
– )?Элементы, имеющие 5, 6 или 7 электронов на последней оболочке, получают электроны последней оболочки во время образования связи. Элементы, которые принимают электроны и образуют связи, называются анионами.
При образовании связи последняя оболочка хлора получает электрон и превращается в хлорид-ион (Cl – ). То есть хлор является анионным элементом.
То есть хлор является анионным элементом.
CL + E — → CL —
Электронная конфигурация иона хлорида (CL — ) IS 1S 2 2S 2 2P 6 3S 2 3P 7778. Электронная конфигурация ионов хлора показывает, что ион хлора имеет три оболочки, а 3-я оболочка имеет восемь электронов.
Эта электронная конфигурация показывает, что ион хлорида приобрел электронную конфигурацию аргона.
То есть в данном случае валентность ионов хлора равна -1. Поскольку последняя оболочка хлорид-иона имеет восемь электронов, валентные электроны хлорид-иона (Cl – ) восемь.
Соединение хлора
Хлор участвует в образовании связей через свой валентный электрон. Эти валентные электроны участвуют в образовании связей с атомами других элементов.
Электронная конфигурация натрия показывает, что валентные электроны натрия едины. Атом натрия отдает свои валентные электроны атому хлора, а атом хлора получает этот электрон.



 Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII). Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.

Leave A Comment