Строение атома фосфора (P), схема и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о строении атома фосфора
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
+15 P)2)8)5;
1s22s22p63
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
3 |
0 |
0 |
+1/2 |
|
s |
3 |
0 |
0 |
-1/2 |
|
p |
3 |
1 |
-1 |
+1/2 |
|
p |
3 |
1 |
0 |
+1/2 |
|
p |
3 |
1 |
1 |
+1/2 |
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
это металл или неметалл, получение и применение, характеристика
Что такое фосфор — это металл или неметалл
Фосфор — элемент, расположенный в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева, является неметаллом, относится к группе пниктогенов.
Химический символ элемента — Р. В состав атома фосфора входит ядро с положительным зарядом (+15) и 15 электронов, распределенных по трем энергетическим уровням (по причине расположения элемента в третьем периоде). На первом уровне содержится 2 электрона, на втором — 8, на третьем (внешнем) — 5:
На первом уровне содержится 2 электрона, на втором — 8, на третьем (внешнем) — 5:
- Первый внутренний уровень содержит 2 электрона на 1s-орбитали.
- Второй уровень включает 2 электрона на 2s-орбитали и 6 электронов на 2р-орбиталях.
- На третьем (внешнем) энергетическом уровне атома фосфора на 3s-орбитали расположена пара спаренных электронов, на 3p-орбитали находятся 3 неспаренных электрона.
Ядро атома фосфора-31 включает в себя:
- 15 протонов;
- 16 нейтронов.
Фосфор относится к элементам p-семейства. Радиус атома фосфора (вычисленный) равен 114 пм. Атомная масса атома фосфора составляет 30,973762(2) а. е. м.
Электронная конфигурация атома фосфора в основном состоянии:
Источник: chemege.ru
Внешний энергетический уровень атома фосфора содержит 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Таким образом, атом фосфора обладает способностью к образованию 3 химических связей по обменному механизму, что соответствует валентности, равной III.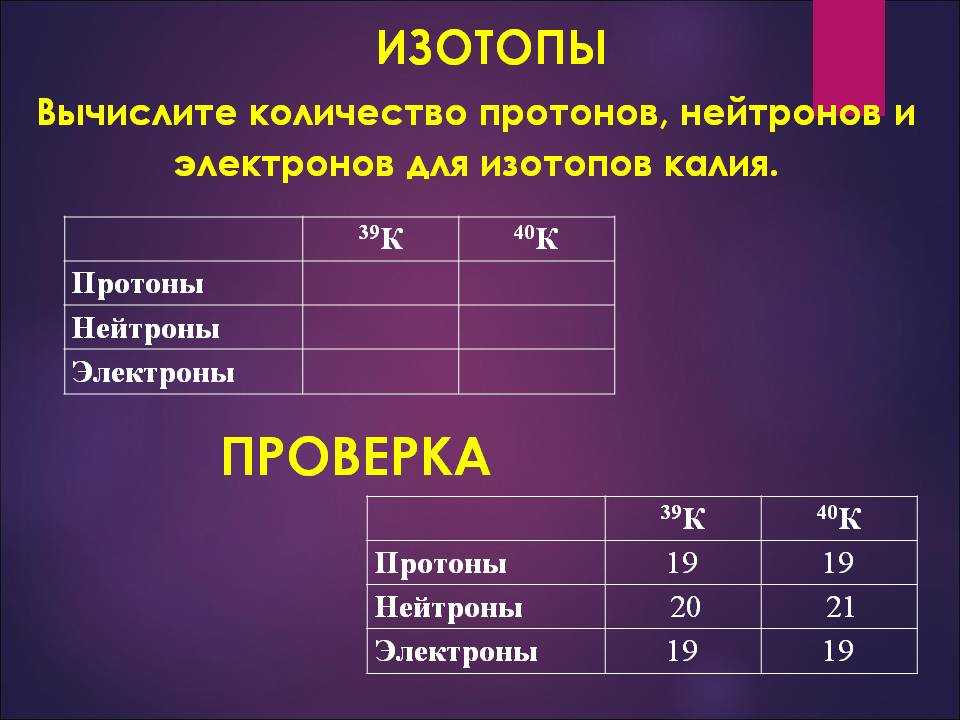 В отличие от азота атом фосфора, имея вакантную 3d орбиталь, способен при переходе в возбужденное энергетическое состояние расспаривать 3s-электроны, один из которых переходи на 3d-орбиталь. Таким образом расширяются валентные возможности атома фосфора и он становится способным проявлять в соединениях валентность, равную V.
В отличие от азота атом фосфора, имея вакантную 3d орбиталь, способен при переходе в возбужденное энергетическое состояние расспаривать 3s-электроны, один из которых переходи на 3d-орбиталь. Таким образом расширяются валентные возможности атома фосфора и он становится способным проявлять в соединениях валентность, равную V.
Электронная конфигурация фосфора в возбужденном состоянии:
Источник: chemege.ru
По этой причине, высшая валентность фосфора в соединениях равна V, что отличает его от азота, у которого высшая валентность равна IV.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5. Фосфор — химический элемент № 15. Он расположен в VА группе Периодической системы.
Источник: yaklass.ru
Внешний слой атома фосфора включает в себя пять валентных электронов. Для того чтобы его завершить, необходимо еще три электрона. По этой причине в соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, в том числе, кислородом, фтором и другими, — положительные степени окисления +3 или +5. Атом фосфора обладает большим числом электронных слоев, чем атом азота. В связи с этим, электроотрицательность, окислительные и неметаллические свойства фосфора выражены в меньшей степени.
Атом фосфора обладает большим числом электронных слоев, чем атом азота. В связи с этим, электроотрицательность, окислительные и неметаллические свойства фосфора выражены в меньшей степени.
Физические и химические свойства
Фосфор способен образовывать разнообразные простые вещества, то есть аллотропные модификации. В нормальных условиях вещество характеризуется твердым агрегатным состоянием. Основные аллотропные модификации фосфора:
- белый;
- красный;
- черный.
Они отличаются по таким показателям, как:
- строение кристаллической решетки;
- цвет;
- плотность;
- физические характеристики;
- химическая активность.
В процессе трансформации вещества в более термодинамически устойчивую модификацию показатели химической активности снижаются. В качестве примера можно привести последовательное превращение белого фосфора в красный, затем красного в черный.
СвойстваИсточник: calorizator.ru
Белый фосфор представляет собой вещество состава Р4. Мягкое вещество белого цвета является ядовитым и обладает характерным чесночным запахом. Вещество характеризуется молекулярной кристаллической решеткой, что объясняет невысокую температуру плавления в 44°С и высокую летучесть. Белый фосфор плавится в резервуаре с подогретой водой, реакционно способен и может самовоспламеняться на воздухе.
Мягкое вещество белого цвета является ядовитым и обладает характерным чесночным запахом. Вещество характеризуется молекулярной кристаллической решеткой, что объясняет невысокую температуру плавления в 44°С и высокую летучесть. Белый фосфор плавится в резервуаре с подогретой водой, реакционно способен и может самовоспламеняться на воздухе.
При покрытии бумаги раствором белого фосфора в сероуглероде после испарения сероуглерода можно наблюдать, как вещество воспламеняет бумагу. На основе данной реакции поставлено множество различных фокусов с самовозгоранием или получением огня из ничего.
Источник: chemege.ru
Источник: chemege.ru
Красный фосфор представляет собой модификацию с атомной кристаллической решеткой. В химии формула вещества Pn или просто Р. Красный фосфор характеризуется полимерным строением со сложной структурой. Материал в твердом агрегатном состоянии не обладает запахом, имеет красно-бурый цвет, не является ядовитым. Данная модификация более устойчива по сравнению с белым фосфором. Вещество образуется из белого фосфора при температуре от 250°С до 300°С в безвоздушной среде.
Вещество образуется из белого фосфора при температуре от 250°С до 300°С в безвоздушной среде.
Источник: chemege.ru
Источник: chemege.ru
Черный фосфор является наиболее стабильной термодинамически и наименее активной химически формой элементарного фосфора. Вещество обладает черной окраской и имеет металлический блеск. Материал жирный на ощупь и обладает некоторыми сходствами с графитом. Черный фосфор не растворяется в воде и в растворителях органического происхождения.
Источник: chemege.ru
Существуют и другие разновидности фосфора, в том числе, желтый и металлический фосфор. В первом случае вещество является неочищенным белым фосфором. В условиях повышенного давления желтый фосфор трансформируется в новую модификацию под названием металлический фосфор, который является хорошим проводником электрического тока.
Источник: chemege.ru
В природе фосфор встречается только в виде соединений. Как правило, он втречается в составе апатитов, фосфоритов и других веществ.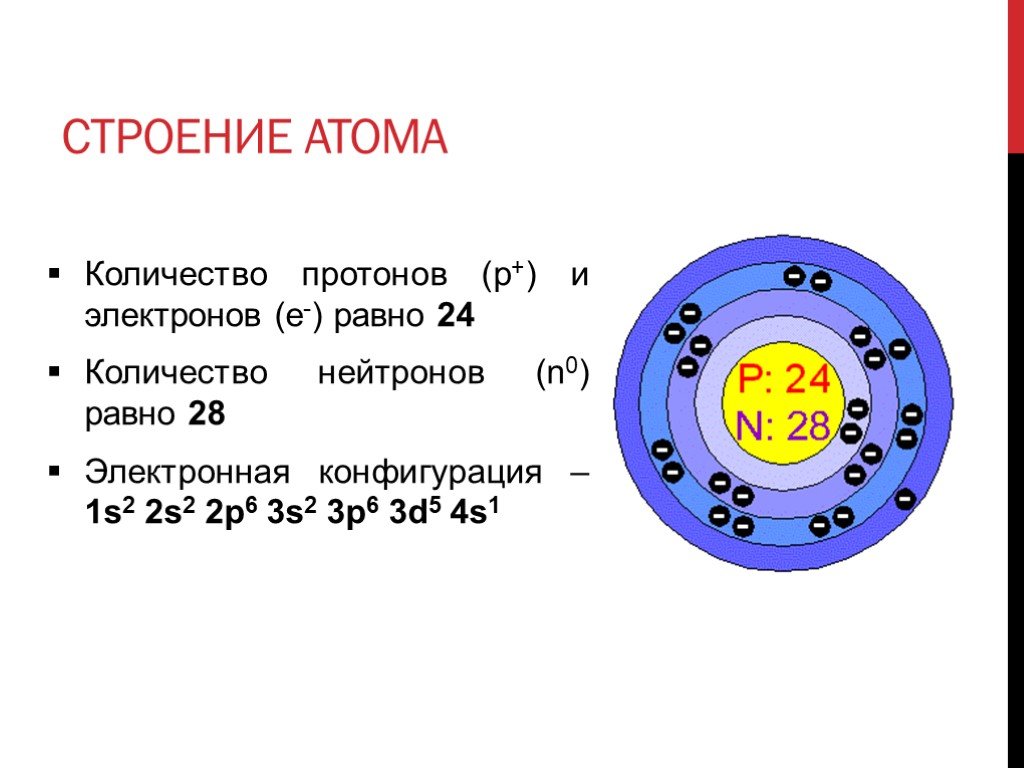 Фосфор является составным компонентом наиболее важных биологических соединений таких, как ДНК, РНК, фосфолипиды.
Фосфор является составным компонентом наиболее важных биологических соединений таких, как ДНК, РНК, фосфолипиды.
Фосфор проявляет химическую активность при обычных условиях и при нагревании. В окислительно-восстановительных реакциях может выступать как:
- окислитель с элементами, которые расположены ниже и левее в Периодической системе;
- восстановитель с элементами, расположенными выше и правее.
В связи с этим, фосфор вступает в химические реакции с металлами и неметаллами.
СвойстваВ результате химической реакции фосфора и кислорода образуются оксиды — ангидриды соответствующих кислот: фосфористый ангидрид P2O3 и фосфорный ангидрид P2O5.
4P+3O2→2P2O3
4P+5O2→2P2O5
СвойстваХимическая реакция фосфора с галогенами приводит к образованию галогенидов, для которых характерна обобщенная формула PHal3 и PHal5.
2P + 3Cl2→2PHal3
2P + 5Cl2→2PHal5
СвойстваВ процессе взаимодействия фосфора с серой образуются сульфиды.
2P+3S→P2S3
2P+5S→ P2S5
СвойстваВзаимодействуя с металлами, фосфор проявляет свойства окислителя.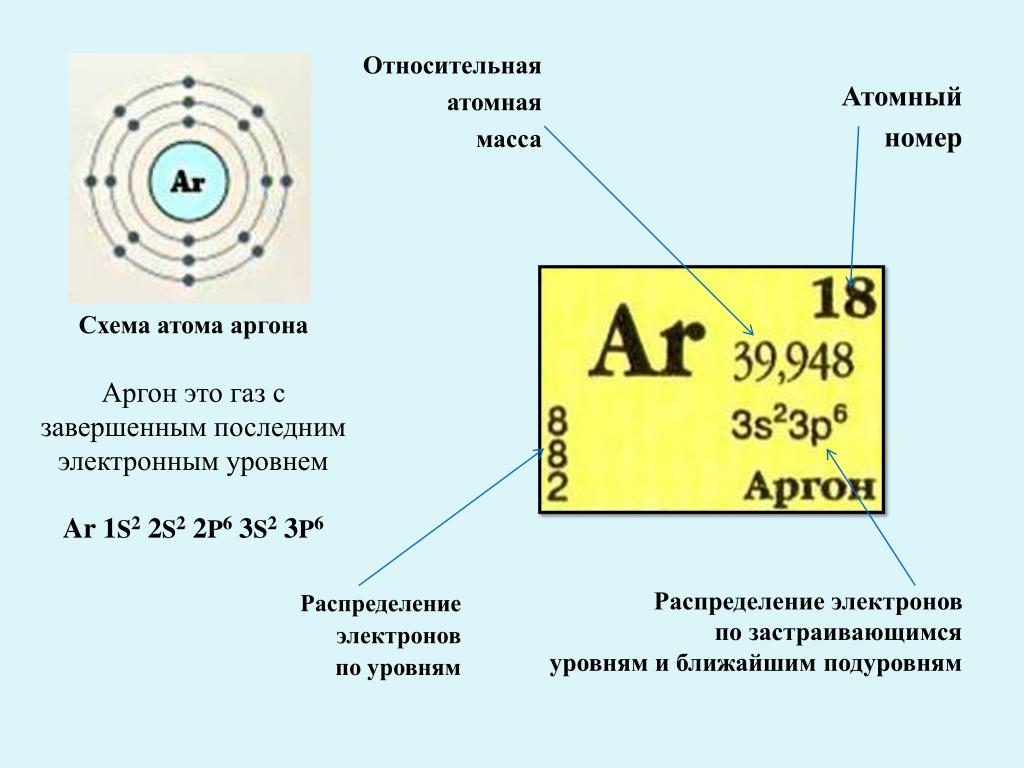 Продуктами данной реакции являются фосфиды.
Продуктами данной реакции являются фосфиды.
Взаимодействие кальция и магния с фосфором приводит к образованию фосфидов кальция и магния:
2P+3Ca→Ca3P2
2P+3Mg→Mg3P2
Взаимодействие натрия с фосфором сопровождается образованием фосфида натрия:
P+3Na→Na3P
СвойстваФосфор не может реагировать непосредственно с водородом.
Со сложными веществами фосфор также вступает в химические реакции. В этом случае вещество чаще проявляет свойства восстановителя. Фосфор диспропорционирует в процессе взаимодействия с некоторыми веществами (например, щелочами).
СвойстваВ процессе химической реакции фосфора с сильными окислителями происходит окисление вещества до оксида фосфора (V) или до фосфорной кислоты.
Окисление фосфора азотной кислотой с образованием фосфорной кислоты:
5HNO3+P→h4PO4+5NO2↑+h3O
5HNO3+3P+2h3O→3h4PO4+5NO↑
Схема окисления фосфора серной кислотой:
2P+5h3SO4→2h4PO4+5SO2+2h3O
Соединения хлора, к примеру, бертолетова соль, также окисляют фосфор:
6P+5KClO3→3P2O5+5KCl
Соединения металлов, обладающие окислительными свойствами, окисляют фосфор.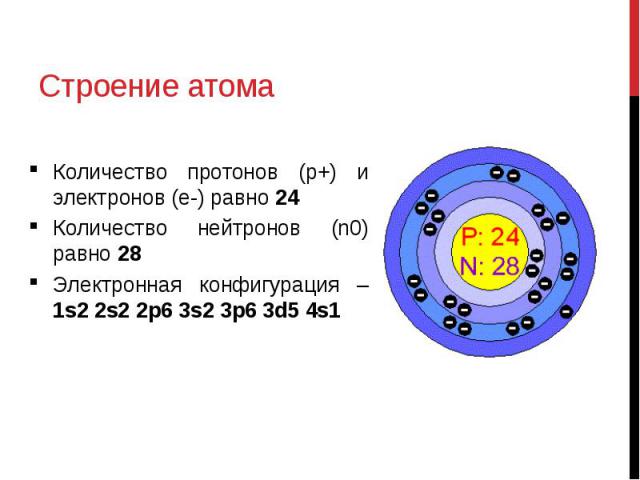 Например, оксид серебра (I):
Например, оксид серебра (I):
2P+5Ag2O→P2O5 + 10Ag
СвойстваВ процессе растворения в щелочах фосфор диспропорционирует на гипофосфит Kh3PO2 и фосфин Ph4.
Реакция фосфора с гидроксидом калия:
4P+3KOH+3h3O→3Kh3PO2+Ph4↑
P4+3KOH+3h3O→3Kh3PO2+Ph4↑
Реакция фосфора с гидроксидом кальция:
8P+3Ca(OH)2+6h3O→3Ca(h3PO2)2+2Ph4↑
СвойстваФосфор сгорает в кислороде. В случаях красного и белого фосфора реакции протекают по-разному. Белый фосфор представляет собой одно из наиболее горючих веществ. Материал воспламеняется при минимальном нагреве, в том числе, при температуре человеческого тела. В этом случае высвобождается большое количество теплоты, и образуется фосфорный ангидрид P2O5. Красный фосфор на воздухе не окисляется, что объясняет отсутствие свечения. Вещество воспламеняется только при поджигании. В результате химической реакции образуется фосфорный ангидрид.
4P+5O2→2P2O5
Соединения фосфора, биологическая роль
Типичные соединения фосфора можно представить в виде таблицы:
Источник: chemege. ru
ru
Соединения фосфора являются неотъемлемым компонентом растительных и животных организмов. Растения формируют запасы данного вещества в семенах и плодах. В организме человека и животных фосфор содержится в тканях скелета, мышц и нервной системы. По усредненным показателям человеческое тело содержит примерно 1,5 кг фосфора:
- из общего объема доля в 1,4 кг находится в костях;
- 130 г вещества приходится на мышцы;
- 12 г фосфора содержит нервная ткань.
У людей во взрослом возрасте около 86% фосфора находится в минеральной части костей и зубов. Оставшийся объем вещества распределен по мышцам, органам, жидкостям организма. Большой концентрацией фосфора обладают ткани нервных клеток и мозга.
Биологическое значение фосфора:
- Фосфор обеспечивает нормальное формирование костной и зубной тканей. В дальнейшем фосфор поддерживает их целостность на протяжении всей жизни человека.
- Входит в состав нуклеиновых кислот, в том числе, ДНК, РНК, молекул, которые хранят и передают наследственную информацию, отвечают за нормальное деление и рост клеток.

- Фосфор, являясь компонентом ферментов, участвует в жировом обмене, синтезе и распаде гликогена и крахмала.
- Как составная часть фосфорной кислоты и фосфатов, фосфор принимает участие в мыслительных процессах, движении, дыхании, обеспечивает нормальный белковый и углеводный обмен.
- Энергетическое питание каждого из процессов жизнедеятельности в составе АТФ.
- Совместно с белками и жирными кислотами фосфор формирует высокоактивные соединения. В качестве примера можно привести лецитин, который необходим для образования клеточных и мозговых оболочек. Большой объем лецитина организм потребляет в процессе физических и психоэмоциональных нагрузок. По этой причине недостаток фосфора снижает защиту клеток.
- Соединения фосфора необходимы, чтобы поддерживать кислотно-щелочное равновесие в организме. Это обусловлено их присутствием в составе крови и других жидкостей. С помощью фосфора формируются активные формы витаминов, так как фосфорсодержащие вещества запускают необходимые для этого ферментные реакции.

- Соединяясь с азотом, жирными кислотами и глицерином, фосфор образует фосфолипиды, которые принимают участие в каждом физиологическом процессе организма.
- Фосфорсодержащие вещества повышают кислотность мочи и снижают вероятность образования камней в почках.
В качестве суточной нормы фосфора для взрослого человека определено количество в 1600 мг. У беременных женщин максимальная потребность в данном элементе увеличивается до 3000 мг. Кормящим матерям необходимо 3800 мг фосфора в сутки. Получить дневную норму вещества человек во взрослом возрасте может, употребляя 130 г сыра, 12 яичных желтков, 6 столовых ложек тыквенных семечек, 500 г мяса или рыбы, либо 400 г овсяных хлопьев. Фосфор усваивается в костях, спустя 4 — 6 часов после попадания в организм с пищей.
Источник: phosfop.blogspot.com
Получение фосфора и его применение
Существует разные способы получения фосфора. Белый фосфор синтезируют с помощью прокаливания природных фосфатов совместно с коксом и песком в электрической печи. При выдерживании продукта реакции в печи в течении некоторого времени белый фосфор Р4 превращается в красный Р.
При выдерживании продукта реакции в печи в течении некоторого времени белый фосфор Р4 превращается в красный Р.
Ca3(PO4)2+3SiO2+5C→3CaSiO3+5CO+2P
Следующий метод предусматривает замену фосфатов другими неорганическими соединениями фосфора, к примеру, метафосфорной кислотой.
4HPO3+10C→P4+2h3O+10CO
Красный и черный фосфор получают из белого фосфора.
Источник: chemege.ru
Фосфор активно применяется в промышленной сфере и сельском хозяйстве. Фосфорсодержащие вещества используют в производстве такой продукции, как:
- топливо;
- спички;
- взрывчатые вещества;
- фосфорные удобрения;
- защитные составы для металлов, предотвращающие коррозию;
- лекарственные препараты, включая антибиотик фосфомицин;
- моющие средства.
Источник: calorizator.ru
Сколько нейтронов содержится в ядре атома фосфора?
Дата последнего обновления: 20 апреля 2023 г.
•
Всего просмотров: 253,8 тыс.
•
Просмотров сегодня: 7,24 тыс.
Подсказка: Для расчета числа нейтронов, присутствующих в ядре атома фосфора, мы должны знать об атомном номере и массовом числе атома фосфора. Зная, что будет легко вычислить количество нейтронов, присутствующих в атомах фосфора.
Полный ответ:
Сначала давайте посмотрим, что такое атом. Вся материя состоит из мельчайших частиц, которые называются атомами. В атомах присутствуют субатомные частицы, такие как протоны, нейтроны, электроны. Атом состоит из ядра, вокруг которого вращаются электроны. Ядро атома состоит из протонов и нейтронов. Протоны и нейтроны вместе называются нуклонами.
Давайте сначала разберемся с атомным номером. Атомный номер — это общее количество электронов или протонов, присутствующих в атомах, и он представлен символом Z.
Теперь давайте перейдем к массовому числу. Массовое число — это общее количество протонов и нейтронов, вместе присутствующих в ядре атома, и оно обозначается символом A.
Теперь давайте рассмотрим атом фосфора. Фосфор имеет атомный номер 15 и массовое число 31.
Чтобы найти количество нейтронов, присутствующих в атоме фосфора, мы должны вычесть количество протонов из массового числа.
Мы можем получить количество протонов из атомного номера, потому что атомный номер — это общее количество электронов или протонов.
Мы знаем, что атомный номер фосфора равен 15, поэтому количество присутствующих протонов также равно 15.
Количество нейтронов = Массовое число атома фосфора – количество протонов
Количество нейтронов, присутствующих в атоме фосфора = 31 – 15 = 16,
Следовательно, количество нейтронов, присутствующих в атоме фосфора, равно 16,
Примечание: Мы должны помнить, что масса электрона настолько мала, что ею можно пренебречь при вычислении массового числа атома фосфора. атом. Мы будем рассматривать только массу протона и нейтронов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Кальций класс 12 химия JEE_Main
Актуальные сомнения
Студенты также читают
CHM1045 Обзорный материал
CHM1045 Обзорный материалОбзор материала CHM1045
Продолжая CHM1045, есть несколько тем, которые вы должны хорошо понимать, чтобы иметь возможность понять концепции, представленные в CHM1046.
1) Строение атома
2) Валентные электроны
3) Структуры Льюиса
4) Ионы и соли
5) Полярность
Давайте начнем с первой из этих тем: Структура атома.
Атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, а электроны — в оболочках, окружающих ядро.
Атомный номер элемента равен количеству протонов, находящихся в его ядре. Если вы измените количество протонов, вы измените элемент, о котором говорите. Атомная масса элемента равна массе его протонов плюс нейтронов. По массе в периодической таблице и атомному номеру вы сможете определить количество нейтронов в атоме.
Пример:
Кислород имеет атомный номер 8 и массу ~16 а.е.м. Это указывает на то, что в ядре атома кислорода 16 — 8 = 8 нейтронов.
Количество электронов в атоме всегда равно количеству протонов, пока атом нейтрален. Когда количество протонов (+ зарядов) не равно количеству электронов (- зарядов), атом называется ионом. Отрицательно заряженные атомы называются анионами, а положительно заряженные атомы называются катионами.
Когда количество протонов (+ зарядов) не равно количеству электронов (- зарядов), атом называется ионом. Отрицательно заряженные атомы называются анионами, а положительно заряженные атомы называются катионами.
Ионы формируются для повышения стабильности атома. Элементы группы VIII, благородные газы, являются наиболее стабильными элементами и имеют восемь валентных электронов (электроны самой внешней оболочки). Все остальные элементы групп I-VII образуют ионы и связи, стремясь получить восемь электронов на своей внешней оболочке.
Пример: Азот является элементом группы V. Чтобы стать похожим на благородный газ Неон, он должен получить 3 электрона. Таким образом, когда азот образует ионы, они имеют 3-заряд, а когда он образует связи, он обычно связывается с тремя другими элементами.
Структура аммиака, показанная выше, является структурой Льюиса. Структуры Льюиса представляют собой изображения молекул, которые используют линии для связей и показывают точки для неподеленных пар электронов. Есть несколько основных правил рисования структур Льюиса, с которыми вы должны быть знакомы:
Есть несколько основных правил рисования структур Льюиса, с которыми вы должны быть знакомы:
Структуры Льюиса построены таким образом, чтобы удовлетворять правилу октетов для каждого из атомов в молекуле. Связи представлены «-», а неподеленные пары электронов представлены «:».
Существуют простые шаги для создания правильной структуры Льюиса:
1) Рассчитайте общее количество доступных валентных электронов.
2)Определить, какой атом будет центральным в молекуле.
3) Расположите атомы симметрично вокруг центрального атома.
4) Разместите связи/электроны вокруг атомов, пока правило октетов не будет выполнено для каждого атома. При необходимости используйте двойные или тройные связи.
5) Покажите любые заряды молекулы с помощью скобок [ ] и поместите заряд в верхний правый угол сразу за скобками
Шаг 1: Рассчитайте общее количество доступных валентных электронов.
В качестве примера возьмем PO 4 3-.
Нам нужно знать, сколько электронов доступно для создания связей для фосфат-иона.
Фосфор находится в группе VA, поэтому у него 5 валентных электронов, а кислород находится в группе VIA, поэтому каждый кислород имеет 6 валентных электронов. Всего валентных электронов = 5 + 4(6) = 29. НО подождите минутку, это нечетное количество электронов, и мы на самом деле не обсуждали этот вопрос, так что чего-то не хватает… О, заряд. На каждый отрицательный заряд иона нам нужно добавить 1 валентный электрон, так что всего получается 29+ 3 = 32 валентных электрона.
Это означает, что у нас есть 32 электрона, которые нужно распределить по связям, чтобы создать ион фосфата.
Шаг 2: Определите, какой атом будет центральным в молекуле.
Центральный атом в молекуле обычно является наименее электроотрицательным атомом. Также часто именно атом позволяет создать наиболее симметричную молекулу. Для фосфата PO 4 3- фосфат является наименее электроотрицательным атомом, и это позволит нам создать наиболее симметричную молекулу, поэтому он, скорее всего, является центральным атомом. Кстати, для других молекул, содержащих водород, мы знаем, что водород может образовывать только одну связь, поэтому атомы водорода НИКОГДА не могут быть центральным атомом.
Для фосфата PO 4 3- фосфат является наименее электроотрицательным атомом, и это позволит нам создать наиболее симметричную молекулу, поэтому он, скорее всего, является центральным атомом. Кстати, для других молекул, содержащих водород, мы знаем, что водород может образовывать только одну связь, поэтому атомы водорода НИКОГДА не могут быть центральным атомом.
Шаг 3: Расположите атомы симметрично вокруг центрального атома.
Большинство творений природы симметричны, и то же самое относится и к большинству химических соединений. При написании структур Льюиса лучше всего наиболее симметричное расположение атомов вокруг центрального атома.
Для фосфата: четыре атома кислорода расположены симметрично вокруг атома фосфора.
Шаг 4: Разместите связи/электроны вокруг атомов, пока для каждого атома не будет выполнено правило октетов. При необходимости используйте двойные или тройные связи
 (Обратите внимание, что показанный заряд является формальным зарядом этих ионов)
(Обратите внимание, что показанный заряд является формальным зарядом этих ионов)Шаг 5: Покажите любые заряды молекулы с помощью скобок [ ] и поместите заряд в верхний правый угол сразу за скобками
Ион фосфата, показанный выше, может объединяться с положительными ионами с образованием солей. Соль — это ионное соединение (металл + неметалл), которое образуется, когда два противоположно заряженных иона объединяются, образуя нейтральное соединение.
Пример: Фосфат натрия = Na 3 PO 4 Это соль, состоящая из ионов Na + и PO 4 3-. На этом этапе вы должны быть в состоянии построить правильную соль из любой комбинации положительных и отрицательных ионов и назвать полученное соединение. Если вы все еще не можете сделать это очень хорошо, вы должны практиковаться!!
Ионные соединения считаются наиболее полярной формой молекулы, поскольку все они в той или иной степени диссоциируют в воде.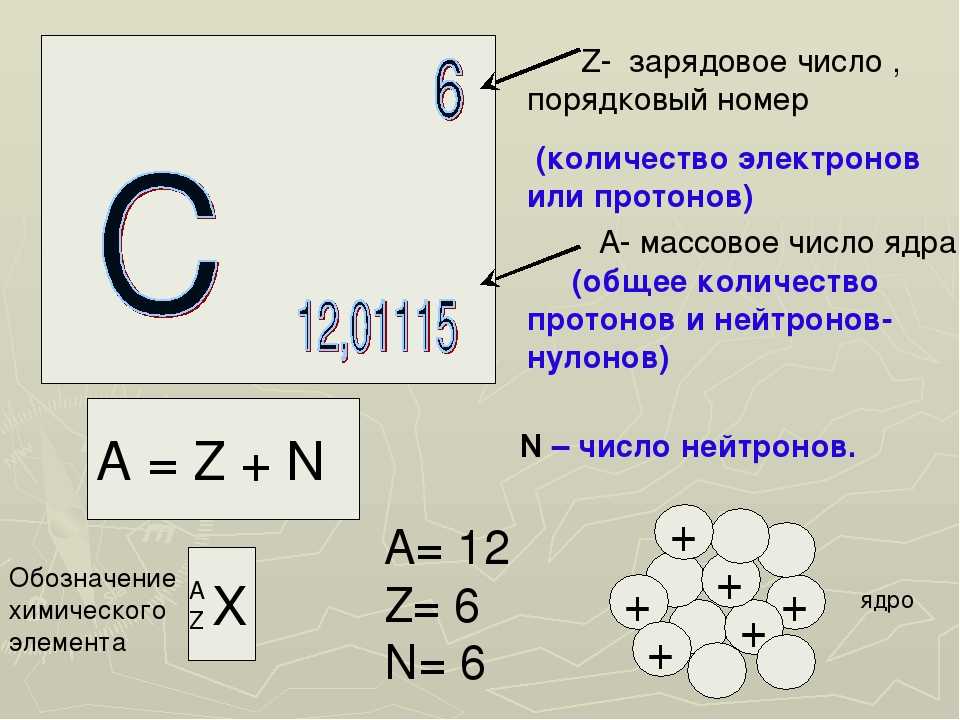 Другие молекулы, ковалентные молекулы, в воде не распадаются на части и поэтому считаются неполярными.
Другие молекулы, ковалентные молекулы, в воде не распадаются на части и поэтому считаются неполярными.
Третья группа молекул является одновременно ковалентной и полярной и поэтому в некоторой степени смешивается с водой. Большая часть материала в первых нескольких главах CHM1046 будет зависеть от ваших знаний об этих типах соединений, поэтому вам нужно будет уметь различать, является ли молекула полярной или нет.
Что вызывает полярность?
Полярные молекулы содержат электроотрицательный атом, который притягивает электроны в молекуле к себе и от других атомов в молекуле. Вы можете думать об этом как о конкурсе популярности, и самый электроотрицательный атом является самым популярным. Все электроны хотят проводить с ним больше времени. Когда это происходит, распределение электронов (- зарядов) концентрируется в одной точке молекулы, а протоны (+ заряды) других атомов остаются несколько открытыми. Это неравномерное распределение создает то, что называется диполем, а молекулы, содержащие диполи, считаются полярными.
Итак, какие элементы электроотрицательны? Наиболее электроотрицательным элементом является фтор, и тенденция электроотрицательности увеличивается слева направо и снизу вверх в периодической таблице.
Другими основными тенденциями, о которых вам следует знать, являются тенденции изменения энергии ионизации и атомного радиуса.
Энергия ионизации или потенциал ионизации — это энергия, необходимая для отрыва электрона от нейтрального атома. Обычно он увеличивается снизу вверх (легче отобрать электрон у атома с большим количеством электронов, чем у атома с небольшим количеством электронов) и слева направо в периодической таблице. Двигаясь слева направо по периоду таблицы Менделеева, вы увеличиваете количество протонов в ядре, но остаетесь в той же орбитальной оболочке. Это означает, что притяжение к ядру увеличивается по мере продвижения слева направо, но экранирование (электроны во внутренних оболочках) остается постоянным.



Leave A Comment