Проверочная работа по теме «Реакции ионного обмена» | Тест по химии (9 класс):
Опубликовано 02.03.2020 — 14:52 — Машеева Цындема Дондоковна
Проверочная работа по теме «Реакции ионного обмена» (9 класс)
1. Запишите уравнения реакции ионного обмена (молекулярные, полные и сокращенные ионные), происходящие между растворами веществ формулы которых приведены ниже.
I вариант
1. NaOH и CuSO4 3. K2CO3 и HCl
2. HNO3 и Ca(OH)2
II вариант
1. BaCl2 и Na2SO4 3. CaCO3 и HNO3
2. H2SO4 и KOH
2. Запишите молекулярные уравнения реакции, соответствующие схемам:
I вариант
Zn2+ + 2OH— = Zn(OH)2 ↓ H+ + OH— = H2O
II вариант
Fe2+ + 2OH— = Fe(OH)2 ↓ SO32- + 2H+ = H2O + SO2 ↑
Скачать:
Предварительный просмотр:
Проверочная работа по теме «Реакции ионного обмена» (9 класс)
1. Запишите уравнения реакции ионного обмена (молекулярные, полные и сокращенные ионные), происходящие между растворами веществ формулы которых приведены ниже.
Запишите уравнения реакции ионного обмена (молекулярные, полные и сокращенные ионные), происходящие между растворами веществ формулы которых приведены ниже.
I вариант
1. NaOH и CuSO4 3. K2CO3 и HCl
2. HNO3 и Ca(OH)2
II вариант
1. BaCl2 и Na2SO4 3. CaCO3 и HNO3
2. h3SO4 и KOH
2. Запишите молекулярные уравнения реакции, соответствующие схемам:
I вариант
Zn2+ + 2OH- = Zn(OH)2 ↓ H+ + OH- = h3O
II вариант
Fe2+ + 2OH- = Fe(OH)2 ↓ SO32- + 2H+ = h3O + SO2 ↑
По теме: методические разработки, презентации и конспекты
организация самостоятельной работы учащихся на уроке при изучении темы «Реакции ионного обмена»
РОпыт по организации самостоятельной работы учащихся на примере урока усвоения конкретных понятий и развития умений и навыков «Реакции ионного обмена». Почему именно на примере этого урока? Вы з…
Почему именно на примере этого урока? Вы з…
Дидактический материал по теме «Реакции ионного обмена»
Представлена презентация для проверки знаний учащихся 9 класса по теме «Реакции ионного обмена» в тестовом виде…
Тестовая работа по теме «Реакции ионного обмена»
Используется для закрепления знаний по теме: «Электролитическая диссоциация. Реакции ионного обмена»…
Урок по теме «Реакции ионного обмена»
Урок проводиться в теме «Изменения, происходящие с веществами»….
Конструкт урока химии 9 класса по теме: «Реакции ионного обмена»
Кострукт содержит цели, задачи урока, планируемые результаты и план урока….
Урок на тему: «Реакции ионного обмена»
Сущность реакций ионного обмена. Условия протекания реакций ионного обмена до конца….
Поурочная разработка урока 9 класс по теме:»Реакции ионного обмена»
Тема урока: «Реакции ионного обмена». Цель: Ознакомить учащихся с реакциями ионного обмена и условиями их протеканияЗадачи:Обучающие:1. Формирование знаний об обрати…
Формирование знаний об обрати…
Поделиться:
Тренировочная работа по химии «Реакции ионного обмена» 9 класс 📕
1. Реакции ионного обмена идут до конца, если образуется малодиссоциирующее вещество:
А)выпадает осадок,
Б)выделяется газ , SO 2 , NH 3 ),
В)образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не диссоциируют. Малорастворимые считаются растворимыми, если записаны ДО реакции, нерастворимыми, если записаны ПОСЛЕ реакции
1.Записать уравнения в молекулярном, ионном полном и ионном сокращенном виде.
Указать уравнения, которые идут до
конца.
FeCl3 + 3NaOH = Fe 3 + 3NaCl
HNO3 + KOH = KNO3 + h3O
Na2S + h3SO4 = Na2SO4 + h3S↑
CaO + HNO3 = Ca 2 + h3O.
Mg 2 + h4PO4 = Mg3 2 + h3O.
Al2 3 + BaCl2 = BaSO4 + AlCl3
2.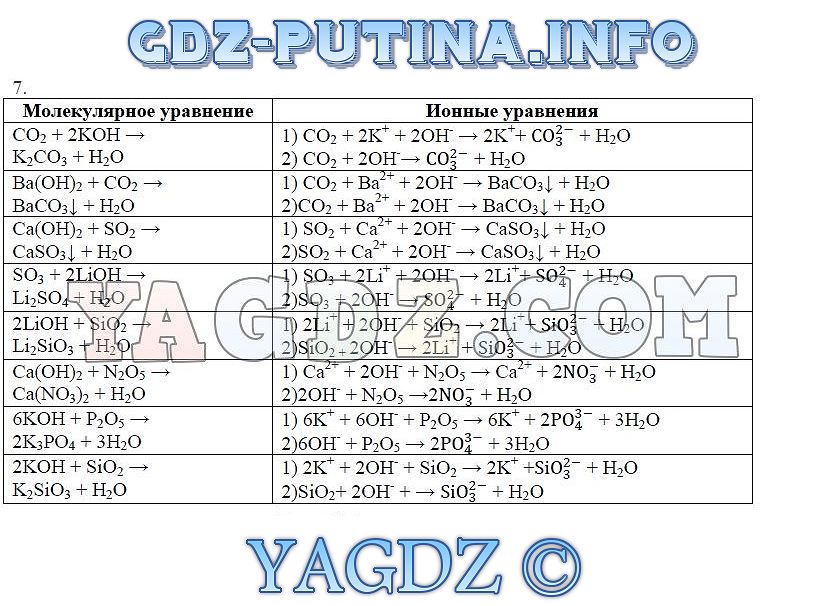 Какой из приведенных реакций Не соответствует Сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
Какой из приведенных реакций Не соответствует Сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + h3SO4 = BaSO4 + 2HCl
2) Ba 2 + h3SO4 = BaSO4 + 2h3O
3) 3BaCl2 + Al2 3 = 3BaSO4 + 2AlCl3
4) Ba 2 + K2SO4 = BaSO4 + 2KNO3
1. Реакции ионного обмена идут до конца, если образуется малодиссоциирующее вещество:
А)выпадает осадок,
Б)выделяется газ , SO 2 , NH 3 ),
В)образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не диссоциируют. Малорастворимые
считаются растворимыми, если записаны ДО реакции, нерастворимыми, если записаны ПОСЛЕ реакции
1.Записать уравнения в молекулярном, ионном полном и ионном сокращенном виде.
Указать уравнения, которые идут до конца.
FeCl3 + 3NaOH = Fe 3 + 3NaCl
HNO3 + KOH = KNO3 + h3O
Na2S + h3SO4 = Na2SO4 + h3S↑
CaO + HNO3 = Ca 2 + h3O.
Mg 2 + h4PO4 = Mg3 2 + h3O.
Al2 3 + BaCl2 = BaSO4 + AlCl3
2. Какой из приведенных реакций Не соответствует Сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + h3SO4 = BaSO4 + 2HCl
2) Ba 2 + h3SO4 = BaSO4 + 2h3O
3) 3BaCl2 + Al2 3 = 3BaSO4 + 2AlCl3
4) Ba 2 + K2SO4 = BaSO4 + 2KNO3
1. Реакции ионного обмена идут до конца, если образуется малодиссоциирующее вещество:
А)выпадает осадок,
Б)выделяется газ , SO 2 , NH 3 ),
В)образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не диссоциируют. Малорастворимые считаются растворимыми, если записаны ДО реакции, нерастворимыми, если записаны ПОСЛЕ реакции
1.Записать уравнения в молекулярном, ионном полном и ионном сокращенном виде.
Указать уравнения, которые идут до конца.
FeCl3 + 3NaOH = Fe 3 + 3NaCl
HNO3 + KOH = KNO3 + h3O
Na2S + h3SO4 = Na2SO4 + h3S↑
CaO + HNO3 = Ca 2 + h3O.
Mg 2 + h4PO4 = Mg3 2 + h3O.
Al2 3 + BaCl2 = BaSO4 + AlCl3
2. Какой из приведенных реакций Не соответствует Сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + h3SO4 = BaSO4 + 2HCl
2) Ba 2 + h3SO4 = BaSO4 + 2h3O
3) 3BaCl2 + Al2 3 = 3BaSO4 + 2AlCl3
4) Ba 2 + K2SO4 = BaSO4 + 2KNO3
1. Реакции ионного обмена идут до конца, если образуется малодиссоциирующее вещество:
А)выпадает осадок,
Б)выделяется газ , SO 2 , NH 3 ),
В)образуется вода.
2. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость.
3. Нерастворимые вещества на ионы не диссоциируют. Малорастворимые считаются растворимыми, если записаны ДО реакции, нерастворимыми, если записаны ПОСЛЕ реакции
1.Записать уравнения в молекулярном, ионном полном и ионном сокращенном виде.
Указать уравнения, которые идут до конца.
FeCl3 + 3NaOH = Fe 3 + 3NaCl
HNO3 + KOH = KNO3 + h3O
Na2S + h3SO4 = Na2SO4 + h3S↑
CaO + HNO3 = Ca 2 + h3O.
Mg 2 + h4PO4 = Mg3 2 + h3O.
Al2 3 + BaCl2 = BaSO4 + AlCl3
2. Какой из приведенных реакций Не соответствует Сокращенное ионное уравнение: Ba2+ + SO42- = BaSO4?
1) BaCl2 + h3SO4 = BaSO4 + 2HCl
2) Ba 2 + h3SO4 = BaSO4 + 2h3O
3) 3BaCl2 + Al2 3 = 3BaSO4 + 2AlCl3
4) Ba 2 + K2SO4 = BaSO4 + 2KNO3
3. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca 2 + CO2 + CaCO3 + h3O
3) Ca 2 = CaCO3 + CO2 + h3O
4) CaO + CO2 = CaCO3
4. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
5. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
6. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl — 2) Cu2+ и S2-
3) Al3+ и SO4 2- 4) Zn2+ и NO3-
7. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4 2) h3SO4 и Ba 2
3) HNO3 + Ba 2 4) HCl + Ba 2
8.При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) Nh5Cl 2) CuCl2 3) ZnSO4 4) h4PO4
3. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca 2 + CO2 + CaCO3 + h3O
3) Ca 2 = CaCO3 + CO2 + h3O
4) CaO + CO2 = CaCO3
4. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
5. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
6. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl — 2) Cu2+ и S2-
3) Al3+ и SO4 2- 4) Zn2+ и NO3-
7. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4 2) h3SO4 и Ba 2
3) HNO3 + Ba 2 4) HCl + Ba 2
8.При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) Nh5Cl 2) CuCl2 3) ZnSO4 4) h4PO4
3. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca 2 + CO2 + CaCO3 + h3O
3) Ca 2 = CaCO3 + CO2 + h3O
4) CaO + CO2 = CaCO3
4. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
5. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
6. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl — 2) Cu2+ и S2-
3) Al3+ и SO4 2- 4) Zn2+ и NO3-
7. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4 2) h3SO4 и Ba 2
3) HNO3 + Ba 2 4) HCl + Ba 2
8.При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) Nh5Cl 2) CuCl2 3) ZnSO4 4) h4PO4
3. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
2) Ca 2 + CO2 + CaCO3 + h3O
3) Ca 2 = CaCO3 + CO2 + h3O
4) CaO + CO2 = CaCO3
4. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
5. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
6. Какая пара ионов не может одновременно присутствовать в растворе?
Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl — 2) Cu2+ и S2-
3) Al3+ и SO4 2- 4) Zn2+ и NO3-
7. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4 2) h3SO4 и Ba 2
3) HNO3 + Ba 2 4) HCl + Ba 2
8.При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
1) Nh5Cl 2) CuCl2 3) ZnSO4 4) h4PO4
Первое появление сан саныча запомнилось не случайно.
Тренировочная работа по химии «Реакции ионного обмена» 9 класс
Ионообменная реакция | Определение, примеры, приложения и факты
Химическая структура катионита
См. все среды
- Связанные темы:
- ионообменная смола ионообменная емкость анионный обмен катионный обмен ионообменник
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
ионообменная реакция , любая из класса химических реакций между двумя веществами (каждая из которых состоит из положительно и отрицательно заряженных частиц, называемых ионами), которая включает обмен одного или нескольких ионных компонентов.
Ионы – это атомы или группы атомов, несущие положительный или отрицательный электрический заряд. В парах или других кратных количествах они составляют вещество многих кристаллических материалов, включая поваренную соль. Когда такое ионное вещество растворяется в воде, ионы в значительной степени освобождаются от ограничений, удерживающих их внутри жесткого массива кристалла, и относительно свободно перемещаются в растворе. Некоторые нерастворимые материалы, несущие положительный или отрицательный заряд на своей поверхности, реагируют с ионными растворами, избирательно удаляя различные ионы, заменяя их ионами других типов. Такие процессы называются ионообменными реакциями. Они используются различными способами для удаления ионов из раствора и для отделения ионов различных типов друг от друга. Такое разделение широко используется в научных лабораториях для очистки и облегчения анализа неизвестных смесей. Ионообменные материалы, такие как цеолиты, также используются в коммерческих целях для очистки воды (среди прочего) и в медицине в качестве искусственных почек и для других целей.
Удивительно, но открытие процессов ионного обмена предшествовало великому шведскому химику Сванте Аррениусу, сформулировавшему ионную теорию. В 1850 году, за девять лет до рождения Аррениуса, в журнале Королевского сельскохозяйственного общества Англии появились отдельные статьи агронома сэра Х.С.М. Томпсон и химик Дж.Т. Способ, описывающий явление ионного обмена, происходящее в почвах. В своей статье, озаглавленной «О способности почв поглощать навоз», Уэй обратился к вопросу о том, как растворимые удобрения, такие как хлористый калий, сохраняются в почве даже после проливных дождей. Уэй взял ящик с отверстием в дне, наполнил его почвой и вылил на почву раствор хлористого калия, собирая жидкость, вытекавшую из дна. Затем он промыл почву дождевой водой и проанализировал собранную им воду как из раствора, так и из дождевой воды. Оказалось, что вода содержит весь первоначально добавленный хлорид, но не содержит калия; калий был заменен химически эквивалентными количествами магния и кальция.
Говоря современным языком, процесс можно описать так: ионы калия попадают в почву и вытесняют ионы кальция и магния. Ионы хлора не участвуют в операции и проходят в неизменном виде. С точки зрения химического уравнения процесс представляет собой 2K + + Ca 2+ (почва) ⇌ Ca 2+ + 2K + (почва), в котором двойная стрелка указывает на то, что обмен обратим. В эксперименте Уэя процесс был доведен до конца (то есть равновесие сдвинулось вправо), потому что вода, просачивающаяся сквозь почву, постоянно контактировала со свежей почвой, насыщенной кальцием. Как также заметил Уэй, калий можно было восстановить, промывая почву раствором хлорида кальция (что сдвигало равновесие в противоположном направлении).
Britannica Quiz
Типы химических реакций
Ионообменная хроматография – определение, принцип, части, шаги, применение

Leave A Comment