ОГЭ по химии | Задание 16
Все для самостоятельной подготовки к ОГЭ
Зарегистрироваться
Русский язык Математика Обществознание Химия Биология
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22
Разбор сложных заданий в тг-канале:
Посмотреть
Задача 1
В ряду химических элементов Na → Mg → Al
- уменьшаются заряды ядер атомов
- увеличивается число электронов во внешнем электронном слое
- уменьшается электроотрицательность
- уменьшается р…
Задача 2
В ряду химических элементов Be → Mg → Ca
- уменьшаются заряды ядер атомов
- увеличивается число электронов во внешнем электронном слое
- уменьшается электроотрицательность
- уменьшается р…
В ряду химических элементов Si → P → S
- уменьшается число протонов в ядре
- уменьшается электроотрицательность
- увеличивается число электронов во внешнем электронном слое
- увеличиваетс…
Задача 4
В каких рядах химические элементы расположены в порядке уменьшения кислотных свойств их высших оксидов?
- В → C → N
- P → Si → Al
- Cl → Br → I
- P → S → Cl
- Ca → Mg → Be
Задача 5
В ряду химических элементов B → Al → In
- уменьшается радиус атомов
- возрастает способность атомов отдавать электроны
- уменьшаются заряды ядер атомов
- уменьшается относительная атомная…
Задача 6
В ряду химических элементов Si → Ge → Sn
- увеличивается число электронных слоёв в атомах
- усиливаются неметаллические свойства соответствующих им простых веществ
- уменьшается значени…
Задача 7
Щёлочноземельные металлы характеризуют следующие признаки:
- радиус атома уменьшается с увеличением атомной массы элементов
- гидроксиды являются щелочами
- образуют гидриды ЭН2
- имеют н…
Задача 8
В ряду химических элементов Be → Mg → Ba
- происходит переход от неметаллических свойств через амфотерные к металлическим
- не изменяется число электронов во внешнем электронном слое …
Задача 9
В порядке усиления неметаллических свойств расположены химические элементы следующих рядов:
- C → N → O
- N → P → As
- Te → S → Se
- Si → В → Be
- Mg → Al → S
Задача 10
Для ряда химических элементов бор → углерод → азот характерны следующие закономерности:
- уменьшается электроотрицательность
- увеличивается число электронов во внешнем электронном сл…
Задача 11
В ряду химических элементов Se → S → O
- увеличивается степень окисления элементов в высших оксидах
- уменьшается число валентных электронов в атомах
- усиливаются неметаллические свойс…
Задача 12
В ряду химических элементов Be → C → N
- уменьшается число протонов в ядре
- уменьшается электроотрицательность
- увеличивается число электронов во внешнем электронном слое
- увеличиваетс…
Задача 13
В ряду химических элементов As → P → N
- увеличивается электроотрицательность
- возрастают радиусы атомов
- усиливаются металлические свойства
- уменьшается валентность в высших оксидах
- в…
Задача 14
Значение высших степеней окисления элементов увеличивается в рядах
- Al → P → Cl
- Se → S → O
- C → Si → Ge
- Ge → As → Se
- Be → Mg → Ca
Задача 15
В ряду химических элементов Be → C → N
- уменьшается число протонов в ядре
- уменьшается электроотрицательность
- увеличивается число электронов во внешнем электронном слое
- увеличиваетс…
Задача 16
В ряду химических элементов As → P → N
- увеличивается электроотрицательность
- возрастают радиусы атомов
- усиливаются металлические свойства
- уменьшается валентность в высших оксидах
- у…
Задача 17
В порядке усиления неметаллических свойств расположены химические элементы следующих рядов:
- N → C → O
- Te → Se → S
- Mg → Al → S
- N → P → As
- Si → В → Be
Задача 18
Щёлочноземельные металлы характеризует следующие признаки:
- радиус атома уменьшается с увеличением атомной массы элементов
- гидроксиды проявляют щелочные свойства
- образуют гидриды Э…
В ряду элементов O → S → Se
- все элементы имеют высшую степень окисления, равную номеру группы
- уменьшается прочность водородных соединений
- увеличивается высшая степень окисления
- ум…
Задача 20
В ряду химических элементов Mg → Si → S
- уменьшается число протонов в ядре
- уменьшается электроотрицательность
- увеличивается число электронов на внешнем электронном слое
- увеличивает…
1 2
Популярные материалы
Составим твой персональный план подготовки к ОГЭ
Задание 2 ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 81%
Ответом к заданию 2 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Посмотреть
Задачи для практики
Задача 1
1) N 2) S 3) P 4) Se 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(пятой) расположены азот, фосфор, мышьяк. Электроотрицательность убывает в пределах одной группы – сверху вниз, поэтому по убыванию электроотрицательности элементы расположены следующим образом: N, P, As.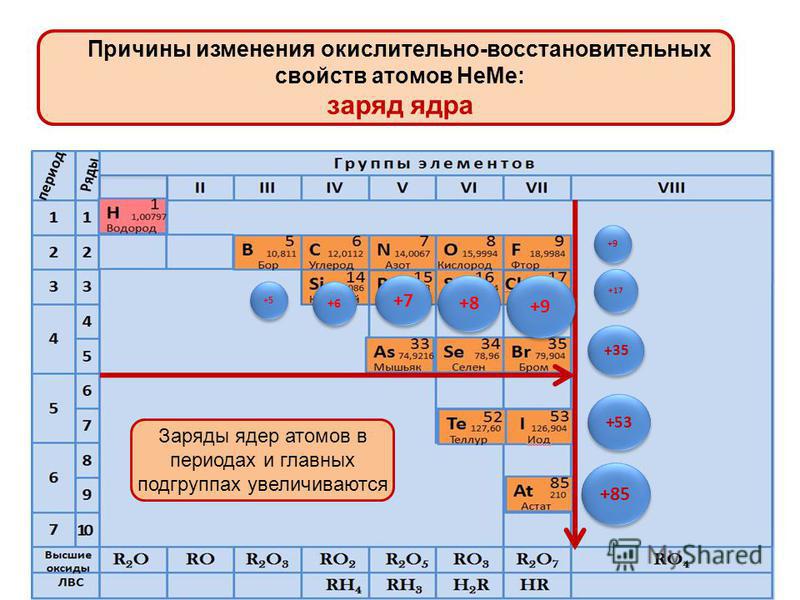
Ответ: 135
Показать решение
Бесплатный интенсив
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Определяем положение элементов в Периодической системе.
1) Теллур Te находится в VIA подгруппе пятого периода.
2) Йод I находится в VIIA подгруппе пятого периода.
3) Кислород O находится в VIA подгруппе второго периода.
4) Сера S находится в VIA подгруппе третьего периода.
5) Стронций Sr находится в IIA подгруппе пятого периода.
В пятом периоде находятся элементы теллур (ответ — 1), йод (ответ — 2) и стронций (ответ — 5).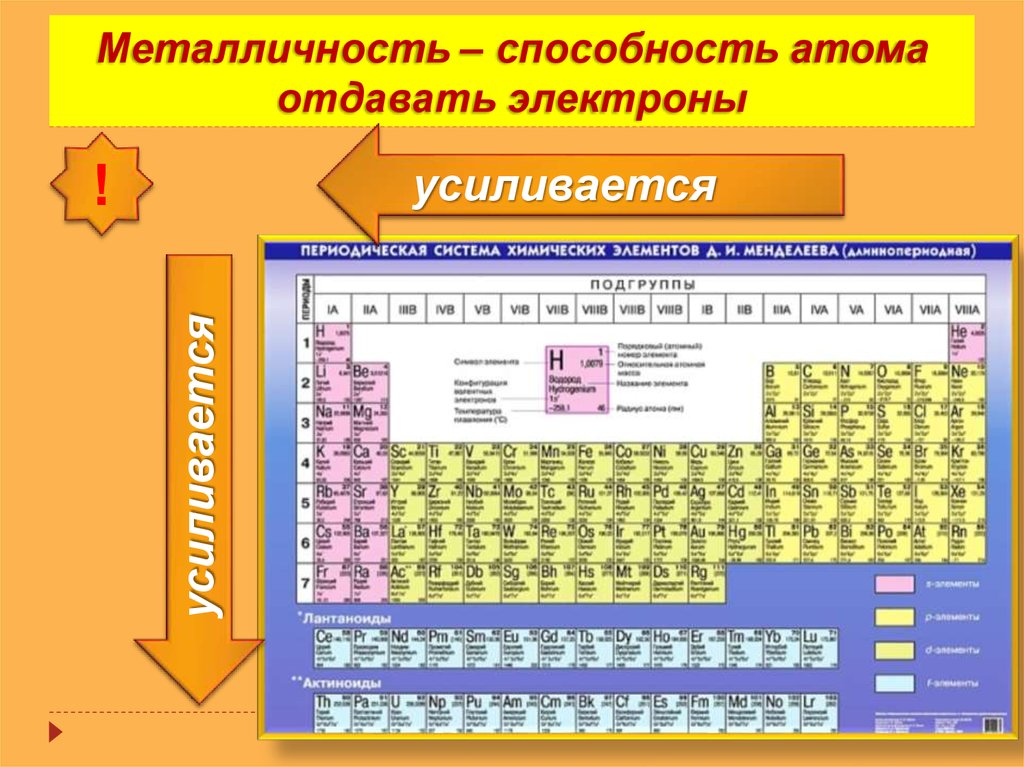
Вывод: правильная последовательность — 5, 1, 2.
Ответ: 512
Показать решение
Бесплатный интенсив
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке уменьшения восстановительных свойств этих неметаллов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Базовые знания. К неметаллам относят элементы главных подгрупп Периодической системы химических элементов Д. И. Менделеева, расположенные правее (выше) условной линии бор (порядковый номер 5, главная подгруппа III группы второго периода) — астат (порядковый номер 85, главная подгруппа VII группы шестого периода), водород и инертные газы.
Вывод: к неметаллам относятся сера (S, номер 2), фосфор (P, номер 3) и кремний (Si, номер 5).
Базовые знания. Восстановительные свойства элементов по периоду уменьшаются слева направо.
Вывод: правильная последовательность уменьшения восстановительных свойств Si → P → S, то есть 5 → 3 → 2.
Ответ: 532
Показать решение
Бесплатный интенсив
Задача 4
1) Cu 2) Ba 3) Ca 4) Ag 5) Be
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке убывания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе II группы находятся Ba, Ca и Be. В пределах группы атомный радиус уменьшается в направлении снизу-вверх, поэтому порядок элементов по уменьшению атомного радиуса следующий: Ba, Ca, Be.
Ответ: 235
Показать решение
Бесплатный интенсив
Задача 5
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(второй) расположены магний, стронций и барий. В пределах одной группы атомный радиус возрастает сверху вниз, поэтому правильный порядок элементов следующий: Ba, Sr, Mg.
Ответ: 341
Показать решение
Бесплатный интенсив
Задача 6
1) Mg 2) Al 3) Sb 4) N 5) Bi
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.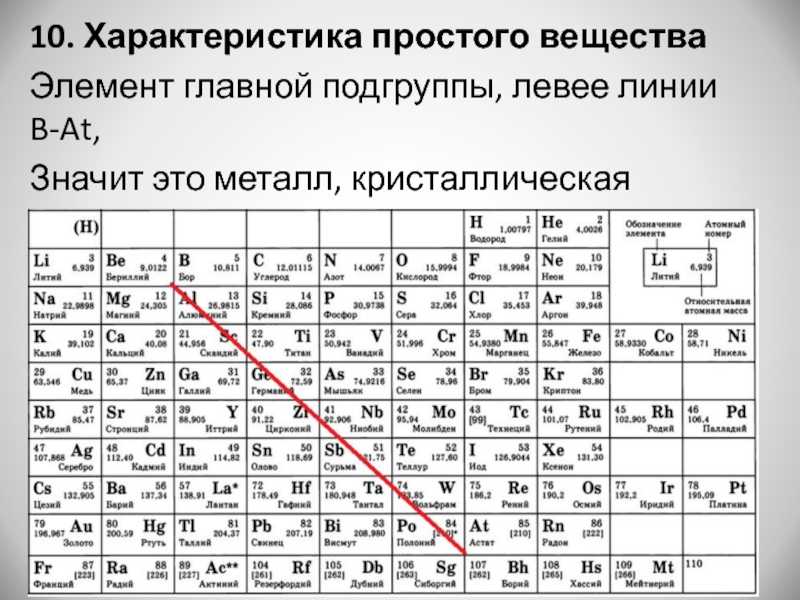 И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке ослабления кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке ослабления кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе V группы из предложенных элементов находятся Sb, N и Bi. Кислотные свойства высших гидроксидов ослабевают в пределах одной группы сверху вниз, поэтому правильный порядок элементов такой: N, Sb, Bi.
Ответ: 435
Показать решение
Бесплатный интенсив
Задача 7
1) Ti 2) Cl 3) Zr 4) I 5) F
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (VII) расположены галогены — хлор, йод и фтор. Электроотрицательность возрастает по мере приближения ко фтору, поэтому элементы следует расположить в следующем порядке: I, Cl, F.
Ответ: 425
Показать решение
Бесплатный интенсив
Задача 8
1) S 2) Al 3) O 4) B 5) Te
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке ослабления восстановительных свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы(шестой) расположены кислород, сера и теллур. В таблице Менделеева восстановительные свойства в пределах одной группы усиливаются сверху вниз, поэтому правильный порядок элементов следующий: Te, S, O.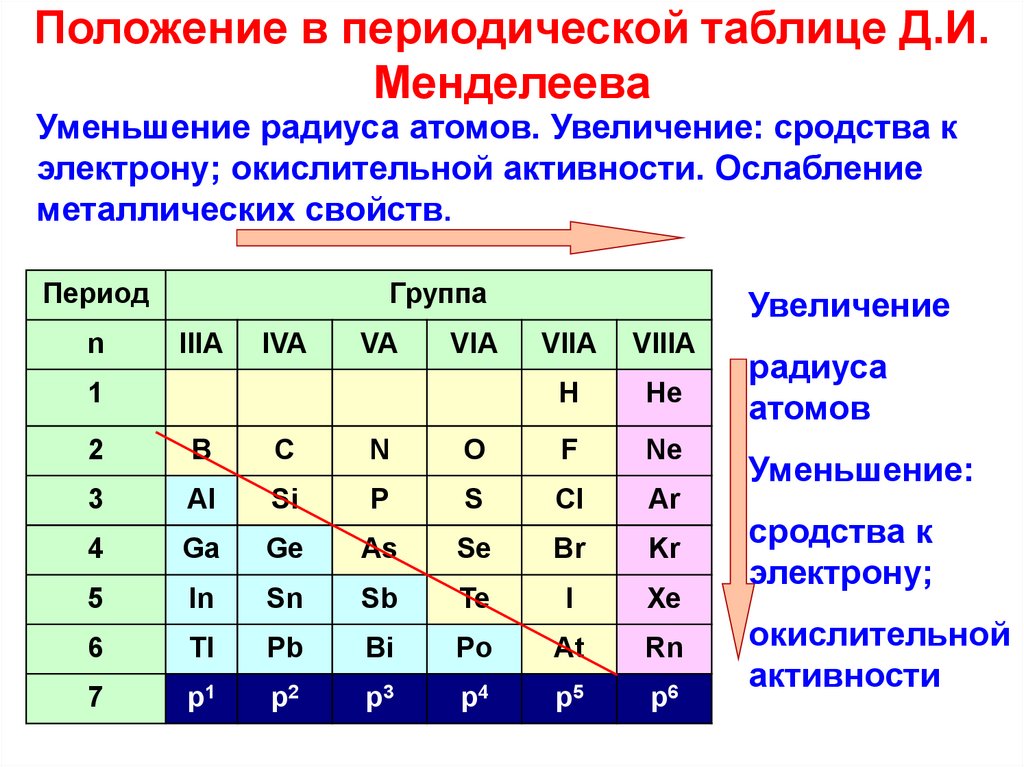
Ответ: 513
Показать решение
Бесплатный интенсив
Задача 9
1) S 2) K 3) O 4) Te 5) Na
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (VI — халькогены) в Периодической системе химических элементов Д. И. Менделеева находятся сера, кислород и теллур. В пределах одной группы атомный радиус возрастает сверху вниз, так как у элементов увеличивается количество электронных слоёв, поэтому правильный порядок элементов следующий: О, S, Te.
Ответ: 314
Показать решение
Бесплатный интенсив
Задача 10
1) N 2) S 3) P 4) Se 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (пятой) находятся N, P и As. Электроотрицательность уменьшается по мере приближения к цезию, то есть в пределах одной группы — сверху вниз, поэтому правильный порядок элементов следующий: N, P, As.
Ответ: 135
Показать решение
Бесплатный интенсив
Задача 11
1) K 2) S 3) Ar 4) Na 5) Se
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одном периоде (третьем) находятся Na, S и Ar. В пределах одного периода атомный радиус возрастает справа налево, поэтому правильный порядок элементов следующий: Ar, S, Na.
В пределах одного периода атомный радиус возрастает справа налево, поэтому правильный порядок элементов следующий: Ar, S, Na.
Ответ: 324
Показать решение
Бесплатный интенсив
Задача 12
1) Mg 2) Cl 3) S 4) Br 5) Ca
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке убывания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В Периодической системе химических элементов Д. И. Менделеева в одном периоде (третьем) находятся Mg, Cl и S. Электроотрицательность уменьшается по мере приближения к цезию, то есть в пределах одного периода — справа налево, поэтому правильный порядок элементов следующий: Cl, S, Mg.
Ответ: 231
Показать решение
Бесплатный интенсив
Задача 13
1) Te 2) Be 3) I 4) Ba 5) Sr
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
Металлические свойства усиливаются ближе к цезию, то есть вниз по группе. В одной группе находятся три элемента: бериллий, стронций и барий, в таком порядке (все ближе к цезию) их и располагаем.
Ответ: 254
Показать решение
Бесплатный интенсив
Задача 14
1) Li 2) Se 3) K 4) S 5) Cs
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке уменьшения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (первой) находятся Li, K, Cs. Электроотрицательность в таблице Менделеева уменьшается по мере приближения ко фтору, то есть в пределах одной группы — сверху вниз, поэтому порядок элементов по уменьшению электроотрицательности следующий: Li, K, Cs.
Электроотрицательность в таблице Менделеева уменьшается по мере приближения ко фтору, то есть в пределах одной группы — сверху вниз, поэтому порядок элементов по уменьшению электроотрицательности следующий: Li, K, Cs.
Ответ: 135
Показать решение
Бесплатный интенсив
Задача 15
1) Li 2) Ar 3) Na 4) Ne 5) Cs
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления окислительных свойств их катионов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одной (1) группе находятся литий, натрий и цезий. Окислительные свойства катионов (= насколько у простого вещества металла слабее восстановительные свойства) увеличиваются ближе к фтору, то есть вправо по периоду или вверх по группе, поэтому: цезий, натрий, литий.
Ответ: 531
Показать решение
Бесплатный интенсив
Задача 16
1) O 2) S 3) N 4) Te 5) P
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы находятся кислород, сера и теллур. Металлические свойства в таблице Менделеева увеличиваются по мере приближения к францию, то есть в пределах одной группы — сверху вниз, поэтому порядок элементов по возрастанию металлических свойств такой: кислород, сера, теллур.
Ответ: 124
Показать решение
Бесплатный интенсив
Задача 17
1) O 2) S 3) Ne 4) Ar 5) Se
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы (шестой) находятся О, S и Se. В пределах одной группы атомный радиус возрастает сверху вниз, поэтому правильный порядок элементов следующий: O, S , Se.
Ответ: 125
Показать решение
Бесплатный интенсив
Задача 18
1) O 2) N 3) S 4) C 5) As
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В одном (2 периоде) находятся азот, углерод и кислород. Электроотрицательность увеличивается ближе к фтору, поэтому углерод, азот, кислород.
Электроотрицательность увеличивается ближе к фтору, поэтому углерод, азот, кислород.
Ответ: 421
Показать решение
Бесплатный интенсив
Задача 19
1) Cl 2) Fe 3) I 4) Mn 5) Br
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
В главной подгруппе одной группы из данных элементов находятся Cl, I, Br. Электроотрицательность возрастает по направлению от цезия к фтору, то есть, в пределах одной группы — снизу вверх, поэтому по возрастанию электроотрицательности элементы расположены следующим образом: I, Br, Cl.
Ответ: 351
Показать решение
Бесплатный интенсив
Задача 20
1) As 2) Cr 3) Na 4) V 5) Sc
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в побочных подгруппах одного периода. Расположите выбранные элементы в порядке уменьшения высшей валентности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
И. Менделеева находятся в побочных подгруппах одного периода. Расположите выбранные элементы в порядке уменьшения высшей валентности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Решение
По периодической таблице Менделеева находим, что в одном периоде находятся элементы: As, Cr, V, Sc. Мышьяк находится в главной подгруппе, поэтому не подходит. Высшая валентность, как правило, зависит от группы, в которой находится элемент. Хром в 6 группе, высшая валентность 6. Ванадий в 5 группе, его высшая валентность равна 5. Скандий находится в 3 группе, высшая валентность 3.
Ответ: 245
Показать решение
Бесплатный интенсив
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк —
это займет буквально 10 секунд.
Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить
уведомления.
Ты всегда можешь запретить
уведомления.
Включить уведомления
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.
Курс стартует 4 сентября. Бесплатный интенсив
Элементы группы 2: щелочноземельные металлы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 594
Щелочноземельные металлы группы 2 включают бериллий, магний, кальций, барий, стронций и радий и представляют собой мягкие серебряные металлы, которые по своему характеру менее металлические, чем щелочные металлы группы 1. Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реакционноспособны, как и щелочные металлы группы 1. Все элементы группы 2 имеют по два электрона на своих валентных оболочках, что дает им степень окисления +2.
Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реакционноспособны, как и щелочные металлы группы 1. Все элементы группы 2 имеют по два электрона на своих валентных оболочках, что дает им степень окисления +2.
- Группа 2: Химические свойства щелочноземельных металлов
- Охватывает элементы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Включает тенденции атомных и физических свойств, тенденции реакционной способности, модели растворимости в гидроксидах и сульфатах, тенденции термического разложения нитратов и карбонатов и некоторые нетипичные свойства бериллия.
- Щелочные земли (группа II) Тенденции
- Группа 2: Общие свойства
- Реакции элементов 2 группы с кислотами
- Реакции элементов 2 группы с кислородом
- Реакции элементов 2 группы с водой
- Растворимость гидроксидов, сульфатов и карбонатов 90 010
- Термическая стабильность нитратов и карбонатов
- Группа 2: Физические свойства щелочноземельных металлов
- На этой странице исследуются тенденции изменения некоторых атомных и физических свойств элементов группы 2: бериллий, магний, кальций, стронций и барий .
 Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.
Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.
- Химия бериллия (Z=4)
- Название бериллий происходит от греческого beryllos, что является названием драгоценного камня берилла. Этот элемент представляет собой тугоплавкий серебристо-белый металл, который является первым представителем щелочноземельных металлов. Он мало распространен в окружающей среде и встречается в основном в минерале берилле с алюминием и кремнием.
- Бериллий фторид
- Некоторые нетипичные свойства соединений бериллия
- Химия магния (Z=12)
- Магний является элементом второй группы и восьмым по распространенности элементом в земной коре. Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом.
 Мелкие частицы магния также могут загореться на воздухе.
Мелкие частицы магния также могут загореться на воздухе.
- Химия кальция (Z=20)
- Кальций является 20-м элементом периодической таблицы. Это металл группы 2, также известный как щелочноземельный металл, и у него нет заселенных электронов на d-орбитали. Кальций является пятым наиболее распространенным элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (на самом деле, даже мертвые) имеют и нуждаются в кальции для выживания. 9Химия стронция (Z=38)
- Стронций является элементом группы 2, который не встречается в свободном виде из-за реактивность с кислородом и водой. Он встречается в природе только в соединениях с другими элементами, такими как стронцианит. Он мягче кальция и энергичнее разлагает воду. Он имеет серебристый вид, но затем становится желтым с образованием оксида. Стронций назван в честь шотландской деревни на Стронтиане.
- Химия бария (Z=56)
- Барий – мягкий серебристо-белый металл с температурой плавления 1000 К.
 Из-за реакции на воздух барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита.
Из-за реакции на воздух барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита. - Бария гидроксид
- Бария сульфат
- Бура
- Химия радия (Z=88)
- Радий получил свое название от латинского слова «радиус» или «луч». Все изотопы радия радиоактивны, многие проявляют люминесценцию, легко реагируя с кислородом и водой. Металл был обнаружен и выделен в 1911 Марии Кюри.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Металл щелочноземельный | Свойства, список и реактивность
таблица Менделеева
Посмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
См. все сопутствующие материалы →
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Возникновение, свойства и использование
До XIX века неметаллические вещества, нерастворимые в воде и не изменяющиеся при воздействии огня, назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0219 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т.е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Викторина «Британника»
Факты, которые вы должны знать: Викторина по периодической таблице
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария).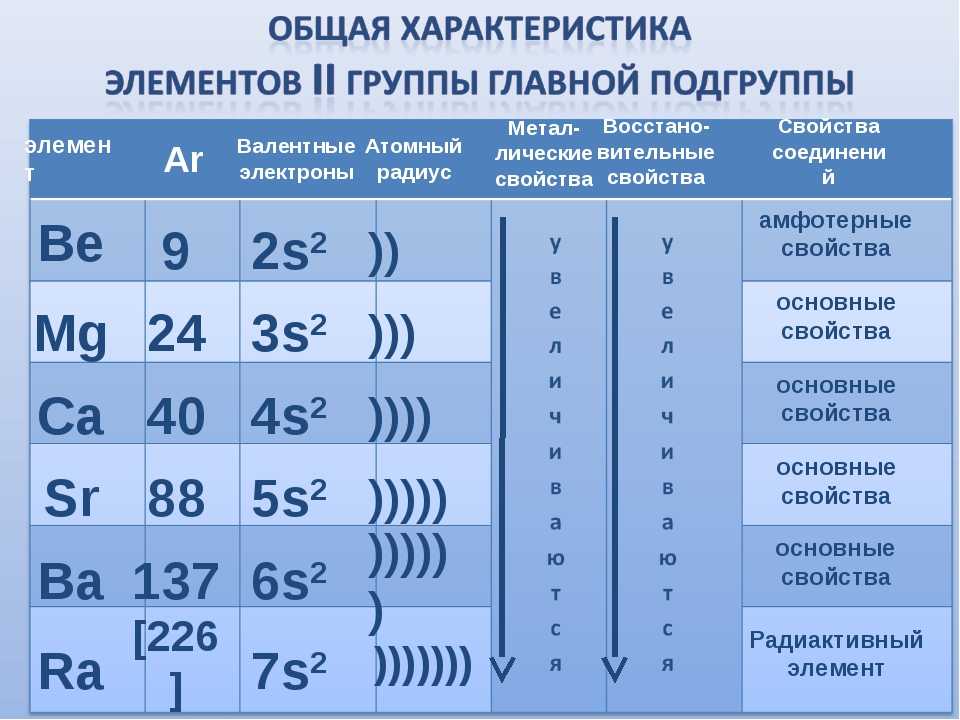 Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0239 glucina (греч. glykys , «сладкий») из-за его сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0239 glucina (греч. glykys , «сладкий») из-за его сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Магний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены в виде нечистых металлов английским химиком сэром Хамфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов калия.

 Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.
Разделы ниже охватывают тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств. Мелкие частицы магния также могут загореться на воздухе.
Мелкие частицы магния также могут загореться на воздухе. Из-за реакции на воздух барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита.
Из-за реакции на воздух барий не встречается в природе в чистом виде. форме, но может быть извлечен из минерального барита.
Leave A Comment