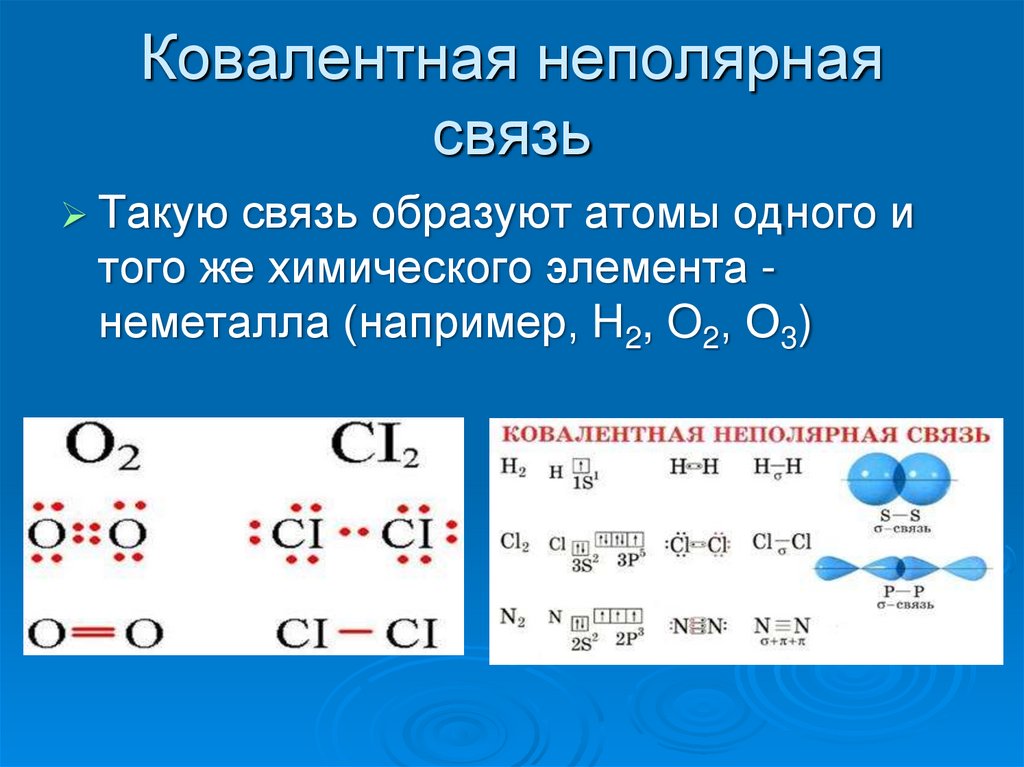
Полярность ковалентной связи и полярность молекул
Если ковалентная связь соединяет два одинаковых атома (например, в молекуле F2), то общая электронная пара принадлежит им в равной степени.
F F .
В этом случае атомы имеют одинаковую электроотрицательность, то есть притягивают электроны с одинаковой силой. Такая ковалентная связь называется неполярной.
Если же атомы разные, то общие электроны смещаются к более электроотрицательному атому. Например, электроотрицательность хлора больше, чем водорода, и общая электронная пара смещается к хлору:
|
|
δ+ δH Cl, или H Cl (ЭОH ЭОCl).
В результате атом хлора получает отрицательный частичный заряд δ(«дельта минус»), а атом водорода – такой же положительный заряд δ+ («дельта плюс»), и ковалентная связь становится полярной.
Ковалентная полярная связь – это наиболее типичный вид связи
в веществах.
Если общая электронная пара принадлежит двум атомам
в равной степени – это неполярная ковалентная связь.
! Если общая электронная пара частично смещена к одному из атомов – это полярная ковалентная связь.
Чем сильнее различаются электроотрицательности атомов, тем больше полярность связи между ними. Так, полярность связи H–C меньше, чем H–F, потому что (ЭОH – ЭОC) < (ЭОH – ЭОF), а связь Н–Н неполярная (ЭОH – ЭОH = 0).
Молекулы тоже могут быть неполярными или полярными.
В простых веществах, где все атомы одинаковые, связи неполярные и молекулы тоже неполярные (h3, O2, P4, S8 и другие).
Рассмотрим сложные вещества. Молекула хлороводорода HCl,
как и любая другая двухатомная молекула с полярной связью, – это полярная молекула, или диполь3. Полярность более сложных молекул зависит от направления связей, то есть от расположения атомов
в пространстве.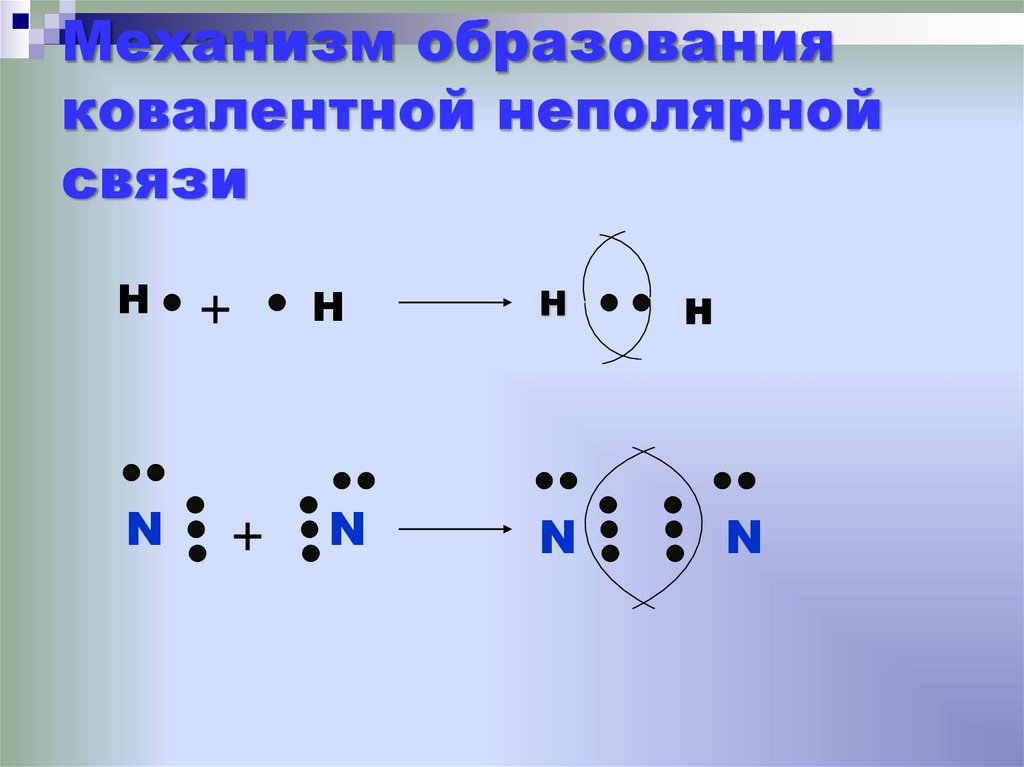
3 Диполем называется частица, в которой центры положительного и отрицательного зарядов не совпадают, находятся в разных местах. Величина диполя тем больше, чем больше заряды и расстояние между ними.
Пример 5. Полярность молекул оксида углерода (IV) и воды.
В трехатомной молекуле СО2 все атомы расположены на прямой линии (линейная молекула). Все связи полярные. Центр отрицательных зарядов находится между атомами кислорода, то есть на атоме углерода. Он совпадает с положительным зарядом, который
также находится на углероде.
δ- δ+ δO С O .
Следовательно, молекула СО2 – неполярная молекула.
В трехатомной молекуле Н2О атомы расположены под углом друг к другу (угловая молекула). Все связи полярные. Центр положительных зарядов находится между атомами водорода. Он не совпадает с отрицательным зарядом на атоме кислорода.
δO H δ+
δ+ H
центр положительных
зарядов
Следовательно, молекула Н2О полярная (диполь).
Материал взят из книги Химическая связь и строение атома (Медведев А.А.)
ковалентная (полярная и неполярная), ионная, металлическая.
Задание № 3
Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кри- сталлах, приводящий к понижению общей энергии системы. При всем многообразии химических связей их природа едина и носит электростатический характер.
Основные виды хим. связи (по распределению электронной плотности между взаимодействующими атомами):Различают ионную, ковалентную и металлическую связь, водородная.
Ковалентная и ионная связи являются базовыми типами связи.
Ионная связь
металл + неметалл
+
–
Na + 11 ) 2 ) 8 )
Cl + 17 ) 2 ) 8 )
1
7
8
Электростатическое притяжение
Cl —
Na +
ионы
Свойства ионной связи
ненаправленная,
так как электромагнитное поле распространяется во все стороны
+
–
притянется столько ионов, сколько уместится
–
–
+
–
Поэтому все вещества с ионной связью имеют немолекулярное строение
Кристаллическая решетка
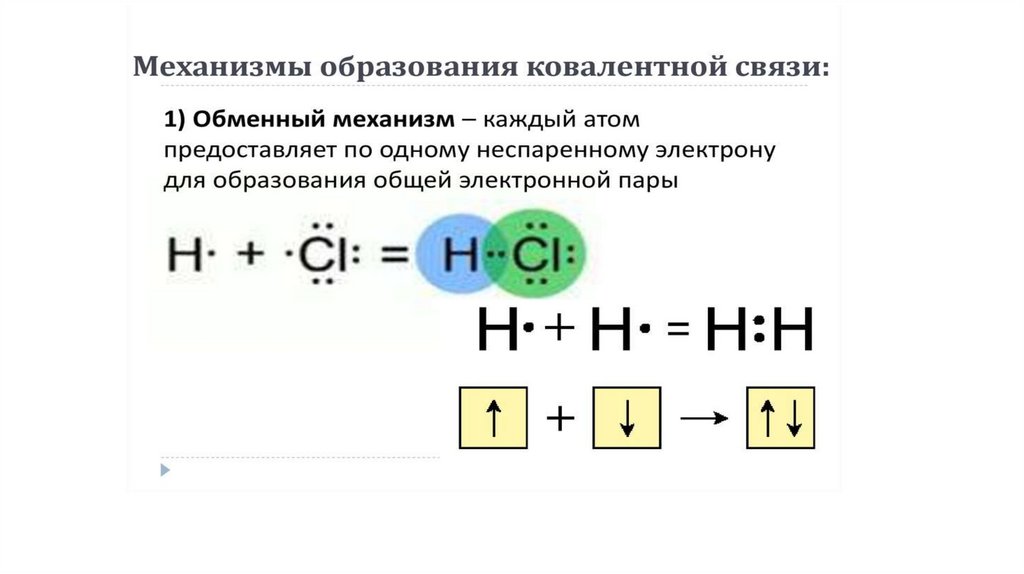
Ковалентная связь
неметалл + неметалл
Cl + 17 ) 2 ) 8 ) 7
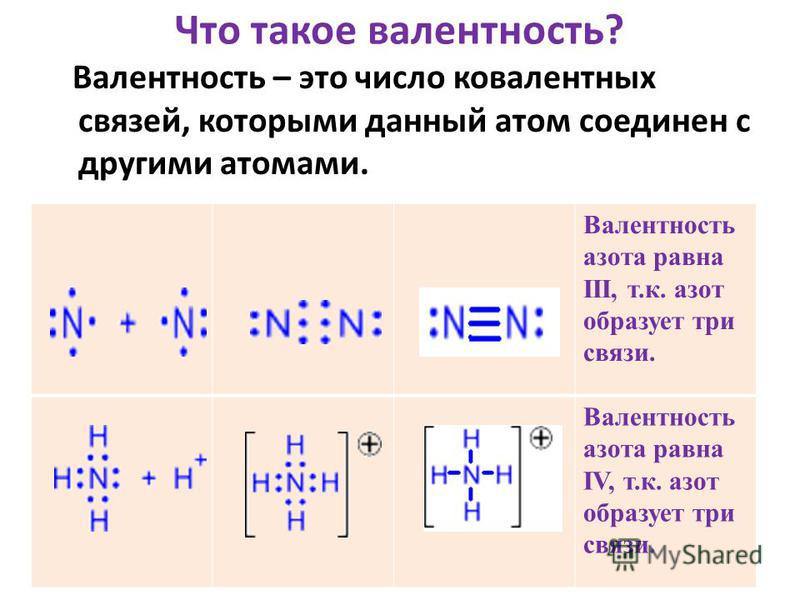
Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
Сl
Сl
Ковалентная неполярная связь
δ-
δ+
Н
Сl
Ковалентная полярная связь
Ковалентная связь может быть образована несколькими парами электронов
N
N
N N
Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Свойства ковалентной связи
направленная,
атомы должны расположиться определенным образом.
104˚
Н
О
Н
насыщаемая,
связывает два атома,
«третий – лишний»
Н:Н
Способы изображения ковалентной связи
электронно-графические схемы
электронные схемы
перекрывание орбиталей
структурные формулы
Н-H
Н 2
Н : Н
s-s
H
НF
Н-F
Н : F
F
s-p
F 2
F-F
F
p-p
F
ион-атомы
+
+
+
+
свободные электроны
+
+
+
+
+
+
+
+
+
+
+
+
Металлическая связь
Как определить вид связи в веществе?
Определите природу химических элементов
если
металл и неметалл
только металл
только неметаллы
связь ионная
связь металлическая
связь ковалентная
если
ЭО элементов одинакова
ЭО элементов различна
связь ковалентная полярная
связь ковалентная неполярная
Определите вид связи в следующих веществах:
Н 2 , Na, NaF, H 2 S, NH 3 , O 2 , Zn, CaS, Mg 3 N 2 , CH 4 , Al, F 2 .
Водородная связь – электростатическое притяжение между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом О, N или F другой молекулы (или другого фрагмента молекулы).
+
—
+
+
+
+
—
+
—
+
—
+
+
+
—
+
—
+
1. Какой вид химической связи в молекуле фтороводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
2. Какой вид химической связи в молекуле бромоводорода?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
3. Какой вид химической связи в молекуле оксида серы(IV)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
4. Какой вид химической связи в молекуле хлорида фосфора(III)?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
5.
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
6. Какой вид химической связи в молекуле азота?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
7. Какой вид химической связи в молекуле хлора?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
8. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
9. Химическая связь в хлориде кальция
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
10. Химическая связь в сульфиде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
11. Химическая связь в оксиде лития
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
12. Химическая связь во фториде калия
Химическая связь во фториде калия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
- CaF2 2) S 3) Zn 4) K2O
14. Какое из указанных веществ имеет металлическую связь?
- Na2S 2) CаO 3) Mg 4) h3
15. Какое из указанных веществ имеет металлическую связь?
- BaO 2) B 3) Cu 4) Cl2
16. Какое из указанных веществ имеет металлическую связь?
- Na2O 2) BaS 3) Bе 4) N2
17. Ионной связью соединены частицы, образовавшиеся из атомов
1) углерода и хлора
2) водорода и серы
3) кислорода и фосфора
4) кальция и фтора
18. Ионная связь не характерна для соединения, образованного атомами
1) натрия и хлора
2) бария и серы
3) кальция и фтора
4) водорода и хлора
19. Веществами с ковалентной полярной и ионной связью являются, соответственно,
1) вода и алюминий
2) сероводород и бром
3) бромоводород и вода
4) вода и фторид магния
20. Веществами с ковалентной неполярной и металлической связью являются соответственно
Веществами с ковалентной неполярной и металлической связью являются соответственно
1) h3 и S
2) SO2 и Na
3) CaCl2 и CO
4) N2 и Pb
21. Ковалентная неполярная связь характерна для
- HBr 2) KBr 3) Br2 4) CaBr2
22. Веществом с ковалентной полярной связью является
- KF 2) PCl3 3) O2 4) CaO
23. Ковалентная неполярная связь характерна для
1) хлорида натрия
2) хлороводорода
3) хлорида фосфора(III)
4) хлора
24. Веществом с металлической связью является
1) барий
2) оксид бария
3) гидроксид бария
4) хлорид бария
25. Ионная связь характерна для
1) сероводорода
2) фтороводорода
3) фторида натрия
4) оксида серы(VI)
26. В оксиде лития химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) Ионная
27. Веществом с ионной связью является каждое из веществ:
1) Nh4, N2
2) CaCl2, Na2O
3) Cu, CaF2
4) CuO, N2O5
28. Веществом с ковалентной неполярной связью является
Веществом с ковалентной неполярной связью является
1) бром
2) сероводород
3) углекислый газ
4) Фтороводород
29. Такой же вид химической связи, как и в молекуле h3S, характерен для
- SiO2 2) K2O 3) BaS 4) Na2S
30. Одинаковый вид химической связи имеют
1) Fe и Fe2O3
2) h3 и CаO
3) P2O5 и Na2O
4) CaO и LiBr
31. Ковалентная полярная связь характерна для
- CaO 2) HI 3) h3 4) MgO
32. Веществом с ионной связью является
1) иодоводород
2) бромид кальция
3) оксид углерода(II)
4) метан
33. Веществом с ковалентной полярной связью является
- Na 2) KF 3) P4 4) HF
34. В молекуле аммиака химическая связь
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
35. Веществом с ионной связью является
- Ca 2) N2O 3) KCl 4) HCl
36. Веществом с ионной связью является
Веществом с ионной связью является
1) оксид кремния
2) оксид натрия
3) оксид углерода(IV)
4) оксид углерода(II)
37. Хлор образует ковалентную полярную связь с
- калием 2) барием 3) водородом 4) кальцием
38. Ковалентная неполярная связь характерна для
1) Аммиака 2) воды 3) фтора 4) калия
39. В сероводороде химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
40. Ковалентную неполярную связь имеет
1) хлор
2) хлороводород
3) оксид хлора(I)
4) хлорид кальция
41. Какой вид химической связи в оксиде бария?
1) ионная
2) Металлическая
3) ковалентная полярная
4) ковалентная неполярная
42. Какой вид химической связи в сульфиде натрия?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
43. Какой вид химической связи имеет белый фосфор?
Какой вид химической связи имеет белый фосфор?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
44. Ковалентную полярную связь имеет каждое из двух веществ
1) сероводород и хлор
2) оксид натрия и оксид хлора(VII)
3) оксид кремния и аммиак
4) хлорида лития и кислород
45. Металлические свойства кальция выражены слабее, чем металлические свойства
- магния 2) алюминия 3) бария 4) кремния
46. Ковалентную полярную связь имеет
1) натрий
2) оксид бария
3) фтороводород
4) сульфид натрия
47. Такой же вид химической связи, как и в молекуле HBr, характерен для
- PCl3 2) KCl 3) MgCl2 4) CaCl2
48. Ковалентную неполярную связь имеет
1) аммиак
2) сероводород
3) белый фосфор
4) Алюминий
49. Какой вид химической связи в оксиде фосфора(V) и оксиде лития?
1) в обоих веществах ковалентная неполярная
2) в обоих веществах ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
50. Одинаковый вид химической связи имеет сера и
Одинаковый вид химической связи имеет сера и
1) кислород
2) магний
3) сульфид магния
4) оксид магния
51. Ковалентная неполярная связь образуется между атомом хлора и атомом
1) калия 2) водорода 3) хлора 4) углерода
52. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
53. Какой вид химической связи в сероводороде и оксиде серы(IV)?
1) ковалентная неполярная и ковалентная полярная
2) в обоих веществах ковалентная полярная
3) в обоих веществах ковалентная неполярная
4) ионная и ковалентная полярная
54. Ковалентную неполярную связь имеет
- Сероводород
2) сульфид калия
3) оксид серы(IV)
4) ромбическая сера
55. В соединении натрия с фтором химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
56. Одинаковый вид химической связи имеет хлорид бария и
Одинаковый вид химической связи имеет хлорид бария и
1) хлор
2) оксид натрия
3) барий
4) оксид хлора(I)
57. Одинаковый вид химической связи имеют аммиак и
1) фторид кальция
2) оксид кальция
3) цинк
4) оксид кремния
58. Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород
2) хлорид натрия и оксид углерода(IV)
3) оксид лития и хлор
4) хлорид бария и оксид натрия
59. Веществами с ионной и ковалентной неполярной связью являются соответственно
1) водород и хлор
2) хлорид натрия и хлор
3) вода и магний
4) хлорид меди(II) и хлороводород
60. Ионную связь имеет
1) азот
2) аммиак
3) оксид азота(IV)
4) хлорид кальция
61. Какой вид химической связи в оксиде хлора(VII)?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
62. Ковалентная полярная связь образуется между атомами
Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода
4) калия и хлора
63. Какой вид химической связи в молекуле азота?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
64. Ковалентную полярную связь имеет каждое из двух веществ
1) CO и P4
2) Nh4 и SO2
3) O3 и Br2
4) CCl4 и K2O
65. Какой(-ие) вид(-ы) связи имеются в молекуле серной кислоты?
1) ковалентная полярная и ионная
2) ковалентная полярная и ковалентная неполярная
3) только ковалентная полярная
4) только ионная
66. Такой же вид химической связи, как и для фторида кальция, характерен для
1) хлора
2) магния
3) оксида серы(IV)
4) сульфида натрия
67. Для какого из веществ характерна ионная связь?
- Н2S 2) K2S 3) SO2 4) S8
68. Какое из указанных веществ имеет ионную связь?
1) HCl 2) Cl2 3) NaCl 4) CO2
69. Химическая связь в бромиде натрия
Химическая связь в бромиде натрия
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) Металлическая
70. Какой вид химической связи в молекуле аммиака?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
71. Химическая связь в хлориде калия
1) ковалентная полярная
2) ковалентная неполярная
3) Металлическая
4) ионная
72. Химическая связь в бромоводороде
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
73. Ковалентная неполярная связь образуется между атомами
1) азота и водорода
2) серы и кислорода
3) алюминия
4) Фосфора
74. Одинаковый вид химической связи имеют хлороводород и
1) калий
2) хлорид натрия
3) вода
4) оксид бария
75. Веществом с ковалентной неполярной связью является
1) азот
2) оксид азота(II)
3) кальций
4) оксид кальция
76. Химическая связь в хлороводороде
Химическая связь в хлороводороде
1) ковалентная неполярная
2) ионная
3) ковалентная полярная
4) металлическая
77. Металлическая связь характерна для
- 2) 3) 4)
Br2 Na2S Na CO2
78. Ковалентной неполярной является химическая связь в соединении
1) CCl4 2) Na2O 3) Fe 4) F2
79. Веществом с металлической связью является
1) оксид калия
2) хлорид натрия
3) аммиак
4) Цинк
80. Какой вид химической связи характерен для вещества, формула которого P4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
81. Какой вид химической связи в молекуле бромоводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
82. Какой вид химической связи в молекуле хлороводорода?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
83. Какое из указанных веществ имеет ковалентную полярную связь?
Какое из указанных веществ имеет ковалентную полярную связь?
1) NaCl
2) h3S
3) h3
4) CaCl2
84. Какое из указанных веществ имеет ковалентную полярную связь?
- NaCl 2) h3S 3) h3 4) CaCl2
85. Ионная связь образуется между
1) фосфором и серой
2) кислородом и водородом
3) бромом и бромом
4) хлором и натрием
86. Ковалентную неполярную связь имеет каждое из двух веществ
1) C60 и S8 2) Na и h3S 3) I2 и Ba 4) CO и KCl
87. Веществом с ковалентной неполярной связью является
1) кальций
2) вода
3) хлороводород
4) Фтор
88. Для какого из веществ характерна ковалентная полярная связь?
- MgO 2) Br2 3) NO 4) Al
89. В соединении серы с водородом химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
90. Для какого из веществ характерна металлическая связь?
- Na2O 2) I2 3) h3S 4) Ca
91. Ионной является химическая связь в соединении
Ионной является химическая связь в соединении
- HBr
2) P2O5
3) BaCl2
4) CO2
92. Для какого из веществ характерна ковалентная неполярная связь?
- Cl2 2) KF 3) CO 4) Cu
93 . Какое из указанных веществ имеет ковалентную неполярную связь?
1) O2 2) Na 3) KCl 4) h3S
94. Ковалентная неполярная связь между атомами характерна для молекулы
1) хлора
2) сероводорода
3) углекислого газа
4) Аммиака
95. Одинаковый вид химической связи имеют оксид кальция и
1) кальций
2) оксид азота(II)
3) хлорид бария
4) Сероводород
96. В каком веществе ковалентная полярная связь?
1) HCl 2) KCl 3) K2O 4) O2
97. Ковалентная полярная связь образуется между атомами
1) натрия и брома
2) серы и кислорода
3) водорода и водорода
4) калия и хлора
98. Для какого из веществ характерна ковалентная полярная связь?
- Nh4 2) CaCl2 3) Li2O 4) N2
99.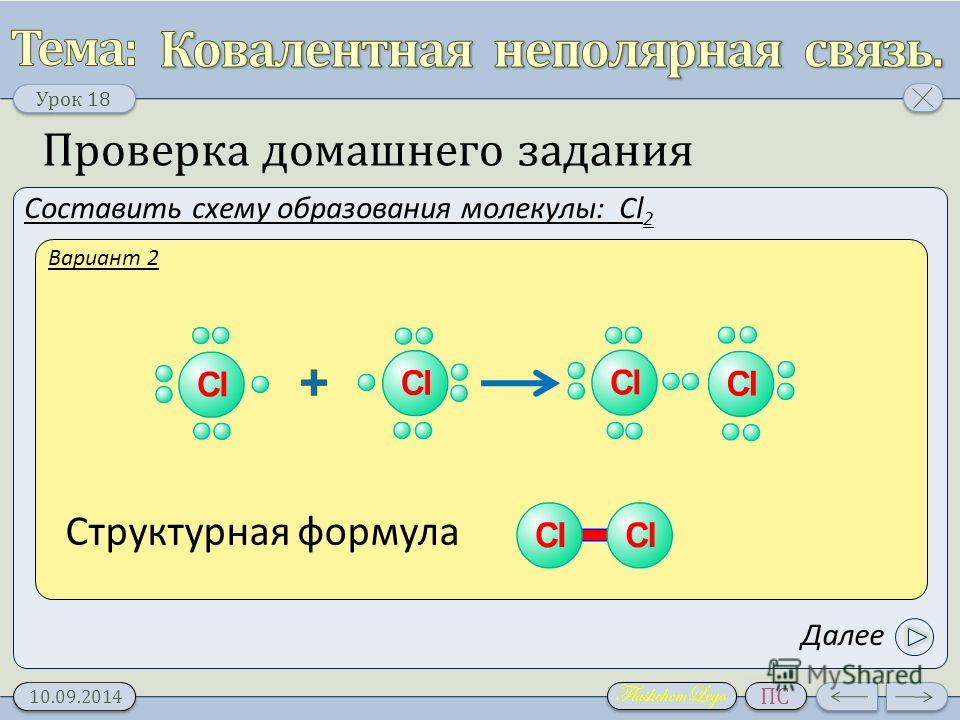 Какой вид химической связи характерен для вещества, формула которого К2О?
Какой вид химической связи характерен для вещества, формула которого К2О?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
100. Какой вид химической связи характерен для вещества, формула которого Nh4?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
101. Одинаковый вид химической связи в веществах, формулы которых
1) Cu и CuCl2
2) HCl и Cl2O7
3) O2 и CaO
4) Na2S и SO2
102. Какой вид химической связи в молекуле аммиака?
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Металлическая
103. Ковалентная полярная связь характерна для вещества, формула которого
- KCl
2) Nh4
3) O2
4) Na
104. Одинаковый вид химической связи имеют
1) кальций и хлорид лития
2) сульфид калия и оксид азота(I)
3) водород и кремний
4) хлороводород и оксид бария
105. Веществом с ионной связью является
Веществом с ионной связью является
1) оксид серы(VI)
2) водород
3) магний
4) фторид натрия
106. Веществом с ковалентной полярной связью является
1) иодид лития
2) алюминий
3) оксид азота(II)
4) Азот
107. Какой вид химической связи в сульфиде калия?
1) ионная связь
2) ковалентная полярная связь
3) ковалентная неполярная связь
4) металлическая связь
108. Химическая связь в молекуле кислорода
1) ковалентная полярная
2) ковалентная неполярная
3) металлическая
4) ионная
109 . Такой же вид химической связи, как и для молекулы кислорода, характерен для
1) серы
2) натрия
3) оксида кальция
4) хлорида лития
110. Какой вид химической связи в оксиде кальция?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
111. Ковалентную неполярную связь имеет каждое из двух веществ:
1) вода и хлор
2) натрий и сероводород
3) иод и фосфор
4) хлорид бария и сера
112.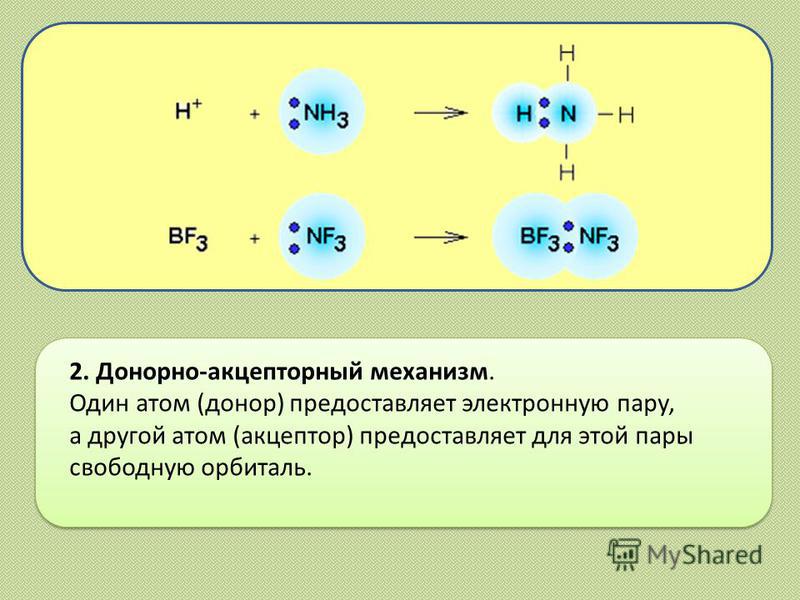 Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) кислород и водород
2) вода и хлороводород
3) вода и водород
4) вода и хлорид натрия
113. Ковалентная полярная связь образуется между атомами
1) лития и кислорода
2) серы и натрия
3) хлора и водорода
4) магния и фтора
114. Какой вид химической связи характерен для вещества, формула которого Na2S?
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) Ионная
115. Какое из указанных веществ имеет ионную химическую связь?
1) оксид кремния
2) бромид калия
3) магний
4) Сероводород
116. Для какого из веществ характерна ковалентная неполярная связь?
1) K 2) Si 3) CO 4) CaO
117. Одинаковый вид химической связи имеют сероводород и
1) оксид кальция
2) магний
3) хлорид кальция
4) Аммиак
118. Вещество с ионным типом связи
Вещество с ионным типом связи
1) SO3
2) Nh4
3) Ca
4) CaO
119. Веществом с ионной связью является
1) хлороводород
2) хлорид кальция
3) хлор
4) хлорная кислота
120. Веществом с ионной связью является
1) оксид серы (IV)
2) оксид бария
3) сероводород
4) аммиак
121. Химическая связь в молекулах серы S8
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Металлическая
122. Химическая связь в молекуле углекислого газа
1) ионная
2) ковалентная неполярная
3) ковалентная полярная
4) Металлическая
123. Ковалентная полярная связь образуется между атомами
1) фтора и фтора
2) натрия и кислорода
3) калия и хлора
4) серы и фтора
124. Химическая связь в молекуле оксида азота(IV)
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
125. Веществом с ковалентной неполярной связью является
Веществом с ковалентной неполярной связью является
1) h3S
2) S8
3) Na
4) CuO
126. Химическая связь в молекуле P4
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) Водородная
127. Ковалентную связь имеет каждое из двух веществ ряда:
- P2O5 и O2
2) CaC2 и CO
3) P4 и NaF
4) CuO и N2O5
128. Ионная связь образуется между атомами
1) брома и фтора
2) кислорода и водорода
3) хлора и натрия
4) натрия и калия
129. Веществом с ковалентной неполярной связью является
1) аммиак
2) алмаз
3) оксид углерода (IV)
4) Сероводород
130. Химическая связь в оксиде кальция
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
131. Ковалентная полярная связь реализуется в веществе
1) h3
2) K2O
3) SO3
4) Hg
132. Вид химической связи в молекуле О2 такой же, как и в
Вид химической связи в молекуле О2 такой же, как и в
- Nh4
2) K2O
3) Br2
4) h3O
133. Тип химической связи в молекуле h3S такой же, как и в
1) Ch5
2) O2
3) MgO
4) CaCl2
134. Какой тип химической связи в молекуле I2?
1) металлическая
2) ковалентная полярная
3) ковалентная неполярная
4) Ионная
135. Химическая связь в молекуле CO
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
136. Химическая связь в молекуле HCl
1) водородная
2) ковалентная неполярная
3) ковалентная полярная
4) ионная
137. Химическая связь в молекуле Nh4
- ковалентная неполярная
2) ковалентная полярная
3) ионная
4) Водородная
138. Ковалентная неполярная связь реализуется в веществе:
1) NaH
2) h3O
3) CO2
4) С (алмаз)
139. Химическая связь в P4
Химическая связь в P4
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
140. Веществом с ионной связью является
1) азотная кислота
2) азот
3) нитрат натрия
4) оксид азота (IV)
S8 полярный или неполярный?
Вопрос = Является ли s8 полярным или неполярным?
Ответ = s8 ( Октасера ) Неполярный
Что такое полярный и неполярный?
Полярный
«В химии полярность — это разделение электрического заряда, приводящее к тому, что молекула или ее химические группы обладают электрическим дипольным или мультипольным моментом.
Полярные молекулы должны содержать полярные связи из-за разницы в электроотрицательности между связанными Полярная молекула с двумя или более полярными связями должна иметь асимметричную геометрию, чтобы диполи связей не компенсировали друг друга.
Полярные молекулы взаимодействуют через диполь-дипольные межмолекулярные силы и водородные связи. Полярность лежит в основе ряда физических свойств, включая поверхностное натяжение, растворимость, температуры плавления и кипения.» (Википедия)
Полярные молекулы
Полярная молекула имеет чистый диполь в результате противоположных зарядов (т.е. частичные отрицательные заряды) из полярных связей, расположенных асимметрично (Википедия)
http://www.school-for-champions.com
Рисунок: вода представляет собой полярную молекулу
Пример полярных молекул
Аммиак (Nh4)
Диоксид серы (SO2)
Сероводород (h3S)
Неполярные молекулы равное распределение электронов между двумя атомами двухатомной молекулы или из-за симметричного расположения полярных связей в более сложной молекуле. (Википедия)
http://www.school-for-champions.com
Изображение: Углекислый газ
Пример молекул неполярных
Толуол
Бензин
Гелий (He)
Неон (Ne)
Криптон (Kr)
Ксенон (Xe)
Водород (h3) x
5 O2)
Carbon Dioxide (CO2)
Methane (Ch5)
Ethylene (C2h5)
List molecules polar and non polar
Molecules polar
SCN- (Thiocyanate)
HCO3- (Bicarbonate)
BrCl3 (трихлорид брома)
HCO3-1
ASCL3 (трихлорсарсин)
OCL2
NO2CL (нитрилхлорид)
CH4F (флуорометан)
H4O+Гидроний
Clf (DIMOLUIRIDE)
CLF3 (трифлхл.
Ch4Ch3OH (Этанол)
Nh3-
BrF3 (БРОМА ТРИФТОРИД)
Ch4Nh3 (Метиламин)
Ch3Br2 (Дибромметан)
HI (Йодистый водород)
Nh5NO3 (Нитрат аммония)0005 C2CL2
NO+ (NitriLooxonium)
SBR2
ICL4+
NO
CH4OH (метанол)
SCL6
NOBR (нитрозиловый бромид)
Brf5 (метанол)
ICL3 (IODINE TRICHLIDE)
BRF5 (BROMOL)
ICL3 (IODINE TRICHLIDE)
(BROMOSL)
(IODINE TRICHLIDE)
(BROMOL). Ch3F2 (дифторметан)
Seh3 (селенид водорода)
COS (сульфид кобальта)
OF2 (дифторид кислорода)
h3SO4 (СЕРНАЯ КИСЛОТА)
h3CO (формальдегид)
NF3 (трифторид азота) (Ацетилбромин)2дибромин0005 TEF4
SCN
CLO3- (Хлорат)
ICL5
MUNEA
SO2CL2 (сульфурилхлорид)
H3SE (водород Селенид)
NH3
XEO3
SBF3
CACL2 (Calcium chorlide)
(ASO3
(Calcium chorlide)
(Aso3
(CALCIUME)
(ARIDIC3) (CALCIUME)
(ARIDIC 3
(CALCIUME)
(ASO3
(CALCIUME) (CALCIUME)
(ARIDIC3)
(CALCIM BRF
CL2O
IF3 (йодиновый трифторид)
SH3
SCL4
CO (угарный газ)
H4O
HNO3 (азотная кислота)
N2H3
NBR3
SO3 2-
CH4COOH (АККОВОЙ КИСКОЙ
N2H5
C2H5OH
NOCL (нитрозилхлорид)
C2H6O (этанол-D6)
SOCL2
H4O+ (Гидрон)
CHF3 (флуороформ)
HCLO (гипохлавный кислотный)
NI3 (NITROFROM)
. NACLIMILE)
NACLIMILE)
. NACLIME (Hypochlory Acid)
Ni3 (NITRODIDIDE)
. NACLIDIME)
. NACLIMILE)
. NACLIDIME)
. NACLIMILE)
. NACLIMILE)
. NACLIMILE). Arsine)
Nh3Cl
OCS (Carbonyl sulfide)
SiCl2F2
glucose
Ch4
N2O
PoCl3 (PHOSPHORUS OXYCHLORIDE)
MgCl2
vinegar
IOF5
phosphate
CHBr3 (Bromoform)
ICl (IODINE MONOCHLORIDE)
carbon monoxide
диоксид серы
PBR3 (фосфор трибромид)
SF2 (серная дифторид)
NH4 (аммиак)
SO2 (диоксид серы)
CH3CL2 (дихлорметан)
SSF4
H3S (Sulfide)
H3S (Dichloromethane).
SCL2 (дихлорид серы)
PH4 (фосфин)
CH3O (формальдегид)
HF (гидрофлуорическая кислота)
HBR (гидробромическая кислота)
NCL3 (азот трихлорид)
PF3 (Phosphorus trifluorIde)
.
.
. NOTLATE
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
(NOTRATE
.0005 NO2 (двуокись азота)
h3O2 (пероксид водорода)
Ch4Br (бромметан)
cn- (цианид)
O3 (ОЗОН)
Ch4CL (хлорметан)
аммиак
OH- (гидроксид)
NO2- (COCl2) (кобальт) chloride)
glycerol
oh
chloroform
nitrogen trichloride
benzoic acid
ether
no3
CLF5 methylene chloride
sodium chloride
Ch4SH
Na2SO4
sodium acetate
CaCO3
1-butanol
Clo-
C4h20
libr
cabr2 (Calcium bromide )
Ch4CN (ACETONITRILE)
Ch4Ch3Ch3OH
C6h22O6
LiNO3 (Lithium nitrate)
MgO
SeOBr2
clo3
c3h7oh
nai (Sodium iodide)
glycerine
bri5
BrO2
ammonium chloride
CF3Cl
BF2Cl
IBr
GaCl3
KMnO4 (POTASSIUM ПЕРМАНГАНАТ)
Na2S (сульфид натрия)
KOH (гидроксид калия)
HCOOH
KBr (бромид калия)
углеводы
ClO4
Cl2CO
clo2-
янтарная кислота ч
серная кислота
0005 sodium nitrate
ethyne
NO2F
CCL3F (Fluorotrichloromethane)
ammonium
ibr3
fluoromethane
C2H5Cl TeCl4
2-propanol
starch
ch3cl
XeOF4
SnCl2
SCO (Carbonyl sulfide)
SbBr3
h3CS
HC2h4O2
po(oh) 3
Пропанол
1-пропанол
бро3-
ч4ч3ч3ч4
CF2Br2
уксусная кислота
анилин
CF
трифторид хлора
фенол
clo2 5 Ch009 90Sманганат калия 30005 nitrogen monoxide
ch4cho
glass
SH
COh3
SOF4
DNA
Ch4Ch3Nh3
Malonic Acid
ethylene glycol
isopropyl alcohol
hydrogen bromide
SeCl4
hydrogen peroxide
ozone
c3h6o
formaldehyde
po3 3
difluoromethane
aspirin
CHCl2
спирт для протирания
флуорен или флуоренол
витамин с
HCl
нитрат
диметиловый эфир
SCl
if4+
Молекулы неполярные
HBRO (гипобромная кислота)
SIF4 (кремниевый тетрафлюрид)
CH4CH4 (Ethane)
N2 (азот)
CO3 2- (Карбонат)
Heptane-
XEO4 (XENON TETRESID )
CBR4 (углерод-тетрабромид)
ALCL3 (алюминиевый трихлорид)
C6H6 (бензол)
NH5BR
C2H5CL2 (Dichloroethan Этин)
C6h24 (ГЕКСАН)
PO4 3- (фосфат)
Geh5 (германский)
PBr5 (пентабромид фосфора)
Nh5 (аммоний)
воск
CI4 (тетрайодметан)
bbr3 (трибромид бора)
h3 (водород)
I2 (йод)
GAH4 (галлан)
SEBR4 (тетрабромид селена)
KRF4
SIBR4
C2H6 (Ethane)
O2 (кислород)
Biphenyl
PO4 3
P4 (Phosphorus tetramer)
SO4 2-
9555555555555555555555555555555555.
55555555555555555559555555595555.
5.
595555.
9555955555555595555555555555955595.
5.
5.
5.
9 BrCl5
SeF6
SeO3
Sih5 (silane)
carbon tetrabromide
AsF5 (Arsenic pentafluoride)
Beh3 (Beryllium hydride)
SiO2
KrF2
Ch3
cholesterol
F2 (Fluorine)
pentane
ClF2
C3H8
Propane
cyclohexane
toluene
SiCl4 (Tetrachlorosilane)
хлор
PF5 (пентафторфосфоран)
BrCl
CO2 (двуокись углерода)
CCl4 (ТЕТРАХЛОРИД УГЛЕРОДА)
XeF2
CS2 (ДИСУЛЬФИД УГЛЕРОДА)
SO3 (ТРИОКСИД СЕРЫ)
Тетрафторид XeF4 (XeF4)0005 BCl3 (BORON TRICHLORIDE)
BeCl2 (Beryllium dichloride)
CF4 (CARBON TETRAFLUORIDE)
Cl2 (Chlorine)
Br2 (Bromine)
Hexane
carbon dioxide
i3-
carbon tetrachloride
carbon disulfide
methane
glycine
sulfur trioxide
бензофенон
кислород
AlF3 (фторид алюминия)
дихлорид бериллия
C8h28 (октан)
C2Cl4
PF6-
XeCl4
SbF5 (пентафторид сурьмы)
Ch4Ch3Ch5 CAN
Ch4Ch3Ch4
0005 silane
s8
BF4 BF4-
SeCl6
BeBr2
BeI2
CSe2
Pcl4
C3H6
Alh4 (Aluminum trihydride)
TeO3 (Tellurium trioxide)
Br-Br
AsCl5
octane
carbonate ions
ClF4 plus
acids
kerosene
ацетилен
C-C
этан
CCl
Cl4
cbr
сульфат
масло
триглицериды
смазка
хлорид бериллия
тетрафторид углерода
бутан 9 азот тетрафторид
00005 ICl2-
бром
углеводород
HE
трихлорид бора
CS
гексафторид серы
sis2
ксенон тетрафторид
Ch5
витамин е
5 5 Ионная
NaBr
KCl
NaF
kf
NaNO3
cao
ki lif
licl (ЛИТИЙ ХЛОРИД)
сульфат аммония
MgF2 Ресурсы:
https://en. wikipedia.org/wiki/Chemical_polarity
wikipedia.org/wiki/Chemical_polarity
http://www.school-for-champions.com/chemistry/polar_molecules.htm#.WZIGddJJbcc
reference.com
www.quora.com
answer.yahoo.com
youtube.com
google.com
https://pubchem.ncbi.nlm.nih.gov
Если ответ неверный, прокомментируйте ниже статья !
Вопрос = Является ли s8 полярным или неполярным?
Ответ = s8 ( Октасера ) Неполярный
Химия
8.9: Свойства полярных ковалентных связей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 349731
- Анонимный
- LibreTexts
Цели обучения
- Рассчитать процент ионного характера ковалентной полярной связи.

В главе 4 мы описали две идеализированные крайности химической связи: (1) ионную связь, при которой один или несколько электронов полностью передаются от одного атома к другому, а полученные ионы удерживаются вместе чисто электростатическими силами, и ( 2) ковалентная связь, при которой электроны распределяются поровну между двумя атомами. Однако большинство соединений имеют полярные ковалентные связи. Ковалентная связь, при которой электроны распределяются между связанными атомами неравномерно, что означает, что электроны являются общими.{-} \) и связь между двумя атомами, обладающими частичными зарядами, является полярной связью .
Рисунок 5.6.1 Распределение электронов в неполярной ковалентной связи, полярной ковалентной связи и ионной связи с использованием электронных структур Льюиса
атомы. В чисто ионной связи (с) электрон полностью перешел от одного атома к другому. Полярная ковалентная связь (b) занимает промежуточное положение между двумя крайностями: связывающие электроны неравномерно распределяются между двумя атомами, а распределение электронов асимметрично, при этом плотность электронов выше вокруг более электроотрицательного атома. Области, богатые электронами (отрицательно заряженные), показаны синим цветом; бедные электронами (положительно заряженные) области показаны красным.
Области, богатые электронами (отрицательно заряженные), показаны синим цветом; бедные электронами (положительно заряженные) области показаны красным.
Полярность связи
Полярность связи — степень ее полярности — в основном определяется относительной электроотрицательностью связанных атомов. В главе 3 электроотрицательность (χ) определялась как способность атома в молекуле или иона притягивать к себе электроны. Таким образом, существует прямая корреляция между электроотрицательностью и полярностью связи. Связь неполярна , если связанные атомы имеют одинаковую электроотрицательность. Однако, если электроотрицательности связанных атомов не равны, связь равна 9{-}}
\end{matrix} \tag{5.6.1} \)
Один из способов оценки ионного характера связи, то есть величины разделения зарядов в полярной ковалентной связи, состоит в следующем: вычислить разницу в электроотрицательности двух атомов: Δχ = χ B − χ A .
Чтобы предсказать полярность связей в Cl 2 , HCl и NaCl, например, мы смотрим на электроотрицательности соответствующих атомов: χ Cl = 3,16, χ H = 2,20 и χ Na = 0,93 (см.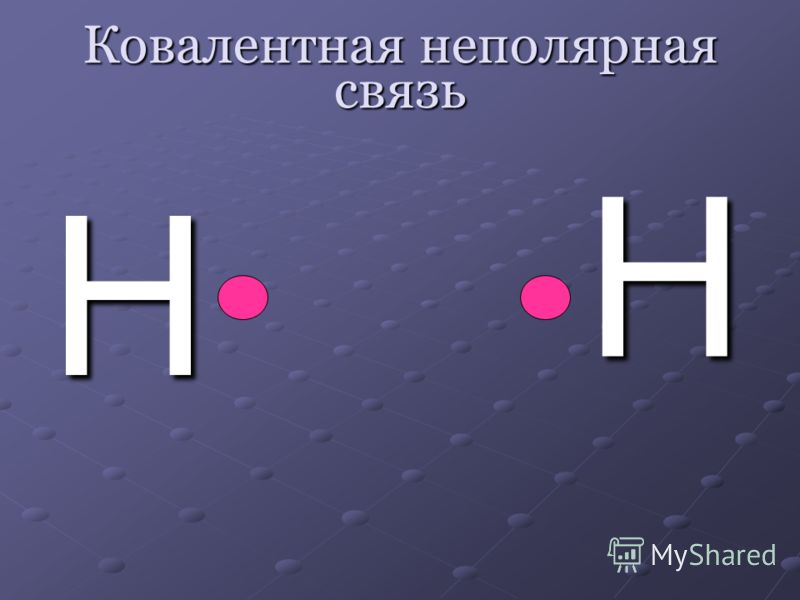 рис. 3.3.2). Cl 2 должен быть неполярным, так как разность электроотрицательностей (Δχ) равна нулю; следовательно, два атома хлора поровну делят связывающие электроны. В NaCl Δχ составляет 2,23. Это высокое значение характерно для ионного соединения (Δχ ≥ ≈ 1,5) и означает, что валентный электрон натрия полностью передан хлору с образованием ионов Na + и Cl — . Однако в HCl Δχ составляет всего 0,96. Связывающие электроны сильнее притягиваются к более электроотрицательному атому хлора, поэтому распределение заряда равно 9{-}}\\
рис. 3.3.2). Cl 2 должен быть неполярным, так как разность электроотрицательностей (Δχ) равна нулю; следовательно, два атома хлора поровну делят связывающие электроны. В NaCl Δχ составляет 2,23. Это высокое значение характерно для ионного соединения (Δχ ≥ ≈ 1,5) и означает, что валентный электрон натрия полностью передан хлору с образованием ионов Na + и Cl — . Однако в HCl Δχ составляет всего 0,96. Связывающие электроны сильнее притягиваются к более электроотрицательному атому хлора, поэтому распределение заряда равно 9{-}}\\
Н\; \; &-& Cl
\end{matrix} \)
Помните, что электроотрицательность трудно измерить точно, и разные определения дают немного разные числа. На практике полярность связи обычно оценивается, а не рассчитывается.
Обратите внимание на образец
Полярность связи и ионный характер увеличиваются с увеличением разницы в электроотрицательности.
Как и энергия связи, электроотрицательность атома в некоторой степени зависит от его химического окружения. Поэтому маловероятно, что сообщаемые значения электроотрицательности атома хлора в NaCl, Cl 2 , ClF 5 и HClO 4 будут точно такими же.
Поэтому маловероятно, что сообщаемые значения электроотрицательности атома хлора в NaCl, Cl 2 , ClF 5 и HClO 4 будут точно такими же.
Дипольные моменты
Асимметричное распределение заряда в полярном веществе, таком как HCl, создает дипольный момент где \( Qr \) в метрах (м). обозначается греческой буквой мю (µ). Дипольный момент определяется как произведение частичного заряда Q связанных атомов на расстояние r между частичными зарядами:
\( \mu=Qr \tag{5.6.2} \)
9{-30}\; C\cdot ·m \tag{5.6.3} \)Когда молекула с дипольным моментом помещается в электрическое поле, она стремится ориентироваться в электрическом поле из-за асимметричного распределения заряда (рис. 5.6.2). ).
Рисунок 5.6.2 Молекулы, обладающие дипольным моментом, частично выравниваются с приложенным электрическим полем
В отсутствие поля (а) молекулы HCl ориентированы случайным образом. Когда приложено электрическое поле (b), молекулы стремятся выровняться с полем, так что положительный конец молекулярного диполя указывает на отрицательный конец и наоборот.
Когда приложено электрическое поле (b), молекулы стремятся выровняться с полем, так что положительный конец молекулярного диполя указывает на отрицательный конец и наоборот.
Мы можем измерить парциальные заряды на атомах в молекуле, такой как HCl, используя уравнение 5.6.2. Если бы связь в HCl была чисто ионной, электрон перешел бы от H к Cl, так что был бы полный +1 заряд на атоме H и полный заряд −1 на атоме Cl. Дипольный момент HCl составляет 1,109 Д, что определяется путем измерения степени его выравнивания в электрическом поле, а сообщаемое расстояние H–Cl в газовой фазе составляет 127,5 пм. Следовательно, заряд каждого атома равен
\[ Q=\dfrac{\mu }{r} =1,109{-20}\;C \tag{5.6.4} \]
Разделив это вычисленное значение на заряд одного электрона (1,6022 × 10 −19 Кл), мы находим, что распределение электронов в HCl равно асимметричным, и что фактически оказывается, что общий отрицательный заряд Cl составляет около -0,18, что фактически соответствует примерно 0,18 e — . Это, конечно, не означает, что на атоме хлора находится доля электрона, но что распределение вероятности электрона благоприятствует стороне атома хлора в молекуле примерно на эту величину. 9{-}}\\
Это, конечно, не означает, что на атоме хлора находится доля электрона, но что распределение вероятности электрона благоприятствует стороне атома хлора в молекуле примерно на эту величину. 9{-}}\\
Н\; \; &-& Cl
\end{matrix} \)
Наши расчетные результаты согласуются с разницей электроотрицательностей водорода и хлора χ H = 2,20; χ Cl = 3,16, χ Cl — χ H = 0,96), значение находится в пределах диапазона для полярных ковалентных связей. Мы указываем дипольный момент, написав стрелку над молекулой. Математически дипольные моменты являются векторами, и они обладают как величиной, так и направлением. Дипольный момент молекулы представляет собой векторную сумму диполей отдельных связей. В HCl, например, дипольный момент обозначается следующим образом:
Стрелка показывает направление потока электронов, указывая на более электроотрицательный атом.
Заряд атомов многих веществ в газовой фазе можно рассчитать, используя измеренные дипольные моменты и длины связей.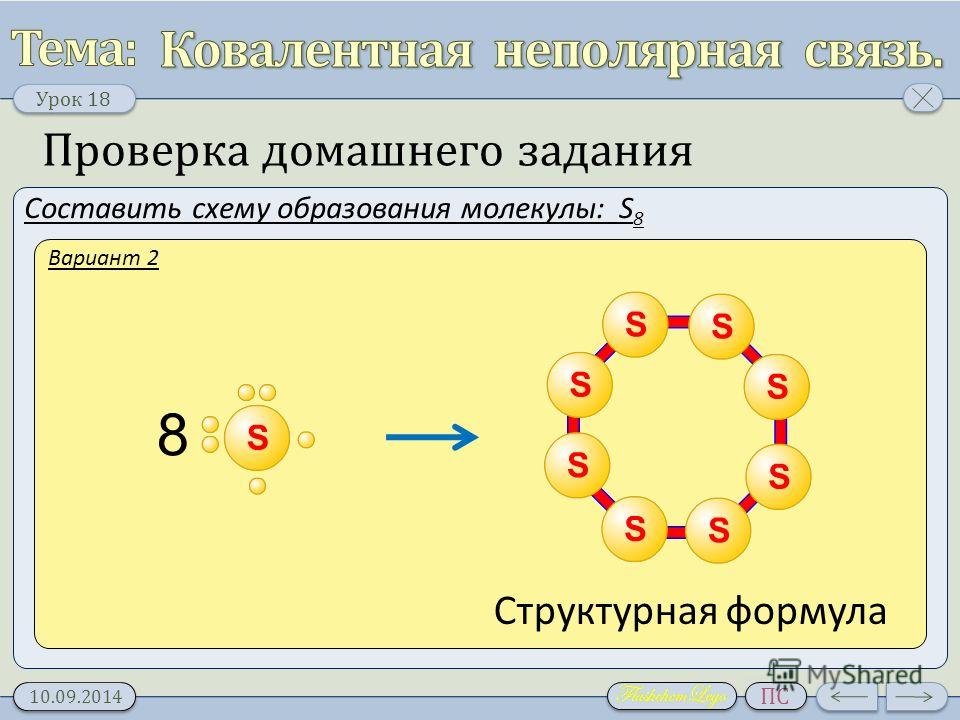 На рис. 5.6.3 показан график процента ионного характера в зависимости от разницы в электроотрицательности связанных атомов для нескольких веществ. Согласно графику, связь в соединениях, таких как NaCl(г) и CsF(г), носит существенно менее 100% ионный характер. Однако по мере того, как газ конденсируется в твердое тело, диполь-дипольные взаимодействия между поляризованными частицами увеличивают разделение зарядов. Таким образом, в кристалле электрон переходит от металла к неметаллу, и эти вещества ведут себя как классические ионные соединения. Данные на рис. 5.6.3 показывают, что двухатомные частицы с разницей электроотрицательностей менее 1,5 имеют ионный характер менее чем на 50 %, что согласуется с нашим более ранним описанием этих частиц как содержащих полярные ковалентные связи. Использование дипольных моментов для определения ионного характера полярной связи показано в примере 9.
На рис. 5.6.3 показан график процента ионного характера в зависимости от разницы в электроотрицательности связанных атомов для нескольких веществ. Согласно графику, связь в соединениях, таких как NaCl(г) и CsF(г), носит существенно менее 100% ионный характер. Однако по мере того, как газ конденсируется в твердое тело, диполь-дипольные взаимодействия между поляризованными частицами увеличивают разделение зарядов. Таким образом, в кристалле электрон переходит от металла к неметаллу, и эти вещества ведут себя как классические ионные соединения. Данные на рис. 5.6.3 показывают, что двухатомные частицы с разницей электроотрицательностей менее 1,5 имеют ионный характер менее чем на 50 %, что согласуется с нашим более ранним описанием этих частиц как содержащих полярные ковалентные связи. Использование дипольных моментов для определения ионного характера полярной связи показано в примере 9.
Рис. 5.6.3 График процента ионного характера связи, определенного по измеренным дипольным моментам, в зависимости от разности электроотрицательностей связанных атомов
разница в электроотрицательности между атомами не является ионной на 100%. Однако твердый CsF лучше всего рассматривать как 100% ионный из-за дополнительных электростатических взаимодействий в решетке.
Однако твердый CsF лучше всего рассматривать как 100% ионный из-за дополнительных электростатических взаимодействий в решетке.
Пример 9
В газовой фазе NaCl имеет дипольный момент 90,001 D и расстояние Na–Cl 236,1 пм. Вычислите процент ионного характера в NaCl.
Given: chemical species, dipole moment, and internuclear distance
Asked for: percent ionic character
Strategy:
A Compute the charge on each atom using the information given
B Найдите процент ионного характера по отношению фактического заряда к заряду одного электрона. 9{-19}\; \cancel{C}} \right )\left ( 100 \right )=79,39\%\simeq 79\% \)
Упражнение
В газовой фазе хлорид серебра (AgCl) имеет дипольный момент 6,08 D и расстояние Ag–Cl 228,1 пм. Каков процент ионного характера хлорида серебра?
Ответ: 55,5%
Резюме
Соединения с полярными ковалентными связями имеют электроны, которые распределены между связанными атомами неравномерно.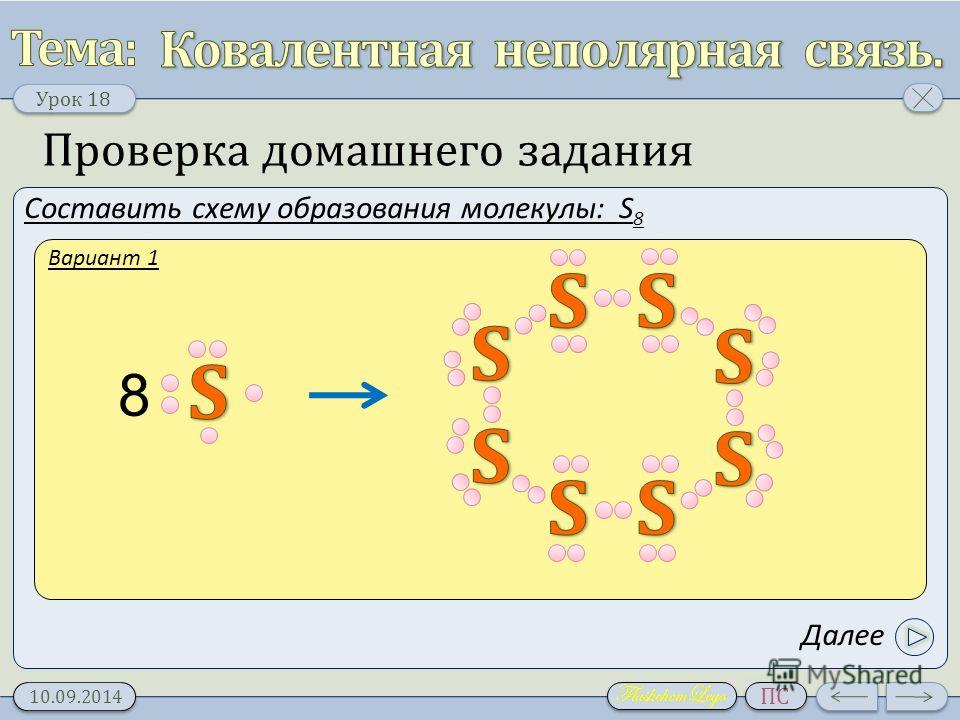 Полярность такой связи во многом определяется относительными электроотрицательностями связанных атомов. Асимметричное распределение заряда в полярном веществе дает дипольный момент , который является произведением частичных зарядов связанных атомов и расстояния между ними.
Полярность такой связи во многом определяется относительными электроотрицательностями связанных атомов. Асимметричное распределение заряда в полярном веществе дает дипольный момент , который является произведением частичных зарядов связанных атомов и расстояния между ними.
Key Takeaway
- Полярность связи и ионный характер увеличиваются с увеличением разницы в электроотрицательности.
Ключевое уравнение
Дипольный момент
Уравнение 4.7.2 µ = Qr
Концептуальные проблемы
Почему ионные соединения, такие как KI, проявляют в газовой фазе значительно менее 100% ионный характер?
Какое из соединений LiI и LiF, по вашему мнению, будет больше похоже на классическое ионное соединение? Что будет иметь больший дипольный момент в газовой фазе? Объясните свои ответы.
Численные задачи
Предскажите, является ли каждое соединение чисто ковалентным, чисто ионным или полярно-ковалентным.

- RbCl
- С 8
- TiCl 2
- SbCl 3
- ЛиИ
- Бр 2
Основываясь на относительной электроотрицательности, классифицируйте связь в каждом соединении как ионную, ковалентную или полярную ковалентную. Укажите направление диполя связи для каждой полярной ковалентной связи.
- НЕТ
- ВЧ
- MgO
- AlCl 3
- SiO 2
- связь С=О в ацетоне
- О 3
Основываясь на относительной электроотрицательности, классифицируйте связь в каждом соединении как ионную, ковалентную или полярную ковалентную. Укажите направление диполя связи для каждой полярной ковалентной связи.
- NaBr
- ИЗ 2
- БКл 3
- связь S–S в CH 3 CH 2 SSCH 2 Ч 3
- связь C–Cl в CH 2 Cl 2
- связь O–H в CH 3 OH
- PtCl 4 2−
Классифицируйте каждый вид как имеющий ионный характер 0–40 %, ионный характер 40–60 % или ионный характер 60–100 % в зависимости от ожидаемого типа связи.
 Обоснуйте свои рассуждения.
Обоснуйте свои рассуждения.- СаО
- С 8
- АлБр 3
- ICl
- Нет 2 С
- SiO 2
- LiBr
Если бы расстояние связи в HCl (дипольный момент = 1,109 дптр) было вдвое больше фактического значения 127,46 пм, как бы это повлияло на заряд, локализованный на каждом атоме? Каким будет процент отрицательного заряда Cl? Как удвоение заряда каждого атома повлияет на дипольный момент при фактическом расстоянии связи? Будет ли это представлять более ионный или ковалентный характер?
Рассчитайте процент ионного характера HF (дипольный момент = 1,826 Д), если расстояние связи H–F составляет 92 пм.
Рассчитайте ионный характер CO (дипольный момент = 0,110 Д), если расстояние C–O равно 113 пм.
Рассчитайте ионный характер PbS и PbO в газовой фазе, используя следующую информацию: для PbS r = 228,69 пм и µ = 3,59 D; для PbO, р = 192,18 мкм и µ = 4,64 D.


 Обоснуйте свои рассуждения.
Обоснуйте свои рассуждения.
Leave A Comment