Периодичность изменения свойств атомов — урок. Химия, 8–9 класс.
Основные характеристики атомов химических элементов:
- заряд ядра;
- число электронных слоёв;
- число электронов на внешнем уровне;
- радиус атома;
- высшая валентность в соединениях с кислородом;
- валентность в летучих водородных соединениях;
- способность отдавать электроны;
- способность принимать электроны.
Заряд ядра атома химического элемента равен порядковому номеру. Он последовательно возрастает от одного элемента к другому.
Число электронных слоёв равно номеру периода, к которому относится химический элемент.
Другие свойства изменяются периодически.
Число внешних электронов одинаково у элементов одной \(A\) группы и совпадает с её номером. В периоде увеличивается от \(1\) до \(8\).
Высшие валентности химических элементов в соединениях с кислородом, как правило, совпадают с номером группы и в каждом периоде увеличиваются.
Валентности в соединениях с водородом (для неметаллов), наоборот, уменьшаются и равны разности \(8\) \(–\) № группы.
Радиусы атомов в каждом периоде уменьшаются, а в группе увеличиваются.
Химические свойства атомов обусловлены их способностью отдавать электроны или их принимать.
Способность атомов отдавать валентные электроны
Чем больше радиус атома, тем слабее удерживаются его внешние электроны. Поэтому способность отдавать электроны усиливается в группах сверху вниз.
В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома.
Легче всего отрываются электроны от атомов щелочного металла франция.
Схематически усиление способности отдавать электроны можно изобразить так:
⇓Fr⇐
Способность атомов притягивать электроны
У элементов одной группы эта способность снижается с увеличением числа электронных слоёв.
В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень.
Наиболее активно принимают электроны атомы галогена фтора.
Изменение способности принимать электроны показывает схема:
⇒F⇑
Отличаются от других элементов по свойствам инертные газы (элементы VIIIA группы). Их атомы имеют заполненные внешние энергетические уровни и поэтому не отдают и не принимают электроны.
Подведём итоги.
Закономерности изменения свойств атомов
Свойство | В периоде | В группе |
Заряд ядра
| увеличивается | увеличивается |
Радиус атома
| уменьшается | увеличивается |
Способность отдавать электроны | уменьшается | увеличивается |
Число валентных электронов | увеличивается | не изменяется |
Способность принимать электроны | увеличивается | уменьшается |
Высшая валентность в оксидах и гидроксидах | увеличивается | не изменяется |
Валентность в летучих водородных соединениях | уменьшается | не изменяется |
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
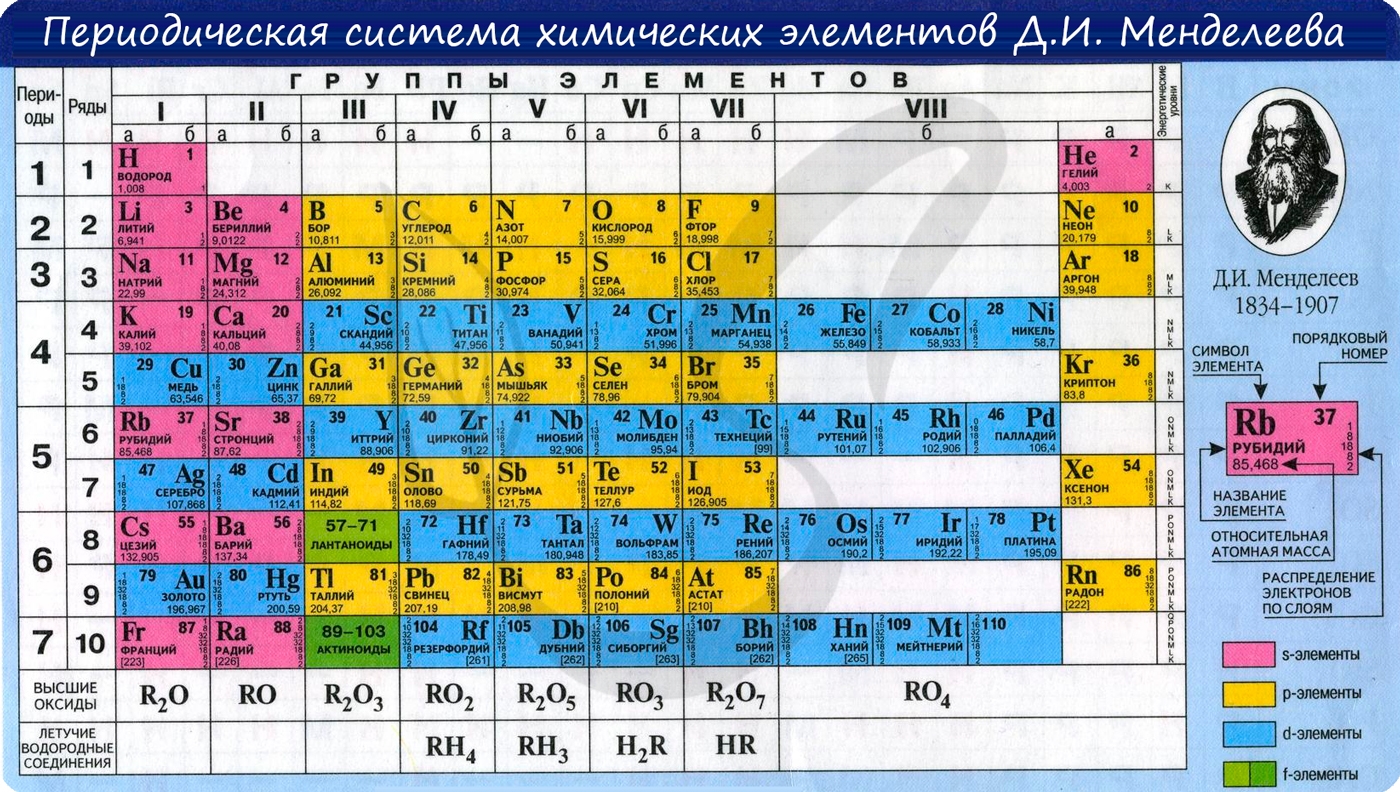
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
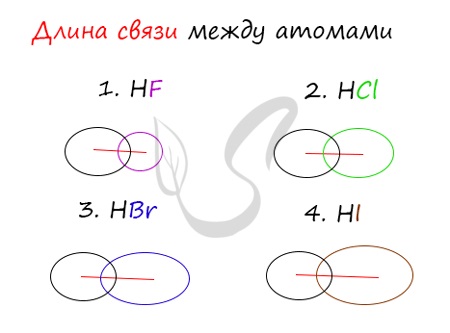
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.

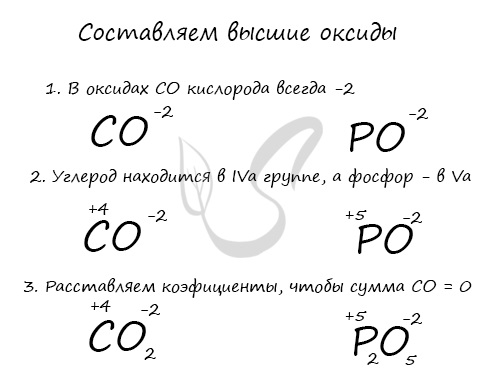
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
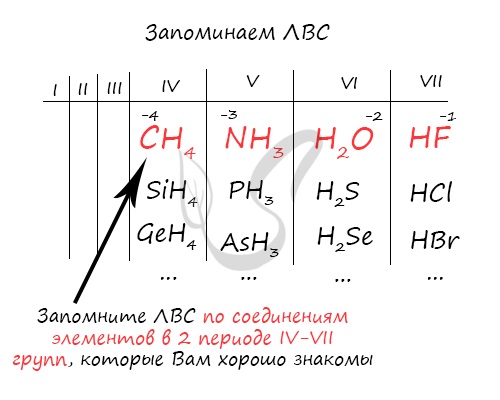
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
Ответы

Периодический закон и система Д.И. Менделеева
1. Слева направо по периоду (см. Таблица Менделеева):
-
- металлические свойства простых веществ ослабевают (уменьшаются)
- неметаллические свойства усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент — фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
-
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
4. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
5. К амфотерным оксидам относятся Al2O3, BeO, ZnO, Cr2O3
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be — Mg — Ca ?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li — Be — B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F — O — N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As — P — N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li — Na — K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O — S — Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si — Al — Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 —> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1. В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3. В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5. В ряду химических элементов As, P, N
1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность
3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7. В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
Как найти продукт Серийный номер
Все типы продуктов указаны ниже :
Материнская плата

- Проверьте наклейку на верхней или нижней стороне материнской платы. Серийный номер указан под штрих-кодом.

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Ноутбук и Eee PC
- Проверьте наклейку на нижней стороне ноутбука или Eee PC.

- Проверьте наклейку на гарантийном талоне. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
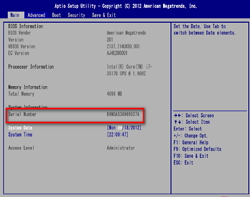
- Проверьте поле данных серийного номера в главном меню BIOS.
- Чтобы войти в меню BIOS, несколько раз нажмите кнопку F2 после включения питания, пока не появится меню BIOS.

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».”
Eee Pad
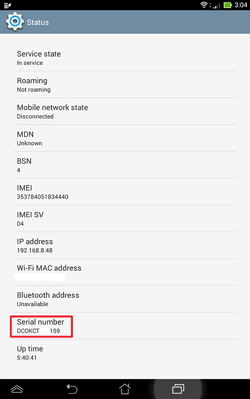
- Найдите серийный номер в «Настройки» -> «О программе» -> «Статус» -> «Серийный номер»

- Проверьте наклейку на устройстве или упаковке. Или проверьте наклейку на гарантийном талоне.
- Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Аксессуары для планшетов

- Возьмите устройство и проверьте, есть ли внизу информация о продукте.

- Вы также можете найти серийный номер на этикетке подарочной коробки;
Графическая карта

- Проверьте наклейку на задней стороне графической карты. Серийный номер указан под штрих-кодом.

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Звуковая карта

- Проверьте наклейку на задней стороне звуковой карты.Серийный номер указан под штрих-кодом.

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
ПК Vivo и Chromebox

- Проверьте наклейку на задней панели Vivo PC / Chromebox. Серийный номер указан после слов «Серийный номер», «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на боковой стороне упаковочной коробки.Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
PadFone и ZenFone
- Найдите серийный номер в «Настройки» -> «Система» -> «О телефоне» -> «Статус» -> «Серийный номер»

- Проверьте наклейку на устройстве или упаковке. Или проверьте наклейку на гарантийном талоне.
- Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN.”
Zenwatch

- Проверьте заднюю крышку Zenwatch. Здесь вы можете найти серийный номер.

- Проверьте упаковку на наличие наклейки. Здесь вы можете найти серийный номер.
Беспроводной маршрутизатор

- Проверить основание устройства.
- Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте гарантийный талон.
- Серийный номер указывается после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на упаковке. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Wireless — повторитель / точка доступа / мосты / Powerline / USB-адаптер Wi-Fi

- Проверить основание устройства.
- Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN.”

- Проверьте гарантийный талон.
- Серийный номер указывается после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на упаковке. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Wireless — адаптер PCI-E

- Проверьте основание адаптера.
- Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN.”

- Проверьте гарантийный талон.
- Серийный номер указывается после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на упаковке. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
ЖК-монитор
- Проверьте наклейку на задней панели ЖК-монитора. Серийный номер указан после слов «Серийный номер», «Серийный номер», «SSN», «S / N» или «SN».”

- Проверьте наклейку на обратной стороне гарантийного талона. Серийный номер указан после слов «Серийный номер», «Серийный номер», «SSN», «S / N» или «SN».
- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «Серийный номер», «SSN», «S / N» или «SN».
Серверная система (установка в стойку)

- Проверьте напечатанную этикетку на серверной системе.Серийный номер печатается прямо под штрих-кодом.
- Этикетку можно найти на боковой стороне корпуса или на верхней части крышки корпуса.

- Найдите этикетку на коробке, серийный номер напечатан под названием модели продукта.
Серверная система (башня)

- Проверьте напечатанную этикетку на серверной системе. Серийный номер печатается прямо под штрих-кодом.
- Этикетку можно найти на боковой стороне корпуса или на верхней части крышки корпуса.
Материнская плата сервера

- Проверьте напечатанную этикетку на материнской плате сервера. Серийный номер печатается прямо под штрих-кодом.
Материнская плата рабочей станции

- Проверьте напечатанную этикетку на материнской плате рабочей станции. Серийный номер печатается прямо под штрих-кодом.
Настольный ПК

- Проверьте наклейку на задней панели настольного ПК.Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на гарантийном талоне. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Моноблочный компьютер

- Проверьте наклейку на задней панели моноблока.Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на гарантийном талоне. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Eee Box PC

- Проверьте наклейку на Eee Box PC.Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на гарантийном талоне. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».

- Проверьте наклейку на боковой стороне упаковочной коробки. Серийный номер указан после слов «Серийный номер», «SSN», «S / N» или «SN».
Как найти номер модели и серийный номер посудомоечной машины?
Расположение номера модели посудомоечной машины? Если вам нужно найти номер модели вашей посудомоечной машины, мы покажем вам, как это сделать, ниже. В определенных местах вам необходимо найти серийный номер и номер модели вашей посудомоечной машины. Сегодня на рынке представлено много разных посудомоечных машин. Большинство посудомоечных машин имеют номер модели и значок с серийным номером в 1 из 4 мест. Номера моделей обычно состоят из цифр или комбинации букв и цифр.Номер модели посудомоечной машины будет указан на ламинированной наклейке или металлической пластине. См. Наши различные таблицы ниже, в которых показано, как найти номер модели посудомоечной машины.
 Номер модели посудомоечной машины Расположение
Номер модели посудомоечной машины Расположение
Зачем нужно искать номер модели посудомоечной машины? Если вам нужно заказать детали для ремонта посудомоечной машины, номер модели — жизненно важная информация. Как только у вас будет номер модели вашей посудомоечной машины, вот тысячи дешевых запчастей для посудомоечной машины, которые вы можете заказать онлайн с бесплатной доставкой.
 Запасные части для посудомоечной машины
Запасные части для посудомоечной машины










Если вам нужен код ошибки для посудомоечной машины , вот информация для посудомоечных машин Bosch, Haier, Hotpoint, Kenmore, KitchenAid, LG и Samsung.
Если вам нужна дополнительная помощь в поиске номера модели посудомоечной машины, оставьте комментарий ниже, и мы будем рады вам помочь.
Пожалуйста, поделитесь нашими проектами помощи по ремонту DIY:
ALLEN VETTER — DIY Repair Assistant
Allen — специалист по обслуживанию дома / бытовой техники и автор / создатель этого веб-сайта.Он имеет 33-летний опыт поиска и устранения неисправностей и ремонта всех типов оборудования. Связаться здесьЕще «Сделай сам» Советы, хитрости, идеи, ремонт «Сделай сам»:
,






Leave A Comment