Химические уравнения — как расставлять коэффициенты?
Поможем понять и полюбить химию
Начать учиться
Из этой статьи вы узнаете, что такое химические уравнения, зачем они нужны и как их составлять, а также вспомните классификацию химических реакций — все это, конечно, с примерами уравнений.
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в ходе этой реакции.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.

Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Это важно
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=».
 Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Типы химических реакций
По числу и составу исходных веществ и продуктов реакции.

По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия.
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑.
Что это за стрелочка? 🤔
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Zn + 2HCl = ZnCl2 + H2↑.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.

В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает | Обозначение | Примеры реагентов |
|---|---|---|
Между жидкостью и твердым веществом | ж—тв | Сода и уксусная кислота |
Между твердым веществом и газом | г—тв | Натрий с водой |
Между жидким веществом и газом | г—ж | |
Между двумя несмешивающимися жидкостями | ж—ж | Вода и масло |
По наличию или отсутствию катализатора
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Например:
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
H2 + I2 ⇄ 2HI.
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.
Татьяна Сосновцева
К предыдущей статье
Способы получения алкенов
К следующей статье
Тепловой эффект
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
ОглавлениеПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮВВЕДЕНИЕ Ионы. Свободные радикалы. Энергия активации. Часть I. РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ I. РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 1. Реакции, протекающие с образованием газов 2. Реакции, протекающие с образованием осадков 3. Реакции, протекающие с образованием слабых электролитов Реакции получения слабых электролитов. Амфотерные электролиты.  4. Реакции, протекающие с образованием комплексных ионов Строение комплексных соединений. О природе сил, обусловливающих комплексообразование. Устойчивость комплексов. Классификация комплексных соединений. Некоторые особенности комплексных соединений. Номенклатура комплексных соединений. II. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ, ПРОТЕКАЮЩИХ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ Составление уравнений реакций получения кислот, оснований и солей. Упражнения Часть II. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ I. КАЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Переход нейтральных атомов в ионное состояние. Энергия ионизации и сродство к электрону. Валентность и степень окисления. Степень окисления. Восстановители и окислители Восстановители, имеющие большое значение в технике и лабораторной практике. Группа окислителей. Окислители, имеющие большое значение в технике и лабораторной практике. Классификация реакций окисления — восстановления II.  СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯСоставление уравнений простейших реакций Составление уравнений сложных реакций Реакции в кислой среде. Реакции в щелочной среде. Реакции в нейтральной среде. Особые случаи составления уравнений окислительно-восстановительных реакций. Составление уравнений реакций диспропорционирования Составление уравнений реакций внутримолекулярного окисления — восстановления Составление уравнений реакций с участием воды Составление уравнений реакций окисления металлов Окислительно-восстановительные эквиваленты. Упражнения III. КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Электродные потенциалы — мера окислительно-восстановительной способности веществ Окислительно-восстановительные потенциалы Константа равновесия. Пользование таблицей окислительно-восстановительных потенциалов и выводы из нее Термодинамическое определение направления химических реакций Упражнения Часть III.  ЯДЕРНЫЕ РЕАКЦИИ ЯДЕРНЫЕ РЕАКЦИИСтроение атома Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Спиновая теория валентности. s-Элементы р-Элементы d-Элементы f-Элементы СТРОЕНИЕ ЯДРА Ядерные силы. Ядерные реакции. Написание уравнений ядерных реакций. Трансурановые элементы. Упражнения ЧАСТЬ IV. УПРАЖНЕНИЯ ПО СОСТАВЛЕНИЮ ХИМИЧЕСКИХ УРАВНЕНИЙ Водород, кислород, перекись водорода Щелочные металлы Медь, серебро, золото Бериллий, магний и щелочноземельные металлы Цинк, кадмий, ртуть Бор, алюминий и элементы подгруппы скандия Углерод, кремний, олово, свинец и элементы подгруппы титана Азот, фосфор, мышьяк, сурьма, висмут и элементы подгруппы ванадия Сера, селен, теллур, полоний Хром, молибден, вольфрам Галогены Марганец Железо, кобальт, никель и платиновые металлы Лантаноиды Актиноиды Дополнительные (смешанные) упражнения Часть V. РЕШЕНИЯ ЗАДАЧ НА СОСТАВЛЕНИЕ УРАВНЕНИЙ Реакции с образованием газов Реакции с образованием и растворением осадков Растворение осадков. 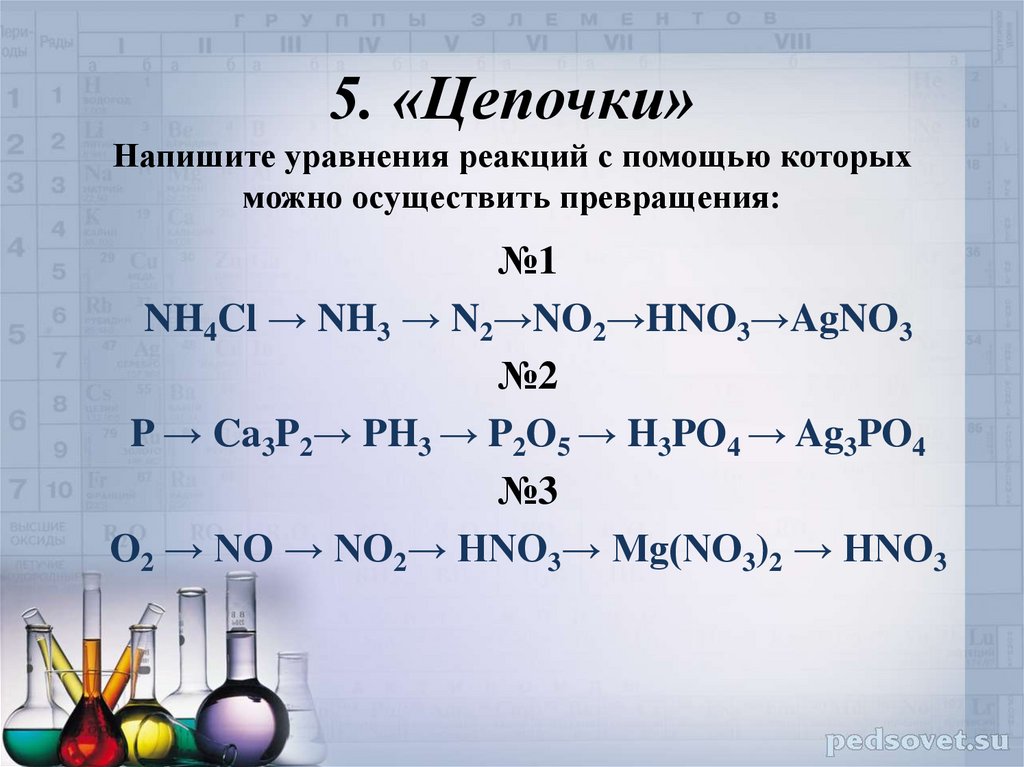 Реакции с образованием слабых электролитов Реакции с образованием комплексных ионов II. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Качественная характеристика окислительно-восстановительных реакций Количественная характеристика окислительно-восстановительных реакций III. УПРАЖНЕНИЯ ПО СОСТАВЛЕНИЮ ХИМИЧЕСКИХ УРАВНЕНИЙ Водород, кислород, перекись водорода Щелочные металлы Сера, селен, теллур, полоний Железо, кобальт, никель и платиновые металлы ОТВЕТЫ ПРИЛОЖЕНИЯ I. Номенклатура неорганических соединений II. Технические и обыденные названия некоторых веществ III. Растворимость солей IV. Растворимость и произведение растворимости малорастворимых веществ V. Потенциалы ионизации элементов (эв) VI. Нормальные (стандартные) окислительно-восстановительные потенциалы VII. Характеристика некоторых элементарных частиц |
Balance Chemical Equation — онлайн-балансировщик
Balance Chemical Equation — онлайн-балансировщик Пожалуйста, включите JavaScript, чтобы использовать этот веб-сайт.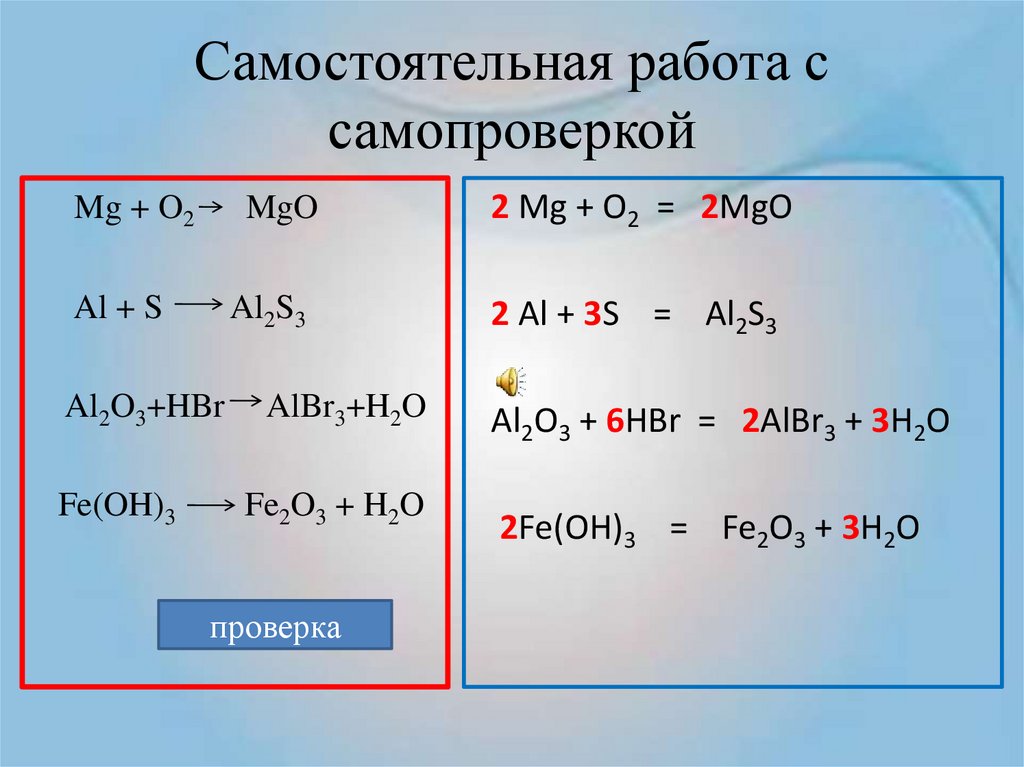
Распечатано с https://www.webqc.org
| Введите химическое уравнение для баланса: |
| Инструкции по балансировке химических уравнений:
|
| химических уравнений сбалансированы сегодня |
Пожалуйста, дайте нам знать, как мы можем улучшить это веб-приложение.
Уравновешивание химических уравнений: практика и повторение
Из всех навыков, которые необходимо знать для изучения химии, составление химических уравнений является, пожалуй, самым важным. Очень многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и работу в лаборатории. Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Конечная цель уравновешивания химических реакций состоит в том, чтобы сделать обе стороны реакции, реагенты и продукты, равными по количеству атомов на элемент. Это вытекает из универсального закона сохранения массы, который гласит, что материя не может быть ни создана, ни уничтожена. Итак, если мы начинаем с десяти атомов кислорода до реакции, нам нужно получить десять атомов кислорода после реакции. Это означает, что химические реакции не изменяют фактические строительные блоки материи; скорее, они просто меняют расположение блоков. Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Но как сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и уравновешивать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте еще раз подсчитать количество атомов каждого элемента с каждой стороны, просто для уверенности.
Проиллюстрируем это на примере:
P 4 O 10 + H 2 O → H 3 PO 4
Во-первых, давайте посмотрим на элемент, который встречается наименее часто. Обратите внимание, что кислород встречается дважды с левой стороны, так что это не лучший элемент для начала. Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором с правой стороны, чтобы сбалансировать их.
Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором с правой стороны, чтобы сбалансировать их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H 3 PO 4 приходится по три молекулы, а у нас четыре молекулы). Итак, чтобы сбалансировать их, мы должны поставить шестерку перед H 9.0050 2 О слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить баланс кислорода. Слева у нас есть десять атомов кислорода из P 4 O 10 и шесть из H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
Слева у нас есть десять атомов кислорода из P 4 O 10 и шесть из H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Попробуйте сбалансировать эти десять уравнений самостоятельно, а затем проверьте ответы ниже. Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся слишком сложными. Просто не забудьте начать с элемента, который отображается меньше всего, и продолжить оттуда. Лучший способ подходить к этим проблемам — медленно и систематически. Глядя на все сразу, легко можно утомиться. Удачи!
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 О
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3
- Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4
- Ч 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Полные решения:
1.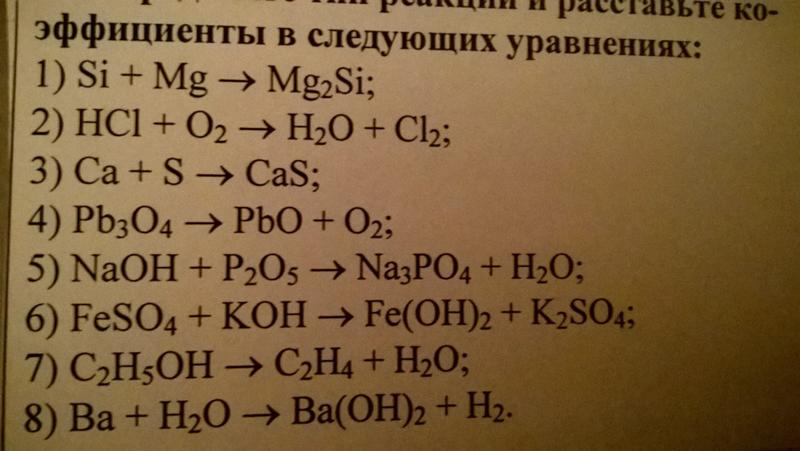 CO 2 + H 2 O → C 6 H 12 O 6 + O 2
CO 2 + H 2 O → C 6 H 12 O 6 + O 2 . Первый шаг на первом этапе. появляются только один раз на каждой стороне уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. Слева только один атом углерода, а справа шесть. Итак, прибавляем коэффициент шесть к углеродсодержащей молекуле слева.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Далее рассмотрим водород. Два атома водорода слева и двенадцать справа. Итак, добавим коэффициент шесть к водородосодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
Теперь пора проверить кислород. Всего слева 18 молекул кислорода (6×2 + 6×1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выравнивания правой части: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент. Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
2. SiCl 4 + H 2 O → H 4 SiO 4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с каждой стороны находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левой части уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны. У левого есть восемь, и у правого также есть восемь, так что мы закончили. Наш окончательный ответ
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, убедитесь, что количество атомов каждого элемента сбалансировано с каждой стороны, прежде чем продолжить.
Эта задача немного сложна, поэтому будьте осторожны. Всякий раз, когда один атом находится в одиночестве по обе стороны уравнения, проще всего начать с этого элемента. Итак, мы начнем с подсчета атомов алюминия с обеих сторон. Есть один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на водород. Слева тоже один, а справа два. Итак, мы добавим коэффициент два слева.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Слева теперь двое, а справа трое. Теперь это не так просто, как просто добавить коэффициент к одной стороне. Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем сделать это, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три и AlCl 3 на два:
Итак, умножим 2HCl на три и AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что мы закончили. Тем не менее, всегда проверяйте дважды. В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий, в правой части, алюминий больше не сбалансирован. Слева один, а справа два. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не совсем закончили. Просматривая уравнение в последний раз, мы видим, что водород также был несбалансирован. Слева шесть, а справа два. Итак, с последней корректировкой, мы получаем наш окончательный ответ:
2Al + 6HCl → 2AlCl 3 + 3H 2
4. Na 2 CO 3 10 2 + HCl O + CO 2 Надеемся, что к этому моменту балансировка уравнений станет проще, и вы освоитесь. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому коэффициенты добавлять не нужно. Так как кислород встречается более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Слева один и справа два, поэтому добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Потом, глядя на хлор, мы видим, что он уже уравновешен двумя с каждой стороны. Теперь мы можем вернуться к кислороду. Три слева и три справа, поэтому наш окончательный ответ:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
50 C 90 5. C 90 H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировку этого уравнения, взглянув на углерод или водород. Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Затем два справа, для водорода, шесть атомов слева и шесть. Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь немного поковыряюсь, по кислороду,
Кислород присутствует в каждой молекуле уравнения, поэтому мы должны быть очень осторожны при его балансировании. Четыре атома кислорода слева и 17 справа. Не существует очевидного способа сбалансировать эти числа, поэтому мы должны использовать небольшую хитрость: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда их использование помогает решить задачу. Кроме того, старайтесь избегать чрезмерного манипулирования органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Итак, чтобы сбалансировать четыре и семнадцать, мы можем умножить O 2 слева на 7,5. Это даст нам
C 7 H 6 O 2 + 7.5O 2 → 7CO 2 + 3H 2 O
3 90 уравнения, поэтому умножьте все на два, чтобы получить целые значения. Теперь наш окончательный ответ:
2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. FE 2 (SO 4 ) 3 + KOH → K 2 SO 4 + FE (OH) 3- 151 SO 4 + FE (OH) 3- 150 3- 150 3- 3- 3-.
Начнем с балансировки утюга с обеих сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe(OH) 3-
Затем мы можем посмотреть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe(OH) 3-
900. Почти готово. Осталось только сбалансировать калий. Слева один атом, а справа шесть, поэтому мы можем сбалансировать их, добавив коэффициент шесть. Таким образом, наш окончательный ответ равен 9.0003
FE 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2FE (OH) 3-
7. CA 3 (PO 4 9001) 7. 7. CA 3 (PO 4 9001) 7. 7. CA 3 (PO 4 9001) 7. 2 + SiO 2 → P 4 O 10 + CaSiO 3
2 + SiO 2 → P 4 O 10 + CaSiO 3 Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент из трех справа, чтобы сбалансировать их.
Ca 3 (ПО 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Тогда для фосфора мы видим, что их два слева и четыре справа. Чтобы сбалансировать их, добавьте коэффициент два слева.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 3CASIO 3
. Обратите внимание, что с этим мы изменили количество кальцимика на кальцие на поса левый. Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли этот шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа по-прежнему три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 6CASIO 3
С тех пор, как оксигенос оксп на данный момент. Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
Теперь проверим количество атомов кислорода с каждой стороны. В левой части 28 атомов, а в правой тоже 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SIO 2 → P 4 O 10 + 6CASIO 3
8. KCLO 3 → KCLO 4 + KCL, это особенно у этого. Потому что ACHOSY, потому что ARCHY ARCHY ARCHY ARSHY ARSHY ARSHY ARSHY ARSHY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTY ARSTIRY, потому что. , встречается в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, с него и начнем. Их три слева и четыре справа. Чтобы сбалансировать их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
, встречается в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, с него и начнем. Их три слева и четыре справа. Чтобы сбалансировать их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор. Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также уравновешен, по четыре с каждой стороны, так что мы закончили, с окончательным ответом
4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 0 5 0 1) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + CaSO 4
9000 Теперь мы можем проверить. Слева их три, а справа только один, поэтому добавление коэффициента, равного трем, уравновешивает их.
Слева их три, а справа только один, поэтому добавление коэффициента, равного трем, уравновешивает их.Ал 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
Двигаясь прямо к кальцию, слева есть только один, а справа три правильно, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
3 элементы сбалансированы, поэтому наше окончательное уравнение равно
AL 2 (SO 4 ) 3 + 3CA (OH) 2 → 2AL (OH) 3 + 3CASO 4
10. H 2 SO + + + + + + + + + + + + + + + + + + + + + 10. HI → H 2 S + I 2 + H 2 O Поскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере. Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Иод только один слева и два справа, поэтому простой коэффициент может уравновесить тех.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород. Слева их четыре, справа десять. Итак, мы знаем, что должны изменить коэффициент либо H 2 SO 4 или HI. Мы хотим изменить что-то, что впоследствии потребует наименьшей доработки, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку H 2 SO 4 уже имеет два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это тоже меняет баланс для йода. Слева теперь восемь, а справа только два. Чтобы исправить это, мы добавим коэффициент 4 справа. После проверки того, что все остальное также уравновешено, мы получаем окончательный ответ
H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством навыков, при изучении баланса химических уравнений требуется практика. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
Есть ли у вас какие-либо советы или приемы, которые помогут сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте применим все на практике. Попробуйте этот практический вопрос по общей химии: Ищете дополнительную практику по общей химии? На сайте Albert.


 Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).

 А. Составление химических уравнений. 4-е издание, перераб. и доп., 1968 — 359 с.
А. Составление химических уравнений. 4-е издание, перераб. и доп., 1968 — 359 с.

 4 + Fe 2 (SO 4 ) 3 + MnSO 4 + HNO 3 + CO 2 + H 2 O
4 + Fe 2 (SO 4 ) 3 + MnSO 4 + HNO 3 + CO 2 + H 2 O
Leave A Comment