Как тромбоциты ускоряют свёртывание крови
Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Поперечный срез через митохондрии клетки лёгкого. Митохондрии выглядят как цистерны, окружённые двойной мембраной; поперечные полосы на снимке — впячивания их внутренней мембраны, на которой сидят ферменты энергетического обмена веществ.
Почувствовав, что стенка кровеносного сосуда повреждена, тромбоциты активируются. Обычные активированные тромбоциты (слева; фото со сканирующего электронного микроскопа) делаются плоскими и образуют, подобно амёбам, многочисленные выросты мембраны.
‹
›
Открыть в полном размере
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови.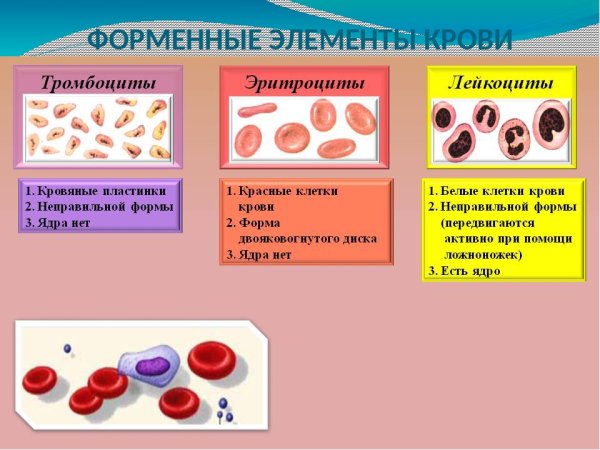
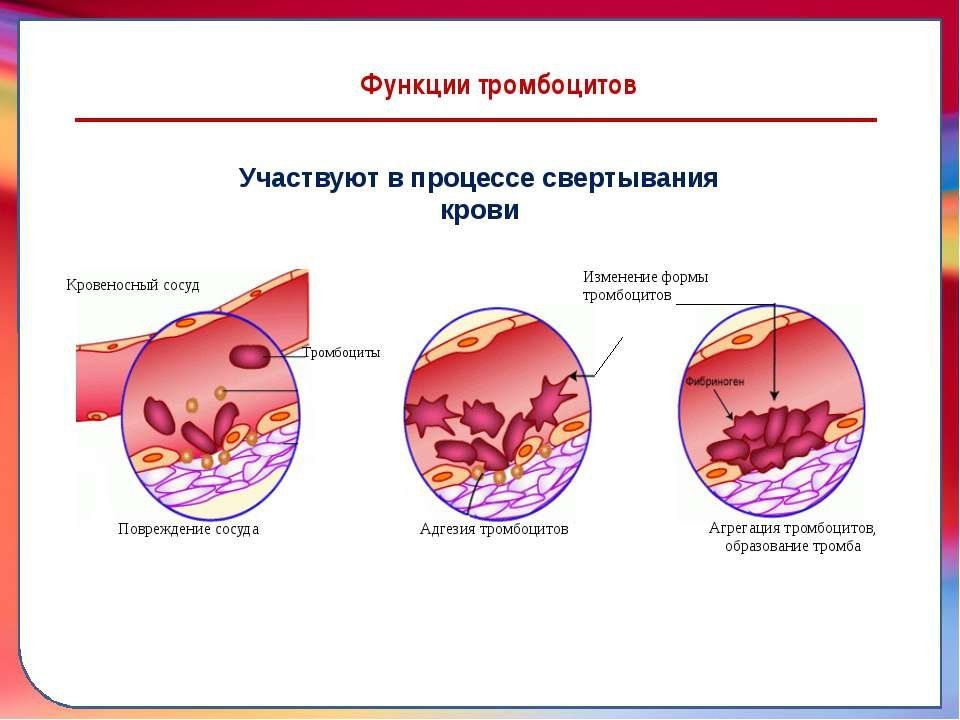
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos — кровь, stasis — остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга. От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген.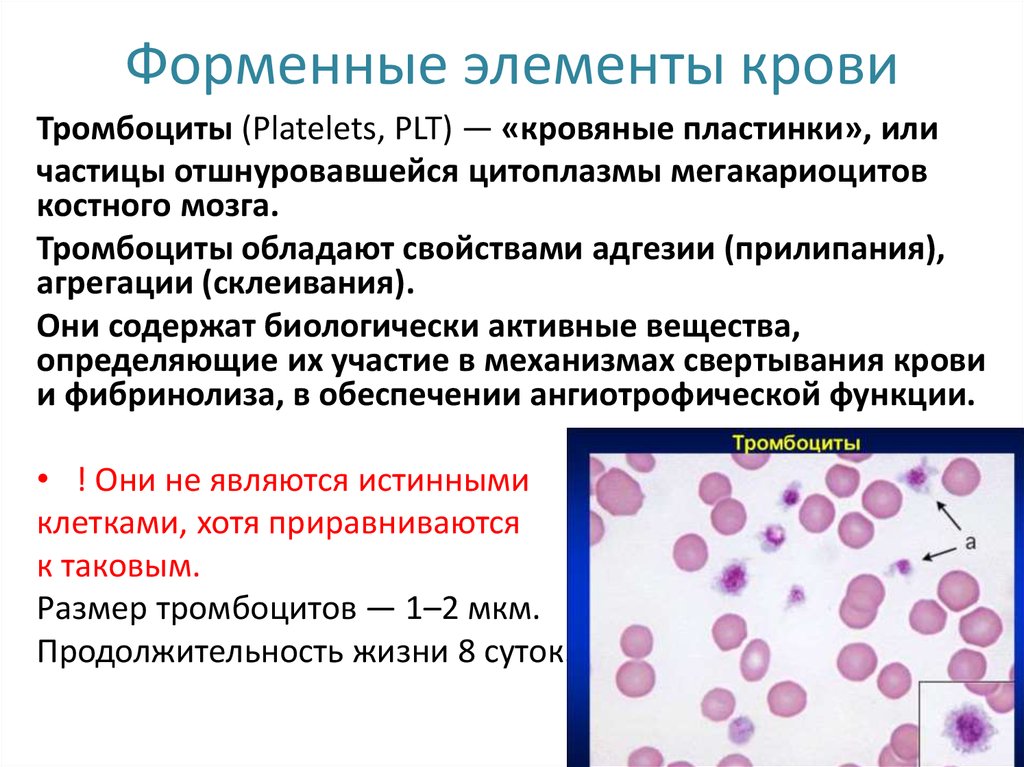
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе.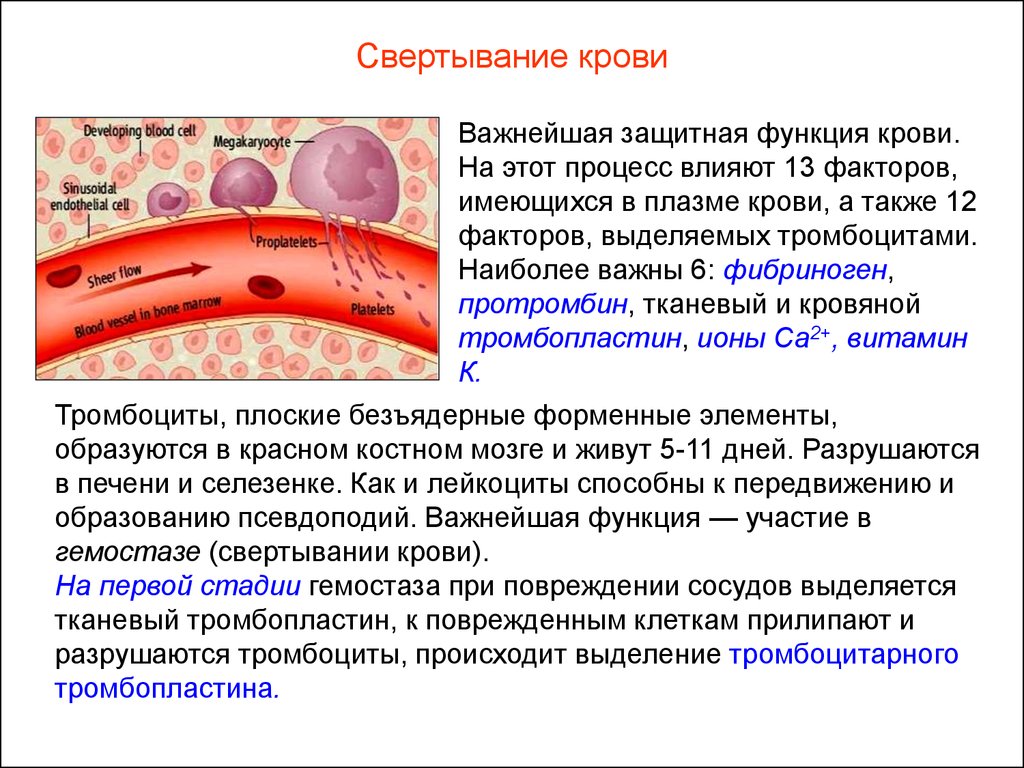
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности.
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов*, директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим Лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале «Molecular BioSystems» статью с описанием модели митохондриального некроза как особой формы клеточной смерти.![]()
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода.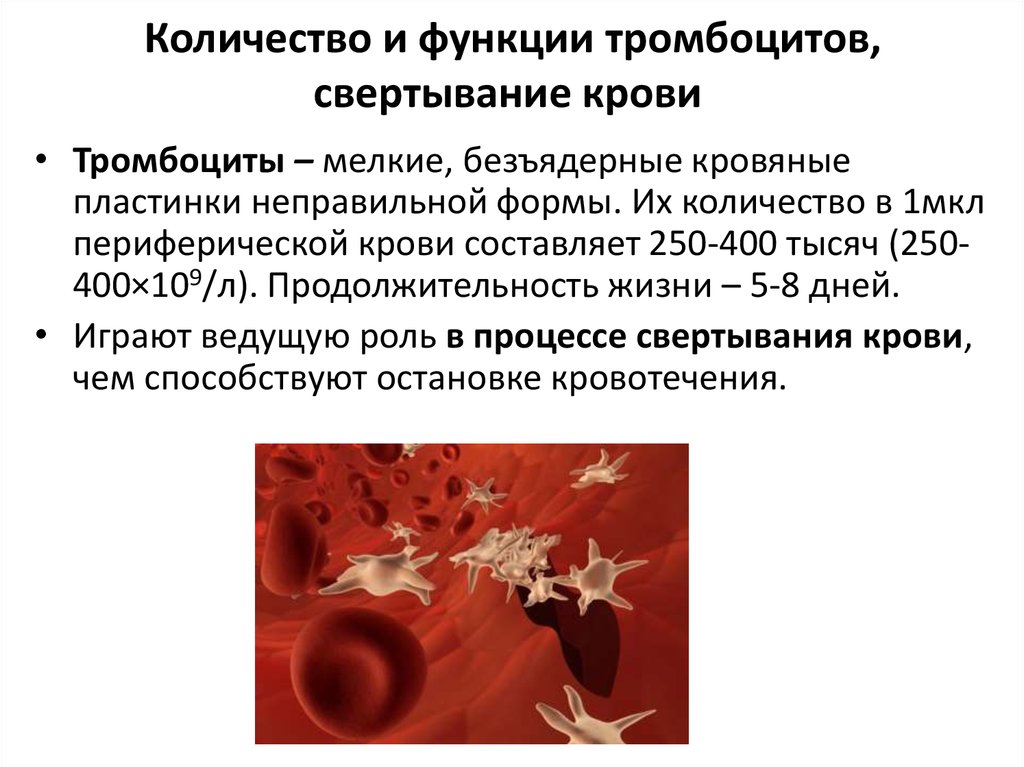 В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000—10 000 раз.
В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000—10 000 раз.
В новой статье, опубликованной в июне этого года в «Journal of Thrombosis and Haemostasis», Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры.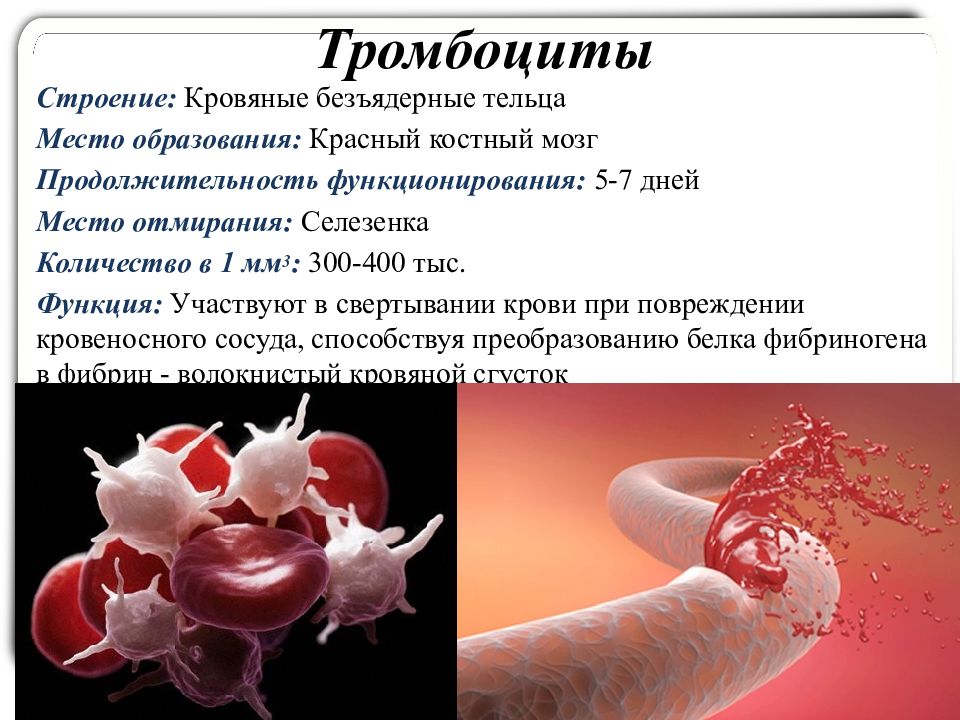 Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — проко-агулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
Комментарии к статье
* Интервью с Фазли Атауллахановым см. «Наука и жизнь» № 1, 2011 г.
Как образуются и работают клетки крови
Полезная информация
Что такое кровь
Кровь состоит из двух основных компонентов ‒ жидкой части (плазмы) и погруженных в нее клеток крови. Плазма, в свою очередь, состоит из воды, а также содержит белки и другие вещества: электролиты, витамины, питательные вещества. К белкам, например, относятся антитела, которые защищают нас от инфекций.
Плазма, в свою очередь, состоит из воды, а также содержит белки и другие вещества: электролиты, витамины, питательные вещества. К белкам, например, относятся антитела, которые защищают нас от инфекций.
По системе сосудов кровь циркулирует по всему организму и обеспечивает нормальное течение жизненно важных процессов. Главные функции крови ‒ транспорт веществ, регуляция процессов обмена и защита организма, поэтому можно сказать, что с помощью клеток крови мы дышим, питаемся, справляемся с инфекциями, а при нарушении их работы страдает весь организм.
Какие бывают клетки крови
Существует три типа клеток крови: эритроциты, тромбоциты и лейкоциты.
Эритроциты ‒ дискообразные клетки без ядра. Они очень пластичны и благодаря этому могут «протискиваться» в самые маленькие капилляры. Каждый эритроцит содержит гемоглобин ‒ белок, который носит на себе кислород и окрашивает эти клетки и всю кровь в красный цвет.
В крошечных кровеносных сосудах легких эритроциты собирают кислород из вдыхаемого воздуха и переносят его в кровотоке ко всем органам, где он необходим для обмена веществ. Так же эритроциты забирают от клеток углекислый газ, с кровотоком транспортируют его обратно в легкие, и мы выдыхаем его.
Так же эритроциты забирают от клеток углекислый газ, с кровотоком транспортируют его обратно в легкие, и мы выдыхаем его.
Кроме того, эритроциты могут собирать и отдавать другие вещества ‒ водород и азот. Это очень важная функция, потому что водород участвует в образовании кислот или щелочей в составе крови, непосредственно влияя на ее кислотно-щелочной баланс ‒ pH. Азот регулирует тонус сосудов: когда эритроциты отдают азот, кровеносные сосуды расширяются и артериальное давление падает.
Тромбоциты ‒ мелкие безъядерные пластинки. Это главные клетки системы свертывания крови, их работа ‒ остановка кровотечения при повреждении сосуда. Скапливаясь на его внутренней стороне, они образуют сгусток-затычку ‒ тромб, который надежно фиксируется с помощью белковых нитей-закрепителей.
Лейкоциты ‒ белые кровяные тельца, которые защищают организм от инфекций. Эти клетки делят на две группы: гранулоциты и агранулоциты.
Гранулоциты содержат гранулы ‒ пузырьки с активными веществами, которые работают, как пули, что позволяет гранулоцитам не только узнавать чужеродные организму клетки (инфекционных агентов), но и уничтожать их. К этой группе относятся нейтрофилы, которые защищают нас от бактериальных и грибковых инфекций; эозинофилы ‒ содержат гранулы с веществами, обладающими высокой антипаразитарной активностью, выброс которых способствует началу воспалительной реакции; и базофилы ‒ они высвобождают гистамины, которые запускают аллергическую реакцию в ответ на появление раздражителя.
К этой группе относятся нейтрофилы, которые защищают нас от бактериальных и грибковых инфекций; эозинофилы ‒ содержат гранулы с веществами, обладающими высокой антипаразитарной активностью, выброс которых способствует началу воспалительной реакции; и базофилы ‒ они высвобождают гистамины, которые запускают аллергическую реакцию в ответ на появление раздражителя.
Агранулоциты ‒ клетки без гранул, в этой группе выделяют моноциты и лимфоциты. Из моноцитов в тканях образуются макрофаги, которые поглощают и переваривают разные «отходы», в том числе бактерии и поврежденные или чужеродные клетки. Лимфоциты ‒ самые высокоточные клетки иммунной системы, они отличаются узкой специализацией ‒ могут узнать портрет конкретного «преступника» и запустить атаку на него. Таким образом они борются с инфекционными агентами и злокачественными заболеваниями. Лимфоциты делятся на два класса: B-клетки ‒ производят антитела, которые метят чужеродную клетку, и Т-клетки ‒ уничтожают помеченную В-клеткой чужеродную клетку или агента.
Лейкоциты живут в крови от нескольких часов до нескольких дней, тромбоциты циркулируют 5‒9 дней, а эритроциты могут находиться в кровотоке до 120 дней.
Основные признаки поражения клеток крови
Если снижено число тромбоцитов (такое нарушение называется тромбоцитопенией), то легко возникают и плохо останавливаются кровотечения. Могут появляться синяки, даже при отсутствии очевидной травмы.
Если мало эритроцитов (анемия), снижается уровень гемоглобина и кислород не доставляется к клеткам в нужном объеме. Из-за этого мы ощущаем слабость, усталость, быстро устаем от привычных нагрузок.
При недостаточном количестве лейкоцитов (лейкопения) организм особенно склонен к инфекциям. В этом случае человек часто болеет и плохо восстанавливается после перенесенных заболеваний.
Как образуются клетки крови
Образование новых клеток крови называется кроветворением, или гемопоэзом. Исходная точка этого процесса ‒ гемопоэтическая стволовая клетка (ГСК), которая обладает неограниченным потенциалом и может стать прародительницей любой клетки крови.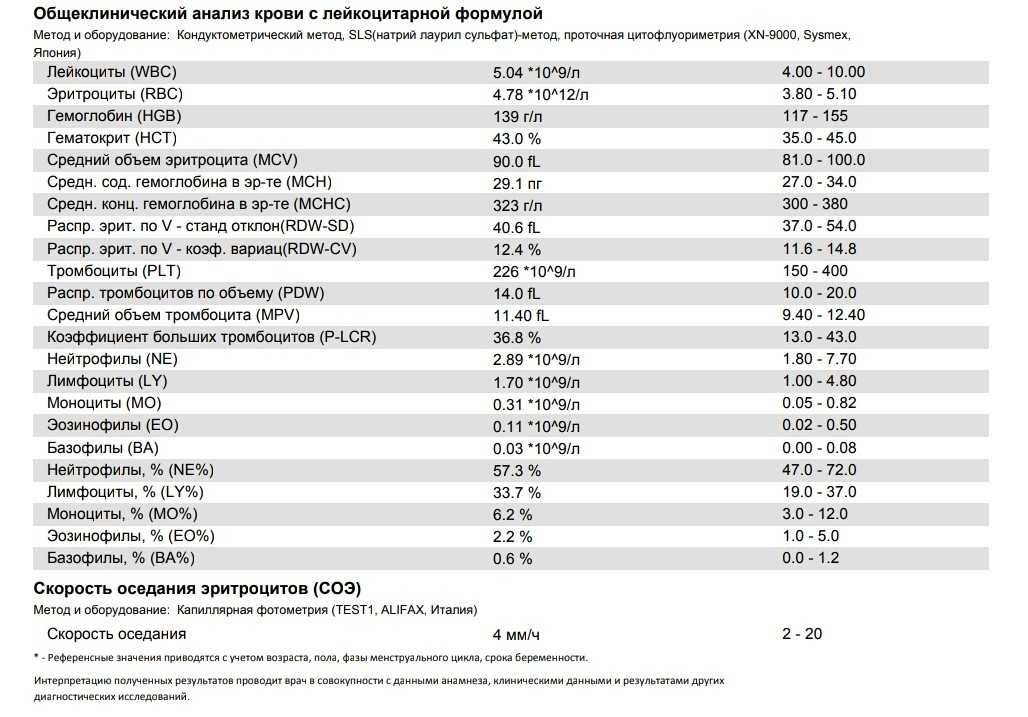 Во «взрослом возрасте» все клетки крови формируются от общей предшественницы в костном мозге ‒ губчатом материале в центре костей.
Во «взрослом возрасте» все клетки крови формируются от общей предшественницы в костном мозге ‒ губчатом материале в центре костей.
Путь образования клеток можно представить в виде генеалогического древа с потомками ‒ ростками. На каждом этапе развития клетки становятся все более специализированными и вместе с тем теряют способность изменить свой путь ‒ они становятся предшественниками тромбоцитов, эритроцитов, гранулоцитов, моноцитов или лимфоцитов. Незрелые или молодые клетки-предшественницы называются бластами.
Каждый следующий шаг развития наделяет клетку все более четкими характеристиками и функциями. Через 5‒6 превращений клетка обретает определенные и специфические признаки. Например, образуются гранулы для гранулоцитов с веществами, способными уничтожать инфекционных агентов, или происходит потеря ядра для формирования эритроцита или тромбоцита. Некоторые клетки «дозревают», уже покинув костный мозг.
Существует два основных вида клеток-предшественниц ‒ миелоидные и лимфоидные. Конечные продукты миелоидного предшественника ‒ эритроциты, тромбоциты, гранулоциты и моноциты. Гранулоциты пройдут стадии развития от миелобласта до созревшего нейтрофила, эозинофила, базофила. От того же миелобласта образуются и моноциты, которые за пределами костного мозга, в тканях организма, превратятся в макрофаги. Эритроциты берут начало от проэритробласта, тромбоциты ‒ от мегакариобласта.
Конечные продукты миелоидного предшественника ‒ эритроциты, тромбоциты, гранулоциты и моноциты. Гранулоциты пройдут стадии развития от миелобласта до созревшего нейтрофила, эозинофила, базофила. От того же миелобласта образуются и моноциты, которые за пределами костного мозга, в тканях организма, превратятся в макрофаги. Эритроциты берут начало от проэритробласта, тромбоциты ‒ от мегакариобласта.
Из общего лимфоидного предшественника образуются Т- и B-лимфоциты, а также клетки натуральные киллеры.
Кроветворение происходит в режиме нон-стоп: за сутки в организме образуется огромное количество клеток ‒ примерно 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
К чему приводит нарушение развития клеток
Сбой в процессе развития может произойти на любой стадии образования клетки. Если поражается ГСК, костный мозг начинает производить нефункциональные или злокачественные клетки вместо здоровых зрелых клеток, в результате чего развиваются острые лейкозы (миелоидные, Т- или В-клеточные). Поражение более поздних предшественников может стать причиной хронического лейкоза, поражение лимфоцитов ‒ причиной лимфомы. Изменение зрелого варианта B-лимфоцита ‒ плазматической клетки вызывает множественную миелому.
Поражение более поздних предшественников может стать причиной хронического лейкоза, поражение лимфоцитов ‒ причиной лимфомы. Изменение зрелого варианта B-лимфоцита ‒ плазматической клетки вызывает множественную миелому.
Стадия развития пораженной клетки обычно фигурирует в диагнозе лимфомы или лейкоза, например острый миелоидный лейкоз или острый лимфобластный лейкоз. Это значит, что клетка вместо того, чтобы следовать по нормальному пути развития, начала бесконтрольно делиться раньше обретения функций здоровой клетки. В результате активного деления аномальные клетки постепенно вытесняют из костного мозга другие ростки кроветворения.
Что влияет на образование клеток крови
Кроветворение должно соответствовать нуждам организма ‒ поэтому этот процесс четко регулируется. При снижении уровня клеток одного вида через специальные сигналы-стимуляторыклетке-предшественнице передается информация о необходимости их усиленного производства. Если, например, возрастают потребности в доставке кислорода к клеткам организма (при беременности или активных занятиях спортом), будут производиться эритроциты.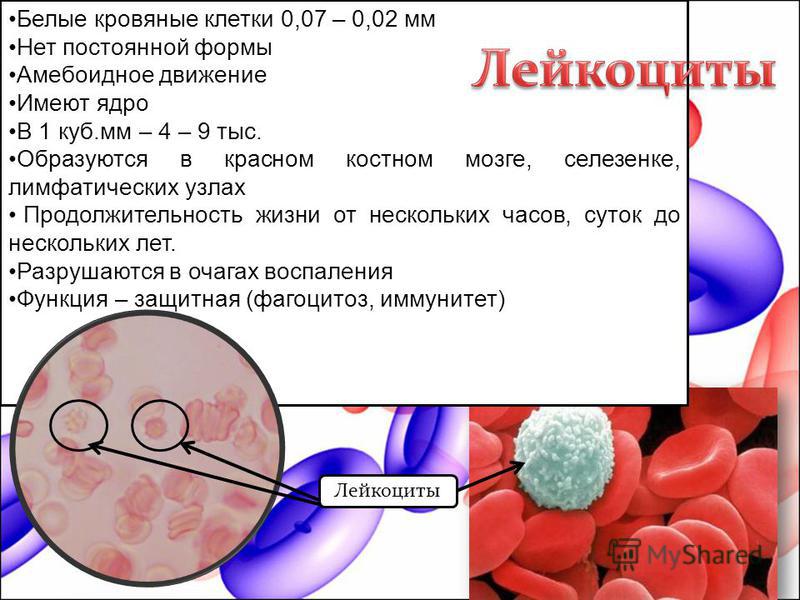 Ведь именно они смогут на гемоглобине «привезти» недостающий кислород всем клеткам крови. Этот заказ будет выполнен в костном мозге.
Ведь именно они смогут на гемоглобине «привезти» недостающий кислород всем клеткам крови. Этот заказ будет выполнен в костном мозге.
Помимо костного мозга в регуляции клеток крови участвуют другие органы ‒ лимфатические узлы, селезенка и печень. Они дирижируют производством, разрушением и функционированием клеток. Поэтому при поражении любого из органов кроветворения страдают клетки крови. Это можно увидеть по изменениям в анализах.
Какие тесты помогают оценить работу системы кроветворения?
Общий анализ крови показывает количественное и качественное соотношение разных клеток крови. Это простой, доступный и при этом один из самых информативных тестов в гематологии, по его показателям можно заметить снижение или, наоборот, избыточное производство определенной фракции клеток.
Анализ крови на показатели гемостаза поможет оценить риски кровотечения или тромбоза.
Таким образом, кровь участвует в важнейших процессах в организме:
1) Транспорт веществ: доставка полезных компонентов (гормонов, витаминов, питательных молекул) к клеткам тела и выведение продуктов их обмена (детоксикация).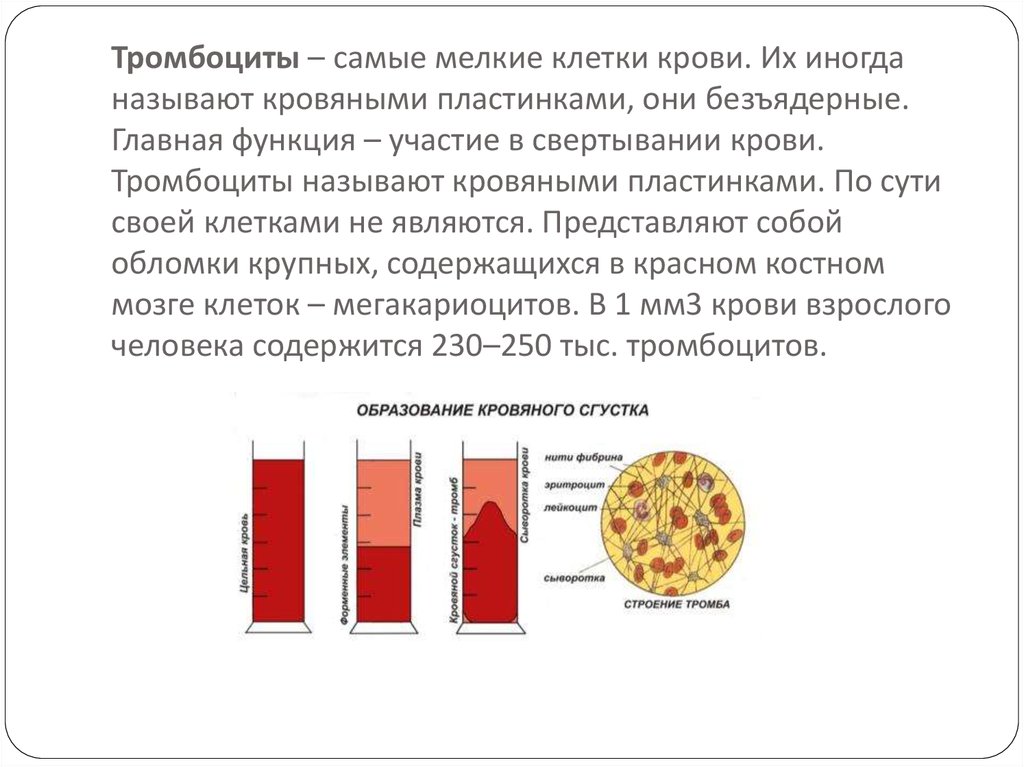
2) Регуляция процессов обмена: доставленные в кровотоке гормоны и активные вещества воздействуют на клетки и передают сигналы/команды от нервной и эндокринных систем в органы и ткани. Также кровь поддерживает баланс веществ, уровень кислотности и содержание гормонов, необходимые для функционирования организма.
3) Детоксикация: выведение продуктов обмена клеток и токсинов и перенос их к почкам и печени, которые перерабатывают и удаляют их из организма.
4) Теплообмен: кровь поддерживает температуру тела благодаря свойствам плазмы, которая может забирать и отдавать тепло, а также за счет изменения скорости кровотока. Когда сосуды расширены, ток крови замедляется, и это приводит к потере тепла. Если мы мерзнем, происходит спазм сосудов и сбережение тепла.
5) Дыхание: эритроциты переносят кислород из вдыхаемого легкими воздуха к каждой клетке организма и выводят углекислый газ обратно к легким, чтобы мы могли его выдохнуть.
6) Защита от инфекций осуществляется с помощью доставки иммунных клеток (лейкоцитов), антител и молекул воспаления.
7) Защита от кровотечений: при повреждении сосуда тромбоциты формируют тромб и «заклеивают» повреждение.
8) Защита от злокачественных заболеваний: лейкоциты уничтожают измененные клетки до того, как они успевают размножиться.
Роль тромбоцитов в иммунной системе и воспалении
1. Elzey BD, Tian J, Jensen RJ, Swanson AK, Lees JR, Lentz SR, et al. Тромбоцитарная модуляция адаптивного иммунитета. Связь между врожденным и адаптивным иммунными компартментами. Иммунитет. 2003;19:9-19. [PubMed] [Google Scholar]
2. Semple JW, Italiano JE, Jr, Freedman J. Тромбоциты и иммунный континуум. Нат Рев Иммунол. 2011;11:264-274. [PubMed] [Google Scholar]
3. Morrell CN, Aggrey AA, Chapman LM, Modjeski KL. Новые роли тромбоцитов в качестве иммунных и воспалительных клеток. Кровь. 2014;123:2759-2767. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Youssefian T, Drouin A, Massé JM, Guichard J, Cramer EM.
Роль тромбоцитов в защите хозяина: поглощение ВИЧ и Staphylococcus aureus происходит в определенном субклеточном компартменте и усиливается за счет активации тромбоцитов. Кровь.
2002;99:4021-4029. [PubMed] [Google Scholar]
Кровь.
2002;99:4021-4029. [PubMed] [Google Scholar]
5. Watson SP, Morgan NV, Harrison P. Сосудистая функция тромбоцитов. Хоффбранд А.В., Мехта А.Б., редакторы. Последипломная гематология. Оксфорд, Великобритания: 2016. [Google Академия]
6. Jenne CN, Urrutia R, Kubes P. Тромбоциты: мостовой гемостаз, воспаление и иммунитет. Int J Lab Гематол. 2013;35:254-261. [PubMed] [Google Scholar]
7. Duerschmied D, Suidan G, Demers M, Herr N, Carbo C, Brill A, et al. Серотонин тромбоцитов способствует привлечению нейтрофилов к местам острого воспаления у мышей. Кровь. 2013;121:1008-1015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Wang X, Luo Y, Masci PP, Crawford R, Xiao Y. Влияние интерлейкина-1 бета на образование сгустков плазмы с низким содержанием тромбоцитов: потенциальное влияние на раннее заживление костей. ПЛОС ОДИН. 2016;11:e0149775. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Kissel K, Berber S, Nockher A, Santoso S, Bein G, Hackstein H. Тромбоциты человека нацелены на дифференцировку дендритных клеток и продукцию провоспалительных цитокинов.
Переливание.
2006;46:818-827. [PubMed] [Google Scholar]
Тромбоциты человека нацелены на дифференцировку дендритных клеток и продукцию провоспалительных цитокинов.
Переливание.
2006;46:818-827. [PubMed] [Google Scholar]
10. Weyrich AS, Elstad MR, McEver RP, McIntyre TM, Moore KL, Morrissey JH, et al. Активированные тромбоциты сигнализируют о синтезе хемокинов моноцитами человека. Джей Клин Инвест. 1996;97:1525-1534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. фон Хундельсхаузен П., Вебер К.С., Хуо Ю., Праудфут А.Е., Нельсон П.Дж., Лей К. и соавт. Отложение RANTES тромбоцитами вызывает остановку моноцитов на воспаленном и атеросклеротическом эндотелии. Тираж. 2001; 103:1772-1777. [PubMed] [Google Scholar]
12. Кроуфорд А., Анджелосанто Дж. М., Надводный К. Л., Блэкберн С. Д., Уэрри Э. Дж. Роль хемокина RANTES в регуляции ответов Т-клеток CD8 при хронической вирусной инфекции. PLoS Патог. 2011;7:e1002098. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Cognasse F, Hamzeh-Cognasse H, Lafarge S, Chavarin P, Cogné M, Richard Y, et al. Тромбоциты человека могут активировать В-клетки периферической крови и увеличивать выработку иммуноглобулинов.
эксп Гематол.
2007; 35:1376-1387. [PubMed] [Google Scholar]
Тромбоциты человека могут активировать В-клетки периферической крови и увеличивать выработку иммуноглобулинов.
эксп Гематол.
2007; 35:1376-1387. [PubMed] [Google Scholar]
14. Ludwig A, Petersen F, Zahn S, Götze O, Schröder JM, Flad HD, et al. CXC-хемокин, активирующий нейтрофилы, пептид-2 индуцирует два различных оптимума хемотаксиса нейтрофилов за счет дифференциального взаимодействия с рецепторами интерлейкина-8 CXCR-1 и CXCR-2. Кровь. 1997;90:4588-4597. [PubMed] [Google Scholar]
15. Baggiolini M, Dewald B, Moser B. Интерлейкин-8 и родственные хемотаксические цитокины — хемокины CXC и CC. Ад Иммунол. 1994;55:97-179. [PubMed] [Google Scholar]
16. Scheuerer B, Ernst M, Dürrbaum-Landmann I, Fleischer J, Grage-Griebenow E, Brandt E, et al. СХС-хемокиновый тромбоцитарный фактор 4 способствует выживанию моноцитов и индуцирует дифференцировку моноцитов в макрофаги. Кровь. 2000;95:1158-1166. [PubMed] [Академия Google]
17. McMorran BJ, Wieczorski L, Drysdale KE, Huang HM, Smith C, Mitiku C, et al. Тромбоцитарный фактор 4 и антиген Даффи необходимы для уничтожения тромбоцитов Plasmodium falciparum.
Наука.
2012; 338:1348-1351. [PubMed] [Google Scholar]
Тромбоцитарный фактор 4 и антиген Даффи необходимы для уничтожения тромбоцитов Plasmodium falciparum.
Наука.
2012; 338:1348-1351. [PubMed] [Google Scholar]
18. Krijgsveld J, Zaat SA, Meeldijk J, van Veelen PA, Fang G, Poolman B, et al. Тромбоцидины, бактерицидные белки из тромбоцитов крови человека, представляют собой продукты делеции С-конца хемокинов СХС. Дж. Биол. Хим. 2000;275:20374-20381. [PubMed] [Академия Google]
19. Kwakman PH, Krijgsveld J, de Boer L, Nguyen LT, Boszhard L, Vreede J, et al. Нативный тромбоцидин-1 и развернутый тромбоцидин-1 проявляют антимикробную активность через различные структурные элементы. Дж. Биол. Хим. 2011; 286:43506-43514. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Купенова М., Витцева О., MacKay CR, Beaulieu LM, Benjamin EJ, Mick E, et al. Тромбоцит-TLR7 опосредует выживаемость хозяина и количество тромбоцитов во время вирусной инфекции в отсутствие тромбоцит-зависимого тромбоза. Кровь. 2014;124:791-802. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Shiraki R, Inoue N, Kawasaki S, Takei A, Kadotani M, Ohnishi Y, et al.
Экспрессия Toll-подобных рецепторов на тромбоцитах человека.
Рез. Тромб.
2004; 113:379-385. [PubMed] [Google Scholar]
Shiraki R, Inoue N, Kawasaki S, Takei A, Kadotani M, Ohnishi Y, et al.
Экспрессия Toll-подобных рецепторов на тромбоцитах человека.
Рез. Тромб.
2004; 113:379-385. [PubMed] [Google Scholar]
22. Cognasse F, Hamzeh H, Chavarin P, Acquart S, Genin C, Garraud O, et al. Доказательства молекул Toll-подобных рецепторов на тромбоцитах человека. Иммунол Селл Биол. 2005;83:196-198. [PubMed] [Google Scholar]
23. Clark SR, Ma AC, Tavener SA, McDonald B, Goodarzi Z, Kelly MM, et al. TLR4 тромбоцитов активирует внеклеточные ловушки нейтрофилов, чтобы заманить бактерии в септическую кровь. Нат Мед. 2007;13:463-469. [PubMed] [Google Scholar]
24. Blair P, Rex S, Vitseva O, Beaulieu L, Tanriverdi K, Chakrabarti S, et al. Стимуляция Toll-подобного рецептора 2 в тромбоцитах человека вызывает тромбовоспалительный ответ посредством активации фосфоинозитид-3-киназы. Цирк рез. 2009;104:346-354. [PMC бесплатная статья] [PubMed] [Google Scholar]
25. Zhang G, Han J, Welch E, Ye RD, Voyno-Yasenetskaya TA, Malik AB, et al. ЛПС стимулирует секрецию тромбоцитов и усиливает агрегацию тромбоцитов посредством TLR4/MyD88 и пути цГМФ-зависимой протеинкиназы.
Дж Иммунол.
2009 г.;182:7997-8004. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ЛПС стимулирует секрецию тромбоцитов и усиливает агрегацию тромбоцитов посредством TLR4/MyD88 и пути цГМФ-зависимой протеинкиназы.
Дж Иммунол.
2009 г.;182:7997-8004. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Bénézech C, Nayar S, Finney B, Withers DR, Lowe K, Desanti GE, et al. CLEC-2 необходим для развития и поддержания лимфатических узлов. Кровь. 2014;123:3200-3207. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Osada M, Inoue O, Ding G, Shirai T, Ichise H, Hirayama K, et al. Рецептор активации тромбоцитов CLEC-2 регулирует разделение кровеносных и лимфатических сосудов путем ингибирования пролиферации, миграции и образования трубочек лимфатических эндотелиальных клеток. Дж. Биол. Хим. 2012; 287:22241-22252. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Chang Y, Hsieh P, Chang Y, Lu MH, Huang TF, Chong KY, et al.
Идентификация нового антагониста тромбоцитов, который связывается с CLEC-2 и подавляет индуцированную подопланином агрегацию тромбоцитов и метастазирование рака.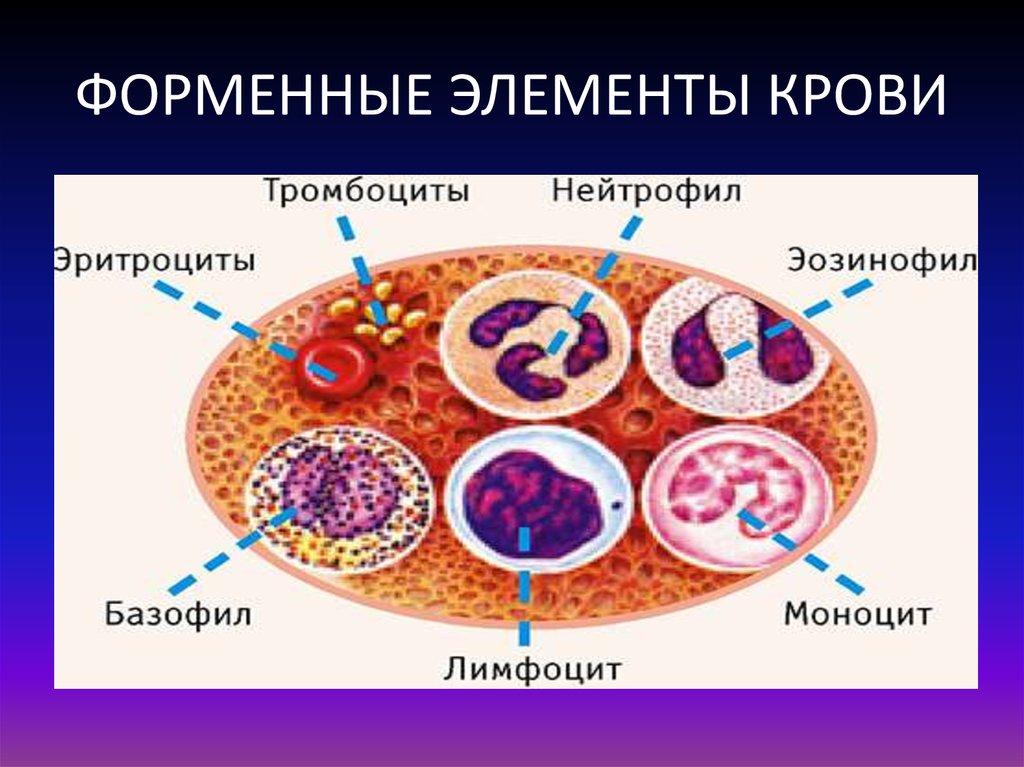 Онкотаргет.
2015;6:42733-42748. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Онкотаргет.
2015;6:42733-42748. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Vanichakarn P, Blair P, Wu C, Freedman JE, Chakrabarti S. Нейтрофилы CD40 усиливают воспаление, опосредованное тромбоцитами. Рез. Тромб. 2008; 122:346-358. [PubMed] [Google Scholar]
30. Elgueta R, Benson M, Vries V, Wasiuk A, Guo Y, Noelle R. Молекулярный механизм и функция вовлечения CD40/CD40L в иммунную систему. Иммунол Ред. 229. 2009. 10.1111/j.1600-065X.2009.00782.x. Авторская рукопись; доступно в PMC 2013 13 ноября. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Elzey BD, Grant JF, Sinn HW, Nieswandt B, Waldschmidt TJ, Ratliff TL. Сотрудничество между тромбоцитарными CD154 и CD4+ Т-клетками для усиления образования зародышевого центра. Дж. Лейкок Биол. 2005;78:80-84. [PubMed] [Google Scholar]
32. Elzey BD, Schmidt NW, Crist SA, et al.
CD154, полученный из тромбоцитов, обеспечивает праймирование Т-клеток и защиту от заражения Listeria monocytogenes. Кровь.
2008;111:3684-3691. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кровь.
2008;111:3684-3691. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Conde I, Cruz M, Zhang H, López J, Afshar-Kharghan V. Активация тромбоцитов приводит к активации и распространению системы комплемента. J Эксперт Мед. 2005; 201:871-879. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Skoglund C, Wetterö J, Tengvall P, Bengtsson T. C1q индуцирует быструю активацию P-селектина и модулирует активацию, запускаемую коллагеном и связанными с коллагеном пептидами, в тромбоцитах человека. Иммунобиология. 2010;215:987-995. [PubMed] [Google Scholar]
35. Zago AC, Simon DI, Wang Y, Sakuma M, Chen Z, Croce K, et al. Важность взаимодействия между лейкоцитарным интегрином Mac-1 и тромбоцитарным гликопротеином Ib-a для рекрутирования лейкоцитов тромбоцитами и для воспалительной реакции на повреждение сосудов. Arq Bras Кардиол. 2008;90:54-63. [PubMed] [Google Scholar]
36. Hasegawa S, Pawankar R, Suzuki K, Nakahata T, Furukawa S, Okumura K, et al.
Функциональная экспрессия высокоаффинного рецептора IgE (FcepsilonRI) в тромбоцитах человека и его внутриклеточная экспрессия в мегакариоцитах человека. Кровь.
1999;93:2543-2545. [PubMed] [Google Scholar]
Кровь.
1999;93:2543-2545. [PubMed] [Google Scholar]
37. Махони Т., Вейрих А., Диксон Д., Макинтайр Т., Прескотт С., Циммерман Г. Клеточная адгезия регулирует экспрессию генов в контрольных точках трансляции в миелоидных лейкоцитах человека. Proc Natl Acad Sci U S A. 2001;98:10284-10289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Frenette PS, Denis CV, Weiss L, Jurk K, Subbarao S, Kehrel B, et al. Глиганд-лиганд 1 P-селектина (PSGL-1) экспрессируется на тромбоцитах и может опосредовать взаимодействие тромбоцитов с эндотелием in vivo. J Эксперт Мед. 2000;191:1413-1422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Laszik Z, Jansen PJ, Cummings RD, Tedder TF, McEver RP, Moore KL. Глиганд-1 P-селектина широко экспрессируется в клетках миелоидного, лимфоидного и дендритного происхождения, а также в некоторых некроветворных клетках. Кровь. 1996; 88:3010-3021. [PubMed] [Google Scholar]
40. Xu T, Zhang L, Geng Z, Wang H, Wang J, Chen M, et al.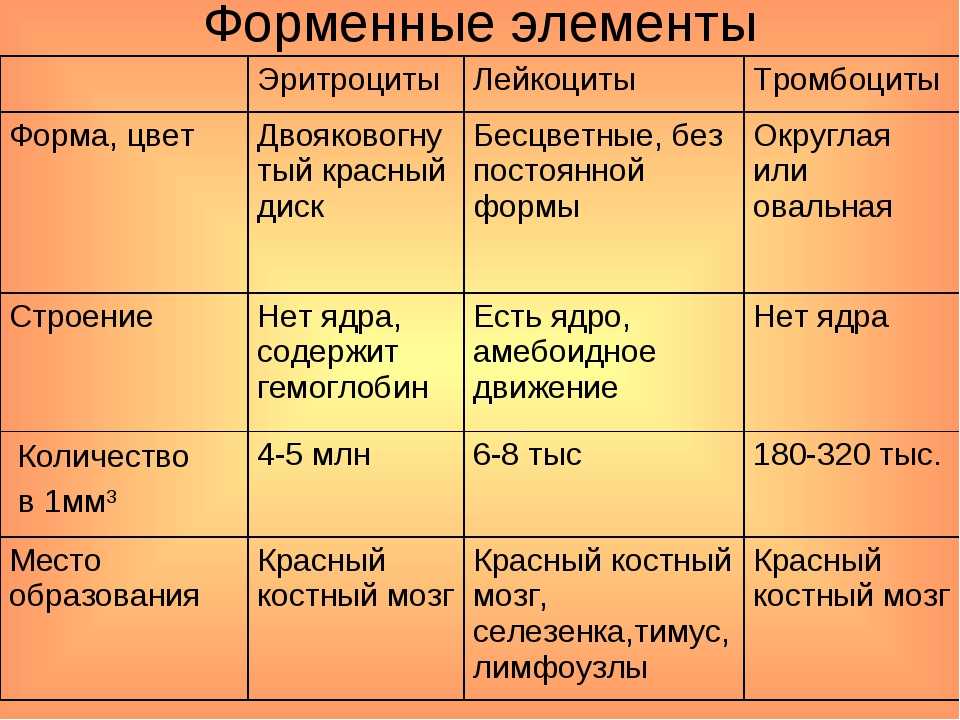 P-селектин сшивает PSGL-1 и усиливает адгезию нейтрофилов к фибриногену и ICAM-1 по механизму, зависящему от киназы Src, но независимому от GPCR.
Сотовый Адх Мигр.
2007; 1:115-123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
P-селектин сшивает PSGL-1 и усиливает адгезию нейтрофилов к фибриногену и ICAM-1 по механизму, зависящему от киназы Src, но независимому от GPCR.
Сотовый Адх Мигр.
2007; 1:115-123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Li G, Kim YJ, Mantel C, Broxmeyer HE. Р-селектин усиливает образование CD14+CD16+ дендритных клеток и ингибирует созревание макрофагов из моноцитов периферической крови человека. Дж Иммунол. 2003; 171:669-677. [PubMed] [Google Scholar]
42. Цудзи Т., Нагата К., Койке Дж., Тодороки Н., Иримура Т. Индукция продукции супероксидных анионов моноцитами и нейтрофилами активированными тромбоцитами посредством взаимодействия P-селектин-сиалил-Льюис-Х. Дж. Лейкок Биол. 1994;56:583-587. [PubMed] [Академия Google]
43. Озген Ю, Озерол Э, Аминчи М. Связь между активацией и апоптозом тромбоцитов. Терк Дж. Гематол. 2007; 24:171-176. [PubMed] [Google Scholar]
44. Bennett JS, Berger BW, Billings PC.
Структура и функция интегринов тромбоцитов. Джей Тромб Хемост.
2009;7(Приложение 1):200-205. [PubMed] [Google Scholar]
Джей Тромб Хемост.
2009;7(Приложение 1):200-205. [PubMed] [Google Scholar]
45. Abram CL, Lowell CA. Плюсы и минусы передачи сигналов лейкоцитарного интегрина. Анну Рев Иммунол. 2009;27:339-362. Примечание: доступно в PMC 2011 от 29 декабря. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Diacovo TG, deFougerolles AR, Bainton DF, Springer TAJ. Функциональный интегриновый лиганд ClinA на поверхности тромбоцитов: молекула межклеточной адгезии-2. Вкладывать деньги. 1994; 94:1243-1251. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Seymour CW, Liu VX, Iwashyna TJ, et al. Оценка клинических критериев сепсиса: для третьего международного консенсуса определений сепсиса и септического шока (сепсис-3). ДЖАМА. 2016; 315:762-774. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Negrotto S, Jaquenod de Giusti C, Rivadeneyra L, Ure AE, Mena HA, Schattner M, et al.
Тромбоциты взаимодействуют с вирусами Коксаки В и играют важную роль в патогенезе вирус-индуцированного миокардита. Джей Тромб Хемост.
2015;13:271-282. [PubMed] [Google Scholar]
Джей Тромб Хемост.
2015;13:271-282. [PubMed] [Google Scholar]
49. Hottz ED, Oliveira MF, Nunes PC, Nogueira RM, Valls-de-Souza R, Da Poian AT, et al. Денге вызывает активацию тромбоцитов, митохондриальную дисфункцию и гибель клеток посредством механизмов, которые включают DC-SIGN и каспазы. Джей Тромб Хемост. 2013;11:951-962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Langer H, Choi E, Zhou H, Schleicher R, Chung KJ, Tang Z, et al. Тромбоциты вносят вклад в патогенез экспериментального аутоиммунного энцефаломиелита. Цирк рез. 2012;110:1202-1210. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Haselmayer P, Grosse-Hovest L, von Landenberg P, Schild H, Radsak MP. Экспрессия лиганда TREM-1 на тромбоцитах усиливает активацию нейтрофилов. Кровь. 2007; 110:1029-1035. [PubMed] [Академия Google]
52. Кан Ф., Херли С., Шеннон О.
Тромбоциты способствуют диссеминации бактерий в мышиной модели стрептококкового сепсиса.
микробы заражают.
2013;15:669-676. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
53. Mayadas T, Cullere X, Lowell C. Многогранные функции нейтрофилов. Анну Рев Патол. 2015;9:181-218. Авторская рукопись; доступно в PMC 2015 1 января. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Jenne CN, Wong CH, Zemp FJ, McDonald B, Rahman MM, Forsyth PA, et al. Нейтрофилы, привлекаемые к очагам инфекции, защищают от заражения вирусом, высвобождая нейтрофильные внеклеточные ловушки. Клеточный микроб-хозяин. 2013;13:169-180. [PubMed] [Google Scholar]
55. Caudrillier A, Kessenbrock K, Gilliss BM, Nguyen JX, Marques MB, Monestier M, et al. Тромбоциты индуцируют нейтрофильные внеклеточные ловушки при остром повреждении легких, связанном с переливанием крови. Джей Клин Инвест. 2012;122:2661-2671. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Furman MI, Barnard MR, Krueger LA, Fox ML, Shilale EA, Lessard DM, et al.
Циркулирующие моноцитарно-тромбоцитарные агрегаты являются ранним маркером острого инфаркта миокарда.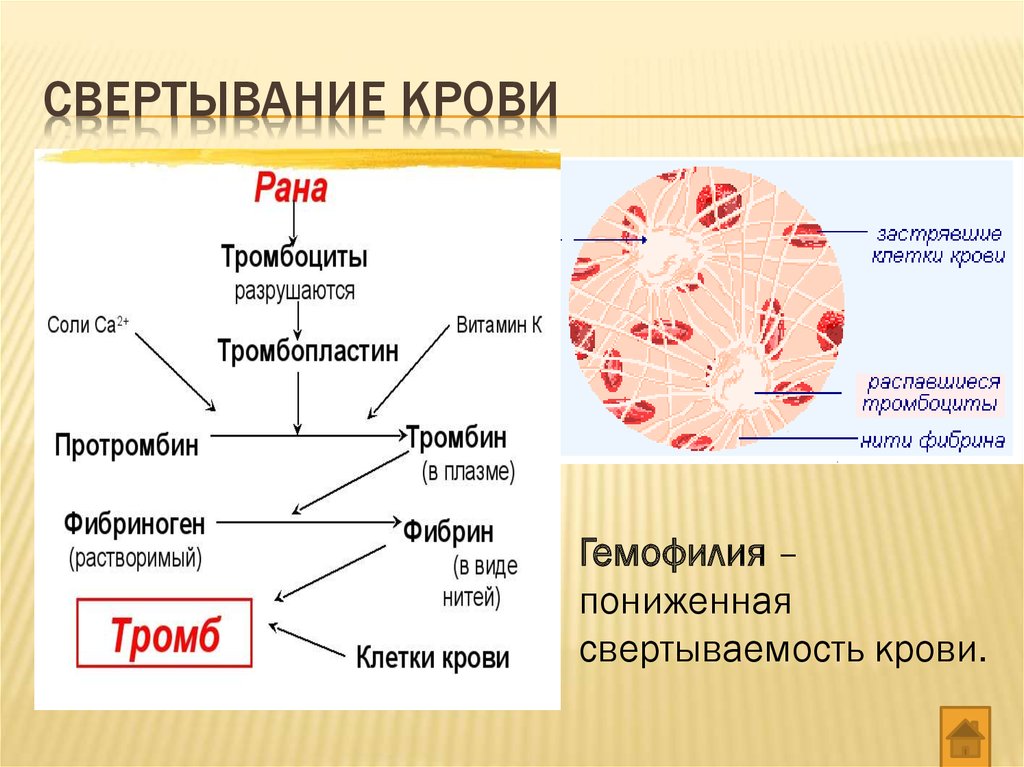 J Am Coll Кардиол.
2001; 38:1002-1006. [PubMed] [Академия Google]
J Am Coll Кардиол.
2001; 38:1002-1006. [PubMed] [Академия Google]
57. Огура Х., Кавасаки Т., Танака Х., Кох Т., Танака Р., Озеки Ю. и др. Активированные тромбоциты усиливают образование микрочастиц и взаимодействие тромбоцитов с лейкоцитами при тяжелой травме и сепсисе. J Травма. 2001;50:801-809. [PubMed] [Google Scholar]
58. Блэр П., Флауменхафт Р. Альфа-гранулы тромбоцитов: основная биология и клинические корреляты. Кровь Преподобный. 2009; 23:177-189. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16.4A: Тромбоциты — Медицина LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 7795
Тромбоциты, также называемые тромбоцитами, представляют собой связанные с мембраной клеточные фрагменты, необходимые для образования сгустков во время заживления ран.![]()
Цели обучения
- Обсудить роль тромбоцитов в крови
Ключевые моменты
- Тромбоциты, также называемые тромбоцитами, образуются из мегакариоцитов, которые образуются из стволовых клеток костного мозга.
- Тромбоциты циркулируют в крови и участвуют в гемостазе, приводя к образованию тромбов и свертыванию крови.
- Тромбоциты лишены ядра, но содержат некоторые органеллы, такие как митохондрии и фрагменты эндоплазматического ретикулума.
- Если количество тромбоцитов в крови слишком низкое, может возникнуть обильное кровотечение. Однако, если количество тромбоцитов слишком велико, могут образовываться тромбы (тромбоз), которые могут закупоривать кровеносные сосуды.
- Тромбоциты являются естественным источником факторов роста, участвующих в заживлении ран, коагулянтов и медиаторов воспаления.
Ключевые термины
- внеклеточный матрикс : Все соединительные ткани и волокна, которые не являются частью клетки, но обеспечивают поддержку.

- тромбоциты : Маленькая бесцветная дискообразная частица, обнаруженная в крови млекопитающих. Он играет важную роль в образовании тромбов.
Тромбоциты, также называемые тромбоцитами, представляют собой связанные с мембраной клеточные фрагменты, полученные в результате фрагментации более крупных клеток-предшественников, называемых мегакариоцитами, которые происходят из стволовых клеток костного мозга. Тромбоциты важны для процесса свертывания крови, что делает их необходимыми для заживления ран.
Структура и распределение тромбоцитов
Тромбоциты имеют неправильную форму, не имеют ядра и обычно имеют диаметр всего 2–3 микрометра. Тромбоциты не являются настоящими клетками, а вместо этого классифицируются как клеточные фрагменты, продуцируемые мегакариоцитами. Поскольку у них нет ядра, они не содержат ядерной ДНК. Однако они содержат митохондрии и митохондриальную ДНК, а также фрагменты и гранулы эндоплазматического ретикулума из родительских клеток мегакариоцитов. Тромбоциты также содержат адгезивные белки, которые позволяют им прикрепляться к фибриновой сетке и эндотелию сосудов, а также к скелету микротрубочек и микрофиламентов, который расширяется в филаменты во время активации тромбоцитов. Менее 1% цельной крови состоит из тромбоцитов. Они составляют около 1/10 -го до 1/20 -го так же много, как лейкоцитов.
Тромбоциты также содержат адгезивные белки, которые позволяют им прикрепляться к фибриновой сетке и эндотелию сосудов, а также к скелету микротрубочек и микрофиламентов, который расширяется в филаменты во время активации тромбоцитов. Менее 1% цельной крови состоит из тромбоцитов. Они составляют около 1/10 -го до 1/20 -го так же много, как лейкоцитов.
Тромбоциты : Изображение под световым микроскопом (40×) мазка периферической крови, окруженного эритроцитами. Один тромбоцит можно увидеть в верхней левой части изображения (фиолетовый), он значительно меньше по размеру, чем эритроциты (окрашены розовым) и два крупных нейтрофила (окрашены фиолетовым).
Функции тромбоцитов
Тромбоциты циркулируют в плазме крови и в первую очередь участвуют в гемостазе (остановке потока крови во время травмы), вызывая образование тромбов, также известное как коагуляция. Адгезивные поверхностные белки тромбоцитов позволяют им накапливаться на фибриновой сетке в месте повреждения, образуя тромбоцитарную пробку, которая свертывает кровь.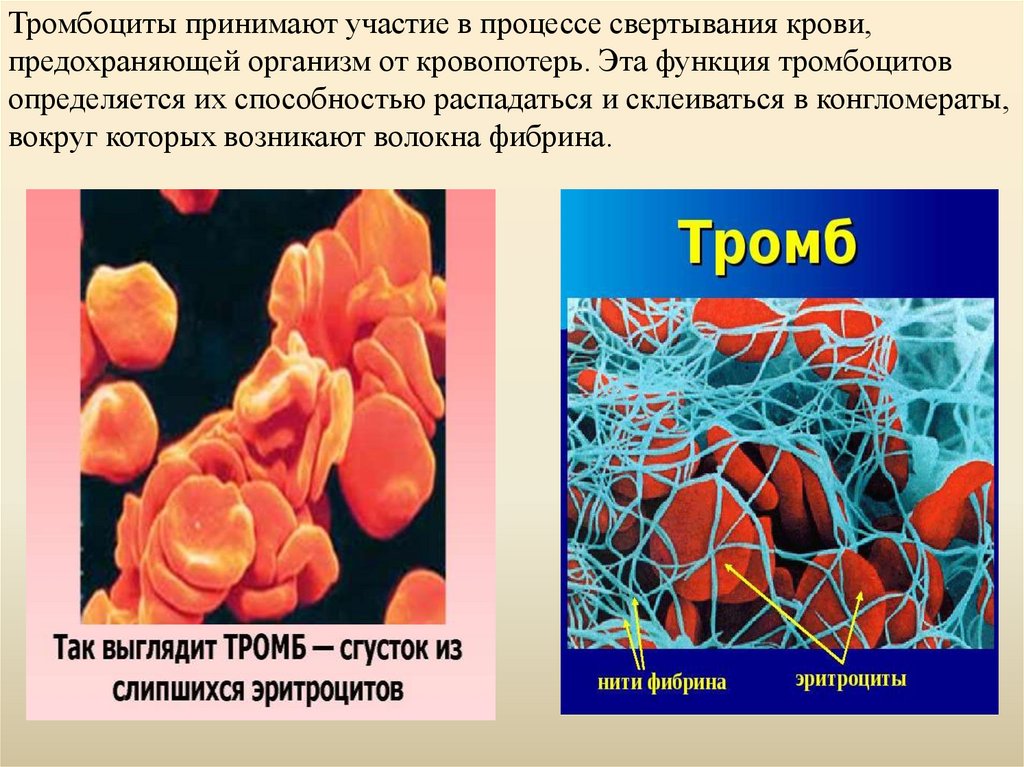 Сложный процесс заживления раны может начаться только после того, как тромб перестанет кровоточить.
Сложный процесс заживления раны может начаться только после того, как тромб перестанет кровоточить.
Тромбоциты выделяют множество факторов, участвующих в коагуляции и заживлении ран. Во время коагуляции они высвобождают факторы, повышающие локальную агрегацию тромбоцитов (тромбоксан А), опосредующие воспаление (серотонин) и способствующие свертыванию крови за счет повышения уровня тромбина и фибрина (тромбопластин). Они также высвобождают факторы роста, связанные с заживлением ран, включая фактор роста тромбоцитов (PDGF), который направляет движение клеток; TGF бета, который стимулирует отложение ткани внеклеточного матрикса в рану во время заживления; и фактор роста эндотелия сосудов (VEGF), который стимулирует ангиогенез или повторный рост кровеносных сосудов. Эти факторы роста играют важную роль в восстановлении и регенерации соединительной ткани. Местное применение этих продуцируемых тромбоцитами факторов, связанных с заживлением, в повышенных концентрациях использовалось в качестве дополнения к заживлению ран в течение нескольких десятилетий.

Leave A Comment