Пропанол-2, химические свойства, получение, Ch4-CH(OH)-Ch4, Ch4CHOHCh4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Пропанол-2: химические свойства и получение
Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
CH3-CHOH-CH3
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.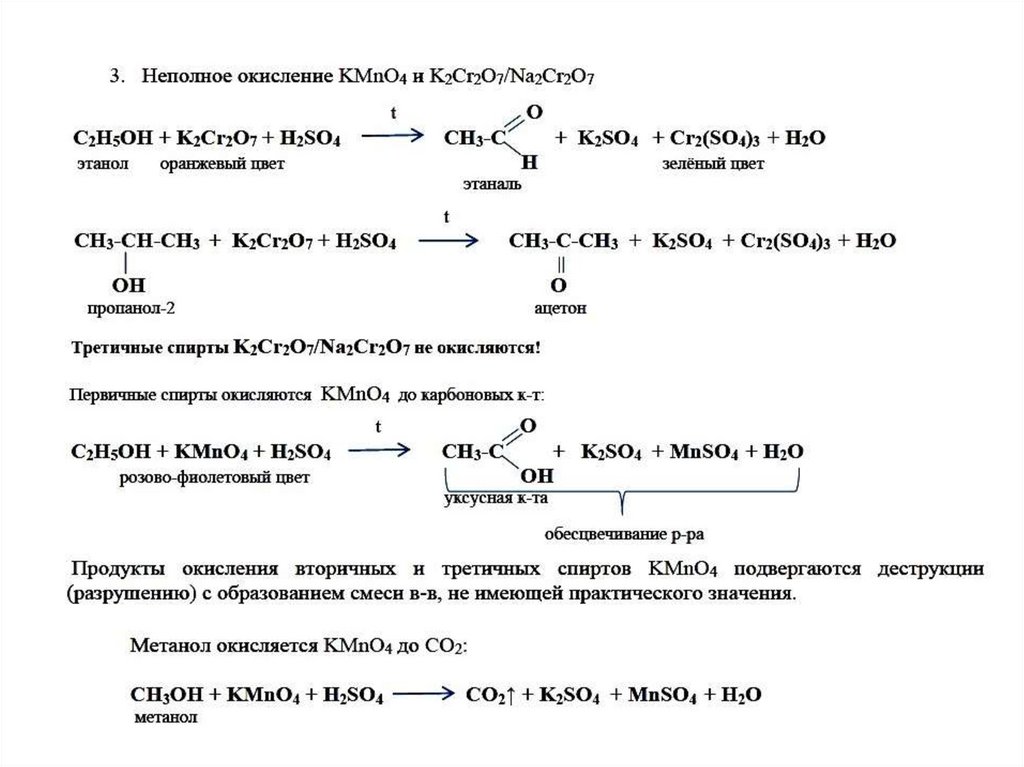 |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92оС).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле.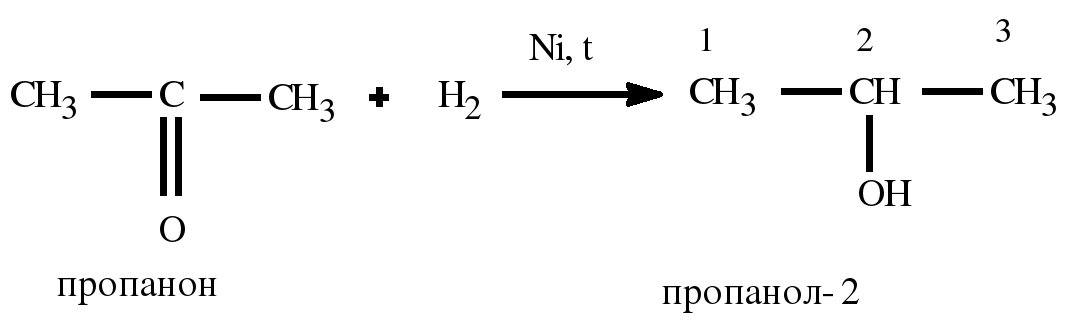 Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.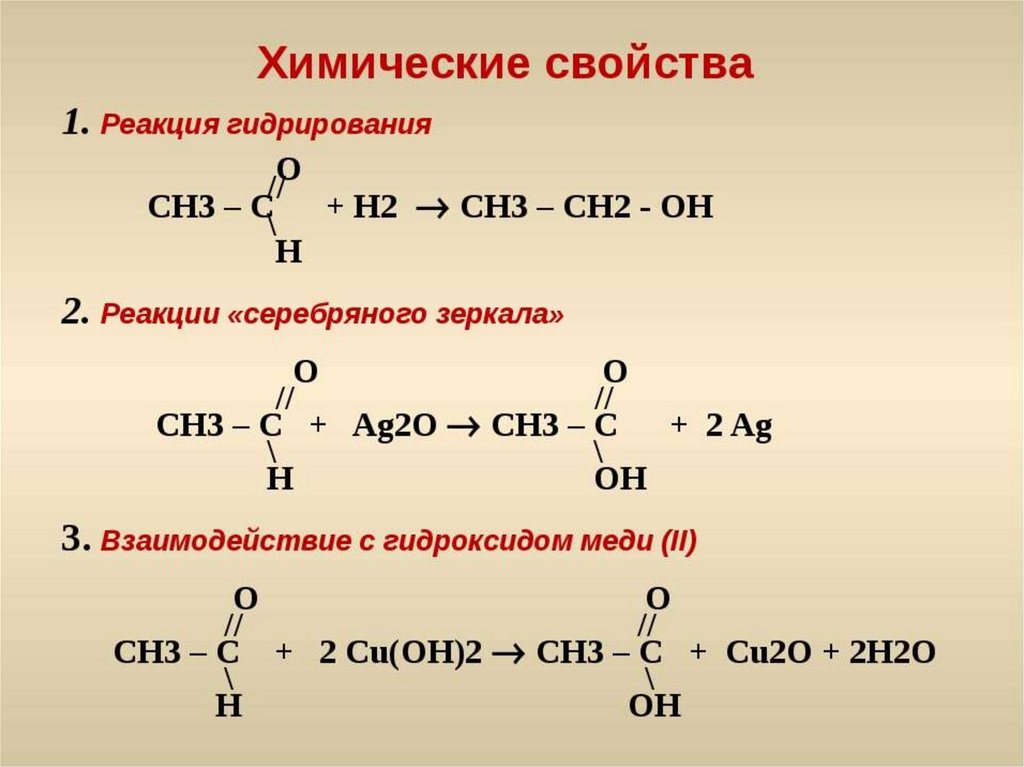
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.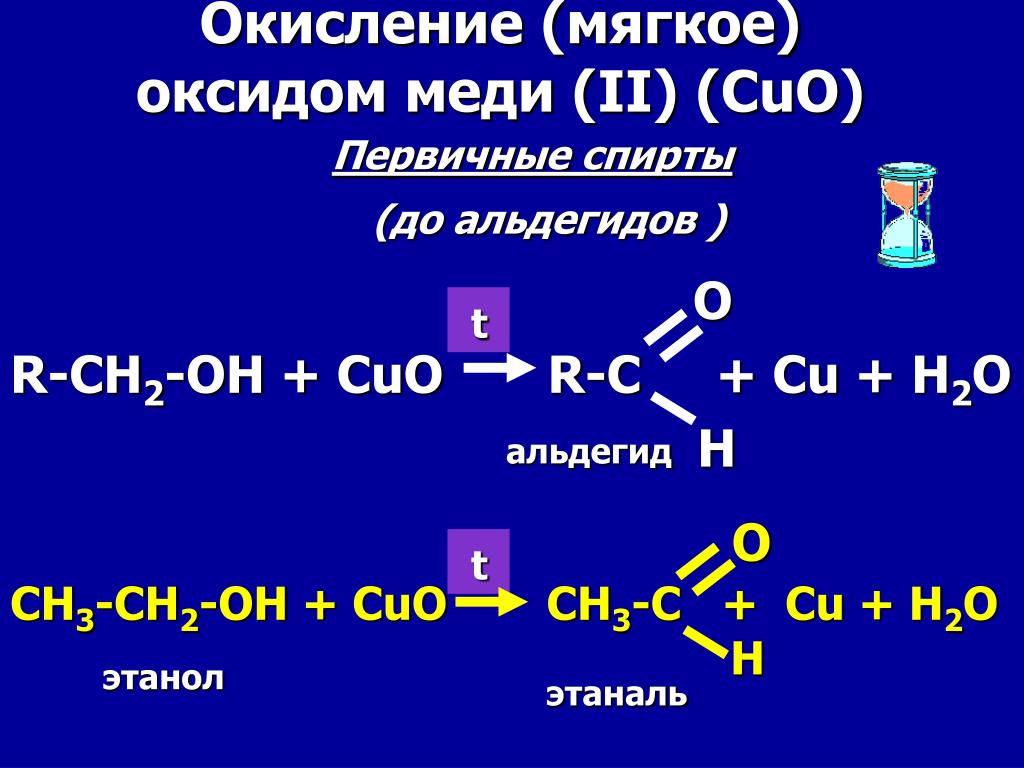 |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода. |
2СН3–CHOH–CH3 + 2K → 2СН3–CHOK–CH3 + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.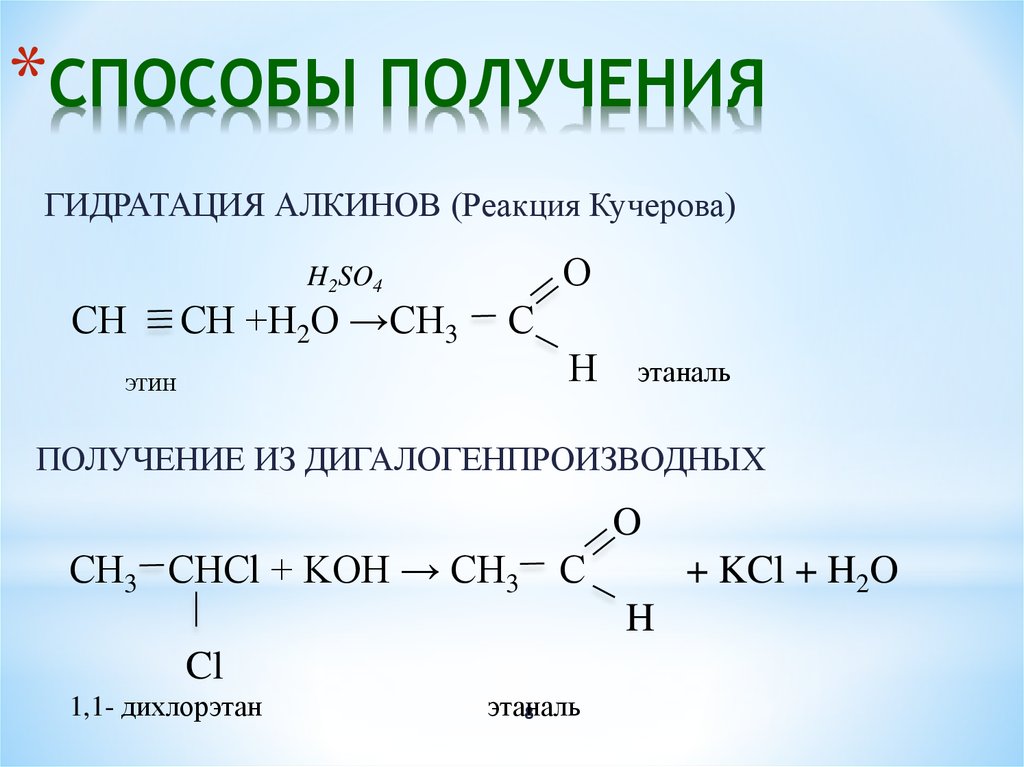
| Например, изопропилат калия разлагается водой: |
СН3–CHOK–CH3 + H2O → СН3–CHOH–CH3 + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
СН3–CHOH–CH3 + HBr → СН3–CHBr–CH3 + H2O
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
СН3–CHOH–CH3 + NH3 → СН3–CHNH2–CH3 + H2O
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
СН3–CHOH–CH3 + СH3COOH → СH3COO–CH(CH3)2 + H2O
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
СН3–CHOH–CH3 → СH3–CH=CH2 + H2O
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
2СН3–CHOH–CH3 → (СН3)2CH–O–СH(CH3)2 + H2O
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
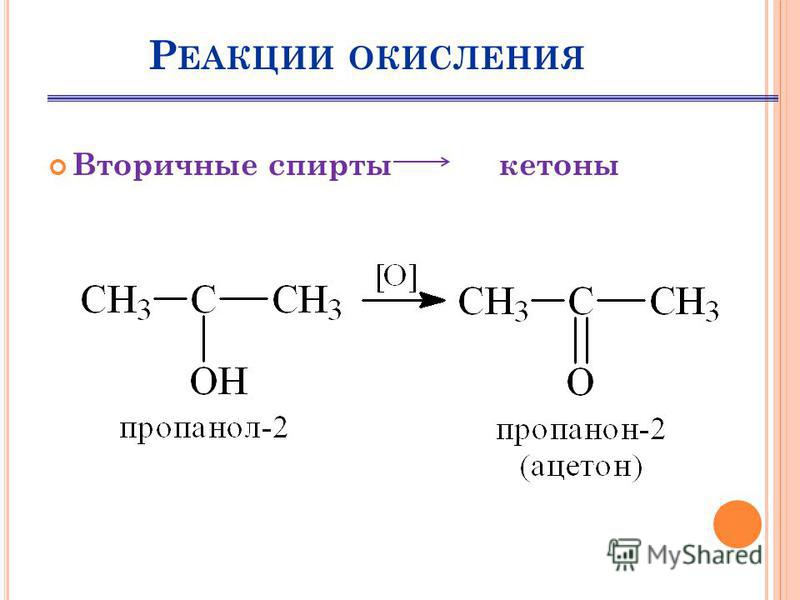
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.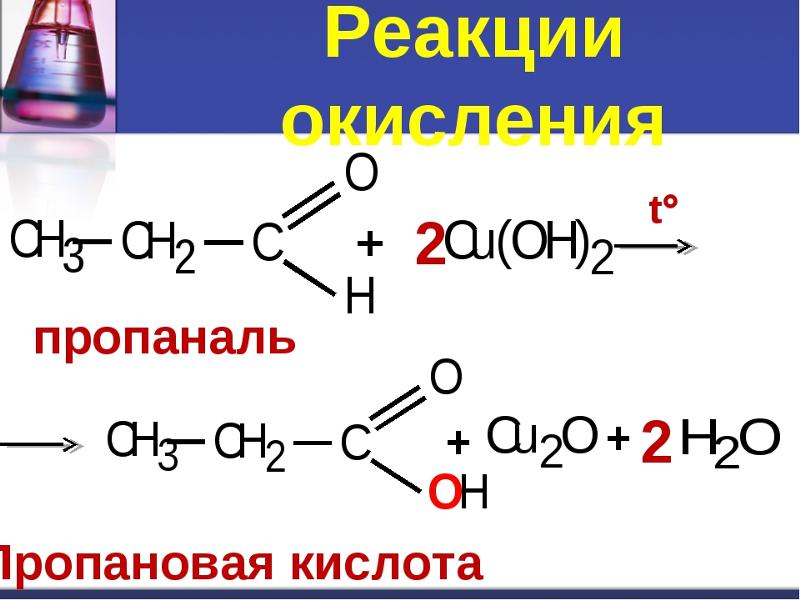
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания пропанола-2: |
2C3H7OH + 9O2 = 6CO2 + 8H2O
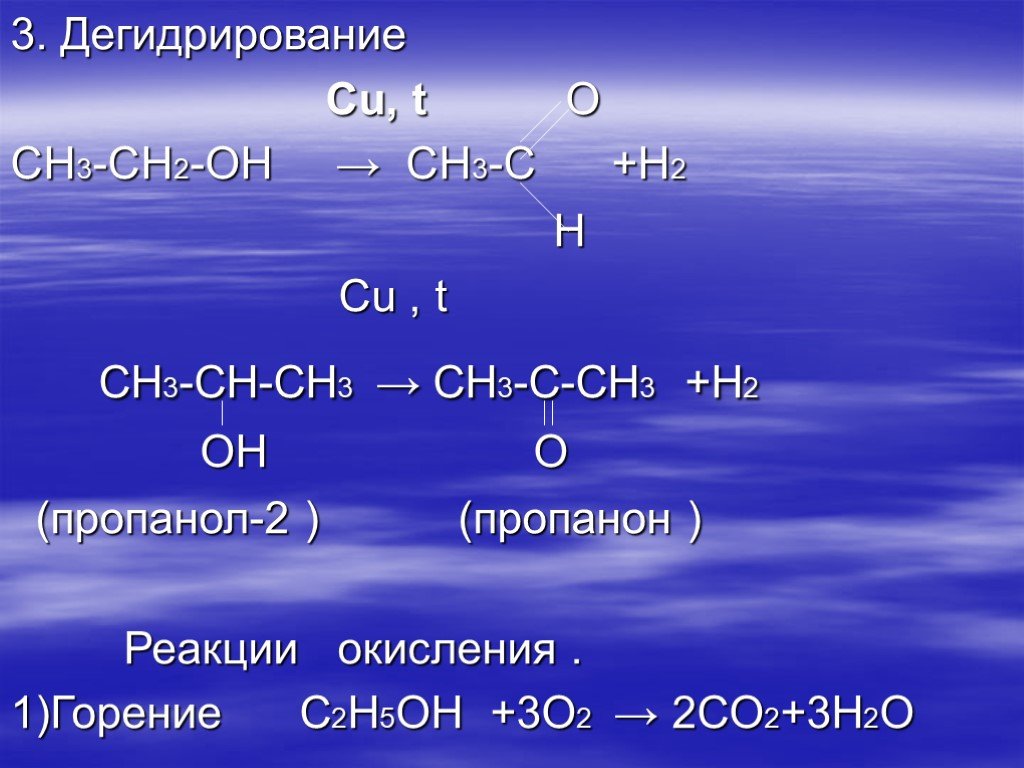
5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
Например, при дегидрировании пропанола-2 образуется ацетон.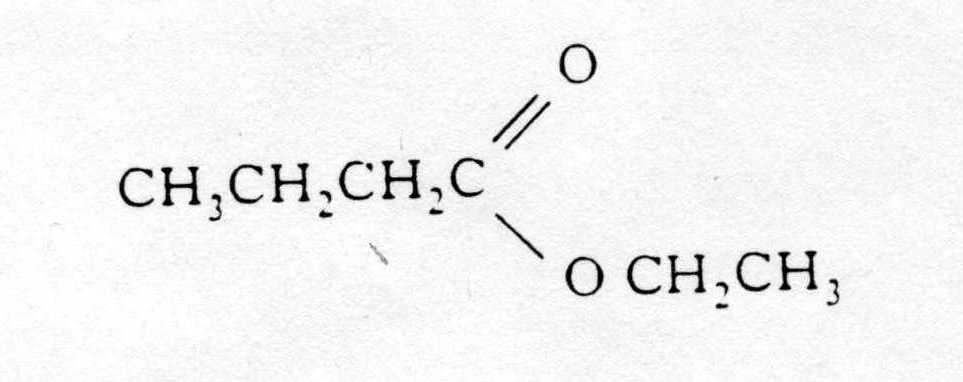 |
СН3–CHOH–CH3 → СН3–CO–CH3 + H2
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl–CH3 + NaOH → СН3–CHOH–CH3 + NaCl
2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
3.
 Гидратация алкенов
Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
Понравилось это:
Нравится Загрузка…
25.17: Реакции окисления — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 54010
Бензойная кислота широко используется в качестве пищевого консерванта либо в виде карбоновой кислоты, либо в виде соли бензоата натрия.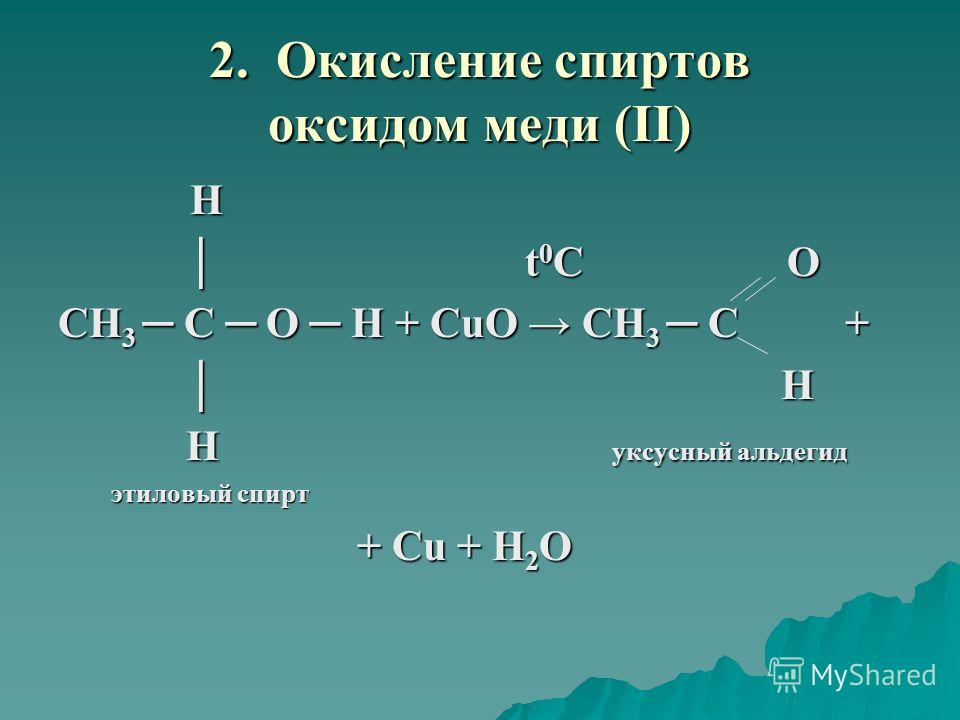 Это соединение наиболее эффективно при добавлении в кислые продукты, такие как фруктовые соки и безалкогольные напитки. Основным промышленным источником бензойной кислоты является частичное окисление толуола кислородом. Процесс недорогой и экологически безопасный.
Это соединение наиболее эффективно при добавлении в кислые продукты, такие как фруктовые соки и безалкогольные напитки. Основным промышленным источником бензойной кислоты является частичное окисление толуола кислородом. Процесс недорогой и экологически безопасный.
Реакции окисления
Окисление можно определить как присоединение кислорода к молекуле или удаление водорода из молекулы. Когда алкан нагревают в присутствии соответствующего катализатора, он может быть окислен до соответствующего алкена в реакции, называемой реакцией дегидрирования. При этом удаляются два атома водорода. Алкен может быть дополнительно окислен до алкина путем удаления еще двух атомов водорода:
\[\text{окисление:} \: \: \ce{CH_3CH_3} \overset{\ce{-H_2}}{\rightarrow } \ce{CH_2=CH_2} \overset{\ce{-H_2}}{\rightarrow} \ce{CH \equiv CH}\nonumber \]
Реакции обратимы, поэтому алкин может быть восстановлен сначала до алкена, а затем до алкана:
\[\text{reduction:} \: \: \ce{CH \equiv CH} \overset{ \ce{_H_2}}{\rightarrow} \ce{CH_2=CH_2} \overset{\ce{+H_2}}{\rightarrow} \ce{CH_3CH_3}\nonumber \]
Алкан является наиболее восстановленной формой углеводород, в то время как алкин является наиболее окисленной формой.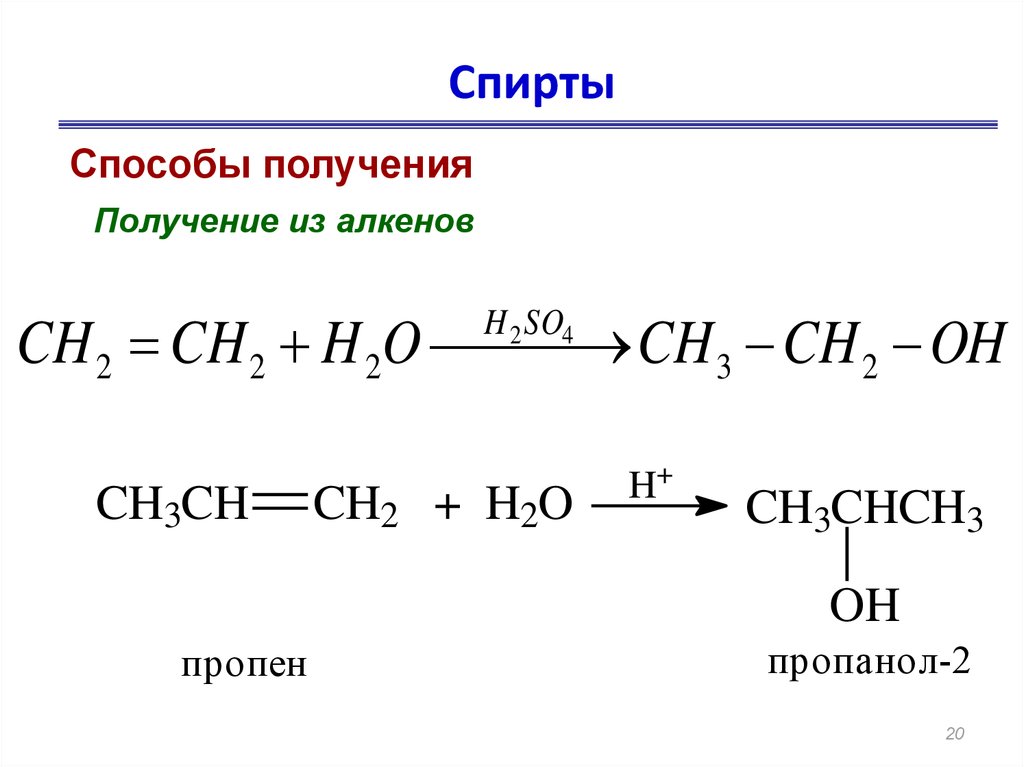
Реакции окисления в органической химии часто включают добавление кислорода к соединению, которое изменяет конкретную функциональную группу этого соединения. Следующая последовательность показывает, как метан может быть окислен сначала до метанола, затем до метаналя, затем до метановой кислоты и, наконец, до диоксида углерода.
\[\begin{array}{ccccccccc} \ce{CH_4} & \overset{\text{прирост кислорода}}{\longrightarrow} & \ce{CH_3OH} & \overset{\text{потеря водорода} }{\longrightarrow} & \ce{CH_2O} & \overset{\text{прирост кислорода}}{\longrightarrow} & \ce{HCOOH} & \overset{\text{потеря водорода}}{\longrightarrow} & \ce{CO_2} \\ \text{метан} & & \text{метанол} & & \text{метаналь} & & \text{метановая кислота} & & \text{углекислый газ} \end{array}\nonumber \ ]
На каждом этапе процесса происходит либо получение кислорода, либо потеря водорода. Каждый шаг также высвобождает энергию, что объясняет, почему полное сгорание алканов до углекислого газа является чрезвычайно экзотермической реакцией. {2-}}}{\стрелка вправо}} \ce{CH_3COOH}\nonumber \]
{2-}}}{\стрелка вправо}} \ce{CH_3COOH}\nonumber \]
Напитки, содержащие этанол, такие как вино, подвержены такому окислению, если хранить их в течение длительного периода времени после того, как они были открыты и подвергнуты воздействию воздуха. Окислившееся вино будет иметь неприятный уксусный вкус из-за образования уксусной кислоты.
В отличие от альдегидов, кетоны устойчивы к дальнейшему окислению, поскольку карбонильная группа находится в середине углеродной цепи, поэтому кетон не может быть преобразован в карбоновую кислоту.
Сводка
- Окисление можно определить как присоединение кислорода к молекуле или удаление водорода из молекулы.
- Первичные спирты могут быть окислены до альдегидов, а затем дополнительно окислены до карбоновых кислот.
- Когда окисляемый спирт представляет собой вторичный спирт, продуктом окисления является кетон, а не альдегид.
- Третичные спирты не окисляются.
Эта страница под названием 25.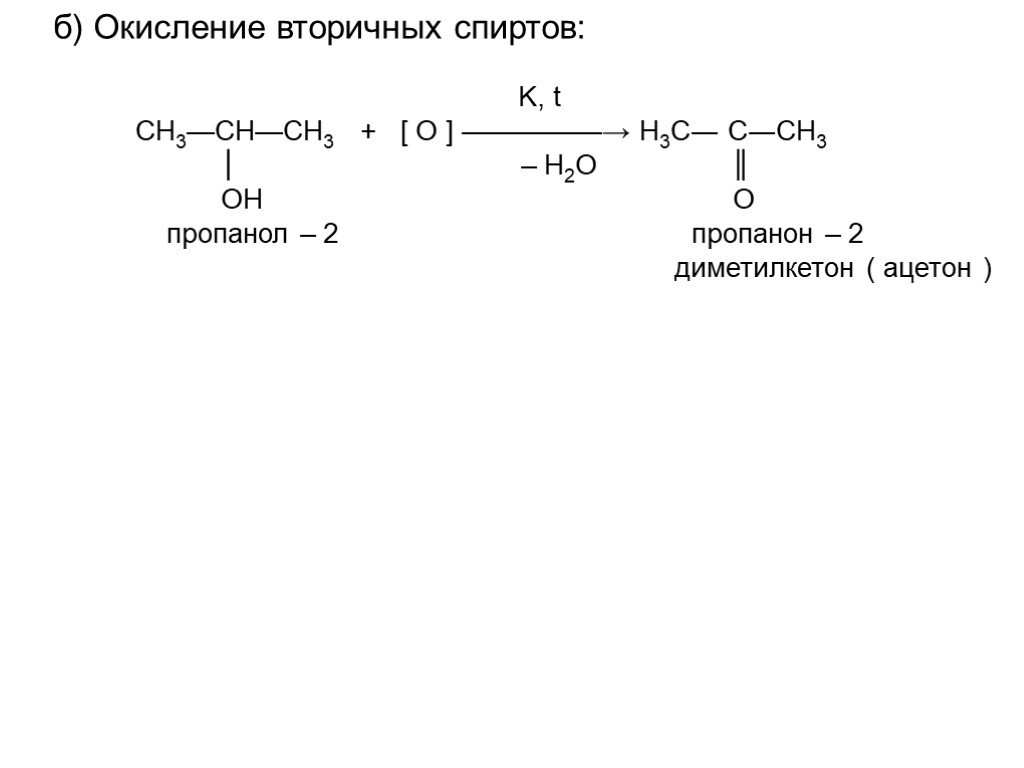 17: Oxidation Reactions распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
17: Oxidation Reactions распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/


 Перейдите по этой ссылке, если вы еще не сталкивались с этими соединениями.
Перейдите по этой ссылке, если вы еще не сталкивались с этими соединениями.
 Для этого кислород от окислителя представлен как [O]. Это привело бы к гораздо более простому уравнению:
Для этого кислород от окислителя представлен как [O]. Это привело бы к гораздо более простому уравнению:

 Третичный спирт не меняет цвет.
Третичный спирт не меняет цвет. Реактив Шиффа специально не упоминается ни в одной из учебных программ Великобритании, но я всегда им пользовался.
Реактив Шиффа специально не упоминается ни в одной из учебных программ Великобритании, но я всегда им пользовался.
Leave A Comment