Тест по теме «Железо» | Методическая разработка по химии (11 класс) на тему:
Вариант №1
- Для железа нехарактерна степень окисления
1) | + 6 | 2) | + 2 | 3) | + 3 | 4) | + 5 |
- При обычных условиях практически осуществима реакция между железом и
1) | серой (кр.) |
2) | серной кислотой (конц.) |
3) | нитратом цинка (р-р) |
4) | нитратом меди (II) (р-р) |
3.В схеме превращений
FeCl2 X1 X2
веществом «X2» является
1) | FeO | 2) | Fe(OH)3 | 3) | FeCl2 | 4) | FeCl3 |
4. Обнаружить в растворе ион Fe +2можно с помощью
Обнаружить в растворе ион Fe +2можно с помощью
1) | Гидроксида натрия |
2) | Роданида калия |
3) | Жёлтой кровяной соли |
4) | нитрата меди (II) |
5. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | ||
А) | Fe+ Cl2 | 1) | Fe2(SO4)3 + SO2 + h3O |
Б) | Fe + HCl | 2) | Хлорид железа (II) |
В) | Fe + h3SO4 (разбавл.) | 3) | FeSO4 + h3 |
Г) | Fe + h3SO4 (конц.) | 4) | Хлорид железа (III) |
5) FeSO4+ SO2 + h3O
6) FeCl3+ h3
Вариант №2
- Для железа характерна степень окисления
1) | + 7 | 2) | + 2 | 3) | + 4 | 4) | + 1 |
2. При сильном нагревании практически осуществима реакция между железом и
При сильном нагревании практически осуществима реакция между железом и
1) | нитратом меди (II) (р-р) |
2) | серной кислотой (р-р) |
3) | нитратом цинка (р-р) |
4) | Водой |
- В схеме превращений
FeCl3 X1 X2 Fe(OH)3
веществами «Х1» и «Х2» могут быть соответственно
1) | Fe2(SO4)3 и Fe2O3 |
2) | FePO4 и Fe3O4 |
3) | Fe(NO3)3 и Fe2O3 |
4) | Fe(OH)3 и Fe2(SO4)3 |
4.Обнаружить в растворе ион Fe +3можно с помощью
1) | Гидроксида натрия |
2) | Роданида калия |
3) | Красной кровяной соли |
4) | нитрата меди (II) |
5.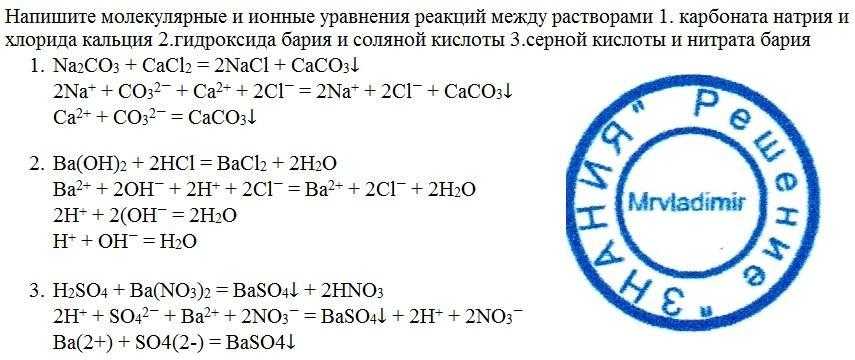 Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | ||
А) | Fe+ S | 1) | FeCl3 |
Б) | Fe + HCl | 2) | FeS |
В) | Fe + HNO3 (разбавл.) | 3) | Fe (NO3)2 + NO + h3O |
Г) | Fe + CI2= | 4) | FeCl2 + h3 |
5) FeCl3+ h3
6) Fe (NO3)2+ h3
Вариант №3
- Для железа характерна степень окисления
1) | + 3 | 2) | + 1 | 3) | + 4 | 4) | + 7 |
- При обычных условиях практически неосуществима реакция между железом и
1) | серой (кр. |
2) | Азотной кислотой (конц.) |
3) | нитратом цинка (р-р) |
4) | нитратом меди (II) (р-р) |
- В схеме превращений
Fe(OH)3 X1 X2
веществом «X2» является
1) | Fe2O3 | 2) | FeO | 3) | FeCl3 | 4) | FeCl2 |
4.Обнаружить в растворе ион Fe +3можно с помощью
1) | Гидроксида натрия |
2) | Роданида калия |
3) | Жёлтой кровяной соли |
4) | нитрата меди (II) |
5.Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | ||
А) | Fe+ Cl2 | 1) | Fe3O4 |
Б) | Fe + HCl | 2) | Fe2O3 |
В) | Fe + O2 | 3) | Fe2(SO4)3 + SO2 + h3O |
Г) | Fe + h3SO4 (конц.) | 4) | FeCl2 + h3 |
5) | FeCl3 + h3 | ||
6) | FeCl3 |
Вариант №4
- Для железа не характерна степень окисления
1) | + 5 | 2) | + 2 | 3) | +3 | 4) | +6 |
- При обычных условиях практически осуществима реакция между железом и
1) | серой (кр. |
2) | Гидроксидом натрия |
3) | Серной кислотой (конц.) |
4) | медью |
- В схеме превращений
Fe(OH)3 X1 FeCl3
веществом «X1» является
1) | Fe2O3 | 2) | FeO | 3) | FeCl2 | 4) | Fe3O4 |
4.Обнаружить в растворе ион Fe +3можно с помощью
1) | Гидроксида натрия |
2) | Гидроксида бария |
3) | Жёлтой кровяной соли |
4) | Красной кровяной соли |
5.Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ | ||
А) | Fe+ Cl2 | 1) | Fe3O4 |
Б) | Fe + S | 2) | Fe O |
В) | Fe + O2 | 3) | Fe2S3 |
Г) | Fe (OH)2 | 4) | FeCl2 + h3 |
5) | FeS | ||
6) | FeCl3 |
тест по химии 11 класс- «Металлы»
При взаимодействии каких веществ водород не выделяется?
1) Zn и h3SO4(разб. ) 2) Al и NaOH(конц.)
) 2) Al и NaOH(конц.)
3) Cu и HNO3(конц.) 4) Zn и NaOH(конц.)
В результате реакции кальция с водой образуются
1) СaO и h3 2) Ca(OH)2 и h3 3) Cah3 и O2 4) Ca(OH)2 и O2
С водой при комнатной температуре взаимодействует каждый из двух оксидов:
1) Fe2O3 и MgO 2) CuО и СаО 3) Na2О и СаО 4) Al2O3 и ВеО
При нагревании медь реагирует с
1) водородом 2) сероводородной кислотой
3) разбавленной серной кислотой 4) концентрированной серной кислотой
Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag 3) Hg 4) Au
Гидроксид кальция реагирует с каждым из двух веществ:
1) HCl и CO2 2) HNO3 и MgO 3) НCl и KOH 4) BaCl2 и NaOH
Гидроксид цинка может реагировать со всеми веществами пары
1) сульфат кальция, оксид серы (VI) 2) гидроксид натрия (р-р), соляная кислота
3) вода, хлорид натрия 4) сульфат бария, гидроксид железа (III)
В схеме превращений FeCl3→X1FeCl2→X2FeCl3 веществами «Х1» и «Х2» могут быть соответственно
1) h3 и HCl 2) HCl и NaCl 3) HCl и Cl2 4) Fe и Cl2
С разбавленной соляной кислотой при обычных условиях не взаимодействует
1) Cu(OH)2 2) CuO 3) Cu 4) CuCO3
Водород не вытесняется из кислот
1) хромом 2) железом 3) медью 4) цинком
При обычных условиях практически осуществима реакция между медью и
1) водой 2) нитратом ртути(II)(р-р) 3) сульфатом алюминия(р-р) 4) соляной кислотой(разб. )
)
При обычной температуре медь реагирует с
1) водой 2) кислородом 3) хлороводородной кислотой 4) азотной кислотой
С водой при комнатной температуре реагирует каждый из двух металлов:
1) барий и медь 2) алюминий и ртуть 3) кальций и литий 4) натрий и серебро
С гидроксидом натрия реагирует:
1) хлорид лития 2) сульфат натрия 3) нитрат меди (II) 4) оксид серы (IV)
5) хлор 6) оксид меди (II) 7) серная кислота
Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими 2) основными 3) амфотерными 4) кислотными
Верны ли следующие суждения о свойствах оксида хрома (III)?
А. Оксид хрома (III) проявляет амфотерные свойства.
Б. Оксид хрома (III) проявляет только восстановительные свойства.
Оксид хрома (III) проявляет только восстановительные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
При взаимодействии кальция с водой образуются(-ется)
1) Ca(OH)2 и h3 2) CaO и h3 3) Ca(OH)2 4) CaO и Н2О2
Оксид цинка взаимодействует с каждым из двух веществ:
1) NaOH и Cu(OH)2 2) Al(OH)3 и h3O 3) KOH и HNO3 4) K2SO4 и P2O5
При комнатной температуре хром взаимодействует с
1) HCl (разб.) 2) h3O 3) h3SO4 (разб.) 4) N2 5) h3
Установите соответствие между исходными веществами и продуктами их взаимодействия.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe+ Cl2 → 1) FeSO4 + h3
Б) Fe + HCl → 2) Fe2(SO4)3 + h3
В) Fe + h3SO4 (разбавл. ) → 3) Fe2(SO4)3 + SO2 + h3O
) → 3) Fe2(SO4)3 + SO2 + h3O
Г)Fe + h3SO4 (конц.) 4) FeCl2 + h3
5) FeCl3 + h3
6) FeCl3
При взаимодействии меди с концентрированной серной кислотой образуются:
1) сульфат меди (II), оксид серы (IV), вода 2) сульфат меди (II), вода
3) оксид меди (II), оксид серы (IV), вода 4) сульфат меди (I), вода, оксид серы (IV)
Гидроксид алюминия взаимодействует с каждым из двух веществ:
1) HNO3 и NaCl 2) HCl и LiOH 3) KOH и Na2SO4 4) NaOH и CaCl2
Амфотерным оксидом является
1) NO 2) Fe2O3 3) СаO 4) SO2
Медь не взаимодействует с
1) разбавленной HNO3 2) концентрированной HNO3
3) разбавленной HCl 4) концентрированной h3SO4
Цинк вытесняет каждый из перечисленных металлов из растворов их солей:
1) Mg, Al, Na 2) Ca, Cu, Ag 3) Fe, Cu, Ag 4) Mg, Ba, Ag
В водном растворе протекает реакция между
1) Cu и ZnCl2 2) Zn и CuSO4 3) Fe и Al(NO3)3 4) Ag и FeSO4
Установите соответствие между реагирующими веществами и продуктами реакции.

РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al и KOH(р-р) 1) гидроксид алюминия и сера
Б) Al и h3SO4(разб.) 2) гидроксид алюминия и сероводород
В) Al2S3 и h3O 3) тетрагидроксоалюминат калия и водород
Г) Al и h3O 4) сульфат алюминия и водород
5) алюминат калия и оксид алюминия
6) гидроксид алюминия и водород
При взаимодействии хрома с соляной кислотой образуются
1) CrCl2 и Н2 2) CrCl3 и Н2О 3) CrCl2 и Н2О 4) CrCl3 и Н2
Оксид алюминия взаимодействует с каждым из двух веществ:
1) NO и CO2 2) Cu(OH)2 и CuO 3) Na2O и NaOH 4) KCl и HCl
Только при высокой температуре с водой реагирует
1) K 2) Zn 3) Ag 4) Sr
В реакцию с оксидом цинка вступает каждое из двух веществ:
1) О2 и SO3 2) h3 и h3S 3) Na2O и HCl 4) CuO и NaCl
Установите соответствие между исходными веществами и продуктами реакции.

ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe + Cl2 1) FeCl2
Б) Fe + HCl 2) FeCl3
В) FeO + HCl 3) FeCl2 + h3
Г) Fe2O3 + HCl 4) FeCl3 + h3
5) FeCl2 + h3O
6) FeCl3 + h3O
К оснóвным оксидам не относится
1) Mn2O7 2) MgO 3) Ag2O 4) CaO
Установите соответствие между реагирующими веществами и продуктами реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Cu и HNO3(разб.) 1) сульфат меди(II), оксид серы(IV) и вода
Б) CuS и O2 2) нитрат меди(II), оксид азота(II) и вода
В) Cu и HNO3(конц.) 3) сульфит меди(II), оксид серы(VI) и вода
Г) Cu и h3SO4(конц.) 4) оксид меди(II) и оксид серы(IV)
5) нитрат меди(II), оксид азота(IV) и вода
6) оксид меди(II) и оксид серы(VI)
При взаимодействии концентрированной серной кислоты с медью при нагревании образуется
1) сера 2) водород 3) оксид серы(IV) 4) оксид серы(VI)
Алюминий может реагировать с
1) сульфатом магния 2) хлоридом натрия 3) нитратом кальция 4) гидроксидом натрия
Установите соответствие между реагирующими веществами и продуктами их взаимодействия.

РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) Zn(OH)2+KOH→сплавл.to 1) Zn(NO3)2 + h3
Б) Zn(OH)2 + KOH(р-р) 2) Zn(NO3)2 + h3O
В) Zn(OH)2 + HNO3 3) K2ZnO2+ h3O
Г) Zn(OH)2 → 4) K2[Zn(OH)4]
5) ZnO + h3
6) ZnO + h3O
Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия 2) хлорида кальция 3) нитрата цинка 4) азотной кислоты
В схеме превращений ZnO → X1 → X2 → Zn(OH)2 веществами «Х1» и «Х2» могут быть соответственно
1) ZnS и ZnSO4 2) ZnSO4 и ZnCl2 3) Zn(OH)2 и Zn 4) ZnCO3 и Zn3(PO4)2
Цинк взаимодействует с раствором
1) CuSO4 2) MgCl2 3) Na2SO4 4) CaCl2
В схеме превращений Ва → X1 → X2 → Ва(NO3)2 веществами Х1 и Х2 являются соответственно
1) Ва(OH)2 и ВаCl2 2) Ва(OH)2 и ВаSO4 3) ВаCl2 и ВаSO4 4) ВаCl2 и ВаO
Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
В схеме превращений
веществом «X» является
1) CuO 2) Cu 3) Cu(OH)2 4) CuCl2
С водой без нагревания реагирует
1) цинк 2) медь 3) железо 4) литий
Оксид кальция взаимодействует с каждым из двух веществ:
1) HCl и h3O 2) Cu и CuCl2 3) NaOH и h3O 4) MgO и MgSO4
Степень окисления хрома в его амфотерных соединениях равна
1) + 6 2) + 2 3) + 3 4) + 1
Медь взаимодействует с каждым из двух веществ:
1) h3SO4(конц. ) и Cl2 2) NaOH и ZnCl2
) и Cl2 2) NaOH и ZnCl2
3) h3SO4(разб.) и Nh4 4) HCl(разб.) и Ca(NO3)2
Водород образуется при взаимодействии
1) Н2SO4(конц.) и Cu 2) HNO3(конц.) и Mg
3) Н2SO4(разб.) и Zn 4) HNO3(разб.) и Ag
С гидроксидом алюминия взаимодействует каждое из двух веществ:
1) h4PO4 и CuS 2) KNO3 и SiO2
3) NaCl и Na2CO3 4) HNO3 и Ba(OH)2
Оксид лития взаимодействует с
1) СО 2) СО2 3) NO 4) CaO
С гидроксидом калия взаимодействует каждое из двух веществ:
1) HNO3 и CO2 2) MgO и h3SO4
3) SO2 и K2SO4 4) Al2O3 и NaOH
Среди перечисленных веществ:
А) Na2O Б) Сr2O3 В) CaO Г) Al2O3 Д) Rb2O Е) ZnO
к оснóвным оксидам относят:
1) АВД 2) АВЕ 3) БГЕ 4) ВГЕ
Взаимодействие натрия с водой относится к реакциям
1) соединения 2) замещения 3) обмена 4) разложения
При сплавлении алюминия с гидроксидом натрия образуется
1) NaAlO2 2) Alh4 3) Na[Al(OH)4] 4) Al2O3
При прокаливании Cr(OН)3 образуется вода и
1) oксид хрома (II) 2) oксид хрома (III) 3) oксид хрома (IV) 4) хром
Оксид кальция взаимодействует с каждым из трех веществ:
1) кислород, вода, серная кислота 2) соляная кислота, углекислый газ, вода
3) оксид магния, оксид серы (IV), аммиак 4) железо, азотная кислота, оксид фосфора (V)
Как гидроксид натрия, так и гидроксид железа(III) взаимодействуют с
1) СО2 2) CuCl2(р-р) 3) h3SO4 4) SiО2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сu Cu(NO3)2 Cu(OH)2 X Cu CuSO4.
Укажите условия протекания реакций.
Гидроксид кальция вступает в реакцию с
1) MgO 2) BaCl2 3) NO 4) h3S
12.2 Факторы, влияющие на скорость реакции
Цели обучения
К концу этого модуля вы сможете:
- Описывать влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорости расходования реагентов и образования продуктов в ходе химических реакций сильно различаются. Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, степень разделения (один большой кусок против множества мелких частиц) реагентов, температура реагентов, концентрация реагентов, и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов. Например, когда небольшие кусочки металлов железа и натрия подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо практически не изменяется. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. Тем не менее, кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция почти взрывоопасна.
Состояние подразделения реагентов
За исключением веществ в газообразном состоянии или в растворе, реакции происходят на границе или границе раздела двух фаз. Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхности контакта между ними. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества. Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. 1). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. 1). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Рисунок 1. (a) Железный порошок быстро реагирует с разбавленной соляной кислотой и образует пузырьки газообразного водорода, поскольку порошок имеет большую общую площадь поверхности: 2Fe( s ) + 6HCl( водный раствор ) ⟶ 2FeCl3( водный раствор) ) + 3h3( г ). б) Железный гвоздь реагирует медленнее.
Посмотрите это видео, чтобы увидеть реакцию цезия с водой в замедленной съемке и обсудить, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно протекают быстрее при более высоких температурах. Еда может быстро испортиться, если ее оставить на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Еда может быстро испортиться, если ее оставить на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Концентрация реагентов
Скорость многих реакций зависит от концентрации реагентов. Скорость обычно увеличивается, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (CaCO 3 ) портится в результате его реакции с загрязняющим веществом диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. 2). Кислотный оксид, диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
[латекс] {\ текст {SO}} _ {2} \ текст {(} г \ текст {)} + {\ текст {H}} _ {2} \ текст {O (} г \ текст {) }\rightarrow{\text{H}}_{2}{\text{SO}}_{3}\text{(}aq\text{)}[/latex]
Карбонат кальция реагирует с сернистой кислотой следующим образом. :
:
[латекс] {\ text {CaCO}} _ {3} \ text {(} s \ text {)} + {\ text {H}} _ {2} {\ text {SO}} _ {3 }\text{(}aq\text{)}\rightarrow{\text{CaSO}}_{3}\text{(}aq\text{)}+{\text{CO}}_{2}\text {(}g\text{)}+{\text{H}}_{2}\text{O(}l\text{)}[/latex]
В загрязненной атмосфере, где концентрация диоксида серы карбонат кальция разлагается быстрее, чем в менее загрязненном воздухе. Точно так же фосфор сгорает гораздо быстрее в атмосфере чистого кислорода, чем в воздухе, который состоит всего лишь на 20% из кислорода.
Рисунок 2. Статуи, изготовленные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются с течением времени из-за воздействия воды, а также теплового расширения и сжатия. Однако загрязняющие вещества, такие как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (кредит: Джеймс П. Фишер III)
Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода в нем выше. Посмотрите это видео, чтобы увидеть пример.
Посмотрите это видео, чтобы увидеть пример.
Наличие катализатора
Растворы перекиси водорода пенятся при попадании на открытую рану, потому что вещества в открытых тканях действуют как катализаторы, увеличивая скорость разложения перекиси водорода. Однако при отсутствии этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции за счет снижения энергии активации, но само при этом не расходуется в ходе реакции. Энергия активации – это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, обеспечивая альтернативный путь или механизм для последующей реакции (рис. 3). Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
Рисунок 3. Присутствие катализатора увеличивает скорость реакции за счет снижения ее энергии активации.
Химические реакции происходят, когда молекулы сталкиваются друг с другом и подвергаются химическому превращению. Прежде чем физически провести реакцию в лаборатории, ученые могут использовать молекулярное моделирование, чтобы предсказать, как обсуждаемые выше параметры повлияют на скорость реакции. Используйте интерактивное приложение PhET Reactions & Rates, чтобы узнать, как температура, концентрация и природа реагентов влияют на скорость реакции.
Ключевые понятия и резюме
На скорость химической реакции влияют несколько параметров. Реакции с участием двух фаз протекают быстрее при большей площади контакта. Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь, который приводит к снижению энергии активации реакции.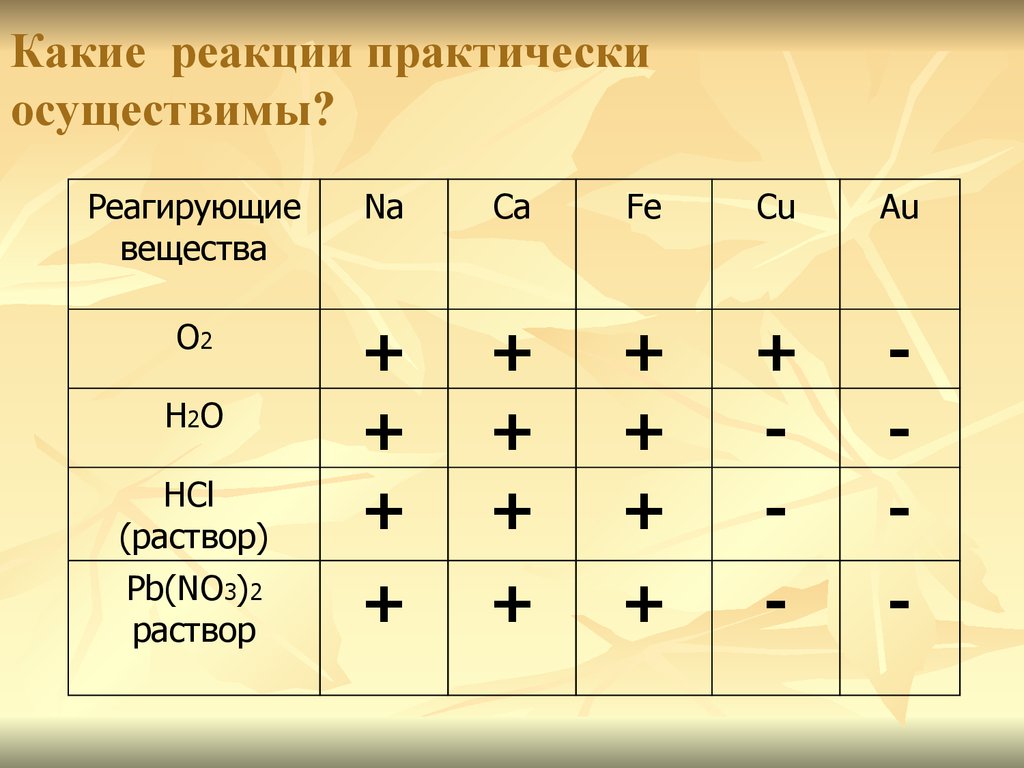
Упражнения
- Опишите влияние каждого из следующих факторов на скорость реакции металлического магния с раствором соляной кислоты: молярность соляной кислоты, температура раствора и размер кусков магния.
- Объясните, почему яйцо варится в кипящей воде в Денвере медленнее, чем в Нью-Йорке. (Подсказка: учитывайте влияние температуры на скорость реакции и влияние давления на температуру кипения.)
- Перейти к интерактивному разделу PhET Reactions & Rates. Используйте вкладку «Одиночное столкновение», чтобы представить, как столкновение между одноатомным кислородом (O) и монооксидом углерода (CO) приводит к разрыву одной связи и образованию другой. Потяните красный поршень назад, чтобы выпустить атом, и наблюдайте за результатами. Затем нажмите «Перезагрузить пусковую установку» и измените на «Угловой снимок», чтобы увидеть разницу.
- Что происходит при изменении угла столкновения?
- Объясните, какое отношение это имеет к скорости реакции.

- В интерактивном режиме PhET Reactions & Rates используйте вкладку «Много столкновений», чтобы наблюдать, как взаимодействуют несколько атомов и молекул в различных условиях. Выберите молекулу для закачки в камеру. Установите начальную температуру и выберите текущие количества каждого реагента. Выберите «Показать облигации» в разделе «Параметры». Как на скорость реакции влияют концентрация и температура?
- В интерактивном режиме PhET Reactions & Rates на вкладке Many Collisions настройте симуляцию с 15 молекулами A и 10 молекулами BC. Выберите «Показать облигации» в разделе «Параметры».
- Оставьте начальную температуру по умолчанию. Наблюдайте за реакцией. Скорость реакции высокая или низкая?
- Нажмите «Пауза», а затем «Сбросить все», а затем еще раз введите 15 молекул А и 10 молекул ВС. Выберите «Показать облигации» в разделе «Параметры». На этот раз увеличивайте начальную температуру до тех пор, пока на графике линия полной средней энергии не окажется полностью над кривой потенциальной энергии.
 Опишите, что происходит с реакцией.
Опишите, что происходит с реакцией.
Показать выбранные ответы
Глоссарий
катализатор: вещество, которое увеличивает скорость реакции, не поглощаясь реакцией
4.1: Скорость реакций
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 164746
- OpenStax
- OpenStax
Развитие навыков
- Описать влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
До сих пор мы рассматривали многие химические реакции, которые могут происходить, и описывали их, используя химические уравнения и стехиометрию.
Центральной теорией кинетики является теория столкновений . Предпосылка этой теории проста: молекулы должны столкнуться, чтобы прореагировать. Следовательно, скорость, с которой протекает реакция, зависит от двух основных факторов:
- Частота столкновений: Чем чаще молекулы сталкиваются друг с другом, тем быстрее протекает реакция.
- Энергия столкновений: Чем сильнее молекулы сталкиваются друг с другом, тем выше вероятность их реакции и тем быстрее протекает реакция.
Скорости расходования реагентов и образования продуктов в ходе химических реакций сильно различаются. Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, физическое состояние реагирующих веществ, температура реагирующих веществ, концентрация реагирующих веществ и наличие катализатора.
Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, физическое состояние реагирующих веществ, температура реагирующих веществ, концентрация реагирующих веществ и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от химической природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов. Например, когда небольшие кусочки металлов железа и натрия подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо практически не изменяется. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. Тем не менее, кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция почти взрывоопасна.
Физическое состояние реагентов
Реакции в легко смешивающихся фазах, таких как газы и жидкости, происходят намного быстрее, чем реакции между твердыми телами. Степень смешивания реагентов влияет на частоту столкновений молекул: если реагенты смешаны более тщательно, молекулы будут сталкиваться чаще и, следовательно, реагировать быстрее. По этой причине многие химические реакции осуществляются в растворе, где реагенты могут легко перемещаться в растворителе. По той же причине реакции с перемешиванием протекают быстрее, чем реакции с диффузией.
Степень смешивания реагентов влияет на частоту столкновений молекул: если реагенты смешаны более тщательно, молекулы будут сталкиваться чаще и, следовательно, реагировать быстрее. По этой причине многие химические реакции осуществляются в растворе, где реагенты могут легко перемещаться в растворителе. По той же причине реакции с перемешиванием протекают быстрее, чем реакции с диффузией.
За исключением веществ в газообразном состоянии или в растворе, реакции происходят на границе раздела двух фаз. Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхности контакта между ними. Это зависит от состояния подразделения реагентов. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества. Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. \(\PageIndex{1}\)). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
\(\PageIndex{1}\)). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Видео \(\PageIndex{1}\) : Реакция цезия с водой в замедленной съемке и обсуждение того, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно протекают быстрее при более высоких температурах. Еда может быстро испортиться, если ее оставить на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Опять же, причина кроется в столкновениях молекул. Температура соответствует средней кинетической энергии молекул. Молекулы с большей кинетической энергией будут сталкиваться друг с другом не только чаще, но и с большей силой, увеличивая скорость своей реакции.
Концентрации реагентов
Скорость многих реакций зависит от концентрации реагентов. Скорость обычно увеличивается, когда увеличивается концентрация одного или нескольких реагентов, потому что молекулярные столкновения становятся более частыми, когда в одном и том же пространстве находится больше молекул реагентов. Например, карбонат кальция (\(\mathrm{CaCO_3}\)) портится в результате его реакции с загрязняющим веществом диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. \(\PageIndex{2}\)). В качестве кислотного оксида диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
\(\PageIndex{2}\)). В качестве кислотного оксида диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1}\]
Карбонат кальция реагирует с сернистой кислотой следующим образом:
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3( aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2}\]
В загрязненной атмосфере, где концентрация диоксида серы карбонат кальция разлагается быстрее, чем в менее загрязненном воздухе. Точно так же фосфор сгорает гораздо быстрее в атмосфере чистого кислорода, чем в воздухе, который состоит всего лишь на 20% из кислорода.
Рисунок \(\PageIndex{2}\): Статуи, сделанные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются с течением времени из-за воздействия воды, а также теплового расширения и сжатия. Однако загрязняющие вещества, такие как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (кредит: Джеймс П. Фишер III).
(кредит: Джеймс П. Фишер III).
Видео \(\PageIndex{2}\) : Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода в воздухе выше.
Присутствие катализатора
Растворы перекиси водорода пенятся при попадании на открытую рану, потому что вещества в открытых тканях действуют как катализаторы , увеличивая скорость разложения перекиси водорода. Однако при отсутствии этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само не расходуется в ходе реакции. Катализатор увеличивает скорость реакции, обеспечивая альтернативный путь или механизм реакции. Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
Химические реакции происходят, когда молекулы сталкиваются друг с другом и подвергаются химическому превращению. Прежде чем физически провести реакцию в лаборатории, ученые могут использовать молекулярное моделирование, чтобы предсказать, как параметры, обсуждавшиеся ранее, повлияют на скорость реакции. Используйте интерактивное приложение PhET Reactions & Rates, чтобы узнать, как температура, концентрация и природа реагентов влияют на скорость реакции.
Резюме
На скорость химической реакции влияют несколько параметров. Реакции с участием двух фаз протекают быстрее при большей площади контакта. Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь, который приводит к снижению энергии активации реакции.
Глоссарий
- скорость реакции
- скорость, с которой расходуются реагенты и образуются продукты в химической реакции
- кинетика
- изучение скоростей химических реакций
- катализатор
- вещество, увеличивающее скорость реакции, но само не поглощающееся реакцией
Авторы
Пол Флауэрс (Университет Северной Каролины, Пемброк), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).- Анна М. Кристиансон, Университет Беллармин
Эта страница под названием 4.1: The Speed of Reactions распространяется под лицензией CC BY и была создана, изменена и/или курирована OpenStax.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.


 )
) )
)



 Опишите, что происходит с реакцией.
Опишите, что происходит с реакцией.
Leave A Comment