Виды химической связи: ковалентная (полярная и неполярная), ионная
Билет № 6
1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной — между двумя атомами с одинаковой электроотрицательностью, т. е. в простых веществах, и полярной — между атомами, электроотрицательность которых различается, т. е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
H• + •H → H : H
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить
энергию (такое же количество энергии выделяется при ее образовании).
Вот почему для разрыва ковалентной связи требуется затратить
энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H–H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентровая связь, когда два электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10–11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. ..
H· + ·Cl: → H :Cl:
·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде — частичный положительный:
Hδ+—Clδ−
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) — акцептором электронной пары:
H+ + :NH3 → NH4+
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой:
H
|
[H — N → H ]+
|
H
Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует
путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
..
Na+ [:Cl:]−
··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток
- Ионная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).

- Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
- Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями, поэтому такие вещества непрочные, легкоплавкие (лёд, сера), зачастую возгоняются, т. е. при нагревании испаряются, минуя жидкую фазу, как сухой лёд CO2, йод I2
- Металлическая кристаллическая решетка характерна для металлов, например, Fe
2. Опыт. Получение и собирание аммиака
Для получения и собирания аммиака в лаборатории насыпаем в пробирку хлорид или сульфат аммония, смешанный с известью Ca(OH)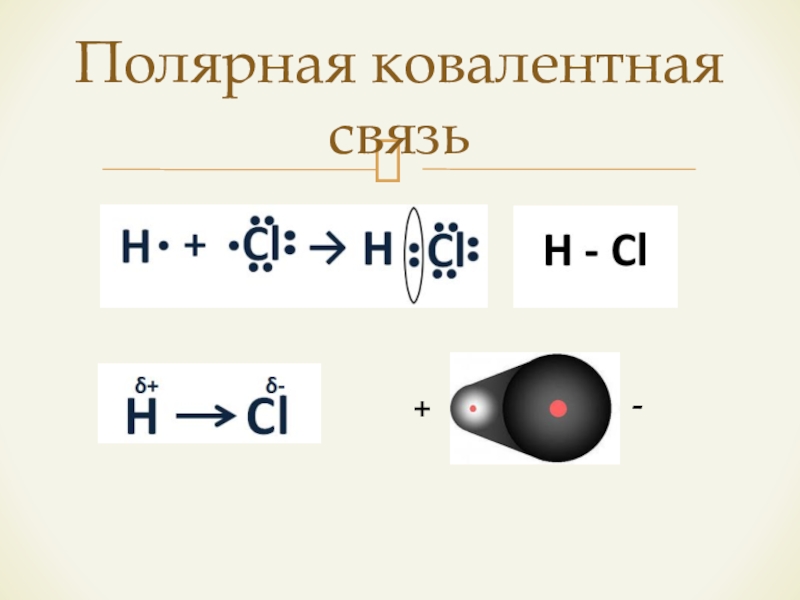
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную раствором фенолфталеина (ф-ф). Бумажка розовеет вследствие образования гидроксид-ионов:
NH3 + HOH NH4+ + OH−
автор: Владимир Соколов
просто и понятно о ее значении в химии
Содержание:
Определение и характеристика
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них).
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
 Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Пример образование неполярной ковалентной связи смотрите ниже на схеме.Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском языке – Covalent Bond.
Схожі записи:
4.4: Полярные и неполярные ковалентные связи
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 67990
Цели обучения
- Ковалентные связи имеют определенные характеристики, которые зависят от идентичности атомов, участвующих в связи. Двумя характеристиками являются длина связи и полярность связи.

Электроотрицательность и полярность связи
Хотя мы определили ковалентную связь как совместное использование электронов, электроны в ковалентной связи не всегда делятся поровну между двумя связанными атомами. Если связь не соединяет два атома одного и того же элемента, всегда будет один атом, который притягивает электроны в связи сильнее, чем другой атом, как показано на рисунке \(\PageIndex{1}\). Когда возникает такой дисбаланс, в результате происходит накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначаемого δ-) на одной стороне связи и некоторого положительного заряда (обозначаемого δ+) на другой стороне связи. Ковалентная связь с неравным распределением электронов, как в части (b) рисунка \(\PageIndex{1}\), называется полярной ковалентной связью. Ковалентная связь, которая имеет равное количество электронов (часть (a) рисунка \(\PageIndex{1}\)) называется неполярной ковалентной связью.
Рисунок \(\PageIndex{1}\) Полярные и неполярные ковалентные связи.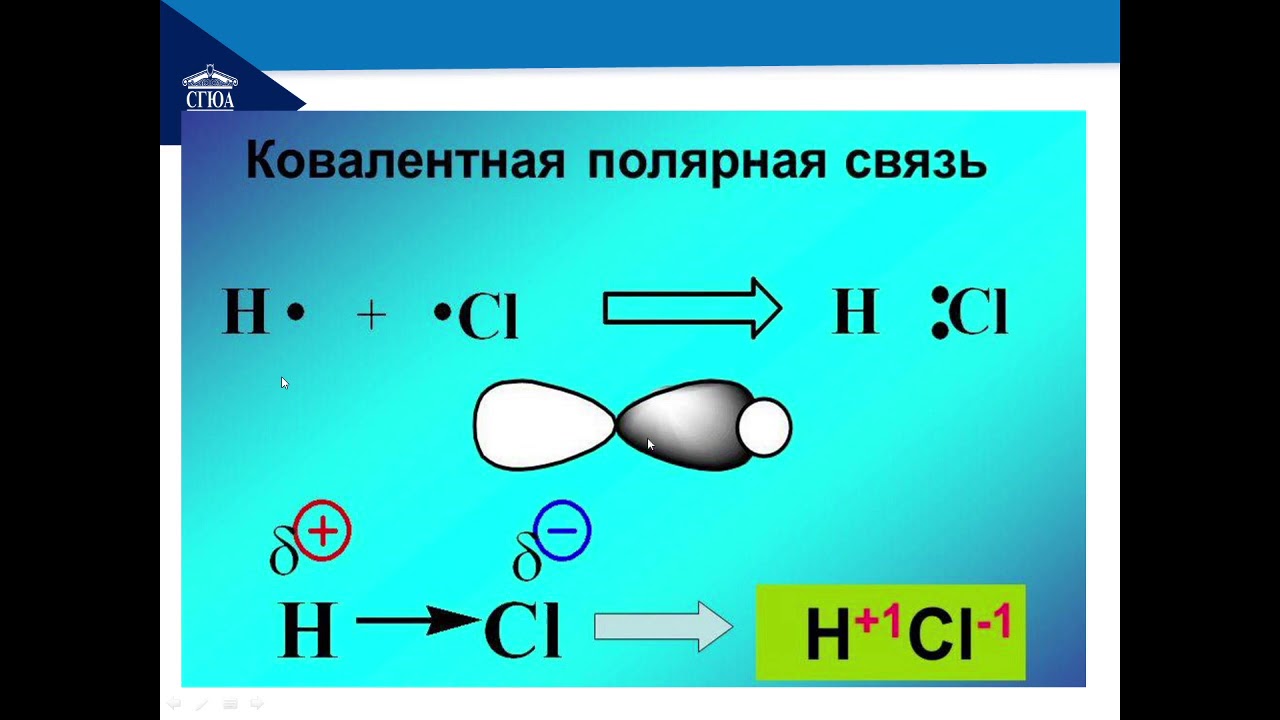 а) Электроны в ковалентной связи принадлежат обоим атомам водорода поровну. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов. Это полярная ковалентная связь.
а) Электроны в ковалентной связи принадлежат обоим атомам водорода поровну. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов. Это полярная ковалентная связь.
Любая ковалентная связь между атомами различных элементов является полярной связью, но степень полярности варьируется в широких пределах. Некоторые связи между различными элементами лишь минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельно полярными, когда электроны передаются, а не делятся. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, когда он образует ковалентную связь. Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \(\PageIndex{2}\) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить по разнице электроотрицательностей двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс совместного использования электронов в связи. Хотя жестких правил нет, общее правило состоит в том, что если разница в электроотрицательностях меньше примерно 0,4, связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Нулевая разность электроотрицательностей, конечно, указывает на неполярную ковалентную связь.
Чем больше разница в электроотрицательностях, тем больше дисбаланс совместного использования электронов в связи. Хотя жестких правил нет, общее правило состоит в том, что если разница в электроотрицательностях меньше примерно 0,4, связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Нулевая разность электроотрицательностей, конечно, указывает на неполярную ковалентную связь.
Рисунок \(\PageIndex{2}\) Электроотрицательности различных элементов. Популярная шкала электроотрицательности имеет значение для атомов фтора, равное 4,0, самое высокое значение.
Пример \(\PageIndex{1}\)
Опишите разность электроотрицательностей между каждой парой атомов и результирующую полярность (или тип связи).
- С и Н
- Н и Н
- Na и Cl
- О и Н
Раствор
- Углерод имеет электроотрицательность 2,5, тогда как значение водорода равно 2,1.
 Разница составляет 0,4, что довольно мало. Поэтому связь C–H считается неполярной.
Разница составляет 0,4, что довольно мало. Поэтому связь C–H считается неполярной. - Оба атома водорода имеют одинаковое значение электроотрицательности — 2,1. Разница равна нулю, поэтому связь неполярная. Электроотрицательность
- натрия составляет 0,9, а хлора — 3,0. Разница составляет 2,1, что довольно много, поэтому натрий и хлор образуют ионное соединение.
- При 2,1 для водорода и 3,5 для кислорода разница электроотрицательностей составляет 1,4. Мы ожидаем очень полярную связь, но не настолько полярную, чтобы связь O–H считалась ионной.
Упражнение
Опишите разницу в электроотрицательности между каждой парой атомов и результирующую полярность (или тип связи).
- С и О
- Н и Н
- Н и Н
- С и F
Когда связи молекулы полярны, молекула в целом может демонстрировать неравномерное распределение заряда в зависимости от того, как ориентированы отдельные связи. Например, ориентация двух связей О–Н в молекуле воды (рис. \(\PageIndex{3}\)) искривлена: один конец молекулы имеет частичный положительный заряд, а другой — частичный отрицательный. заряжать. Короче говоря, сама молекула полярна. Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100°C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C=O в диоксиде углерода полярные, они лежат прямо напротив друг друга и поэтому нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа. (Например, углекислый газ становится газом при температуре -77°C, что почти на 200° ниже температуры кипения воды.)
Например, ориентация двух связей О–Н в молекуле воды (рис. \(\PageIndex{3}\)) искривлена: один конец молекулы имеет частичный положительный заряд, а другой — частичный отрицательный. заряжать. Короче говоря, сама молекула полярна. Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100°C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C=O в диоксиде углерода полярные, они лежат прямо напротив друг друга и поэтому нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа. (Например, углекислый газ становится газом при температуре -77°C, что почти на 200° ниже температуры кипения воды.)
Рисунок \(\PageIndex{3}\) Физические свойства и полярность. На физические свойства воды и углекислого газа влияет их полярность.
Упражнения по обзору концепции
На что указывает электроотрицательность атома?
Какой тип связи образуется между двумя атомами, если разница в электроотрицательностях мала? Середина? Большой?
Ответы
Электроотрицательность — это качественная мера того, насколько атом притягивает электроны в ковалентной связи.
неполярный; полярный; ионный
Ключевые выводы
- Ковалентные связи между разными атомами имеют разную длину связи.
- Ковалентные связи могут быть полярными или неполярными, в зависимости от разницы в электроотрицательности вовлеченных атомов.
Авторы и авторство
- Анонимный
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Полярные и неполярные связи и молекулы
В этом учебнике по химии мы объясним разницу между полярными связями и неполярными связями . Затем мы расскажем вам определение полярной молекулы и что такое неполярная молекула . И последнее, но не менее важное: вы узнаете, что такое дипольный момент .
Что означают полярный и неполярный?Проще говоря, полярный означает противоположно заряженный, а неполярный означает одинаково заряженный. Ковалентные связи могут быть полярными и неполярными. Чтобы понять разницу между полярными и неполярными связями, важно понять электроотрицательность.
Что такое электроотрицательность? Электроотрицательность — это мера того, насколько сильно атом хочет соединиться с другим атомом. Электроотрицательность увеличивается слева направо и вниз по каждому столбцу периодической таблицы. Шкала Полинга описывает электроотрицательность элемента со шкалой от 0,7 до 4. Фтор является наиболее электроотрицательным элементом с электроотрицательностью 4. Цезий является наименее электроотрицательным элементом с электроотрицательностью 0,7.
Электроотрицательность увеличивается слева направо и вниз по каждому столбцу периодической таблицы. Шкала Полинга описывает электроотрицательность элемента со шкалой от 0,7 до 4. Фтор является наиболее электроотрицательным элементом с электроотрицательностью 4. Цезий является наименее электроотрицательным элементом с электроотрицательностью 0,7.
Полярная связь — это тип ковалентной связи. Связь между двумя или более атомами является полярной, если атомы имеют значительно разные электроотрицательности (> 0,4). Полярные связи не разделяют электроны поровну, а это означает, что отрицательный заряд электронов неравномерно распределяется в молекуле. Это вызывает дипольный момент. Дипольный момент возникает, когда один конец связи положительный, а другой конец отрицательный. Классическим примером полярной связи является связь в воде между водородом и кислородом. Связь классифицируется как полярная связь, потому что она имеет большую разность электроотрицательностей 1,4. Электроны в водороде сильнее притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Электроны в водороде сильнее притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Неполярные связи также относятся к типу ковалентных связей. В отличие от полярных связей, неполярные связи делят электроны поровну. Связь между двумя или более атомами является неполярной, если атомы имеют одинаковую электроотрицательность или разность электроотрицательностей менее 0,4. Примером неполярной связи является связь в хлоре. Хлор содержит два атома хлора. Электроны делятся поровну, потому что разница электроотрицательностей между двумя атомами равна нулю.
Что такое полярные молекулы?
В химии определение полярной молекулы — это молекула, которая имеет заряд на одной стороне молекулы, который не компенсируется. Он имеет область частичного заряда. Один конец слегка положительный, другой конец слегка отрицательный. Обычно они асимметричны, с неравномерным распределением электронов.
Полярные молекулы могут иметь ионные или полярные ковалентные связи. Молекула с двумя полюсами называется диполем . Когда вы измеряете величину полярности молекулы, результат называется 9.0037 дипольный момент .
Если молекула неполярна, то молекулы либо поровну делят электроны, т.е. они имеют неполярную связь или полярные связи симметричны в случае двуокиси углерода или четыреххлористого углерода. В этих молекулах есть диполи, но они компенсируются из-за симметрии.
Полярные молекулы имеют тенденцию слипаться и выстраиваться в группы, что влияет на свойства полярных соединений, таких как вода. Молекулы воды могут фактически выстраиваться под действием электростатической силы. Кроме того, полярные растворители склонны растворять полярные растворенные вещества, а неполярные растворители растворяют неполярные растворенные вещества.
Примеры полярных молекул
Является ли HF полярным?
Да, плавиковая кислота HF является полярной из-за большой разницы в электроотрицательности водорода и фтора. Молекула является полярно-ковалентной.
Молекула является полярно-ковалентной.
Является ли вода полярной молекулой?
Да, из-за изогнутой несимметричной формы молекулы. К атомам кислорода притягивается больше электронов, что приводит к суммарному заряду.
Является ли ацетон полярным или неполярным?
Из-за карбонильной группы ацетон является несколько полярной молекулой. Существуют разные степени полярности, и ацетон менее полярен, чем вода, потому что только часть молекулы ацетона имеет полярную связь.
Подробнее примеры полярных молекул
Диоксид серы SO 2 , аммиак NH 3 , углеродный моноксид Co, этанол C 2 H 5 OH, Methanol CH 2 2 2 2 2 2 2 H 5 OH, Methanol CH . S, хлорметан CH 3 Cl, озон O3, трихлорид фосфора (поскольку он имеет тригонально-пирамидальную геометрию) PCl 3
Неполярные молекулы
В неполярной молекуле не образуются положительные или отрицательные полюса. Любые заряды распределяются равномерно по молекуле. Неполярные молекулы обычно симметричны, как тетраэдрическая молекула четыреххлористого углерода. Другим примером является трифторид бора, который является тригонально-плоским. В симметричных молекулах дипольные заряды компенсируются.
Любые заряды распределяются равномерно по молекуле. Неполярные молекулы обычно симметричны, как тетраэдрическая молекула четыреххлористого углерода. Другим примером является трифторид бора, который является тригонально-плоским. В симметричных молекулах дипольные заряды компенсируются.
Неполярные молекулы обычно хорошо растворяются в неполярных растворителях, но не растворяются в воде.
Примеры неполярных молекул
Является ли углекислый газ полярным?
Нет, CO 2 не полярен, хотя связи полярны. Из-за линейной симметрии молекулы отрицательные заряды вокруг атомов кислорода компенсируются.
Является ли HCl полярной или неполярной?
Поскольку хлор более электроотрицателен, чем водород, соляная кислота HCl образует полярную связь и, следовательно, является полярной молекулой. Не существует симметрии, которая могла бы компенсировать дипольный заряд.
Дополнительные примеры неполярных молекул
Бензол C 6 H 6 , Метан CH 4 , Четыреххлористый углерод CCl 4 , Трифторид бора (поскольку он имеет тригонально-плоскую геометрию) гексан C 6 H 14 , азот N 2
Наша новая интерактивная периодическая таблица
Лучший способ просмотреть свойства и тенденции элементов, включая электроотрицательность, — это наша новая супер-крутая интерактивная периодическая таблица.


 Разница составляет 0,4, что довольно мало. Поэтому связь C–H считается неполярной.
Разница составляет 0,4, что довольно мало. Поэтому связь C–H считается неполярной.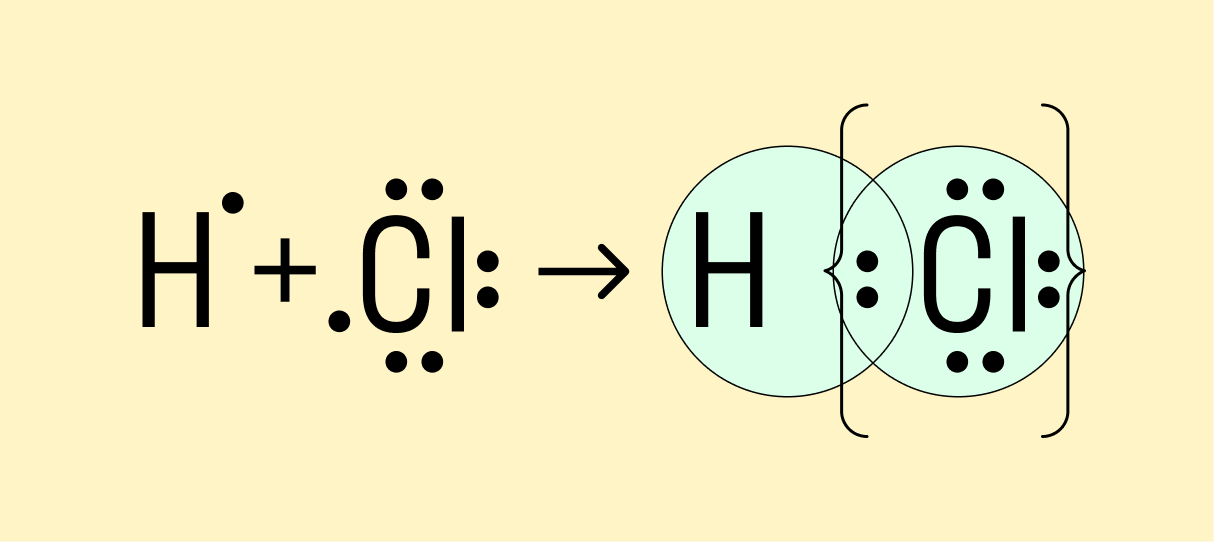
Leave A Comment