Вопрос 4 § 11 Химия 9 класс Габриелян Кто знает, почему щелочные и щёлочноземельные металлы хранят под керосином? – Рамблер/класс
Вопрос 4 § 11 Химия 9 класс Габриелян Кто знает, почему щелочные и щёлочноземельные металлы хранят под керосином? – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Почему щелочные и щёлочноземельные металлы хранят
лия, хранят в вазелине?
ответы
Щелочные и щелочноземельные металлы очень активны и реагиру-
ют практически со всем, с чем соприкасаются.
Например, на воздухе эти металлы легко окисляются. Если эти ме-
таллы хранить под слоем керосина, к которому они инертны, то можно
уберечь от ненужных взаимодействий. Литий — самый легкий из ме-
таллов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее. ..)
..)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Опыты по химии. Щелочные и щелочно-земельные металлы
Чтобы поделиться, нажимайте
Взаимодействие щелочных металлов с водой
Щелочные металлы: литий, натрий, калий — очень активны. На воздухе они реагируют с кислородом и водяными парами, поэтому их хранят под слоем керосина. Литий — самый легкий из всех металлов, он легче керосина. Извлечем кусочек лития из керосина, очистим его. Литий достаточно твердый по сравнению с другими щелочными металлами и с трудом режется ножом. Поместим кусочек лития в чашку Петри, наполненную водой. Литий энергично реагирует с водой с выделением водорода и образованием щелочи — гидроксида лития. При добавлении капли раствора фенолфталеина в чашку Петри появляется малиновая окраска. Натрий — более мягкий металл, легко режется ножом. Срез натрия — серебристо-белый, быстро тускнеет на воздухе. Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь — гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Срез натрия — серебристо-белый, быстро тускнеет на воздухе. Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь — гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
2 Li + 2 H2O = 2 LiOH + H2
2 Na + 2 H2O = 2 NaOH + H2
2 K + 2 H2O = 2 KOH + H2
Оборудование: чашки Петри, фильтровальная бумага, пинцет, скальпель.
Техника безопасности.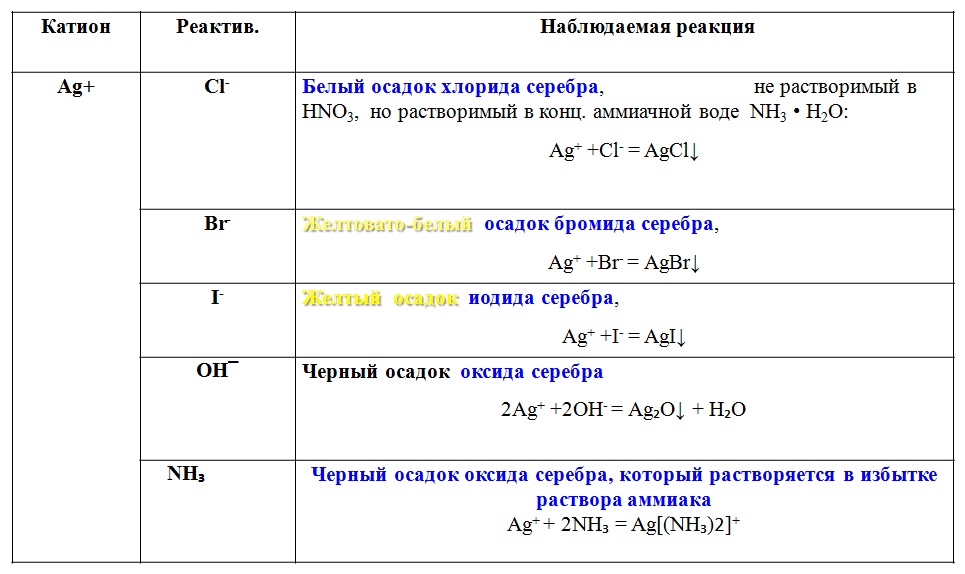 Соблюдать правила работы со щелочными металлами. Кусочки металлов, используемых в опыте, не должны быть больше рисового зерна.
Соблюдать правила работы со щелочными металлами. Кусочки металлов, используемых в опыте, не должны быть больше рисового зерна.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Горение кальция на воздухе
Кальций — серебристо-белый очень твердый металл. Ввиду высокой химической активности его хранят под слоем керосина. Для того чтобы поджечь кальций на воздухе, нужна очень высокая температура. В присутствии кислорода кальций загорается при более низких температурах. Извлечем кальций из керосина, промокнем керосин фильтровальной бумагой. Опустим кусочек кальция в расплавленный нитрат калия. Как известно, нитрат калия при нагревании разлагается с выделением кислорода:
2КNO3= 2KNO2 + O2
Внесем кальций вместе с небольшим количеством нитрата калия в пламя горелки. Кальций загорается кирпично-красным пламенем. Основным продуктом горения кальция на воздухе является оксид кальция:
Кальций загорается кирпично-красным пламенем. Основным продуктом горения кальция на воздухе является оксид кальция:
2Са + О2 = 2СаО
Оборудование: тигельные щипцы, горелка, шпатель.
Техника безопасности. Соблюдать правила пожарной безопасности. На рабочем столе поместить теплоизолирующую прокладку.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Жесткость воды
Жесткость воды обусловлена ионами кальция и магния. Природная вода всегда содержит соли магния и кальция. Сравним свойства жесткой и свободной от солей дистиллированной воды. В колбы с жесткой и дистиллированной водой добавим мыльный раствор. Закроем колбы и взболтаем их. В колбе с дистиллированной водой образуется обильная пена. В колбе с жесткой водой появились нерастворимые в воде соединения кальция и магния. Вот поэтому в жесткой воде мыло не мылится.
Вот поэтому в жесткой воде мыло не мылится.
С17H35COONa → C17H35 COO— + Na+
2 C17H35 COO— + Ca2+ = (C17H35 COO)2Ca↓
2 C17H35 COO— + Mg2+ = (C17H35 COO)2Mg↓
Оборудование: колбы, химические стаканы, пипетка.
Техника безопасности. Опыт безопасен.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Приготовление жидкого сплава натрия и калия
Свойства сплавов отличаются от свойств исходных металлов. При комнатной температуре натрий и калий – твердые вещества. Температура плавления натрия 97,8 °С, температура плавления калия 63, 5 °С. Сейчас вы увидите, что сплав натрия и калия при комнатной температуре – жидкость.Сплав получается при плотном контакте натрия и калия. Из-за высокой активности металлов действие происходит в стакане с керосином. Прижмем кусочки металлов друг к другу и слегка потрем. На дно стакана падают капли жидкого сплава. Мы увидели, что температура плавления сплава оказалась ниже температуры плавления исходных металлов.
Температура плавления натрия 97,8 °С, температура плавления калия 63, 5 °С. Сейчас вы увидите, что сплав натрия и калия при комнатной температуре – жидкость.Сплав получается при плотном контакте натрия и калия. Из-за высокой активности металлов действие происходит в стакане с керосином. Прижмем кусочки металлов друг к другу и слегка потрем. На дно стакана падают капли жидкого сплава. Мы увидели, что температура плавления сплава оказалась ниже температуры плавления исходных металлов.
Оборудование: пинцет, скальпель, стакан химический, фильтровальная бумага.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Самовозгорание цезия на воздухе
Цезий – чрезвычайно активный щелочной металл. Он имеет серебристо-белый цвет, при обычной температуре вязкую, пастообразную консистенцию. Температура плавления цезия 28,7 °С. Из за высокой активности металл хранят в запаянных стеклянных ампулах. Цезий реагирует с водой со взрывом. На воздухе цезий мгновенно воспламеняется. Если раздавить ампулу цезия, то мы увидим легкий дымок. Соприкоснувшись с кислородом воздуха цезий сгорел. При сгорании цезия образуются не оксиды, а пероксиды и надпероксиды цезия.
Температура плавления цезия 28,7 °С. Из за высокой активности металл хранят в запаянных стеклянных ампулах. Цезий реагирует с водой со взрывом. На воздухе цезий мгновенно воспламеняется. Если раздавить ампулу цезия, то мы увидим легкий дымок. Соприкоснувшись с кислородом воздуха цезий сгорел. При сгорании цезия образуются не оксиды, а пероксиды и надпероксиды цезия.
2Сs + O2 = Cs2O2
Сs + O2 = CsO2
Оборудование: щипцы, огнезащитная прокладка.
Техника безопасности. При разбивании ампулы с цезием использовать защитный экран, работать только в защитных очках.
Постановка опыта и текст – к. п.н. Павел Беспалов.
п.н. Павел Беспалов.
Способы устранения жесткости воды
В природной воде растворены соли кальция и магния. Это гидрокарбонаты и сульфаты. Покажем два способа осаждения гидрокарбонатов для уменьшения жесткости воды. Первый способ – кипячение. При кипячении* растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается.
Сa(HCO3)2 = CaCO3 ↓ + H2O + CO2↑
Второй способ – добавление известковой воды. При добавлении известковой воды гидрокарбонаты переходят в карбонаты и вода становится более мягкой.
Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 H2O
Но жесткость воды зависит еще и от сульфатов кальция и магния. Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4
Теперь мы знаем, как уменьшить жесткость воды. Накипь внутри чайника ‑ это осадок карбонатов кальция и магния с примесью сульфата кальция. Накипь можно удалить со стенок, используя разбавленный раствор уксусной кислоты.
Оборудование: пробирки, штатив для пробирок, химические стаканы, пипетка, спиртовка, шпатель, держатель для пробирок.
Техника безопасности.
Требуется соблюдение правил обращения с нагревательными приборами.
Постановка опыта – Елена Махиненко, текст – к. п.н. Павел Беспалов.
п.н. Павел Беспалов.
Почему щелочные металлы хранятся в керосине?
Последняя обновленная дата: 04 -й марта 2023 г.
•
Всего просмотров: 159K
•
Просмотр сегодня: 1,42K
Ответ
Проверенные
159K+ виды
HINT: Alkali Mitylium, Alkali Mitylis, Alkal , и литий склонны терять электроны. Натрий, калий и литий легко реагируют с газами в воздухе или влагой. Масло препятствует реакции щелочных металлов с кислородом и влагой.
Полный ответ:
Щелочные металлы относятся к первой группе. Металлы имеют тенденцию терять электроны. Реакционная способность металлов уменьшается при движении слева направо в таблице Менделеева. По мере того, как электроотрицательность растет слева направо в периодической таблице, становится все труднее удалять электроны из металлов, снижая реакционную способность.
Щелочные металлы находятся в верхней левой части периодической таблицы, где их электроотрицательность самая низкая, а их реакционная способность самая высокая.
Щелочные металлы вследствие их сильной реакции на кислород и влагу удерживаются в керосине.
Дополнительная информация:
Щелочные металлы представляют собой группу химических элементов в $s — $блоке периодической таблицы, обладающих схожими свойствами: они серебристого цвета и их можно резать пластиковым ножом.
При стандартной температуре и давлении щелочные металлы очень реакционноспособны и легко теряют свой внешний электрон, образуя катионы с зарядом $ + 1$.
Все щелочные металлы, открытые до сих пор, были найдены в природе.
Рубидиевые и цезиевые атомные часы, натриевые лампы и поваренная соль — вот лишь некоторые из различных применений щелочных металлов.
Примечание:
Наиболее активными металлами в периодической таблице являются щелочные металлы. Реакционная способность щелочных металлов увеличивается по мере их продвижения вниз по группе.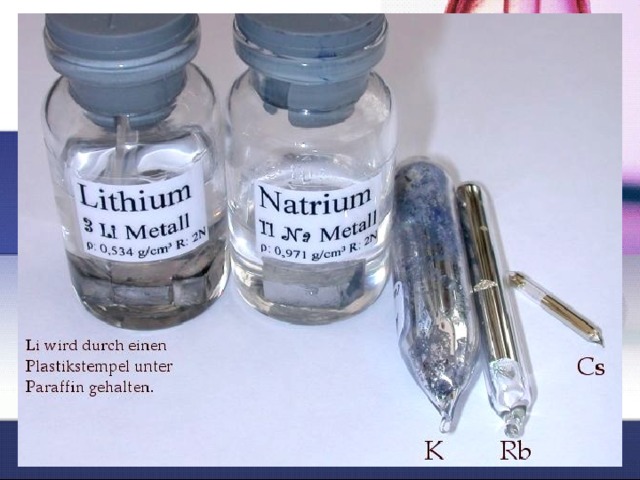 Поскольку электроотрицательность металла уменьшается по мере его продвижения вниз по группе, он легче теряет электроны, увеличивая свою реакционную способность. Цезий является наиболее реакционноспособным из щелочных металлов.
Поскольку электроотрицательность металла уменьшается по мере его продвижения вниз по группе, он легче теряет электроны, увеличивая свою реакционную способность. Цезий является наиболее реакционноспособным из щелочных металлов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Актуальные сомнения
[Решено] Металл _____ всегда хранится в керосине?
- Натрий
- Кальций
- Магний
- Алюминий
Вариант 1: Натрий
Свободный
Электрические заряды и закон Кулона)
84,9 тыс. пользователей
пользователей
10 вопросов
10 баллов
10 минут
Правильный ответ: Натрий.
КОНЦЕПЦИЯ:
- Щелочные металлы обладают высокой реакционной способностью из-за их большого размера и низкой энергии ионизации.
- Натрий — щелочной металл, его всегда держат в керосине
- Энергично горит на воздухе или кислороде с образованием перекиси натрия.
2Na + O 2 → Na 2 O 2
- Реагирует с двуокисью углерода, образуя слой карбоната на его поверхности.
- Он также реагирует с влагой и выделяет водород.
2Na + 2H 2 O → 2NaOH + H 2
- Все эти реакции могут быть экзотермическими.

- Поэтому натрий нельзя хранить в воде.
ПОЯСНЕНИЕ:
- Кальций, магний и алюминий также реагируют с кислородом и водой, но эти реакции не такие бурные, как реакции натрия и других щелочных металлов.
- Кальций
- Реакция с водой — Кальций реагирует с водой и выделяет водород, это бурная реакция, но не бурная, как у натрия.
Ca + 2H 2 O → Ca(OH) 2 + H 2
- Кальций медленно окисляется 9 Ca+2O 9 O13 на воздухе0127 2
- Магний
- Реагирует только с горячей водой.
- Горит на воздухе: 2Mg + O 2 → 2MgO
- Алюминий
- Алюминий не реагирует с чистой водой.
- Алюминий медленно окисляется на воздухе: Al + O 2 → Al 2 O 3
Поделиться в WhatsApp
Последние технические обновления армейской службы Agniveer
Последнее обновление: 2 декабря 2022 г.

Leave A Comment