Кількість теплоти. Питома теплоємність речовини
Фізика. Повторне видання. 8 клас. Сиротюк
Цей підручник можна завантажити у PDF форматі на сайті тут.
Для кількісного опису властивостей теплообміну застосовують спеціальні фізичні величини, однією з яких є кількість теплоти.
Кількість теплоти показує, яка кінетична енергія хаотичного (безладного) руху молекул передалася від одного тіла до іншого під час теплообміну, у результаті чого змінилася внутрішня енергія обох тіл, що були в тепловому контакті.
Від яких умов теплообміну залежить кількість теплоти?
Усім вам, мабуть, доводилося нагрівати воду, і ви добре знаєте, що для нагрівання чайника, ущерть заповненого водою, потрібна більша кількість теплоти, ніж для такого самого чайника, наповненого до половини. Звідси випливає: що більша маса тіла, то більшу кількість теплоти потрібно затратити, щоб змінити його температуру на одну й ту саму кількість градусів.
Дослід 1. На однакові нагрівники поставимо однакові посудини, в одній з яких налито 200 г води (мал. 48, а), а в другій — 400 г (мал. 48, б). Виміряємо початкову температуру води — вона однакова в обох посудинах.
На однакові нагрівники поставимо однакові посудини, в одній з яких налито 200 г води (мал. 48, а), а в другій — 400 г (мал. 48, б). Виміряємо початкову температуру води — вона однакова в обох посудинах.
Мал. 48
Нагріваючи воду до певної температури, побачимо, що посудину з водою масою 400 г потрібно гріти вдвічі довше, ніж посудину з водою масою 200 г, тобто їй слід надати удвічі більшої кількості теплоти. Кількість теплоти, яка потрібна для нагрівання тіла, залежить від маси цього тіла.
Що більша маса тіла, то більшу кількість теплоти треба надати йому, щоб нагріти до певної температури.
У той самий час тіло, яке охолоджується, передає навколишньому середовищу тим більше кількості теплоти, чим більша його маса. Наприклад, якщо залишити холонути посудини з попереднього досліду, то посудина, у якій маса води дорівнює 400 г, набуде кімнатної температури за час, удвічі більший, ніж та, у якій води 200 г, а отже, поверне і вдвічі більшу кількість теплоти.
Дослід 2. Поставимо тепер посудину з водою кімнатної температури на нагрівник і нагріємо воду, наприклад, на 10 °С. Процес нагрівання триватиме деякий час, за який тілу буде передано певну кількість теплоти. Якщо ми вирішимо підвищити температуру води ще на 10 °С, то процес нагрівання треба буде продовжити, і він триватиме такий самий час, який знадобився в першій частині досліду. Зрозуміло, що при цьому воді буде передано додатково таку саму кількість теплоти, що й раніше. Отже, що більша різниця кінцевої і початкової температур тіла під час нагрівання, то більшої кількості теплоти йому треба надати.
Що більша різниця кінцевої і початкової температур тіла, то більшу кількість теплоти йому буде передано під час нагрівання.
Дослід 3. Візьмемо дві однакові посудини, перша з яких містить 400 г води (мал. 49, а), а друга — 400 г олії (мал. 49, б) кімнатної температури і поставимо їх на однакові нагрівники. Отже, маси обох рідин однакові й нагріватимемо їх до однакової температури, наприклад до 40 °С.
Мал. 49
Спостерігаючи за показами термометрів, занурених у кожну з рідин, побачимо, що олія набуде заданої температури першою. Щоб температура води зрівнялася з температурою олії, нагрівання води треба продовжити і надати їй додаткової кількості теплоти.
Кількість теплоти, яка потрібна для нагрівання тіла до певної температури, залежить від того, з якої речовини виготовлено тіло.
Дослід 4. Нагріємо залізне та алюмінієве тіла однакової маси до певної температури, наприклад до 40 °С (мал. 50). Зануримо кожне з тіл в окремі посудини з однаковою кількістю води кімнатної температури в кожній. Через певний час побачимо, що вода, у яку помістили алюмінієве тіло, нагрілася більше, ніж вода, у яку поклали залізне тіло.
Мал. 50
Тіла з різних речовин однакової маси і температури, охолоджуючись, виділяють різну кількість теплоти.
Кількість теплоти — це внутрішня енергія, яку одержує або втрачає тіло під час теплообміну. Вона залежить від речовини, з якої виготовлено тіло, маси цього тіла та різниці його кінцевої і початкової температур.
Вона залежить від речовини, з якої виготовлено тіло, маси цього тіла та різниці його кінцевої і початкової температур.
Кількість теплоти позначають великою латинською літерою Q. Одиницею кількості теплоти, як і енергії, є один джоуль (1 Дж). Використовують також кратні одиниці кількості теплоти: один кілоджоуль (1 кДж) і один мегаджоуль (1 МДж).
1 кДж = 1000 Дж;
1 МДж = 1 000 000 Дж.
Щоб підвищити температуру води масою 1 кг на 1 °С, треба надати їй кількість теплоти, що дорівнює 4200 Дж; якщо нагрівати 1 кг золота на 1 °С, то потрібна кількість теплоти, яка дорівнює лише 130 Дж. Отже, кожна речовина масою 1 кг для нагрівання на 1 °С потребує певної кількості теплоти. Під час охолодження цих речовин масою 1 кг на 1 °С, виділятимуться такі самі кількості теплоти.
Фізичну величину, що показує, яка кількість теплоти потрібна для зміни температури речовини масою 1 кг на 1 °С, називають питомою теплоємністю речовини.
Питому теплоємність речовини позначають малою латинською літерою с. Одиницею питомої теплоємності речовини є один джоуль, поділений на один кілограм і один градус Цельсія (1 Дж/(кг • °С)).
У таблиці 2 наведено значення питомої теплоємності для багатьох речовин, що використовуються у промисловості й побуті.
Таблиця 2
Питома теплоємність речовин
Речовина | Питома теплоємність речовини, Дж/(кг • °С) | Речовина | Питома теплоємність речовини, Дж/(кг • °С) |
Вода | 4200 | Сталь | 500 |
Спирт | 2500 | Залізо | 460 |
Ефір | 2350 | Нікель | 460 |
Гас | 2100 | Мідь | 380 |
Лід | 2100 | Латунь | 380 |
Повітря | 1000 | Цинк | 380 |
Алюміній | 920 | Срібло | 250 |
Пісок | 880 | Олово | 250 |
Цегла | 880 | Свинець | 140 |
Скло | 840 | Ртуть | 130 |
Чавун | 540 | Золото | 130 |
Що означає вислів «питома теплоємність срібла дорівнює 250 Дж/(кг • °С)»? Цей вислів означає, що для нагрівання 1 кг срібла на 1 °С потрібно затратити кількість теплоти, що дорівнює 250 Дж, або під час охолодження 1 кг срібла на 1 °С виділяється кількість теплоти, що дорівнює 250 Дж.
Аналізуючи таблицю 2, бачимо, що вода має дуже велику питому теплоємність. Тому вода в морях і океанах, нагріваючись улітку, вбирає велику кількість теплоти, і в місцях поблизу великих водойм улітку не буває так жарко, як у місцях, віддалених від води. Узимку вода охолоджується й віддає значну кількість теплоти, через те зима в цих місцях не така люта. Завдяки великій питомій теплоємності воду широко використовують у системах водяного опалення, для охолодження двигунів.
Раніше з результатів дослідів було зроблено висновок, що для нагрівання будь-якого тіла потрібно затратити певну кількість теплоти, яка пропорційна масі тіла, різниці його кінцевої і початкової температур та залежить від роду речовини, з якої воно виготовлене.
Як обчислити кількість теплоти, коли задано певні значення всіх цих величин? Наприклад, треба обчислити, яку кількість теплоти одержала під час нагрівання мідна деталь масою 5 кг, якщо її температура збільшилася від 20 до 520 °С. У таблиці 2 знаходимо значення питомої теплоємності міді: вона дорівнює 380 Дж/(кг • °С). Це означає, що для нагрівання міді масою 1 кг на 1 °С потрібно 380 Дж, а для нагрівання міді масою 5 кг на 1 °С потрібна в 5 разів більша кількість теплоти, тобто 380 Дж • 5 = 1900 Дж. Для нагрівання міді масою 5 кг на 500 °С потрібна ще в 500 разів більша кількість теплоти, тобто
Це означає, що для нагрівання міді масою 1 кг на 1 °С потрібно 380 Дж, а для нагрівання міді масою 5 кг на 1 °С потрібна в 5 разів більша кількість теплоти, тобто 380 Дж • 5 = 1900 Дж. Для нагрівання міді масою 5 кг на 500 °С потрібна ще в 500 разів більша кількість теплоти, тобто
1900 Дж • 500 = 950 000 Дж = 950 кДж.
Щоб обчислити кількість теплоти, яка потрібна для нагрівання тіла, або кількість теплоти, яку виділяє тіло під час охолодження, треба питому теплоємність речовини помножити на масу тіла та на різницю кінцевої і початкової температур тіла.
Математично це правило записують у вигляді такої формули:
Q = cm(t2 — t1),
де Q — кількість теплоти; с — питома теплоємність речовини; m — маса тіла; t1 — початкова температура тіла; t2 — кінцева температура тіла.
Щоб визначити масу тіла, яке нагрівається або охолоджується, потрібно кількість теплоти поділити на питому теплоємність речовини й на різницю кінцевої і початкової температур тіла:
Щоб визначити питому теплоємність речовини, з якої виготовлено тіло, потрібно кількість теплоти поділити на масу тіла й на різницю його кінцевої і початкової температур:
Щоб визначити, на скільки градусів змінилася температура тіла, потрібно кількість теплоти поділити на питому теплоємність речовини й на масу тіла:
ЧИ ЗНАЄТЕ ВИ, ЩО. ..
..
- Одиницею кількості теплоти з давніх-давен була особлива одиниця — калорія (з лат. calor — тепло, жар).
- Калорія (кал) — це кількість теплоти, яку треба передати 1 г води для нагрівання її на 1 °С. Можна сказати також, що калорія — це кількість теплоти, яку втрачає 1 г води, охолоджуючись на 1 °С.
- Користуються також більшою одиницею кількості теплоти кілокалорією:
1 ккал = 1000 кал;
1 кал = 4,19 Дж.
ЗАПИТАННЯ ДО ВИВЧЕНОГО
- 1. Що таке кількість теплоти?
- 2. Від яких фізичних величин залежить кількість теплоти, потрібна для нагрівання тіла?
- 3. Назвіть одиниці кількості теплоти.
- 4. Що таке питома теплоємність речовини? Що вона показує?
Попередня
СторінкаНаступна
СторінкаЗміст
У світі цікавої фізики: грудня 2016
Теплові явища. 8 клас
контрольна
8 клас
контрольна
«Теплові явища»
В – 1.
1. В яких одиницях вимірюється питома теплоємність речовини?
А. Дж/кг Б. Дж/кг∙°С В. Дж Г. кг
2. За якою з формул
визначається кількість теплоти, що виділилася при згорянні палива?
А. Q=mg Б. Q=
q m В. Q=
Lm Г. Q= r m
3. Для плавлення 2 кг міді, взятої при температурі плавлення, знадобилося 420 кДж теплоти. Визначте питому теплоту плавлення міді.
4. На однакових пальниках нагрівається вода, мідь і залізо рівної маси. Побудувати графік для води, для міді та для заліза.
5. Маса срібла 10 гр. Скільки енергії виділиться при його кристалізації і охолодженні до 60°С, якщо срібло взято при температурі плавлення?
6. При виході з річки
ми відчуваємо холод. Чому?
Чому?
7. У калориметрі знаходиться 0,3 кг води при температурі 20°С. Яку масу води з температурою 40°С потрібно додати в калориметр, щоб встановлена температура дорівнювала 25°С? Теплоємністю калориметра знехтувати.
8. Визначте ККД двигуна трактора, яким для виконання роботи 1,89∙106 Дж знадобилося 1,5 кг палива з питомою теплотою згоряння 4,2∙106 Дж/кг
9. У залізній коробці масою 300 г хлопчик розплавив 200 г олова. Яка кількість теплоти пішла на нагрівання коробки і плавлення олова, якщо початкова температура їх дорівнює 32°С?
В – 2.
1. В яких одиницях вимірюється кількість теплоти?
А. Дж/кг Б. Дж/кг∙°С В. Дж Г.. кг
2. За якою з формул
визначається кількість теплоти, що
виділилася при конденсації пари?
А.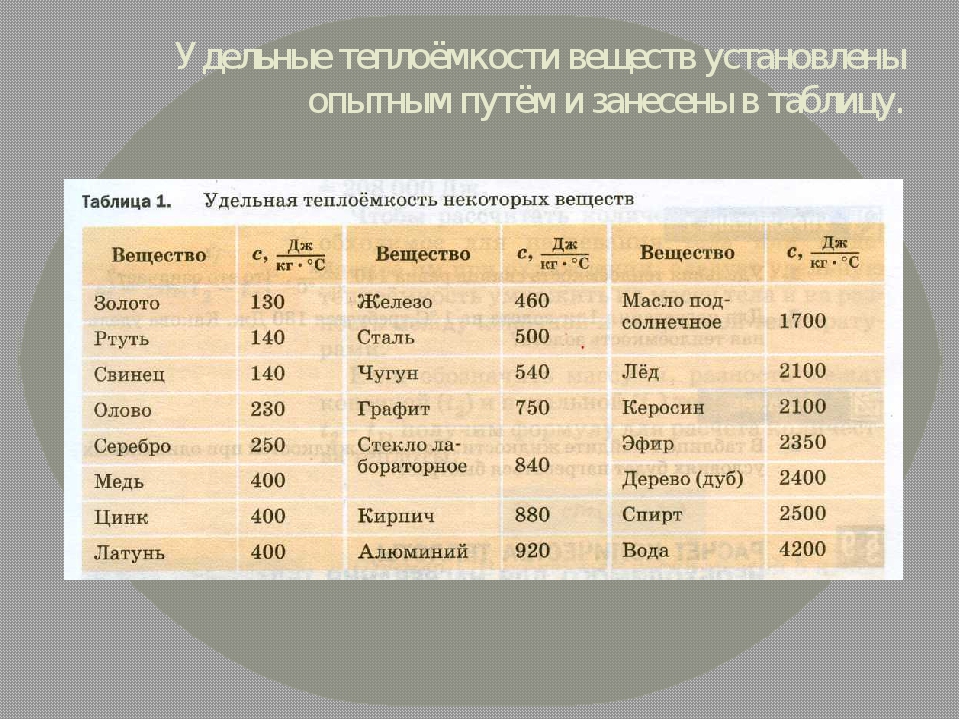 Q= Lm Б. Q=rm .B Q= km Г. Q= cm
Q= Lm Б. Q=rm .B Q= km Г. Q= cm
3. На нагрівання залізної деталі від 20°С до 220°С витрачено 92 кДж теплоти. Визначте масу деталі.
4. Три тіла рівної маси з питомими теплоємностями, нагрілися під дією одного нагрівача на однакове число градусів. Яке з тіл нагрілося повільніше?
5. Скільки енергії необхідно для плавлення шматка свинцю масою 500 г, взятого при температурі 27°С?
6. В якому взутті більше мерзнуть ноги взимку: у просторій або тісної? Чому?
7.В скляний стакан масою 0,12 кг при температурі 15°С налили 0,2 кг води при температурі 100°С. При якій температурі встановиться теплова рівновага? Втратами теплоти знехтувати.
8. Визначте ККД
вагранки, що працює на коксі, якщо коксу витрачається 300 кг, а сірого чавуну
розплавляється 1,5 т при початковій температурі 20оС.
9. Щоб охолодити 5 кг води, взятої при 20°С до 8°С, у воду кидають шматочки льоду, які мають температуру 0°С. Яку кількість льоду потрібно для охолодження води?
В – 3.
1. В яких одиницях вимірюється питома теплота плавлення?
А. Дж/кг Б. Дж/кг∙°С В . Дж Г. кг
2. За якою з формул визначається
кількість теплоти, необхідна для
нагрівання речовини?
А. Q= cm Б. Q= um В. Q=
cm( t2-t1 ) Г. Q=gm
3. Яку кількість теплоти необхідно для перетворення в пар 2 кг води, що має температуру 100 ° с?
4. Три тіла рівної маси з питомими теплоємностями, … нагрілися під дією одного нагрівача на однакове число градусів. Яке з тіл нагрілося швидше?
5. Скільки енергії витрачено на нагрівання води масою 750 г від 20°С до кипіння і подальше утворення пари масою 250 г?
6. Перш ніж налити в
склянку окріп, опускають в склянку чайну ложку. Поясніть, для чого це роблять?
Перш ніж налити в
склянку окріп, опускають в склянку чайну ложку. Поясніть, для чого це роблять?
7. Срібну ложку масою 50 г опустили в посудину, що містить 250 г води при температурі 90°С. Визначте питому теплоємність срібла, якщо початкова температура ложки 30°С. Теплоємністю посудини знехтувати.
8. На спиртівці нагріли 224 г води від 15°С до 75°С і при цьому спалили 5 г спирту. Визначте ККД спиртівки.
9. У воду масою 600 г,
взятої при температурі 60°С, кидають 10 г льоду при температурі 0°С, який перетворюється у воду. Знайдіть
температуру води, встановлену після танення льоду.
В – 4.
1. В яких одиницях вимірюється питома теплота пароутворення речовини?
А. Дж/кг Б. Дж/кг∙°С В Дж Г. °С
2. За якою з формул
визначається кількість теплоти, необхідної для плавлення речовини?
А. Q=nm Б Q=bt. В.Q=yt Г. Q=Lm
Q=nm Б Q=bt. В.Q=yt Г. Q=Lm
3. При нагріванні 2 кг бронзи на 20°С витрачено 7600Дж теплоти. Яка питома теплоємність бронзи?
4. Зобразіть графіки нагрівання та кипіння рідин однакової маси: води, спирту і ефіру.
5. Скільки енергії необхідно для плавлення залізного брухту масою 4 т, якщо початкова температура заліза 39°С?
6. Як утворюються бризи?
7. У ванні змішали 39 літрів води при температурі 2°С і 21 літр води при температурі 60°С. Визначте сталу температуру. Втратами тепла на нагрівання ванни знехтувати.
8. Скільки коксу потрібно для плавлення 4 тонн чавуну, взятого при температурі 30°С, якщо ККД вагранки 12%?
9. Пар масою 0,7 кг
при температурі 100°С впускають в холодну воду, взяту в кількості 12 кг Температура води після
впуску в неї пара піднімається до 70°С. Визначте початкову температуру води.
Визначте початкову температуру води.
Теплота згоряння палива. Коефіцієнт корисної дії нагрівника. 8 клас.
Мета уроку: пояснити фізичний зміст питомої теплоти згоряння палива, навчити учнів обчислювати кількість теплоти, що виділяється в процесі повного згоряння палива; розвивати індивідуальні і творчі здібності учнів; виховувати наполегливість у досягненні мети.
Обладнання: мультимедійні задачі.
Хід уроку.
І. Організаційний момент.
Оголошення теми і мети уроку.
ІІ. Перевірка домашнього завдання.
Фронтальне опитування.
1.
Від чого залежить кількість теплоти, необхідна для нагрівання тіла?
2.
За якою формулою обчислюють кількість теплоти, передану тілу в ході нагрівання або виділену ним під час охолодження?
3.
Який фізичний зміст питомої теплоємності? Питома теплоємність води 4200
. Що це означає?
4.
Назвіть одиницю питомої теплоємності речовини.
5.
Яка система називається теплоізольованою?
6.
Сформулюйте рівняння теплового балансу.
Розв’язування задач.
1.
До
3 кгводи при температурі 30ºС додали
5 кг води при температурі 80ºС. Визначте температуру
суміші.
Визначте температуру
суміші.
2.
В алюмінієву каструлю масою
400 гналили
2,5 кгводи при температурі 25ºС і почали нагрівати до кипіння. Яку кількість теплоти передали каструлі з водою?
ІІІ. Пояснення нового матеріалу.
Досить часто людина добуває теплову енергію, спалюючи різні речовини. Це відбувається завдяки хімічній реакції горіння, що супроводжується виділенням теплоти. Так, під час згоряння природного газу відбувається хімічна реакція окиснення, внаслідок якої утворюється оксид карбону СО
і вода, а також виділяється певна кількість теплоти. Наприклад, під час згоряння
1 мгазу, який на 90 відсотків складається з метану СН
, виділяється приблизно 40 МДж теплоти. Цієї кількості
теплоти достатньо, щоб нагріти майже
Цієї кількості
теплоти достатньо, щоб нагріти майже
води від 0 до 100 °С.
Хімічна реакція, під час якої відбувається окиснення з виділенням теплоти, називається горінням.
Природно, що різні речовини під час горіння виділяють різну кількість теплоти. Найвищу теплотворну здатність мають речовини, які називають паливом. Для її характеристики застосовують фізичну величину, яка називається питомою теплотою згоряння палива (позначається q). Її числове значення показує, яка кількість теплоти виділяється внаслідок повного згоряння
1 кгпалива.
Є різні види палива: тверде (вугілля, дрова, сланці, торф), рідке (бензин, мазут, гас, дизпаливо, спирт), газоподібне (метан, пропан, ацетилен).
Одиницею
питомої теплоти згоряння палива є джоуль на кілограм. Значення питомої теплоти
згоряння деяких видів палива подано в таблиці на стор. 205.
205.
За значенням питомої теплоти згоряння палива можна визначити кількість теплоти, яка виділяється під час згоряння
1 кгпалива. Наприклад, при спалюванні
1 кгсухих дров виділяється приблизно 12 000 кДж теплоти. Для того щоб обчислити кількість теплоти, що виділяється внаслідок згоряння довільної кількості палива, треба питому теплоту згоряння палива помножити на його масу:
Q = qm.
Для
теплопередачі часто застосовують нагрівники, за допомогою яких можна
використати теплоту згоряння палива — газові пальники, спиртівки, печі.
Кількість теплоти, яка утворюється під час згоряння в них палива, частково йде
на нагрівання тіл, а частина її втрачається (розсіюється в навколишнє
середовище, нагріває сам пальник тощо). Тому кажуть про коефіцієнт корисної дії
(ККД) нагрівника, який визначає у відсотках частину кількості теплоти QK, що
пішла на нагрівання, від повної кількості теплоти.
ККД нагрівника характеризує ефективність використання теплоти, отриманої внаслідок згоряння палива.
ІV. Закріплення нового матеріалу.
1. При повному згорянні бензину виділилося 1,63 • 10
кДж теплоти. Скільки бензину спалено?
2. Скільки дров треба спалити, щоб отримати таку саму кількість теплоти, як від спалювання
1,5 кгбензину?
3. Скільки гасу треба спалити, щоб нагріти
3 лводи від 20 °С до температури кипіння, якщо на її нагрівання витрачається 60 % енергії?
4. До якої температури можна нагріти
50 лводи, температура якої дорівнює 20 °С, спаливши
100 гбензину, якщо ККД нагрівника становить 50 % ?
5. Який ККД спиртівки, якщо для підвищення
температури
Який ККД спиртівки, якщо для підвищення
температури
води на
5 °С витрачено
1 гспирту?
Теоретичні питання.
1. Що таке горіння?
2. Чому для одержання теплової енергії використовують паливо?
3. ЯКИЙ фізичний зміст питомої теплоти згоряння палива?
4. За таблицею питомої теплоти згоряння палива з’ясуйте, яке паливо має найбільшу, а яке — найменшу теплотворну здатність.
5. Оцініть за теплотворною здатністю, чим вигідніше опалювати приміщення — вугіллям чи дровами.
6. Вивчивши будову нагрівника, запропонуйте спосіб, за допомогою якого можна конструктивно підвищити ККД нагрівника.
V. Підсумок уроку.
Підсумок уроку.
Домашнє завдання: §41. Впр.41 № 4,5,6.
Конспект уроку з фізики: Плавлення і кристалізація твердих тіл
Мета: з’ясувати суть теплових процесів плавлення і кристалізації, переконати Учнів, що плавлення і кристалізація тіл відбуваються за незмінної температури; навчити обчислювати кількість теплоти в даних процесах; закріпити вміння і на¬вички розв’язувати задачі.
Обладнання: нагрівач, колба зі шматочками льоду, термометр до 100 °С.
Хід уроку
I. Проведення атестації (усна форма, 15 хв.).
II. Аналіз контрольної роботи (до 5хв.).
ІІІ. Вивчення нового матеріалу.
1. Розповідь учителя.
Розглянемо ще один процес теплообміну—плавлення і кристалізацію твердих тіл.
Виконаємо такий дослід. Посудину, в якій знаходиться сніг (шматочки льоду), ставимо на нагрівник (електрична плитка, спиртівка) і спостерігатимемо за показа¬ми термометра. Зараз покази термометра нижчі 0 °С. Тобто лід має температуру нижчу ніж 0 °С. Вмикаємо нагрівник. (Поки лід нагрівається, учні записують тему уроку в зошитах і креслять осі координат для побудови графіка). Один із учнів стежить за показами термометра. Обов’язково фіксується температура 0 °С. Через 2 — 3 хв. лід розтанув, покази термометра почали збільшуватися. Зачекаймо кілька хвилин, поки лід розтане і вода почне нагріватися.
За отриманими даними будуємо графік.
Ділянка АВ відповідає процесу нагрівання льоду;
ВС — процесу танення льоду;
CD — нагріванню води.
Якщо охолоджувати воду, відбудетьтся зворотний процес. Причому вода замерзає (кристалізується) при 0 °С і коли закінчиться процес кристалізації, температура почне знижуватися.
Ми спостерігали за процесами, що зображені на гра¬фіку; з’ясуємо це детальніше.
2. Евристична бесіда:
— Що можна сказати про температуру танення льоду і кристалізацію води?
— Що відбудеться, якщо під час танення припинити нагрівання?
— Під час танення льоду енергія виділяється нагрівником, але температура льо¬ду і води залишається сталою. Який висновок можна з цього зробити ?
— Що відбувається під час кристалізації?
3. Слово вчителя.
Отже, на танення льоду необхідно витрачати певну кількість теплоти. Вона потрібна для того, щоб зруйнувати впорядковане розміщення молекулу кристалах льоду.
Кількість теплоти, яка обхідна для того, щоб розплавити 1 кг даної кристаліч¬ної речовини при температурі плавлення, називають питомою теплотою плавлен¬ня і позначають буквою L (ель).
Щоб визначити кількість теплоти, необхідної для плавлення будь-якої маси речо¬вини, потрібно питому теплоту плавлення помножити на масу речовини, тобто:
Q=Lm, (1)
4. Робота з підручником.
— Розгорніть підручники на с. 41.
— Розгляньте таблицю № 5 (с. 41).
— Дайте відповіді на запитання:
а) Яка температура плавлення льоду, нафталіну, спирту?
б) Яка речовина, із наведених у таблиці, має найвищу температуру плавлення?
Найнижчу?
в) Що означає цифра 332 для льоду?
г) Яка речовина має найбільшу питому теплоту плавлення?
ґ) Скільки теплоти віддає 1 кг цинку під час кристалізації й при якій температурі це відбувається?
5. Слово вчителя.
Речовини, які мають сталу температуру плавлення, називають кристалічними. Але є речовини, що не мають певної температури плавлення. їх називають аморф¬ними. До них належать: скло, пластмаси, віск, смола, пластилін, сургуч тощо.
6. Заповнення таблиці «Зведена таблиця фізичних величин «.
IV. Закріплення вивченого матеріалу.
Розв’яжіть задачу № 3 із вправи 9 (с. 46).
VI. Домашнє завдання.
Вивчіть § 12. Прочитайте § 13. Зверніть увагу на приклади розв’язків задач. Розв’яжіть задачу № 1 із вправи 9 (с. 46), для сильніших — учнів задача № 2 із] вправи 9. Виконайте експеримент: винесіть посудину з водою на вулицю й зафік¬суйте температуру кристалізації води (не використовуйте медичний термометр).
46), для сильніших — учнів задача № 2 із] вправи 9. Виконайте експеримент: винесіть посудину з водою на вулицю й зафік¬суйте температуру кристалізації води (не використовуйте медичний термометр).
Підписатися на: Дописи (Atom)
Удельная теплоемкость воздуха
Удельная теплоемкость воздуха — (обновлено 26.07.08)Номинальные значения, используемые для воздуха при температуре 300 K: C P = 1,00 кДж/кг.K, C v = 0,718 кДж/кг·К, а к = 1,4. Однако все они являются функциями температуры, а также с чрезвычайно высоким температурным диапазоном опыт работы с двигателями внутреннего сгорания и газотурбинными двигателями получить существенные ошибки. В следующей таблице приведены значения удельная теплоемкость в зависимости от температуры. Мы находим, что выбор значений удельных теплоемкостей в среднем температура каждого процесса дает результаты с достаточной точностью (в пределах 1%).
Идеальный газ удельная теплоемкость воздуха
Температура
КC P
кДж/кг. K
KC v
кДж/кг.Kк
250
1,003
0,716
1,401
300
1,005
0,718
1.400
350
1,008
0,721
1,398
400
1,013
0,726
1,395
450
1,020
0,733
1,391
500
1,029
0,742
1,387
550
1,040
0,753
1,381
600
1,051
0,764
1,376
650
1,063
0,776
1,370
700
1,075
0,788
1,364
750
1,087
0,800
1,359
800
1,099
0,812
1,354
900
1.
 121
1210,834
1,344
1000
1,142
0,855
1,336
1100
1,155
0,868
1,331
1200
1,173
0,886
1,324
1300
1.190
0,903
1,318
1400
1.
 204
2040,917
1,313
1500
1,216
0,929
1,309
Значения до 1000 К первоначально были опубликованы в «Таблицах тепловых свойств газов», NBS Circular 564, 1955. Последний пять строк были рассчитаны по формуле BG Kyle «Chemical и термодинамика процессов», Englewood Cliffs / Prentice Hall, 1984 г. и имеют погрешность <1%.
__________________________________________________________________________________________
Инженерная термодинамика Израиля
Уриэли находится под лицензией Creative
Commons Attribution-Noncommercial-Share Alike 3.0 США
Лицензия
Тепловые свойства вещества
Тепловые свойства вещества Удельная теплоемкость:
(ккал/(кг o C))
| Вода | 1,0 |
|---|---|
| Лед | 0,49 |
| Пар | 0,48 |
| Стекло | 0,20 |
| Сталь | 0,11 |
| Медь | 0,092 |
| Алюминий | 0,215 |
Единица ккал (килокалория) является единицей энергии. 1 ккал = 4186 Дж
1 ккал = 4186 Дж
В единицах ккал/(кг o С) удельная теплоемкость воды равна 1,
При переходе тепла от одного материала к другому температура контакта слой более холодного материала увеличивается. От тепловой энергии контактного слоя должен распространяться по холодному материалу путем проводимости или конвекции. Как Эффективность передачи тепла зависит от удельная теплоемкость г. материал. Удельная теплоемкость с – это количество энергии, необходимое для повысить температуру одного кг материала на 1 градус Кельвина или Цельсия.
с = ΔQ/(м ΔT).
Удельная теплоемкость: (ккал/(кг o C))
Удельная теплоемкость воды примерно в 4 раза выше, чем у воздуха. Точная удельная теплоемкость вещества зависит от условие, при котором он измеряется. Для газов удельная теплоемкость измеренная при постоянном объеме, отличается от удельной теплоемкости измеряется при постоянном давлении.
Чем меньше удельная теплоемкость материала, соприкасающегося с кожей,
тем меньше тепла требуется для доведения температуры пограничного слоя до
температура вашей кожи. Как быстро тепло уносится от этой границы
слой теперь зависит от теплопроводности материала и от того,
нет конвекционных токов. Чтобы свести к минимуму потерю тепла кожей,
окружить его материалом с низкой удельной теплоемкостью и низкой проводимостью, и
предотвратить конвекцию. Кроме того, вы должны свести к минимуму потери тепла через излучение.
Как быстро тепло уносится от этой границы
слой теперь зависит от теплопроводности материала и от того,
нет конвекционных токов. Чтобы свести к минимуму потерю тепла кожей,
окружить его материалом с низкой удельной теплоемкостью и низкой проводимостью, и
предотвратить конвекцию. Кроме того, вы должны свести к минимуму потери тепла через излучение.
Проблема:
Образец меди весом 50 г находится при температуре 25 o C. При 1200 Дж тепловой энергии добавляется к нему, какова конечная температура меди?
Решение:
- Рассуждение:
Мы знаем удельную теплоемкость меди, поэтому знаем, какую энергию она требуется, чтобы поднять температуру одного кг меди на 1 градус Кельвина или Цельсия. - Детали расчета:
ΔT = ΔQ/(см·м). Для меди с = 9,2*10 -2 ккал/( кг o С).
ΔT = 1200 Дж*(1 ккал/4186 Дж)/(0,05 кг*9,2*10 -2 ккал/(кг o С)) = 62,3 o С.
T = 87,3 o С.
Проблема:
Алюминиевый калориметр массой 100 г содержит 250 г воды.
калориметр и вода находятся в тепловом равновесии при 10 o С.
Два металлических блока помещаются в воду. Один кусок 50 г.
медь 80 o C. Другой имеет массу 70 г и
исходно при температуре 100 o C. Вся система
стабилизируется при конечной температуре 20 o C.
(a) Определите удельную теплоемкость неизвестного образца.
(b) Угадайте материал неизвестного образца.
Решение:
- Рассуждение:
Калориметр минимизирует обмен энергией с среда. Таким образом, полная энергия системы равна (приблизительно) постоянный.
ΔQ всего = ΔQ вода + ΔQ алюминий + ΔQ медь + ΔQ неизвестный объект = 0, - Детали расчета:
Температура алюминиевого калориметра и температура воды повышаются на 10 o C. Количество энергии, полученное объектом, температура которого повышается на ΔT, равно ΔQ
= мкΔТ.
Количество энергии, полученное объектом, температура которого повышается на ΔT, равно ΔQ
= мкΔТ.
Приток воды ΔQ воды = 0,25 кг*1 ккал/(кг o С)*10 o С = 2,5 ккал.
Прирост алюминия ΔQ алюминия = 0,1 кг*0,215 ккал/(кг o Кл)*10 o Кл = 0,215 ккал.
Температура меди падает 60 o С.
Потери меди ΔQ меди = -0,05 кг*0,092 ккал/(кг o Кл)*60 o Кл = -0,276 ккал.
Таким образом, неизвестный объект теряет ΔQ unknown объект = (-2,5 + -0,215 + 0,276) ккал = -2,439ккал.
Его удельная теплоемкость c = ΔQ/(m ΔT) = 2,439/(0,07*80) ккал/(кг o Кл) = 0,436 ккал/(кг o Кл) = 1,82 Дж/(г К).
Неизвестный материал, вероятно, бериллий.
Вопрос:
Почему температура в прибрежных городах достаточно стабильна, но в пустыне оно может значительно различаться между днем и ночью?
Ответ:
Ключевым фактором здесь является вода. Вода имеет высокую удельную теплоемкость, поэтому она способна
сохранять, поглощать и высвобождать много энергии. У побережья вода поглощает тепло
в течение дня и хранит его, высвобождая ночью, действуя как теплоотвод.
В пустыне мало воды, чтобы запасать энергию и высвобождать ее в таком количестве.
цикла, поэтому температура гораздо более чувствительна к тому, светит солнце или нет.
Вода имеет высокую удельную теплоемкость, поэтому она способна
сохранять, поглощать и высвобождать много энергии. У побережья вода поглощает тепло
в течение дня и хранит его, высвобождая ночью, действуя как теплоотвод.
В пустыне мало воды, чтобы запасать энергию и высвобождать ее в таком количестве.
цикла, поэтому температура гораздо более чувствительна к тому, светит солнце или нет.
Материя существует в разных состояниях. Может, для например, быть в твердом, жидком или газообразном состоянии. Эти состояния называются фазами . Атомы и молекулы, составляющие материю, движутся по-разному в разные фазы.
- В твердом теле атомы колеблются около равновесия позиции, но не могут течь или распространяться. Межмолекулярный силы очень сильны, а импульсивные силы от столкновений атомы с тепловой энергией в среднем значительно слабее.
- В жидкостях атомы или молекулы могут протекать мимо
друг друга, но поддерживают тесный контакт.
 Некоторый порядок
сохраняется в диапазоне нескольких молекулярных диаметров.
межмолекулярные силы не пренебрежимо малы по сравнению с
импульсивные силы от столкновений с атомами тепловой энергии и
молекулы.
Некоторый порядок
сохраняется в диапазоне нескольких молекулярных диаметров.
межмолекулярные силы не пренебрежимо малы по сравнению с
импульсивные силы от столкновений с атомами тепловой энергии и
молекулы. - В газах атомы или молекулы движутся свободно. Их среднее расстояние намного больше атомного или диаметр молекулы и межмолекулярная сила становятся пренебрежимо малы по сравнению с импульсивными силами от столкновений с теплоэнергетические атомы и молекулы. Поведение большинства газов хорошо описывается законом идеального газа, PV = Nk Б Т.
Твердые
Жидкие
Газовые
Как правило, тепло передается от объекта с более высокой температурой к
объект более низкой температуры. Температура – это величина, которая
указывает, будет ли течь теплота и в каком направлении она
будет течь. При переходе тепла от более горячего к более холодному объекту
температура более горячего объекта уменьшается, а температура
более холодный объект поднимается. Средняя кинетическая энергия
молекул в более горячем объекте уменьшается, а среднее кинетическое
энергия молекул в более холодном объекте увеличивается. Но когда
объект меняет фазу, его температура не меняется, хотя
добавляется или отводится тепло. плавка льда и кипящей воды
являются знакомыми примерами. Во время смены
фаза температура не меняется, но внутренняя
энергия делает. Внутренняя энергия равна сумме кинетической энергии
молекул и химической потенциальной энергии
молекулы. При фазовом переходе средняя кинетическая энергия
молекулы остаются прежними, но средняя потенциальная энергия
изменения.
Средняя кинетическая энергия
молекул в более горячем объекте уменьшается, а среднее кинетическое
энергия молекул в более холодном объекте увеличивается. Но когда
объект меняет фазу, его температура не меняется, хотя
добавляется или отводится тепло. плавка льда и кипящей воды
являются знакомыми примерами. Во время смены
фаза температура не меняется, но внутренняя
энергия делает. Внутренняя энергия равна сумме кинетической энергии
молекул и химической потенциальной энергии
молекулы. При фазовом переходе средняя кинетическая энергия
молекулы остаются прежними, но средняя потенциальная энергия
изменения.
Процессы, представленные красными стрелками, требуют
энерговклад.
Процессы, представленные черными стрелками, высвобождают энергию.
Плавление это фазовый переход .
Лед и вода — разные фазы одного и того же вещества. При атмосферном
сжатый лед существует при температурах ниже 0 o C. Если мы хотим
повысить температуру 1 кг льда на 1 градус Цельсия, скажем, с -5 до С
до — 4 o С, нам нужно 0,49 ккал тепла. Но если мы хотим расплавиться
На 1 кг льда при температуре 0 o С нам нужно 80 ккал тепла. Это тепло
используется для разрыва химических связей и преобразуется в потенциальную энергию. Это
называется скрытой теплотой плавления или скрытой теплотой плавления
сплав (L f ). Скрытая теплота – это теплота, изменяющая фазу
вещество без изменения его температуры. Когда мы нагреваем смесь
вода и лед, тепло будет перетекать из воды в лед при 0, или С
пока весь лед не растает. Если бы мы могли термически изолировать смесь, она
достигло бы теплового равновесия при 0 o C, и лед больше не таял бы.
Если теплота отводится от воды при температуре 0, o °С, она замерзает в лед, а не превращается в лёд.
становится холоднее. Замораживание высвобождает
скрытая теплота плавления.
Если мы хотим
повысить температуру 1 кг льда на 1 градус Цельсия, скажем, с -5 до С
до — 4 o С, нам нужно 0,49 ккал тепла. Но если мы хотим расплавиться
На 1 кг льда при температуре 0 o С нам нужно 80 ккал тепла. Это тепло
используется для разрыва химических связей и преобразуется в потенциальную энергию. Это
называется скрытой теплотой плавления или скрытой теплотой плавления
сплав (L f ). Скрытая теплота – это теплота, изменяющая фазу
вещество без изменения его температуры. Когда мы нагреваем смесь
вода и лед, тепло будет перетекать из воды в лед при 0, или С
пока весь лед не растает. Если бы мы могли термически изолировать смесь, она
достигло бы теплового равновесия при 0 o C, и лед больше не таял бы.
Если теплота отводится от воды при температуре 0, o °С, она замерзает в лед, а не превращается в лёд.
становится холоднее. Замораживание высвобождает
скрытая теплота плавления.
При замораживании выделяется большое количество тепла. поэтому температура большого водоема очень стабильна вблизи точки замерзания. Зимняя погода умеренная до большой степени этим фактором. Зимние температуры останутся около 0 o C, пока вся местная вода не замерзнет. Но также требуется много энергии, чтобы растопить лед, и поэтому Местные температуры не сильно повышаются до тех пор, пока лед не растаял.
Кипение является фазовым переходом . Вода и
пар – это разные фазы одного и того же вещества. При атмосферном давлении
вода существует при температуре от 0 90 396 o 90 397 C до 100 90 396 o 90 397 C. Если
мы хотим поднять температуру 1 кг воды на 1 градус Цельсия, скажем, от
50 o C до 51 o C нам потребуется 1 ккал тепла. Но если мы
хотим вскипятить 1 кг воды при температуре 100 o С и превратить ее в пар, который нам нужен
540 ккал тепла. Это называется скрытым кодом . теплота парообразования (L V ). Он используется для разрыва
связи, удерживающие молекулы воды в жидкости. Кипение
температура воды зависит от давления. Чем ниже давление, тем ниже
это температура кипения. При более низком давлении молекулам требуется меньше кинетических
энергии для выхода из жидкости.
теплота парообразования (L V ). Он используется для разрыва
связи, удерживающие молекулы воды в жидкости. Кипение
температура воды зависит от давления. Чем ниже давление, тем ниже
это температура кипения. При более низком давлении молекулам требуется меньше кинетических
энергии для выхода из жидкости.
Кипящая вода не повышает температуру выше 100 o C, пока вся вода не испарится. Пар, который мы видим, не водяной пар, который невидим, а скопление мелкой воды капли, которые образуются при охлаждении газообразного водяного пара.
Фазы материи
Добавление тепла в заданную фазу изменяет температуру.
Удельная теплоемкость c: ΔQ = c*m*ΔT
Добавление тепла во время фазового перехода преобразует одну фазу в другую фазу.
без изменения температуры.
Скрытая теплота L: ΔQ = m*L
Проблема:
Сколько тепловой энергии требуется, чтобы превратить кубик льда массой 40 г из твердого тела при -10 o C в пар при 110 o C?
Решение:
- Рассуждение:
Требуется тепловая энергия на
поднять температуру льда до 0 o С,
растопить лед,
поднять температуру воды до 100 o С,
кипятить воду,
и поднять температуру пара до 110 o С, - Детали расчета:
Поднять температуру льда до 0 o C нам нужно
ΔQ = 0,04 кг*(0,49 ккал/(кг o C))*10 o С = 0,196 ккал.
Чтобы растопить лед, нам нужно
ΔQ = 0,04 кг * 80 ккал/кг = 3,2 ккал.
Для повышения температуры воды до 100 o C нужно
ΔQ = 0,04 кг*(1 ккал/(кг или С))*100 o C= 4 ккал.
Чтобы вскипятить воду, нам нужно
ΔQ = 0,04 кг * 540 ккал/кг = 21,6 ккал.
Для повышения температуры пара до 110 o С нужно
ΔQ = 0,04 кг*(0,48 ккал/(кг o С))*10 o С = 0,192 ккал.
Общая необходимая тепловая энергия составляет
(0,196 + 3,2 + 4 + 21,6 + 0,192) ккал = 29,188 ккал.
Проблема:
Если 90 г расплавленного свинца при его температуре плавления
из 327,3 или С заливают в отливку массой 300 г.
форме из железа и первоначально при 20 o С, что является конечным
температура системы? Предположим, что энергия не теряется
к окружающей среде.
Свинец: скрытая теплота L f = 2,45*10 4 Дж/кг, удельная теплоемкость с = 128 Дж/(кг o С).
Железо: удельная теплоемкость с = 448
Дж/(кг o Кл).
Решение:
- Обоснование:
Энергосбережение: Энергия, выделяемая свинцом, поглощается железо.
Температура плавления свинца 327,3 o °С. Свинец будет выделять энергию по мере затвердевания и охлаждения до температуры T.
Железо будет поглощать энергию по мере нагревания до температуры T. - Детали расчета:
Предположим, что конечная температура системы равна T.
Тогда количество энергии, выделяемой свинца при затвердевании составляет
ΔQ = 0,09 кг*(2,45*10 4 Дж/кг) = 2205 Дж,
, а количество энергии, выделяемой при его охлаждении, равно 9.0018 ΔQ = 0,09 кг*(128 Дж/(кг o Кл))*(327,3 o Кл — Т) = (11,52 Дж/ o Кл)*(327,3 или С-Т).
Эта энергия поглощается железом. Следовательно, для железа мы имеем
2205 Дж + (11,52 Дж/ o Кл)*(327,3 o Кл — Т) = 0,3 кг*448. Дж/(кг o Кл))*(Т — 20 o Кл).
Дж/(кг o Кл))*(Т — 20 o Кл).
5975,5 Дж — (11,52 Дж/ o Кл)*T = (134 Дж/ o Кл)*T — 2688 Дж.
8663,5 Дж = (145,52 Дж/ o Кл)*T.
Т = 59.5 o С.
Вопрос:
Апельсин производители во Флориде опрыскивают свои деревья водой, когда ожидаются заморозки. Почему Это работает?
Ответ:
- Когда вода замерзает снаружи установки, выделяется скрытая теплота. Как
пока присутствует смешанная фаза воды и льда, температура не падает
ниже 0 o C. Ледообразование снаружи растения удерживает жидкости внутри
растение при температуре 0 o C.
Жидкость внутри растения представляет собой раствор различных веществ, растворенных в вода. Растворенные материалы служат своего рода естественным антифризом, который понижает температуру замерзания жидкости внутри ниже 0 o С, и лед не образуется внутри растения.
Если опрыскивание продолжается в течение длительного времени, вес ледяной нагрузки на растение становится достаточно большим, чтобы повредить его.
Выпаривание и сублимация
Температура вещества является мерой средней кинетической энергии атомов или молекулы, из которых состоит вещество. Но не все частицы имеют одинаковую кинетическую энергии, они имеют распределение энергий. Некоторые частицы в жидкости или твердое тело может иметь достаточную кинетическую энергию, чтобы разорвать химические связи и оставить вещество. Жидкость испаряется а твердое тело сублимация . Когда частицы с наибольшей кинетической энергией покидают вещество, средняя кинетическая энергия оставшихся частиц уменьшается. Поэтому температура вещества уменьшается. Испарение охлаждает вещество.
Игрушка, демонстрирующая процесс охлаждения
Испарение — это диппи-птица. Диппи-птица изготавливается путем выдувания
стеклянная трубка, впадающая в колбу, как горловина воронки. Этот
верхняя луковица становится головой птицы. Вторая лампочка становится
тело. Трубка доходит почти до дна этого нижнего
луковица, как соломинка в безалкогольный напиток.
Птица наполнена жидкостью с высоким давлением паров. Голова птицы покрыта пухом, что дает большую площадь для испарение. Когда голова мокрая, испарение вызывает охлаждение и конденсация газа внутри фары, и давление капли. Это заставляет жидкость ползти вверх по шее в область более низкого давления. Центр тяжести смещается к голове конец птицы. Птица падает в стакан с водой, где пух снова становится влажным. Но когда птица достигает своего максимальная обедненность, нижний конец трубки торчит из жидкости, и жидкость может вытекать из трубки обратно в нижнюю колбу. Это смещает центр тяжести назад и смешивает газ. Процесс продолжается пока в стакане есть вода.
Внешний ссылка: техника пьющей птицы (Youtube)
Терминология для различных фазовых переходов:
| Из жидкости в газ: | Испарение |
|---|---|
| Из газа в жидкость: | Конденсат |
| Твердое вещество в газообразное: | Сублимация |
| Из газа в твердое: | Депонирование |
Относительная влажность
Молекулы могут покидать жидкую воду в результате испарения, но молекулы также могут
повторно войти в жидкую воду, если в окружающем воздухе есть водяной пар. Мы
назовем это явление конденсацией . Относительная влажность – отношение скорости
конденсации к скорости испарения. Если уйдет в два раза больше молекул
жидкости, чем возвращаются в жидкость, то относительная влажность равна 0,5
или 50%. Относительная влажность зависит от температуры и от
плотность водяного пара в воздухе. Чем выше температура, тем
выше средняя кинетическая энергия молекул и, следовательно, скорость при
которые они уходят. Чем выше плотность водяного пара в воздухе,
тем выше скорость возвращения молекул.
Мы
назовем это явление конденсацией . Относительная влажность – отношение скорости
конденсации к скорости испарения. Если уйдет в два раза больше молекул
жидкости, чем возвращаются в жидкость, то относительная влажность равна 0,5
или 50%. Относительная влажность зависит от температуры и от
плотность водяного пара в воздухе. Чем выше температура, тем
выше средняя кинетическая энергия молекул и, следовательно, скорость при
которые они уходят. Чем выше плотность водяного пара в воздухе,
тем выше скорость возвращения молекул.
В закрытом контейнере при заданной температуре равновесие будет
достигнут, и количество молекул воды, покинувших поверхность воды, будет
равно числу, возвращаемому в единицу времени. Давление водяного пара при
равновесие называется давлением насыщенных паров . В
более высокая температура, больше молекул может покинуть поверхность и насыщенный пар
давление выше. Температура, при которой давление пара равно
к атмосферному давлению называется температурой кипения. Если жидкость
открытым для воздуха, то давление пара рассматривается как парциальное давление вдоль
с другими составляющими воздуха.
Температура, при которой давление пара равно
к атмосферному давлению называется температурой кипения. Если жидкость
открытым для воздуха, то давление пара рассматривается как парциальное давление вдоль
с другими составляющими воздуха.
При температуре ниже 100 o C вода, оставленная открытой для
воздуха, медленно испаряется с его поверхности. Давление его паров намного ниже, чем
атмосферное давление. Внутри также образуются микроскопические пузырьки.
но эти крошечные пузырьки водяного пара с низким давлением, равным
давление, немедленно подавляются гораздо более высоким давлением
атмосфера давит на поверхность жидкости. Когда вода нагревается и
его температура достигает 100 o С, давление его паров достигает
давление окружающего воздуха. Теперь пузырьки, образующиеся при испарении в
внутренности жидкости больше не подавляются. Они вырастают до больших размеров, поднимаются
на поверхность и выпускают пары в воздух. Это иногда взрывоопасно
испарение, которое начинается внутри жидкости, называется кипением. Пузыри
представляют собой водяной пар, возможно смешанный с небольшим количеством воздуха, который раньше
растворил воду. Ранее растворенный воздух также производит крошечные пузырьки.
которые появляются в начале процесса нагрева.
Пузыри
представляют собой водяной пар, возможно смешанный с небольшим количеством воздуха, который раньше
растворил воду. Ранее растворенный воздух также производит крошечные пузырьки.
которые появляются в начале процесса нагрева.
Вопрос:
Погода в Ноксвилле летом часто жаркая и влажная. Под теми условиях, почему время после восхода солнца самое комфортное время суток? Почему это не время сразу после захода солнца, когда температура начинает падать? немного опуститься?
Ответ:
Сразу после восхода солнца, когда температура повышается, скорость испарения
увеличивается. Однако количество водяного пара в воздухе все еще невелико.
Поэтому скорость конденсации и относительная влажность довольно низкие.
Таким образом, пот на коже испаряется. Испарение охлаждает оставшуюся
пот и, посредством проводимости, кожу. Так как плотность водяного пара в
воздух увеличивается, чистая скорость испарения уменьшается, потому что больше и
больше молекул попадает в жидкость.

Leave A Comment