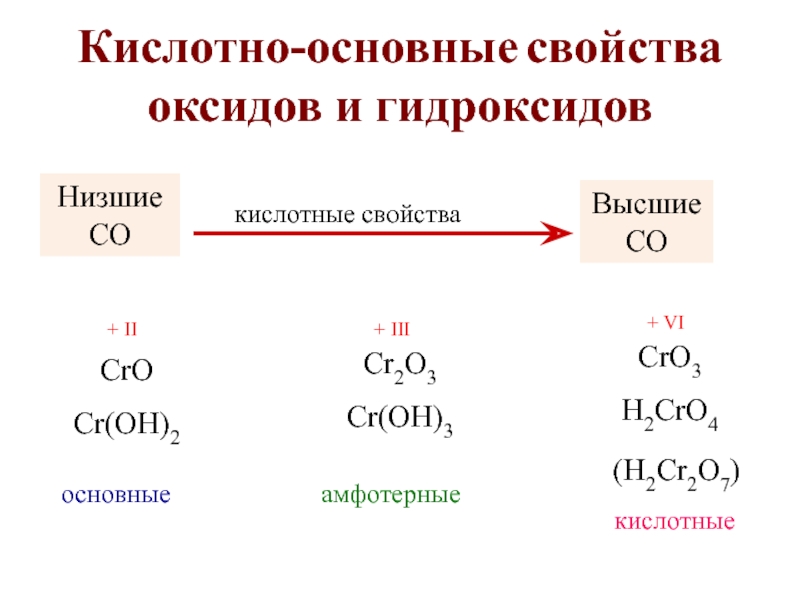
2.2.4. Кислотно-основные свойства оксидов и гидроксидов
Оксиды металлов в низших степенях окисления (+1,+2) имеют основный характер. Им соответствуют основания, например: Cu2O→ CuOH; CaO→ Ca (OH)2; MnO→Mn(OH)2; K2O→KOH; BaO→Ba(OH)2; FeO→Fe(OH)2.
Оксиды неметаллов в любой степени окисления, а также металлов со степенью окисления > +4 проявляют кислотные свойства. Им соответствуют кислоты, например: CO2→H2CO3; V2O5→HVO3; Mn2O7→HMnO4; SO3→H2SO4; N2O5→HNO3; MoO3→H2MoO4.
Оксиды металлов со степенью окисления +2 могут проявлять амфотерные свойства. Им соответствуют и основания, и кислоты, например:
Основание
Zn(OH)2;
Al(OH)3;
Sn(OH)4.
Оксид ZnO; Al2O3; SnO2.
Кислота H2ZnO2; HAlO2; H2SnO3.
У оксидов одного и того же элемента с увеличением степени окисления основные свойства ослабевают и усиливаются кислотные свойства, например:
Элемент | Cr | ||
С.о. | +2 | +3 | +6 |
Оксид | CrO | Cr2O3 | CrO3 |
Свойства | основные | амфотерные | кислотные |
Форма гидроксида | Cr(OH)2 | Cr(OH)3 HСrO | H2CrO4 H2Cr2O7 |
Внешний
и предвнешний энергетические уровни
атомов имеют следующую электронную
конфигурацию А, В (таблица).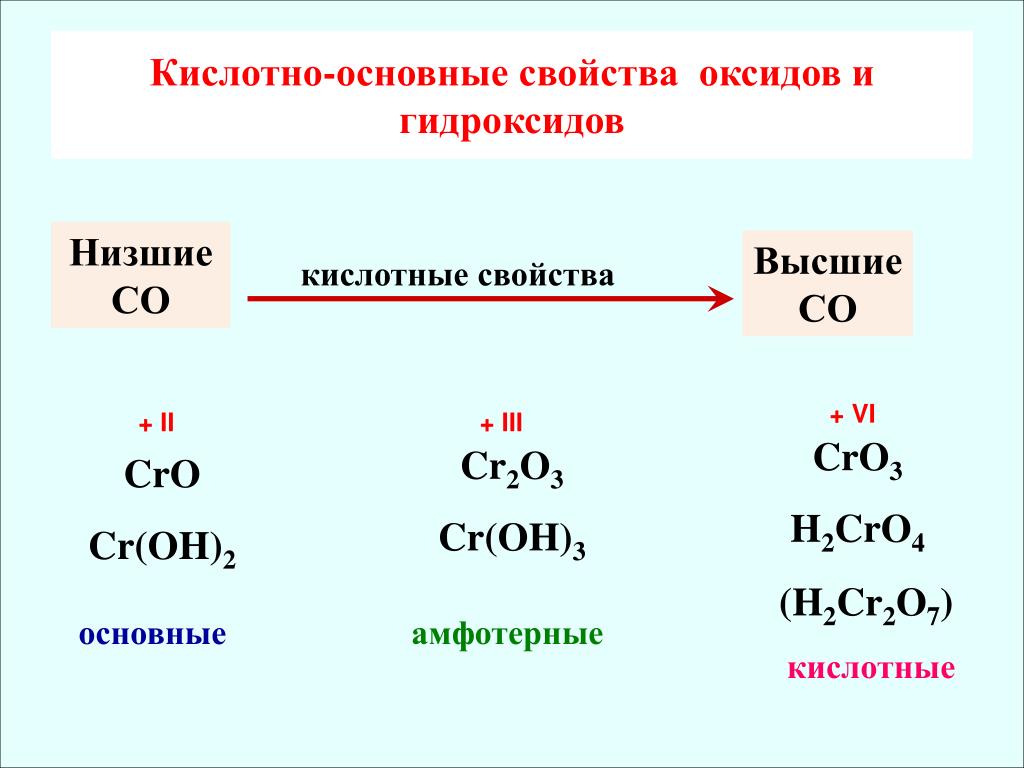
Таблица
Электронные конфигурации
Номер задачи | Электронная конфигурация | |
А | В | |
21 | …5d6 6s2 | …5s25p3 |
22 | …7s2 | …4d7 5s1 |
23 | …2s22p1 | …5d2 6s2 |
24 | …5d3 6s2 | …3p64s2 |
25 | …4s24p2 | …5d4 6s2 |
26 | …3d5 4s1 | …3s23p3 |
27 | …4s24p2 | …5p6 |
28 | …5d10 6s2 | …4s24p2 |
29 | …5d3 6s2 | …2s22p2 |
30 | …3d5 4s2 | …5s25p2 |
31 | …3s23p | …4d2 5s2 |
32 | …4p65s2 | …3p64s1 |
33 | …3s23p2 | …5d5 6s2 |
34 | …2p63s1 | …5d4 6s2 |
…3s23p1 | …5d3 6s2 | |
36 | …3p64s2 | …4d4 5s1 |
37 | …4s24p1 | …5d1 6s2 |
38 | …3s2 3p4 | …3d1 4s2 |
39 | …3d2 4s2 | …5s2 5p3 |
40 | …3d2 4s2 | …6s2 6p1 |
Найти положение
этих элементов в периодической системе,
указав период, группу, подгруппу.
41. Как изменяется электроотрицательность и способность атомов принимать электроны в ряду F→Cl →Br→I?
42. Укажите, какое из двух соединений является более сильным основанием? Почему? a) NaOH или Cs(OH)2;б) Са(ОН)2 или Ga(OH)3; в) Sn(OH)2
43. Какую низшую степень окисления проявляют водород, фтор, сера, азот? Почему? Составьте формулы соединений кальция с данными элементами в этой степени окисления. Как называются эти соединения?
44. Марганец образует соединения, в которых
он проявляет степени окисления +2, +3, +4,
+6, +7. Составьте формулы оксидов и
гидроксидов, отвечающих этим степеням
окисления. Напишите уравнения реакций,
доказывающих амфотерность гидроксида
марганца (IV)?
Марганец образует соединения, в которых
он проявляет степени окисления +2, +3, +4,
+6, +7. Составьте формулы оксидов и
гидроксидов, отвечающих этим степеням
окисления. Напишите уравнения реакций,
доказывающих амфотерность гидроксида
марганца (IV)?
45. У какого элемента пятой группы — сурьмы или висмута сильнее выражены металлические свойства? Почему?
46. Какой из элементов четвертого периода — ванадий или мышьяк — обладают более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов.
47. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
48.
49. Как изменяется энергия ионизации атомов благородных газов от гелия к радону? Почему?
50. На каком основании элементы хром и сера, фосфор и ванадий указаны в одной группе? Почему их помещают в разных подгруппах периодической системы?
ГДЗ (ответы) Химия 8 класс Григорович А.В., 2016 §6 Периодический закон Д. И. Менделеева » Допомога учням
Другие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Сформулируйте Периодический закон. Свойства химических элементов, а также образованных ими простых и сложных веществ находятся в периодической зависимости от относительных атомных масс элементов.
Вопрос 2 Какие свойства элементов и их соединений изменяются периодически? Высшая валентность элементов (от I-VIIІ), характеристика простого вещества (от металлов к неметаллам), химический характер высших оксидов (от основных через амфотерные к кислотным).
Вопрос 3 Что называют периодом химических элементов? Ряд химических элементов, расположенных в порядке возрастания их атомных масс, начинающийся с Гидрогена или щелочного металлического элемента и заканчивающийся инертным элементом, называют периодом.
Вопрос 4 Какие периоды называют малыми?
Первый (содержит 2 элемента), второй и третий (содержат по 8 элементов) периоды содержат до 8 элементов, поэтому их называют малыми.
Какие периоды называют большими?
Пятый, шестой, седьмой периоды содержат по 18 и более элементов, поэтому их называют большими.
Почему их называют именно так? Поскольку в малых периодах переход от типичного металлического элемента к типовому неметаллическому элементу происходит через семь элементов, а в больших периодах такой же переход происходит через 17 или 31 элементы.
Вопрос 5 Чем отличается изменение характера элементов в больших и малых периодах? В больших периодах изменение свойств происходит значительно медленнее: свойства соседних элементов в больших периодах отличаются значительно меньше, чем в соседних элементов малых периодов.
Вопрос 6 В какой части периода расположены элементы, относящиеся к семействам:
а) щелочных элементов
В начале каждого периода (слева Периодической системы).
б) галогенов
На предпоследнем месте каждого периода (справа Периодической системы).
в) инертных элементов?
В конце каждого периода (в конце периодической системы).
Задания для усвоения материала
Задание 1 Найдите в Периодической системе элементы, расположенные не в порядке увеличения относительной атомной массы.
№18 Аргон Ar(Ar)=40 и №19 Калий Ar(K)=39
№27 Кобальт Co Ar(Co)=58,93 и №28 Никель Ar(Ni)=58,69
№52 Теллур Ar(Te)=127,6 и №53 Иод Ar(I)=126,9
Какие противоречия появятся, если их расположить согласно их атомным массам? Нарушится периодическая смена свойств химических элементов, а также образованных ими простых и сложных веществ.
Задание 2 Как изменяется характер оксидов элементов в периоде? В периоде характер оксидов изменяется от основного к кислотному.
Проиллюстрируйте уравнениями реакций свойства оксидов Лития и Карбона.
Li2O + H2O = 2LiOH щелоч литий гидроксид
СO2 + H2O = H2CO3 карбонатная кислота
Какие свойства характерны для их гидратов?
В периоде слева направо ослабляются основные свойства и усиливаются кислотные свойства гидратов.
Продукты присоединения воды к оксидам, называют гидратами.
Задание 3 Составьте формулы высших оксидов и гидратов оксидов элементов третьего периода. Укажите характер этих соединений (кислотный или оснóвный).
|
Na2O NaOH основный
|
MgO Mg(OH)2 основный
|
Al2O3 Al(OH)3; H2AlO3 амфотер- ный |
SiO2 H2SiO3 кислот- ный
|
P2O5 H3PO4 кислот- ный
|
SO3 H2SO4 кислот- ный
|
Cl2O7 HCl кислот- ный
|
Задание 4 Элемент в Периодической системе имеет порядковый номер 16.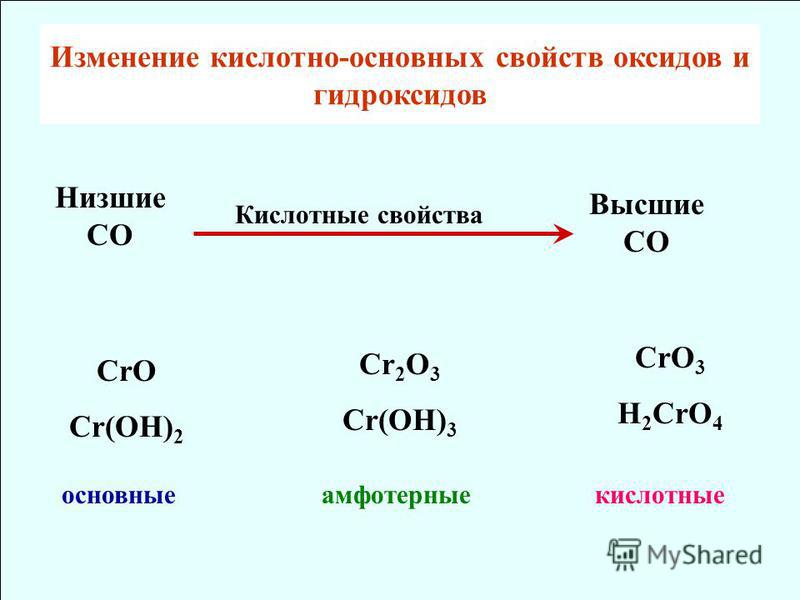 Какими свойствами обладают его оксиды, соответствующие высшей и низшей валентности? Элемент с порядковым №16 ― это Сульфур S, который образует два оксиды SO3 (валентность Сульфура VI) и SO2 (валентность Сульфура IV), которые проявляют кислотные свойства, и их гидратами являются кислоты.
Какими свойствами обладают его оксиды, соответствующие высшей и низшей валентности? Элемент с порядковым №16 ― это Сульфур S, который образует два оксиды SO3 (валентность Сульфура VI) и SO2 (валентность Сульфура IV), которые проявляют кислотные свойства, и их гидратами являются кислоты.
SO2 + H2O = H2SO3
SO3 + H2O = H2SO4
Образует ли этот элемент соединения с Гидрогеном? Образует.
H2S ― сульфидна кислота.
Задание 5 Проанализируйте положение в Периодической системе элементов, способных образовывать летучие соединения с Гидрогеном (см. форзац 1).
Элементы IV ― VII групп.
Проявление элементом каких свойств свидетельствует об образовании им летучего соединения с Гидрогеном? Неметаллических свойств, ведь летучие соединения с Гидрогеном образуют только неметаллы.
Задание 6 До конца 60-х гг. XIX в. два элемента — А и Б — считали двухвалентными металлическими элементами и приписывали им неправильные атомные массы. Не найдя для них в Периодической системе места, которое соответствовало бы их свойствам, Д. И. Менделеев увеличил в полтора раза значения их атомных масс и уточнил валентность каждого из них, и тогда место для них нашлось. Неправильные атомные массы, которые приписывались элементам, были следующие: у элемента А — около 60, а у элемента Б — немногим больше 90. Найдите им место в Периодической системе и назовите эти элементы.
XIX в. два элемента — А и Б — считали двухвалентными металлическими элементами и приписывали им неправильные атомные массы. Не найдя для них в Периодической системе места, которое соответствовало бы их свойствам, Д. И. Менделеев увеличил в полтора раза значения их атомных масс и уточнил валентность каждого из них, и тогда место для них нашлось. Неправильные атомные массы, которые приписывались элементам, были следующие: у элемента А — около 60, а у элемента Б — немногим больше 90. Найдите им место в Периодической системе и назовите эти элементы.
Поскольку Ar(A)=60•1,5=90>89, поэтому этим элементом есть Итрий Y с порядковым №39 и Ar(Y)=89
Поскольку Ar(Б)=90•1,5=135<137, поэтому этим елементом есть Барий Ва с порядковым №56 и Ar(Ba)=137
Другие задания смотри здесь…
неорганическая химия — Почему оксиды с элементом в более высокой степени окисления более кислые
спросил
Изменено 3 года, 2 месяца назад
Просмотрено 6к раз
$\begingroup$
Мы наблюдаем такую тенденцию кислотно-основного свойства оксидов в большинстве случаев:
$\ce{Mn2O7}$ является кислотным, $\ce{MnO}$ является основным, промежуточные оксиды становятся все менее кислыми и более основными по мере уменьшения степени окисления $\ce{Mn}$.
В чем причина такой общей тенденции почти во всех случаях?
Я видел много объяснений этого, большинство из них связаны со способностью высвобождать протон связи $\ce{E-O-H}$ в гидролизованном оксиде. Но большинство оксидов переходных металлов не гидролизуются в воде. Итак, я ищу альтернативное объяснение, не связанное с гидролизом оксида. Кроме того, в большинстве объяснений в Интернете отсутствует какая-либо ссылка, поэтому я предпочитаю ссылку.
- неорганическая химия
- кислотно-щелочной
- степень окисления
$\endgroup$
2
$\begingroup$
Это не всегда так. Согласно Википедии, медь (I) становится кислой, образуя анионный гидроксидный комплекс, примерно на 1,5 единицы pH ниже , чем у меди (II). Более высокая степень окисления меди квалифицируется как менее кислая. {2+}$ дают $Cr(OH)_3$ и $Cr(OH)_2$, которые также являются нерастворимыми и некислотными.
{2+}$ дают $Cr(OH)_3$ и $Cr(OH)_2$, которые также являются нерастворимыми и некислотными.
$\endgroup$
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
неорганическая химия — Почему основность оксидов увеличивается вниз по группе?
$\begingroup$
В качестве примера возьмем оксиды группы $13$. Элементы этой группы $\ce{B,Al,Ga,In,Tl}$.
Оксид бора $\ce{B2O3}$ является кислотным, $\ce{Al2O3}$ и $\ce{GaO3}$ – амфотерными, а $\ce{In2O3}$ и $\ce{Tl2O3}$ – основными природа.
В чем причина этого?
- неорганическая химия
- кислотно-основная
$\endgroup$
2
$\begingroup$
Как указано в комментариях, основные факторы играют роль
- Размер атома
По мере увеличения атомного размера элемента его сродство к электрону соответственно уменьшается. Получается, что при вертикальном движении в таблице Менделеева размер атома превосходит его электроотрицательность по отношению к основности. Атомный радиус галлия, например, примерно в два раза больше, чем у бора, поэтому в ионе галлия заряд распределяется по значительно большему объему.
Атомный радиус галлия, например, примерно в два раза больше, чем у бора, поэтому в ионе галлия заряд распределяется по значительно большему объему.
Электростатические заряды, как положительные, так и отрицательные, более стабильны, когда они «рассредоточены», чем когда они сосредоточены в одном месте.
- Сродство к электрону
Способность атома «принимать электрон» уменьшается вниз по группе, следовательно, увеличивается тенденция элементов быть хорошими основаниями Льюиса (вспомним, что основание Льюиса является донором электронной пары). Таким образом, уменьшение сродства к электрону вниз по группе означает, что элементы скорее отдают электрон, чем принимают его.
- Электроотрицательность
Чем более электроотрицательный атом, тем лучше он способен нести отрицательный заряд. Вниз по группе электроотрицательность элементов уменьшается вниз по группе. B очень электроотрицательный и не выпускает легко электроны, а вместо этого удерживает их, кроме того, способен стабилизировать отрицательный заряд и, следовательно, имеет хорошие кислотные свойства в отличие от элементов, находящихся ниже по группе.

Leave A Comment