2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Вторичные спирты окисляются оксидом меди (II) до кетонов.
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Методы получения спиртов
1. Спирты можно получить действием воды на алкены. Реакцию проводят в присутствии серной кислоты, при этом сначала образуется эфир серной кислоты, а затем под действием воды — соответствующий спирт.
Этот метод используют в промышленности для получения этилового и изопропилового спирта. Он называется методом сернокислотной гидратации.
2. Кроме того, спирты можно получать действием водного раствора щелочи на галогенпроизводные (гидролиз галогенпроизводных):
3. Этиловый спирт получают брожением глюкозы:
С6
Основные
реакции спиртов — это реакции по
гидроксильной группе.
1. Спирты реагируют с металлическим натрием. При этом водород в гидроксильной группе замещается на металл — образуется алкоголят и выделяется водород:
2CH3-CH2-OH + 2Na 2 CH3-CH2-ONa + Н2
этилат натрия
2. Спирты взаимодействуют с минеральными и органическими кислотами, при этом происходит образование сложных эфиров:
3. При нагревании спиртов с водоотнимающими средствами происходит отщепление молекулы воды от молекулы спирта и образуется алкен:
4. Если эту реакцию проводить в избытке спирта и при температуре, не превышающей 160°С, происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир:
5. При действии галогенводородов (НС1, HBr, H) гидроксильная группа замещается на галоген (Cl. Br, )
6. Спирты
окисляются сильными окислителями или
кислородом воздуха при температуре
300-500°С на катализаторах. При этом
первичные спирты образуют альдегиды,
вторичные — кетоны.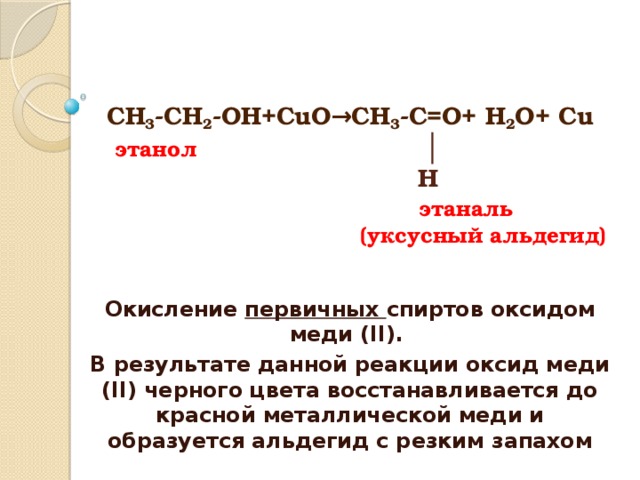
Для получения двухатомных спиртов (гликолей) применимы те же способы, что и для одноатомных спиртов. Этиленгликоль обычно получают из этилена следующими методами:
Гликоли дают все реакции одноатомных спиртов с тем лишь различием, что в реакции могут участвовать как одна, так и две гидроксильные группы.
При действии на гликоли гидрата окиси меди образуется голубой осадок комплексного соединения. Эта реакция используется как качественная реакция на гликоли.
Этиленгликоль применяется как антифриз для автомобильных двигателей, т.к. понижает температуру застывания воды. Полиэфиры этиленгликоля находят применение в различных отраслях промышленности.
Первым представителем трехатомных спиртов является глицерин. Его получают гидролизом жиров, которые представляют собой сложные эфиры глицерина и высших жирных кислот.
Гидролиз
жиров обычно называют омылением,
поскольку образующиеся при этом натриевые
соли высших жирных кислот являются
мылами. Глицерин также получают из
пропилена, который выделяют из газов
процессов крекинга.
Глицерин также получают из
пропилена, который выделяют из газов
процессов крекинга.
Химические свойства глицерина обусловлены наличием трех гидрок-сильных групп, при этом глицерин может давать три ряда производных: моно-, ди- и трипроизводные. Глицерин применяется в парфюмерии, кондитерском производстве, для получения нитроглицерина.
Ароматические соединения, у которых гидроксильная группа находится при углеродном атоме в боковой цепи, называют ароматическими спиртами. Их простейшими представителями являются:
Для этих
спиртов присущи способы получения и
химические свойства, которые характерны
для алифатических спиртов. Эти спирты
представляют практический интерес,
поскольку в свободном виде и в виде
эфиров широко распространены в
растительном мире и часто в виде сложных
эфиров применяются в парфюмерии из-за
приятного запаха. Например, бензиловый
спирт в свободном виде или в виде эфиров
встречается в масле жасмина. -Фенил-этиловый
спирт является основной составляющей
в розовом масле.
Окисление оксидом меди(II)
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
редокс — Как медь окисляет спирты?
$\begingroup$
Рассмотрим, например, нагревание этанола в присутствии меди до 300 °C. Как он дает этаналь как продукт?
Медь в элементарном состоянии (степень окисления 0). Поскольку для Cu невозможна отрицательная степень окисления, это означает, что он должен восстанавливать этанол до этана. Определенную роль здесь, конечно, должна сыграть высокая температура. Что бы это могло быть?
- редокс
- переходные металлы
- органическое окисление
$\endgroup$
1
$\begingroup$
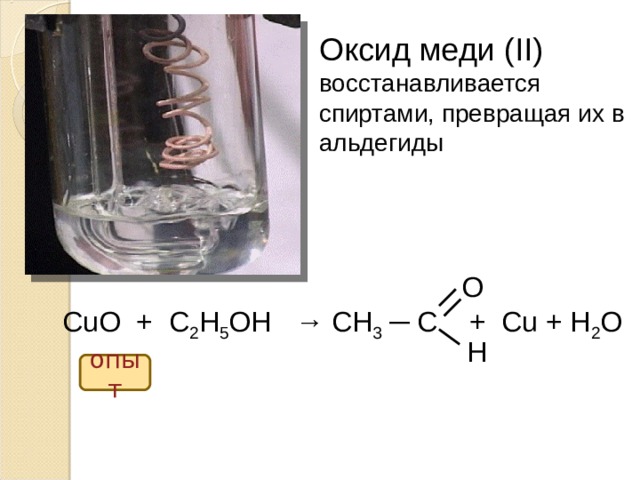
При нагревании на воздухе кусок металлической меди окисляется до черного оксида меди $\ce{CuO}$ по схеме $$\ce{2 Cu + O2 -> 2 CuO}$$
При нагревании оксида меди $ \ce{CuO}$ находится в контакте с парами этанола $\ce{C2H5OH}$, реагирует по схеме: $$\ce{CuO + C2H5OH -> Cu + Ch4CHO + h3O}$$ и регенерируется металлическая медь .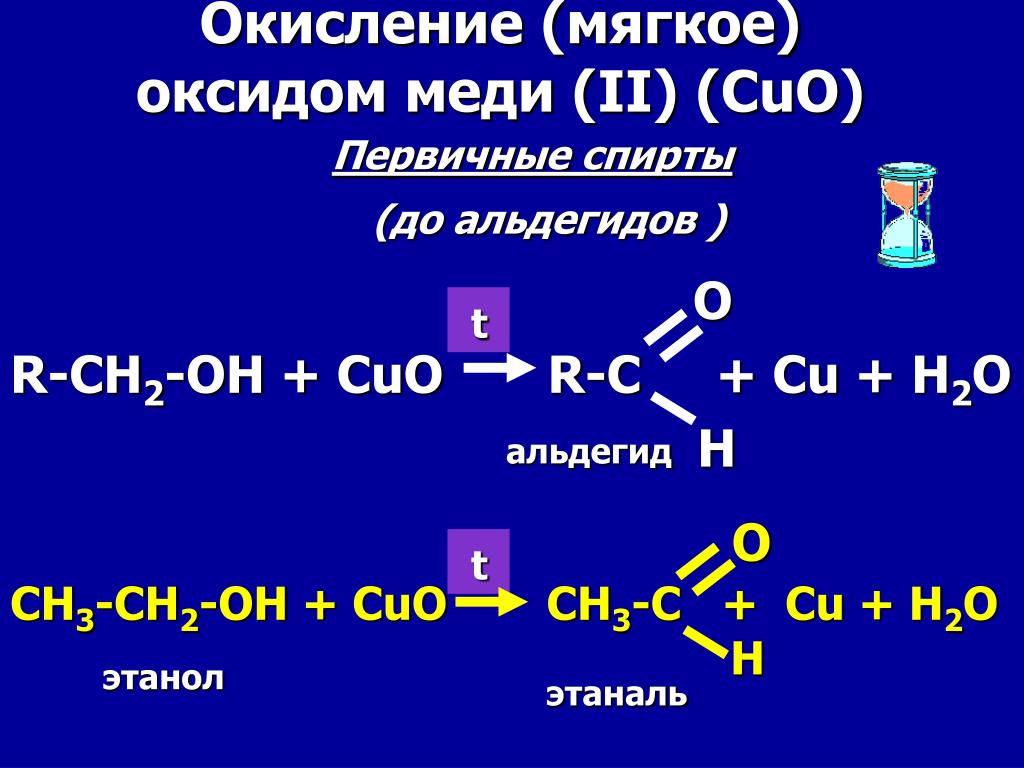 Так, если медную пластину нагреть в смеси воздух + этанол, она одновременно окисляется до $\ce{CuO}$ и восстанавливается до $\ce{Cu}$, так что единственный видимый эффект в эксперименте состоит в том, что этанол молекулы превращаются в молекулы этаналя $\ce{Ch4CHO}$.
Так, если медную пластину нагреть в смеси воздух + этанол, она одновременно окисляется до $\ce{CuO}$ и восстанавливается до $\ce{Cu}$, так что единственный видимый эффект в эксперименте состоит в том, что этанол молекулы превращаются в молекулы этаналя $\ce{Ch4CHO}$.
$\endgroup$
2
$\begingroup$
У вас, вероятно, было одно или оба из следующих:
Медь содержала немного оксида, который окислял спирт, оставляя металл.
Если бы в вашей системе был воздух, особенно при нагревании, медь могла бы вступить с ним в реакцию с образованием оксида (относительно быстрая реакция при нагревании), и вы вернулись к (1). Тогда металл, конечно, будет доступен для реакции с большим количеством воздуха. Фактически это будет каталитическое окисление.
Медь на самом деле известна в отрицательных степенях окисления, но это не происходит и не должно упоминаться здесь.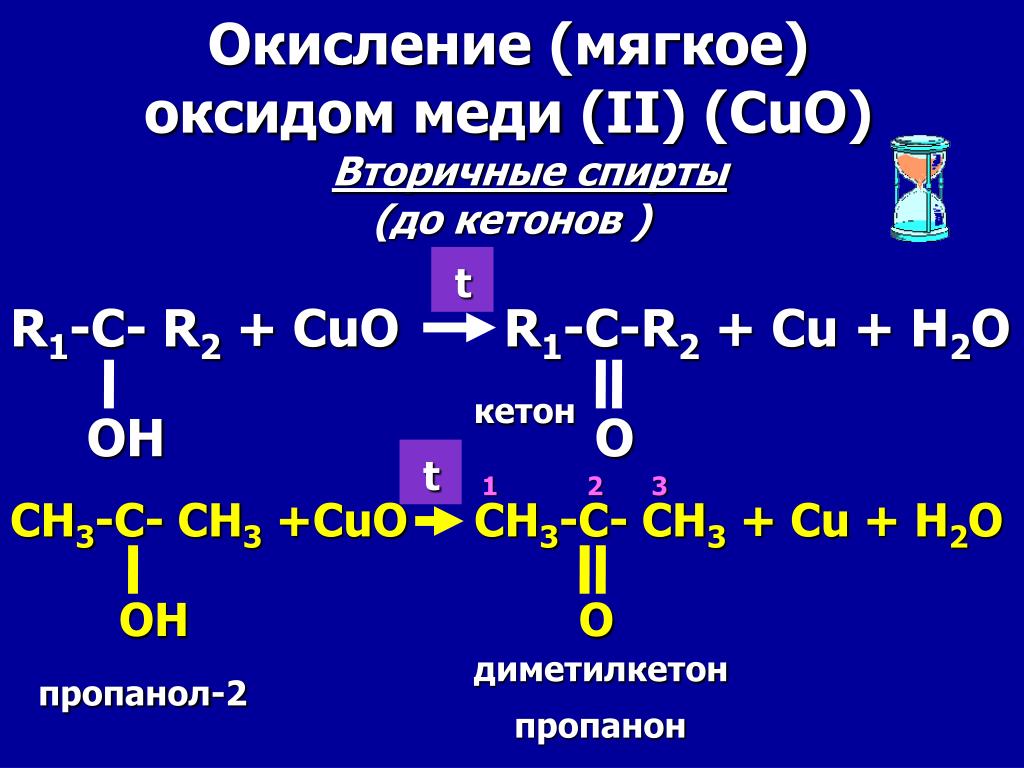
$\endgroup$
$\begingroup$
Медь является очень хорошим дегидрирующим и обезвоживающим средством.
Когда первичный спирт нагревают в присутствии меди, то один водород, связанный с кислородом, а другой, связанный с углеродом, уходит в виде газообразного водорода, превращая его в альдегид.
Дальнейшее окисление альдегида в карбоновую кислоту нежелательно.
Вторичный спирт превращается в кетон, демонстрируя ту же природу, что и выше.
Но третичные спирты проявляют дегидратирующую природу, превращая спирт в алкен по правилу Зайцева.
$\endgroup$
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Реакции дегидрирования этанола, катализируемые медью, нанесенной на пористые смешанные оксиды Al–Mg
Дэви Д. Петролини, и Веллингтон Х. Кассинелли, б Кристиан А. Перейра, c Эрнесто А. Уркиета-Гонсалес, c Целсо В. Сантилли и и Леандро Мартинс * и
Принадлежности автора
* Соответствующие авторы
и Instituto de Química, UNESP – Universidade Estadual Paulista, R. Prof. Francisco Degni 55, 14800-900 Araraquara, SP, Бразилия
Prof. Francisco Degni 55, 14800-900 Araraquara, SP, Бразилия
Электронная почта: [email protected]
б Instituto Federal de São Paulo – Campus Avaré, Av. Проф. Селсу Феррейра да Силва, 1333 г., Jardim Europa, Аваре, СП, Бразилия
с Centro de Pesquisas em Materiais Avançados e Energia – Федеральный университет Сан-Карлоса, Родовия Вашингтон-Луис, км 235, Сан-Карлос, СП, Бразилия
Аннотация
rsc.org/schema/rscart38″> Смешанные оксиды алюминия и магния (AlMgO), приготовленные с помощью эмульсионно-опосредованного золь-гель метода, пропитывали раствором нитрата меди и использовали в реакциях дегидрирования этанола с получением ацетальдегида и этилацетата. Эмульгированная система позволила получить макро-мезопористую подложку, что привело к превосходному диспергированию меди. Пористый катализатор был примерно в 3 раза более активен, чем непористый аналог, за счет образования на поверхности носителя Cu 0 вместе с более активными видами Cu + . Фактически, одновременное присутствие Cu + и Cu 0 было благоприятным для каталитических характеристик, так как частоты оборота составляли 122 и 166 ч -1 для непористого эталонного катализатора. и для пористого соответственно. Оба катализатора дезактивировались за счет спекания частиц меди, однако пористый дезактивировался в меньшей степени вследствие лучшего диспергирования частиц меди на макро- и мезопористом носителе.

Leave A Comment