Аммиак. Физические и химические свойства аммиака, получение, применение. Соли аммония
Урок посвящен изучению темы «Аммиак». Вы узнаете о свойствах соединений азота, в которых он проявляет степень окисления -3, в какие химические реакции и при каких условиях вступает аммиак.
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова
По другим сведениям, аммиак получил своё название от древнеегипетского слова
I. Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH
III. Получение аммиака
|
В лаборатории |
В промышленности |
|
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха: Опыт: “Получение аммиака” |
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия:
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода) |
IV. Химические свойства аммиака
Химические свойства аммиака
Для аммиака характерны реакции:
- C изменением степени окисления атома азота (реакции окисления)
- Без изменения степени окисления атома азота (присоединение)
1. Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 → N+2
NH3 – сильный восстановитель
- Взаимодействие с кислородом
1.Горение
Опыт: “Горение аммиака”(при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Видео — эксперимент: «Окисление аммиака в присутствии оксида хрома»
- Взаимодействие с оксидами металлов
2NH3 + 3CuO = 3Cu + N2 + 3H2O
- Взаимодействие с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- Аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
2. Реакции без изменения степени окисления атома азота (присоединение —Образование иона аммония NH4+ по донорно-акцепторному механизму)
Реакции без изменения степени окисления атома азота (присоединение —Образование иона аммония NH4+ по донорно-акцепторному механизму)
Видео — эксперимент:
Видео — эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео-эксперимент:“Взаимодействие аммиака с концентрированными кислотами”
Видео — эксперимент: «Фонтан»
Видео — эксперимент: «Растворение аммиака в воде»
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония — это сложные вещества, в состав которых входят ионы аммония Nh5+, соединённые с кислотными остатками.
Например,
Nh5Cl – хлорид аммония
(NH4)2SO4 — сульфат аммония
Nh5NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
Nh5H
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: Nh4 + HNO3 → Nh5NO3
2 способ: Аммиачная вода + кислота: 2Nh5OH + h3SO4 → (Nh5)2SO4+ 2Н2O
4. Химические свойства
Химические свойства
Общие свойства
1. Сильные электролиты (диссоциируют в водных растворах полностью)
Nh5Cl → Nh5+ + Cl—
2. Взаимодействие с кислотами (реакция обмена)
(Nh5)2CO3 + 2НCl → 2Nh5Cl + Н2O + CO2
2Nh5+ + CO32- + 2H+ + 2Cl— → 2Nh5+ + 2Cl— + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(Nh5)2SO4 + Ba(NO3)2 → BaSO4↓ + 2Nh5NO3
2Nh5+ + SO42- + Ba2+ + 2NO3— → BaSO4↓ + 2Nh5+ + 2NO3—
Ba2+ + SO42- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: Nh5Cl → Nh4 + HCl (при нагревании)
Nh5HCO3 → Nh4 + Н2O + CO2
youtube.com/embed/BXo0cNYvAbc» frameborder=»0″ allowfullscreen=»allowfullscreen»>б) если анион проявляет окислительные свойства: Nh5NO3 → N2O + 2Н2O (при нагревании)
(Nh5)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на Nh5+ — ион аммония
При нагревании со щелочами выделяется газ аммиак
Nh5Cl + NaOH → NaCl + Nh4 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
Nh5Cl + Н2O → Nh5OH + HCl
Nh5+ + Н2O → Nh5OH + H+
5. Применение
- Нитрат аммония (аммиачная селитра) Nh5NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (Nh5)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония Nh5HCO3 и карбонат аммония (Nh5)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония Nh5Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.

VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
|
Соли |
Химические свойства, общие с другими солями (1 – 3) |
Специфические свойства (1 – 2) |
|
1. Хлорид аммония |
|
|
|
2. Карбонат аммония |
|
|
|
3. Сульфид аммония |
|
|
|
4. Сульфат аммония |
|
|
|
5. |
|
|
Задание №2.
Ответьте на вопрос: Гидрокарбонат аммония иногда применяют при выпечке кондитерских изделий. Какие свойства гидрокарбоната при этом используют? Ответ подтвердите уравнениями реакций.
Задание №3. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
Задание №4. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
VIII. Тренажеры
Тренажёр №1: «Горение аммиака»
Тренажёр №2:«Химические свойства аммиака»
ЦОРы
Опыт: “Получение аммиака”
Опыт: “Горение аммиака”
Видео — Эксперимент: «Окисление аммиака в присутствии оксида хрома»
Анимация: “Донорно-акцепторнорный механизм”
Видео — Эксперимент: “Качественная реакция на аммиак”
Видео — Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео — Эксперимент: “Взаимодействие аммиака с концентрированными кислотами”
Видео — Эксперимент: «Фонтан»
Видео — Эксперимент: «Растворение аммиака в воде»
Опыт: “Разложение карбоната аммония”
Опыт: “Качественная реакция на ион аммония”
Опыт:“Разложение дихромата аммония”
ФГБОУ ВО ПГФА Минздрава России
«Таймлайн: 0:04 Вступительное слово
1:25 Об академии
2:35 О приемной кампании
3:45 О факультетах и направлениях обучения, проходных баллах
15:11 Документы для поступления
17:33 О дополнительных баллах
20:15 О специальности «Провизор» и «Фармацевт»
27:46 Об аптечной сети АО «Пермфармация»
32:54 Об опыте работы провизором
37:14 Об истории фармации
40:45 Кем могут работать фармспециалисты
43:25 Где могут работать фармспециалисты в Пермском крае»
youtube.com/embed/frg0GOv-UXA»>Серия обучающих программ по вопросам здорового питания
…
Здоровое питание. Советы на каждый день
…
еще …
Наши новости
Пермская фармакадемия договорилась о сотрудничестве с сирийским Дамасским университетом
28 марта 2023
Открыт тестовый доступ к электронной коллекции Henry Stewart Talks: The Biomedical & Life Sciences Collection
16 марта 2023
еще …
Наши события
В ПГФА наградили лучших студентов иностранцев по итогам зимней сессии
05 апреля 2023
85 лет Молоховой Лилии Георгиевне (1938-2007)
03 марта 2023
еще . ..
..
Конференции, олимпиады, форумы…
Итоги конкурса для студентов ФГБОУ ВО ПГФА «Картины из таблеток»
03 апреля 2023
Поздравляем победителей очного этапа VII Всероссийской олимпиады по истории фармации 2022-2023 уч.года
28 марта 2023
О завершении и итогах заочного этапа Всероссийской олимпиады по истории фармации
24 марта 2023
еще …
Новости спорта
Завершилось личное первенство ПГФА по настольному теннису
29 марта 2023
Итоги I Спартакиады студентов медицинских и фармацевтических вузов России по женскому волейболу
20 марта 2023
Новости с I Спартакиады медицинских и фармацевтических ВУЗов ПФО
20 марта 2023
еще …
Button
Ученый совет
Коммерческое предложение ПК 2023
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
День открытых дверей
Информация об аккредитации специалистов
Галерея новостей
Видеообзор — введение в профессию
Юбилей ПГФА.
 Уже 85 лет наша академия готовит кадры для фармотрасли. Подробно рассказываем где это происходит сейчас
Уже 85 лет наша академия готовит кадры для фармотрасли. Подробно рассказываем где это происходит сейчасПоказываем аудитории, лаборатории, корпуса. Вы увидите все возможности для обучения, трудоустройства и отдыха тех, кто выбрал ПГФА. Здесь про науку, образование и наши ценности.
Смотреть все видеообзоры о професии
Пермская государственная фармацевтическая академия — для талантливых и целеустремленных
Cюжет ГТРК «Пермь» о юбилейных мероприятиях ПГФА и подписании соглашения о создании фармкластера
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Сумма степеней окисления азота в \\[N{{H}_{4}}N{{O}_{3}}\\] равна:(a)+1(b)+2(c) +4 (d) Ни один из этих
Последняя обновленная дата: 31 марта 2023 г.
•
Общее представление: 284,1K
•
Просмотры сегодня: 7,58K
Ответ
Проверенные
284,1K+ просмотры
Подсказка: нитрит аммония может ионизироваться на два иона. Оба содержат один атом азота. Каждый атом азота имеет свою индивидуальную степень окисления в зависимости от общей степени окисления. 9{-}\].
Мы знаем, что в аммонии степень окисления водорода всегда +1. В аммонии 4 атома водорода, а общая степень окисления аммония равна +1. Примем за х степень окисления азота в нитрате аммония.
X+4=+1
X=-3
Степень окисления азота в аммонии равна -3.
В случае нитрат-иона кислород имеет степень окисления -2. Есть 3 атома кислорода. Итак, полная степень окисления кислорода в молекуле нитрата равна -6. Полная степень окисления нитрат-иона равна -1. Следовательно, степень окисления азота в нитрат-ионе равна 9.0023 X-6=-1
X=+5
Теперь рассчитаем сумму степеней окисления азота в нитрате аммония
Сумма =5-3= +2
Сумма двух степеней окисления азота в нитрате аммония равна + 2.
Правильный вариант (б).
Дополнительная информация: Степени окисления элемента представляют количество электронов, которые атом может получить, потерять или разделить, когда он химически связывается с атомом другого элемента. Его также называют переносом электронов. Степень окисления используется для определения изменений в окислительно-восстановительных реакциях и аналогична валентным электронам, но отличается от формального заряда. Расположение атомов и вероятность существования молекулы называется формальным зарядом. 9{+}\]. Аммиак представляет собой газ, а аммоний находится в растворе. Аммоний является щелочным в растворе и дает pH 8.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к 12 классу по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю бракосочетания фейерверки 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом Химический класс 11 JEE_Main
Фосфин получают из следующей руды Химический класс кальция 12 JEE_Main
Актуальные сомнения
Что такое степень окисления азота — в физической химии нитрат аммония?
Задавать вопрос
спросил
Изменено 2 года, 3 месяца назад
Просмотрено 855 раз
$\begingroup$
Уравнение: $\ce{Nh5Cl + AgNO3 -> Nh5NO3 + AgCl}$
Я знаю, что степень окисления $\ce{N}$ в $\ce{Nh5Cl}$ равна -3, а в $\ce{AgNO3}$ +5.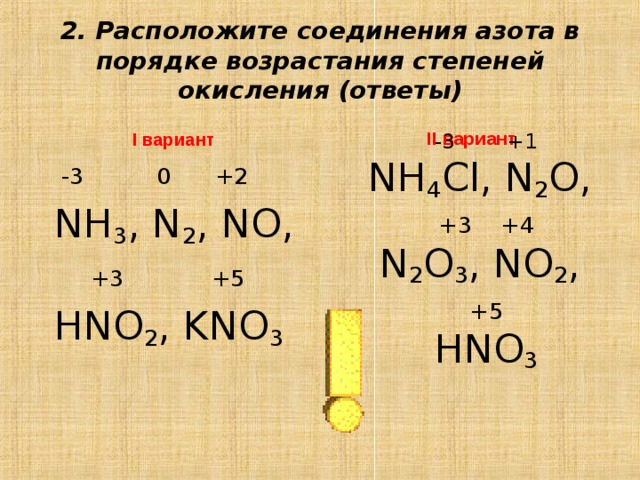


 Нитрат аммония
Нитрат аммония
Leave A Comment