Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time — Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
2 марта 2023
Современные тренды и прогнозы развития искусственного интеллекта
2 марта 2023
Первенство города Пятигорска по гиревому спорту
28 февраля 2023
Студенты ПМФИ приняли участие в международном брифинге
28 февраля 2023
В ПМФИ прошёл концерт, посвящённый 23 февраля
22 февраля 2023
Директор ПМФИ поздравляет сотрудников с 23 февраля
22 февраля 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ —
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности «Фармация», «Стоматология», «Лечебное дело», «Медицинская биохимия», будет проходить 30 августа 2021 г.
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13. 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Соединения азота. Окислительно-восстановительные реакции Взаимодействие металлов с серной кислотой
Рассмотрим степени окисления всех элементов в азотной кислоте. Кислород в сложных соединениях почти всегда находится в степени окисления -2 (за исключением пероксидов, надоксидов, фторида кислорода и т.д.). Атом водорода, который обязательно входит в состав протонных кислот, имеет степень окисления +1. Чтобы определить степень окисления атома азота, необходимо решить простое уравнение. Пусть х — степень окисления азота, тогда, по принципу электронейтральности молекулы, 1 + х + 3 * (-2) = 0, откуда х = 5. Ответ: степени окисления элементов в азотной кислоте равны +1, +5, -2 для водорода, азота и кислорода соответственно.
В данном задании вам необходимо определить степень окисления следующего соединения:
Определите последовательность выполнения данного задания
- Запишите что означает степень окисления;
- Определите степень окисления азотной кислоты;
- Запишите описание.

Степень окисления в данном соединении следующая
Степень окисления — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно — восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху.
Степень окисления азотной кислоты следующая:
HNO3 — степень окисления водорода + 1, степень окисления азота + 5, степень окисления кислорода — 2.
При обычных условиях азотная кислота представляет собой бесцветную жидкость (плотность 1,52 г/см 3), кипящую при 82,6 o C, а при температуре (-41,6 o C) затвердевающую в прозрачную кристаллическую массу. Брутто-формула — HNO 3 . Молярная масса — 93 г/моль. Строение молекулы азотной кислоты приведено на рис. 1.
Азотная кислота смешивается с водой в любых соотношениях. Является сильным электролитом, т.е. в водном растворе практически полностью диссоциирует на ионы. В ОВР проявляет себя в роли окислителя.
Рис. 1. Строение молекулы азотной кислоты с указанием валентных углов между связями и длин химических связей.
HNO3, степени окисления элементов в ней
Чтобы определить степени окисления элементов, входящих в состав азотной кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
(+1) + х + 3×(-2) = 0;
1 + х — 6 = 0;
Значит степень окисления азота в азотной кислоте равна (+5):
H +1 N +5 O -2 3 .
Примеры решения задач
ПРИМЕР 1
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась — составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.

Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам .
Задача .Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
А) Ag + HNO 3 → AgNO 3 + NO + H 2 O
б) Ca +H 2 SO 4 → CaSO 4 + H 2 S + H 2 O
в) Be + HNO 3 → Be(NO 3) 2 + NO + H 2 O
Решение .
Для решения данной задачи воспользуемся правилами определения степени окисления .
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO 3 → AgNO 3 + NO + H 2 O.
Шаг 1 . Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO 3 определим степень окисления, как сумму степеней окисления каждого из элементов .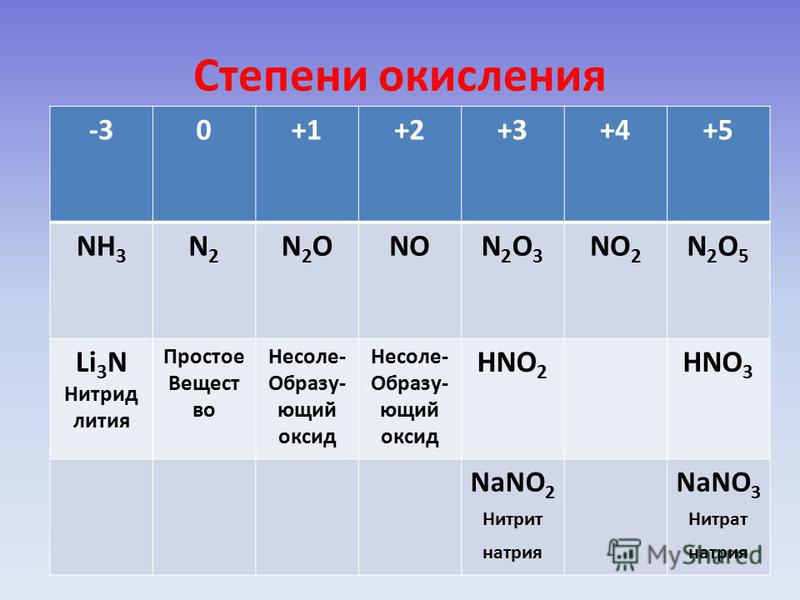
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO 3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H 2 O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде , с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag 0 + H +1 N +5 O -2 3 → Ag +1 N +5 O -2 3 + N +2 O -2 + H +1 2 O -2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов .
Шаг 3 . Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют )
Ag 0 — 1e = Ag +1
N +5 +3e = N +2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4 . Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO 3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO 3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H 2 O
Ответ:
3Ag + 4HNO 3 = 3AgNO 3 + NO + 2H 2 O
Составим электронный баланс для каждого элемента реакции окисления Ca +H 2 SO 4 → CaSO 4 + H 2 S + H 2 O
Для H 2 SO 4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO 4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H 2 S степень окисления водорода +1, соответственно серы -2
Ca 0 +H +1 2 S +6 O -2 4 → Ca +2 S +6 O -2 4 + H +1 2 S -2 + H +1 2 O -2
Ca 0 — 2e = Ca +2 (коэффициент 4)
S +6 + 8e = S -2
4Ca + 5H 2 SO 4 = 4CaSO 4 + H 2 S + 4H 2 O
Соединения со степенью окисления –3. Соединения азота в степени окисления -3 представлены аммиаком и нитридами металлов.
Соединения азота в степени окисления -3 представлены аммиаком и нитридами металлов.
Аммиак — NH 3 — бесцветный газ с характерным резким запахом. Молекула аммиака имеет геометрию тригональной пирамиды с атомом азота в вершине. Атомные орбитали азота находятся в sp 3 -гибридном состоянии. Три орбитали задействованы в образовании связей азот-водород, а четвертая орбиталь содержит неподеленную электронную пару, молекула имеет пирамидальную форму. Отталкивающее действие неподеленной пары электронов приводит к уменьшению валентного угла от ожидаемого 109,5 до 107,3 °.
При температуре -33,4 °С аммиак конденсируется, образуя жидкость с очень высокой теплотой испарения, что позволяет использовать его в качестве хладагента в промышленных холодильных установках.
Наличие у атома азота неподеленной электронной пары позволяет ему образовать еще одну ковалентную связь по донорно-акцепторному механизму. Таким образом в кислой среде происходит образование молекулярного катиона аммония — NH 4 + . Образование четвертой ковалентной связи приводит к выравниванию валентных углов (109,5 °) за счет равномерного отталкивания атомов водорода.
Образование четвертой ковалентной связи приводит к выравниванию валентных углов (109,5 °) за счет равномерного отталкивания атомов водорода.
Жидкий аммиак хороший самоионизирующийся растворитель:
2NH 3 NH 4 + + NH 2 —
амид-анион
В нем растворяются щелочные и щелочноземельные металлы, образуя окрашенные токопроводящие растворы. В присутствии катализатора (FeCl 3) растворенный металл реагирует с аммиаком c выделением водорода и образованием амида, например:
2Na + 2NH 3 = 2NaNH 2 + H 2
амид натрия
Аммиак очень хорошо растворим в воде (при 20 °С в одном объеме воды растворяется около 700 объемов аммиака). В водных растворах проявляет свойства слабого основания.
NH 3 + H 2 O ® NH 3 ×H 2 O NH 4 + + OH —
= 1,85·10 -5
В атмосфере кислорода аммиак горит с образованием азота, на платиновом катализаторе аммиак окисляется до оксида азота(II):
4NH 3 + 3O 2 = 2N 2 + 6H 2 O; 4NH 3 + 5O 2 = 4NO + 6H 2 O
Как основание аммиак реагирует с кислотами, образуя соли катиона аммония, например:
NH 3 + HCl = NH 4 Cl
Соли аммония хорошо растворимы в воде и слабо гидролизованы. В кристаллическом состоянии термически нестойки. Состав продуктов термолиза зависит от свойств кислоты, образующей соль:
В кристаллическом состоянии термически нестойки. Состав продуктов термолиза зависит от свойств кислоты, образующей соль:
NH 4 Cl ® NH 3 + HCl; (NH 4) 2 SO 4 ® NH 3 + (NH 4)HSO 4
(NH 4) 2 Cr 2 O 7 ® N 2 + Cr 2 O 3 + 4H 2 O
При действии на водные растворы солей аммония щелочей при нагревании выделяется аммиак, что позволяет использовать данную реакцию как качественную на соли аммония и как лабораторный метод получения аммиака.
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 О
В промышленности аммиак получают прямым синтезом.
N 2 + 3H 2 2NH 3
Поскольку реакция сильно обратима, синтез ведут при повышенном давлении (до 100 мПа). Для ускорения процесс проводят в присутствии катализатора (губчатое железо, промотированное добавками) и при температуре около 500 °С.
Нитриды образуются в результате реакций многих металлов и неметаллов с азотом. Свойства нитридов закономерно изменяются в периоде. Например, для элементов третьего периода:
Нитриды s-элементов I и II групп представляют собой кристаллические солеподобные вещества, легко разлагающиеся водой с образованием аммиака.
Li 3 N + 3H 2 O = 3LiOH + NH 3
Из нитридов галогенов в свободном состоянии выделен только Cl 3 N, кислотный характер проявляется в реакции с водой:
Cl 3 N + 3H 2 O = 3HClO + NH 3
Взаимодействие нитридов разной природы приводит к образованию смешанных нитридов:
Li 3 N + AlN = Li 3 AlN 2 ; 5Li 3 N + Ge 3 N 4 = 3Li 5 GeN 3
нитридоалюминат нитридогерманат(IV) лития
Нитриды ВN, AlN, Si 3 N 4 , Ge 3 N 4 – твердые полимерные вещества с высокими температурами плавления (2000-3000 °С), они полупроводники или диэлектрики. Нитриды d-металлов — кристаллические соединения переменного состава (бертолиды), очень твердые, тугоплавкие и химически устойчивые, проявляют металлические свойства: металлический блеск, электропроводность.
Соединения со степенью окисления –2. Гидразин — N 2 H 4 — наиболее важное неорганическое соединение азота в степени окисления -2.
Гидразин представляет собой бесцветную жидкость, с температурой кипения 113,5 °С, дымящуюся на воздухе.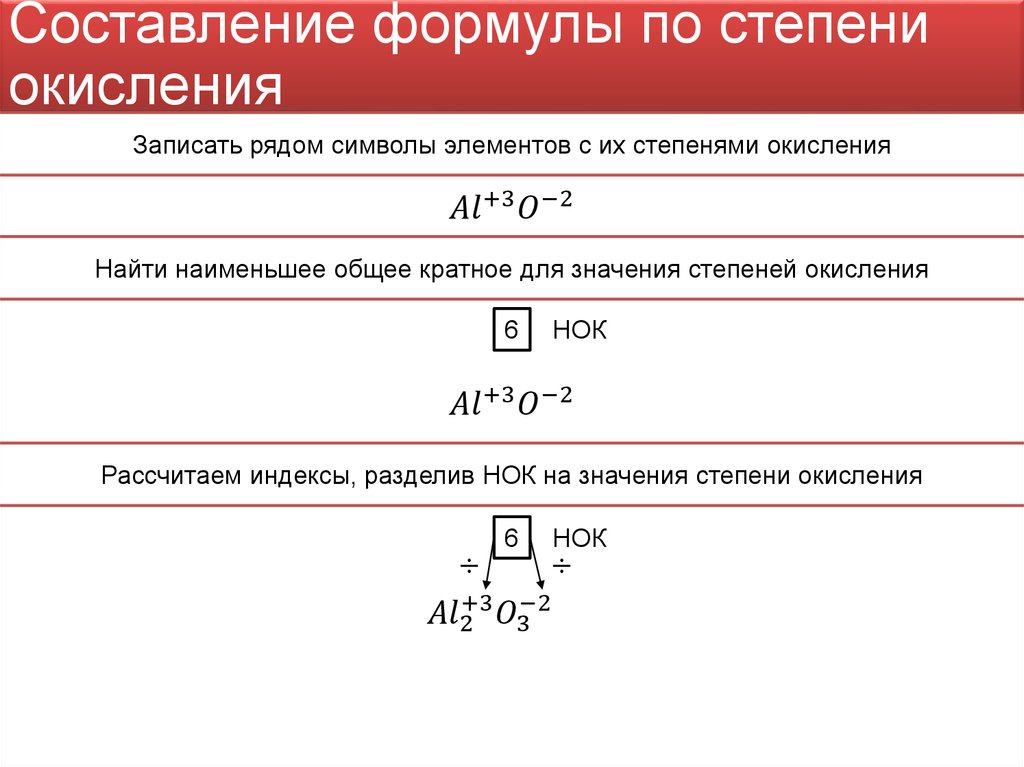 Пары гидразина чрезвычайно ядовиты и образуют с воздухом взрывообразные смеси. Получают гидразин, окисляя аммиак гипохлоритом натрия:
Пары гидразина чрезвычайно ядовиты и образуют с воздухом взрывообразные смеси. Получают гидразин, окисляя аммиак гипохлоритом натрия:
2N -3 H 3 + NaCl +1 O = N 2 -2 H 4 + NaCl -1 + H 2 O
Гидразин смешивается с водой в любых соотношениях и в растворе ведет себя как слабое двухкислотное основание, образуя два ряда солей.
N 2 H 4 + H 2 O N 2 H 5 + + OH — , K b = 9,3×10 -7 ;
катион гидрозония
N 2 H 5 + + H 2 O N 2 H 6 2+ + OH — , K b = 8,5×10 -15 ;
катион дигидрозония
N 2 H 4 + HCl N 2 H 5 Cl; N 2 H 5 Cl + HCl N 2 H 6 Cl 2
хлорид гидрозония дихлорид дигидрозония
Гидразин сильнейший восстановитель:
4KMn +7 O 4 + 5N 2 -2 H 4 + 6H 2 SO 4 = 5N 2 0 + 4Mn +2 SO 4 + 2K 2 SO 4 + 16H 2 O
Несимметричный диметилгидразин (гептил) широко применяется в качестве ракетного топлива.
Соединения со степенью окисления –1. Гидроксиламин — NH 2 OH — основное неорганическое соединение азота в степени окисления -1.
Получают гидроксиламин восстановлением азотной кислоты водородом в момент выделения при электролизе:
HNO 3 + 6H = NH 2 OH + 2H 2 O
Это бесцветное кристаллическое вещество (т.пл. 33 °С), хорошо растворимое в воде, в которой проявляет свойства слабого основания. С кислотами дает соли гидроксиламмония – устойчивые бесцветные вещества, растворимые в воде.
NH 2 OH + H 2 O + + OH — , K b = 2×10 -8
ион гидроксиламмония
Атом азота в молекуле NH 2 OН проявляет промежуточную степень окисления (между -3 и +5) поэтому гидроксиламин может выступать как в роли восстановителя, так и в роли окислителя:
2N -1 H 2 OH + I 2 + 2KOH = N 0 2 + 2KI + 4H 2 O;
восстановитель
2N -1 H 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (N -3 H 4) 2 SO 4 + 2H 2 O
окислитель
NH 2 OН легко разлагается при нагревании, подвергаясь диспропорционированию:
3N -1 H 2 OH = N 0 2 + N -3 H 3 + 3H 2 O;
Соединения со степенью окисления +1.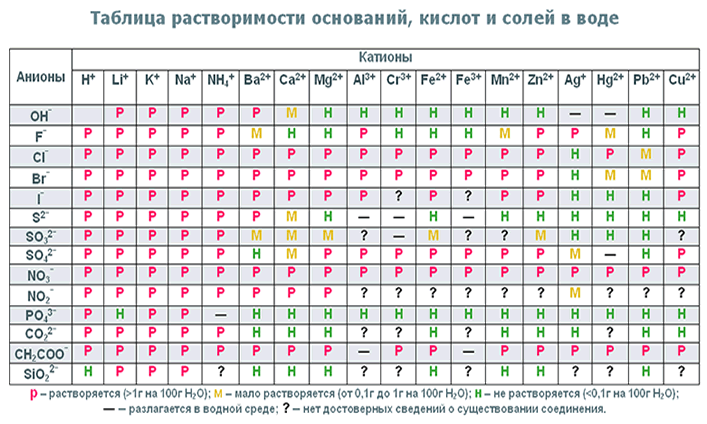 Оксид азота(I) — N 2 O (закись азота, веселящий газ). Строение его молекулы можно передать резонансом двух валентных схем, которые показывают, что рассматривать это соединение как оксид азота(I) можно только формально, реально это оксонитрид азота(V) — ON +5 N -3 .
Оксид азота(I) — N 2 O (закись азота, веселящий газ). Строение его молекулы можно передать резонансом двух валентных схем, которые показывают, что рассматривать это соединение как оксид азота(I) можно только формально, реально это оксонитрид азота(V) — ON +5 N -3 .
N 2 O — бесцветный газ со слабым приятным запахом. В малых концентрациях вызывает приступы безудержного веселья, в больших дозах оказывает общее анестезирующее действие. Смесь закиси азота (80%) и кислорода (20%) использовалась в медицине для наркоза.
В лабораторных условиях оксид азота(I) можно получить разложением нитрата аммония. N 2 O, полученный данным методом, содержит примеси высших оксидов азота, которые чрезвычайно токсичны!
NH 4 NO 3 ¾® N 2 O + 2H 2 O
По химическим свойствам оксид азота(I) типичный несолеобразующий оксид, с водой, кислотами и щелочами не реагирует. При нагревании разлагается с образованием кислорода и азота. По этой причине N 2 O может выступать в роли окислителя, например:
N 2 O + H 2 = N 2 + H 2 O
Соединения со степенью окисления +2. Оксид азота(II) — NO — бесцветный газ, чрезвычайно токсичен. На воздухе быстро окисляется кислородом с образованием не менее токсичного оксида азота(IV). В промышленности NO получают окислением аммиака на платиновом катализаторе или, пропуская воздух через электрическую дугу (3000-4000 °С).
Оксид азота(II) — NO — бесцветный газ, чрезвычайно токсичен. На воздухе быстро окисляется кислородом с образованием не менее токсичного оксида азота(IV). В промышленности NO получают окислением аммиака на платиновом катализаторе или, пропуская воздух через электрическую дугу (3000-4000 °С).
4NH 3 + 5О 2 = 4NО + 6H 2 О; N 2 + O 2 = 2NO
Лабораторным методом получения оксида азота(II) является взаимодействие меди с разбавленной азотной кислотой.
3Cu + 8HNO 3 (разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Оксид азота(II) — несолеобразующий оксид, сильный восстановитель, легко реагирует с кислородом и галогенами.
2NO + O 2 = 2NO 2 ; 2NO + Cl 2 = 2NOCl
хлористый нитрозил
В то же время, при взаимодействии с сильными восстановителями NO выполняет функцию окислителя:
2NO + 2H 2 = N 2 + 2H 2 O; 10NO + 4Р = 5N 2 + 2Р 2 O 5
Соединения со степенью окисления +3. Оксид азота(III) — N 2 O 3 — жидкость интенсивно синего цвета (т. кр. -100 °С). Устойчив только в жидком и твердом состоянии при низких температурах. По-видимому, существует в двух формах:
кр. -100 °С). Устойчив только в жидком и твердом состоянии при низких температурах. По-видимому, существует в двух формах:
Получают оксид азота(III) совместной конденсацией паров NO и NO 2 . В жидкости и в парах диссоциирует.
NO 2 + NO N 2 O 3
По свойствам типичный кислотный оксид. Реагирует с водой, образуя азотистую кислоту, с щелочами образует соли — нитриты.
N 2 O 3 + H 2 O = 2HNO 2 ; N 2 O 3 + 2NaOH = 2NaNO 2 + H 2 O
Азотистая кислота — кислота средней силы (K a = 1×10 -4). В чистом виде не выделена, в растворах существует в двух таутомерных формах (таутомеры — изомеры, находящиеся в динамическом равновесии).
нитрито-форма нитро-форма
Соли азотистой кислоты устойчивы. Нитрит-анион проявляет ярко выраженную окислительно-восстановительную двойственность. В зависимости от условий он может выполнять как функцию окислителя, так и функцию восстановителя, например:
2NaNO 2 + 2KI + 2H 2 SO 4 = I 2 + 2NO + K 2 SO 4 + Na 2 SO 4 + 2H 2 O
окислитель
KMnO 4 + 5NaNO 2 + 3H 2 SO 4 = 2MnSO 4 + 5NaNO 3 + K 2 SO 4 + 3H 2 O
восстановитель
Азотистая кислота и нитриты склонны к диспропорционированию:
3HN +3 O 2 = HN +5 O 3 + 2N +2 O + H 2 O
Соединения со степенью окисления +4. Оксид азота(IV) — NO 2 — бурый газ, с резким неприятным запахом. Чрезвычайно токсичен! В промышленности NO 2 получают окислением NO. Лабораторным методом получения NO 2 является взаимодействие меди с концентрированной азотной кислотой, а также термическое разложение нитрата свинца.
Оксид азота(IV) — NO 2 — бурый газ, с резким неприятным запахом. Чрезвычайно токсичен! В промышленности NO 2 получают окислением NO. Лабораторным методом получения NO 2 является взаимодействие меди с концентрированной азотной кислотой, а также термическое разложение нитрата свинца.
Cu + 4HNO 3 (конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O;
2Pb(NO 3) 2 = 2PbO + 4NO 2 + O 2
Молекула NO 2 имеет один неспаренный электрон и является стабильным свободным радикалом, поэтому оксид азота легко димеризуется.
Процесс димеризации обратим и очень чувствителен к температуре:
парамагнитен, диамагнитен,
бурый бесцветен
Диоксид азота — кислотный оксид, взаимодействует с водой, образуя смесь азотной и азотистой кислоты (смешанный ангидрид).
2NO 2 + H 2 O = HNO 2 + HNO 3 ; 2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
Соединения со степенью окисления +5. Оксид азота(V) — N 2 O 5 — белое кристаллическое вещество.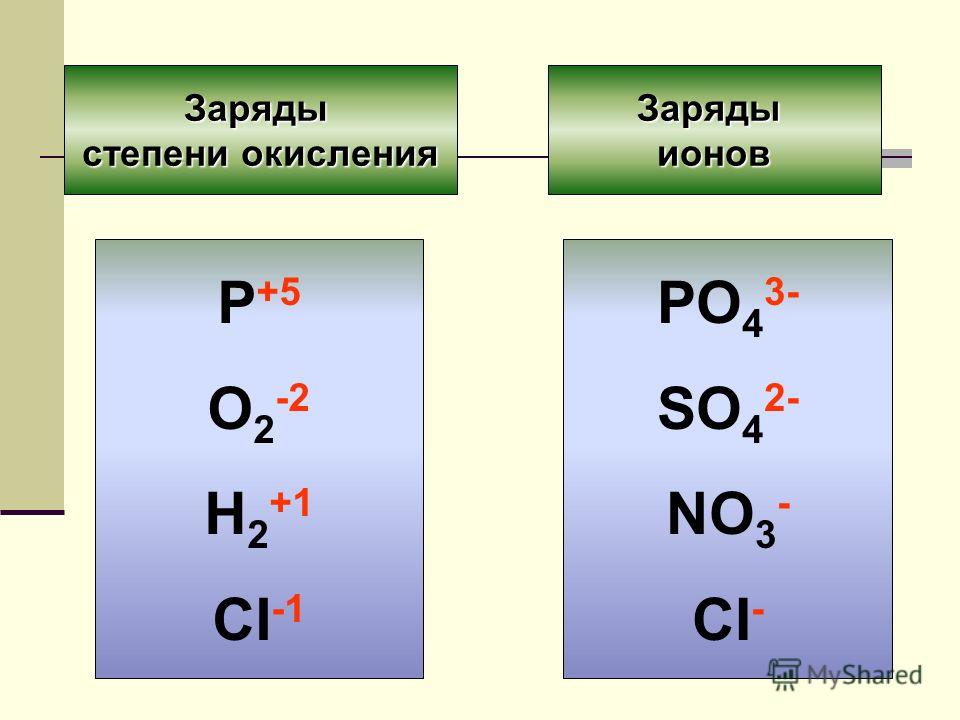 Получается дегидратацией азотной кислоты или окислением оксида азота(IV) озоном:
Получается дегидратацией азотной кислоты или окислением оксида азота(IV) озоном:
2HNO 3 + P 2 O 5 = N 2 O 5 + 2HPO 3 ; 2NO 2 + O 3 = N 2 O 5 + O 2
В кристаллическом состоянии N 2 O 5 имеет солеподобное строение — + — , в парах (т.возг. 33 °С) — молекулярное.
N 2 O 5 — кислотный оксид — ангидрид азотной кислоты:
N 2 O 5 + H 2 O = 2HNO 3
Азотная кислота — HNO 3 — бесцветная жидкость с температурой кипения 84,1 °С, при нагревании и на свету разлагается.
4HNO 3 = 4NO 2 + O 2 + 2H 2 O
Примеси диоксида азота придают концентрированной азотной кислоте желто-бурую окраску. С водой азотная кислота смешивается в любых соотношениях и является одной из сильнейших минеральных кислот, в растворе нацело диссоциирует.
Строение молекулы азотной кислоты описывается следующими структурными формулами:
Сложности с написанием структурной формулы HNO 3 вызваны тем обстоятельством, что, проявляя в данном соединении степень окисления +5, азот, как элемент второго периода, может образовать только четыре ковалентные связи.
Азотная кислота — один из сильнейших окислителей. Глубина ее восстановления зависит от многих факторов: концентрация, температура, восстановитель. Обычно при окислении азотной кислотой образуется смесь продуктов восстановления:
HN +5 O 3 ® N +4 O 2 ® N +2 O ® N +1 2 O ® N 0 2 ® +
Превалирующим продуктом окисления концентрированной азотной кислотой неметаллов и неактивных металлов является оксид азота(IV):
I 2 + 10HNO 3 (конц) = 2HIO 3 + 10NO 2 + 4H 2 O;
Pb + 4HNO 3 (конц) = Pb(NO 3) 2 + 2NO 2 + 2H 2 O
Концентрированная азотная кислота пассивирует железо и алюминий. Алюминий пассивируется даже разбавленной азотной кислотой. Азотная кислота любой концентрации не действует на золото, платину, тантал, родий и иридий. Золото и платина растворяется в царской водке — смеси концентрированной азотной и соляной кислот в соотношении 1: 3.
Au + HNO 3 + 4HCl = H + NO + 2H 2 O
Сильное окисляющее действие царской водки обусловлено образование атомарного хлора при распаде хлористого нитрозила — продукта взаимодействия азотной кислоты с хлороводородом.
HNO 3 + 3HCl = Cl 2 + NOCl + 2H 2 O;
NOCl = NO + Cl×
Эффективным растворителем малоактивных металлов является смесь концентрированной азотной и плавиковой кислот.
3Ta + 5HNO 3 + 21HF = 3H 2 + 5NO + 10H 2 O
Разбавленная азотная кислота при взаимодействии с неметаллами и малоактивными металлами восстанавливается преимущественно до оксида азота(II), например:
3P + 5HNO 3 (разб) + 2H 2 O = 3H 3 PO 4 + 5NO;
3Pb + 8HNO 3 (разб) = 3Pb(NO 3) 2 + 2NO + 4H 2 O
Активные металлы восстанавливают разбавленную азотную кислоту до N 2 O, N 2 или NH 4 NO 3 , например,
4Zn + 10HNO 3 (разб) = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O
Основная масса азотной кислоты идет на производство удобрений и взрывчатых веществ.
Получают азотную кислоту в промышленности контактным или дуговым способом, которые отличаются первой стадией — получением оксида азота(II). Дуговой способ основан на получении NO при пропускании воздуха через электрическую дугу. В контактном способе NO получают окислением аммиака кислородом на платиновом катализаторе. Далее оксид азота(II) окисляется до оксида азота(IV) кислородом воздуха. Растворяя NO 2 в воде в присутствии кислорода получают азотную кислоту с концентрацией 60-65%.
В контактном способе NO получают окислением аммиака кислородом на платиновом катализаторе. Далее оксид азота(II) окисляется до оксида азота(IV) кислородом воздуха. Растворяя NO 2 в воде в присутствии кислорода получают азотную кислоту с концентрацией 60-65%.
4NO 2 + O 2 + 2H 2 O = 4HNO 3
При необходимости азотную кислоту концентрируют перегонкой с концентрированной серной кислотой. В лаборатории 100 %-ную азотную кислоту можно получить действием концентрированной серной кислоты на кристаллический нитрат натрия при нагревании.
NaNO 3 (кр) + H 2 SO 4 (конц) = HNO 3 + NaHSO 4
Соли азотной кислоты — нитраты — хорошо растворимы в воде, термически неустойчивы. Разложение нитратов активных металлов (исключая литий), стоящих в ряду стандартных электродных потенциалов левее магния, приводит к образованию нитритов. Например:
2KNO 3 = 2KNO 2 + O 2
При разложении нитратов лития, магния, а также нитратов металлов, расположенных в ряду стандартных электродных потенциалов правее магния, вплоть до меди, выделяется смесь оксида азота(IV) и кислорода. Например:
Например:
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
Нитраты металлов, расположенных в конце ряда активности, разлагаются до свободного металла:
2AgNO 3 = 2Ag + 2NO 2 + O 2
Нитраты натрия, калия и аммония широко используются для производства пороха и взрывчатых веществ, а также в качестве азотных удобрений (селитры). В качестве удобрений используют также сульфат аммония, аммиачную воду и карбамид (мочевину) — полный амид угольной кислоты:
Азид водорода (динитридонитрат) — HN 3 (HNN 2) – бесцветная летучая жидкость (т.пл. –80 °С, т.кип. 37 °С) с резким запахом. Центральный атом азота находится в sp-гибридизации, степень окисления +5, соседние с ним атомы имеют степень окисления –3. Структура молекулы:
Водный раствор HN 3 – азотистоводородная кислота по силе близка к уксусной, K a = 2,6×10 -5 . В разбавленных растворах устойчива. Её получают взаимодействием гидразина и азотистой кислоты:
N 2 Н 4 + HNO 2 = HN 3 + 2Н 2 О
По окислительным свойствам HN 3 (HN +5 N 2) напоминает азотную кислоту. Так, если при взаимодействии металла с азотной кислотой образуются оксид азота(II) и вода, то с азотистоводородной кислотой – азот и аммиак. Например,
Так, если при взаимодействии металла с азотной кислотой образуются оксид азота(II) и вода, то с азотистоводородной кислотой – азот и аммиак. Например,
Cu + 3HN +5 N 2 = Cu(N 3) 2 + N 2 0 + NH 3
Смесь HN 3 и HCl ведет себя подобно царской водке. Соли азотистоводородной кислоты — азиды. Относительно устойчивы только азиды щелочных металлов, при температуре > 300 °С они разрушаются без взрыва. Остальные распадаются со взрывом при ударе или нагревании. Азид свинца используют в производстве детонаторов:
Pb(N 3) 2 = Pb + 3N 2 0
Исходным продуктом для получения азидов является NaN 3 , который образуется в результате реакции амида натрия и оксида азота(I):
NaNH 2 + N 2 O = NaN 3 + H 2 O
4.2.Фосфор
Фосфор представлен в природе одним изотопом — 31 Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca 3 (PO 4) 2 — фосфорит, Ca 5 (PO 4) 3 X (X = F,Cl,OH) — апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).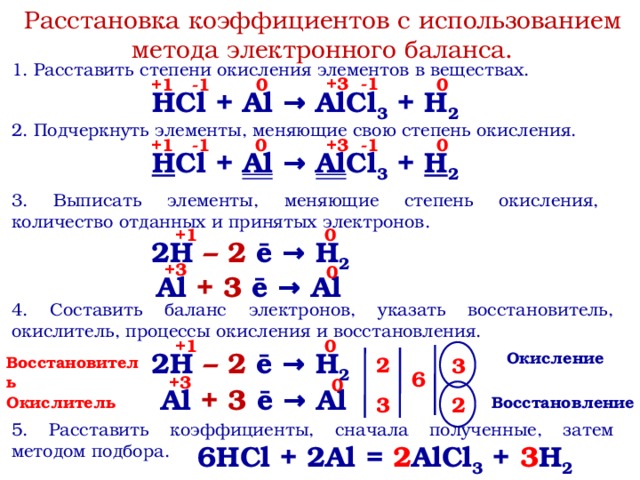
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
Ca 3 (PO 4) 2 + 3SiO 2 + 5C = 3CaSiO 3 + 2P + 5CO
Простое вещество — фосфор — образует несколько аллотропных модификаций, из которых основными являются белый, красный и черный фосфор. Белый фосфор образуется при конденсации паров фосфора и представляет собой белое воскоподобное вещество (т.пл. 44 °С), нерастворимое в воде, растворимое в некоторых органических растворителях. Белый фосфор имеет молекулярное строение и состоит из тетраэдрических молекул P 4 .
Напряженность связей (валентный угол P-P-P составляет всего 60 °) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный фосфор получается при нагревании белого фосфора под давлением 120 тыс.атм. Имеет полимерное строение, обладает полупроводниковыми свойствами, химически устойчив и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминесценция).
2P + 3O 2 = 2P 2 O 3 ; P 2 O 3 + O 2 = P 2 O 5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
2P + 3Cl 2 = 2PCl 3 ; PCl 3 + Cl 2 = PCl 5
При взаимодействии с активными металлами фосфор выступает в роли окислителя, образуя фосфиды — соединения фосфора в степени окисления -3.
3Ca + 2P = Ca 3 P 2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты.
P + 5HNO 3 (конц) = H 3 PO 4 + 5NO 2 + H 2 O
При кипячении с растворами щелочей белый фосфор диспропорционирует:
4P 0 + 3KOH + 3H 2 O = P -3 H 3 + 3KH 2 P +1 O 2
фосфин гипофосфит калия
Найдите степень окисления P в $Na{H_2}P{O_4}$.
Последняя обновленная дата: 26 февраля 2023
•
Общее представление: 209,3K
•
Просмотры сегодня: 5,94K
Ответ
Проверено
209,3K+ виды
HINT: 9003 }P{O_4}$ называется дигидрофосфатом натрия или монофосфатом натрия. Это соединение содержит натрий (Na), водород (H), фосфор (P) и кислород (O). Фосфор принадлежит к группе азота, и его атомный номер равен 15. Общая степень окисления натрия равна +1, кислорода равна -2, а водорода равна +1. Итак, используя степени окисления этих атомов, мы собираемся найти степень окисления фосфора.
Итак, используя степени окисления этих атомов, мы собираемся найти степень окисления фосфора.
Полный ответ: Нам дано найти степень окисления P в $Na{H_2}P{O_4}$.
Фосфор является неметаллом и относится к группе 17 th . Его атомный номер — 15.
Степень окисления, также известная как степень окисления, представляет собой общее количество электронов, которые атом либо теряет, либо приобретает для образования связи с другим атомом.
Степень окисления полного соединения всегда равна нулю, что означает, что соединение всегда должно быть нейтральным. Так что и здесь степень окисления $Na{H_2}P{O_4}$ равна нулю, а это означает, что сумма всех степеней окисления атомов, участвующих в образовании $Na{H_2}P{O_4}$, должна составлять нуль.
Мы знаем, что степень окисления натрия +1, водорода +1 и кислорода -2, и пусть степень окисления фосфора в $Na{H_2}P{O_4}$ равна x.
Тогда $1\left( { + 1} \right) + 2\left( { + 1} \right) + x + 4\left( { — 2} \right) = 0$, так как есть 2 атома водорода и 4 атома кислорода
$ \Rightarrow 1 + 2 + x — 8 = 0$
$ \Rightarrow x — 5 = 0$
$\следовательно x = + 5$
Следовательно, степень окисления фосфора в $Na{ H_2}P{O_4}$ равно +5.
Примечание: Фосфор имеет переменную валентность (+5, +3), поэтому его называют поливалентным неметаллом. Не путайте степень окисления с валентностью. Иногда валентность и степень окисления могут быть одинаковыми, а иногда могут различаться. Валентность — нет. электронов, присутствующих в самой внешней оболочке определенного элемента, тогда как степень окисления — нет. электронов, которые элемент потерял или приобрел при образовании определенного соединения.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Актуальные сомнения
Реакция натрия + аммиака | Na + Nh4 Balanced Equation
Амид натрия (NaNH 2 ) может быть получен реакцией натрия с газообразным аммиаком. Эта реакция
помогает нам узнать важные факты о
аммиак. Когда,
натрий реагирует с аммиаком, образуется амид натрия и водород.
Эта реакция
помогает нам узнать важные факты о
аммиак. Когда,
натрий реагирует с аммиаком, образуется амид натрия и водород.
- Автор: Хешан Нипуна, Последнее обновление: 30.08.2022
Na + NH
3 → NaNH 2 + H 2Натрий реагирует с газообразным аммиаком с образованием амида натрия и газообразный водород в качестве продуктов. Но обычно, сжиженный аммиак используется для получения содамида в этой реакции. Химическое уравнение получения содамида приведено ниже.
Na + NH 3 → NaNH 2 + H 2
Содамид называют амидом натрия и азанидом натрия.
Балансное уравнение газообразного аммиака и реакции натрия
Это окислительно-восстановительная реакция. Это уравнение можно легко сбалансировать с помощью методов контроля (вы можете попробовать окислительно-восстановительный потенциал).
методы балансировки, если хотите).
2Na + 2NH 3 → 2NaNH 2 + H 2
Изменение степени окисления
- Натрий окисляется из степени окисления 0 в степень окисления +1.
- Водород в аммиаке восстанавливается до степени окисления 0 из степени окисления +1.
Свойства о реакции аммиака и натрия
Из-за образования газообразного водорода могут возникнуть пожары. Также эта реакция говорит нам об особых свойствах газообразного аммиака.
Газообразный аммиак может вести себя как кислота
Аммиак известен в химии как основной газ. Но в этой реакции газообразный водород выделяется с реакцией натрия.
Обычно металлы выделяют газообразный водород при взаимодействии с кислотами, такими как натрий, и реакцией с разбавленной HCl. Это
реакция аналогична реакции металл-кислота, потому что натрий является металлом, и в качестве продукта выделяется газообразный водород. Итак, аммиак
должны иметь кислотные характеристики так же, как основные свойства, чтобы показать такую реакцию.
Аммиак является окислителем (натрий окисляется)
Вследствие окисления натрия аммиак считается окислителем.
Об амиде натрия
- Амид натрия является сильным основанием.
- Амид натрия бурно реагирует с водой с образованием аммиака и гидроксида натрия.
Каковы правильные утверждения следующего.
- В этой реакции натрий выступает в роли восстановителя.
- Для проведения этой реакции следует использовать водный раствор аммиака
- Содамид проявляет кислотные свойства в воде.
- Атомы водорода в молекулах аммиака восстанавливаются.
В реакции газообразного натрия и аммиака. натрий окисляется. Следовательно, натрий ведет себя как восстановитель. Восстановление происходит в молекуле аммиака по мере образования газообразного водорода. Степень окисления водорода снижена с +1 до 0.
Вопросы
Что верно из следующего о реакции натрия и аммиака?
- Это окислительно-восстановительная реакция, при которой аммиак окисляется до газообразного азота.
- Натрий окисляется и в качестве продукта получается нитрид натрия.
- Один продукт реакции дает сильный щелочной раствор при добавлении к воде.
- В продукте реакции атомы водорода содержатся только в газообразном водороде.
Ответ 3.
Продукт реакции натрия и аммиака реагирует с водой или только растворяется в воде?
Содамид, продукт реакции натрия и аммиака, вступает в реакцию с водой с образованием гидроксида натрия и газообразного аммиака. Поэтому этот водный раствор должен иметь более высокое значение рН.
натрия в водном растворе аммиака, что произойдет?
Водный аммиак означает водный раствор гидроксида аммония. В присутствии воды все щелочные металлы реагируют с водой с образованием гидроксида металла и газообразного водорода.



Leave A Comment