Углеводы Открытая биология. Учебник
Углеводы
Переходя к рассмотрению органических веществ, нельзя не отметить значение углерода для жизни. Вступая в химические реакции, углерод образует прочные ковалентные связи, обобществляя четыре электрона. Атомы углерода, соединяясь между собой, способны образовывать стабильные цепи и кольца, служащие скелетами макромолекул. Углерод также может образовывать кратные ковалентные связи с другими углеродными атомами, а также с азотом и кислородом. Все эти свойства обеспечивают уникальное разнообразие органических молекул.
Макромолекулы, составляющие около 90 % массы обезвоженной клетки, синтезируются из более простых молекул, называемых мономерами. Существуют три основных типа макромолекул: полисахариды, белки и нуклеиновые кислоты; мономерами для них являются, соответственно, моносахариды, аминокислоты и нуклеотиды.
Углеводами называют вещества с общей формулой Cx(H2O)y, где x и y – натуральные числа.
В животных клетках содержится небольшое количество углеводов, а в растительных – почти 70 % от общего количества органических веществ.
Углеводы делятся на простые (моносахариды) и сложные (дисахариды и полисахариды). Моносахариды имеют общую формулу (CH2O)n, где n изменяется от 3 до 9. Самые распространённые моносахариды – глюкоза и фруктоза, имеющие формулу (CH2O)6. Все моносахариды имеют сладкий вкус, кристаллизуются и легко растворяются в воде.
Моносахариды играют роль промежуточных продуктов в процессах дыхания и фотосинтеза, участвуют в синтезе нуклеиновых кислот, коферментов, АТФ и полисахаридов, служат источниками энергии, высвобождаемой при окислении в процессе дыхания. Производные моносахаридов – сахарные спирты, сахарные кислоты, дезоксисахара и аминосахара – имеют важное значение в процессе дыхания, а также используются при синтезе липидов, ДНК и других макромолекул.
Дисахариды образуются в результате реакции конденсации между двумя моносахаридами. Иногда они используются в качестве запасных питательных веществ. Наиболее распространенными из них являются мальтоза (глюкоза + глюкоза), лактоза (глюкоза + галактоза) и сахароза (глюкоза + фруктоза). Лактоза содержится только в молоке. Сахароза (тростниковый сахар) наиболее распространена в растениях; это и есть тот самый сахар, который мы обычно употребляем в пищу.
Полисахариды состоят из моносахаридов. Большие размеры делают их молекулы практически нерастворимыми в воде; они не оказывают влияние на клетку и потому удобны в качестве запасных веществ. При необходимости они могут быть превращены обратно в сахара путём гидролиза.
Крахмал (полимер глюкозы) запасается в клетках в виде так называемых крахмальных зерен. Эквивалентом крахмала в животном организме является гликоген (у позвоночных он содержится в печени и мышцах).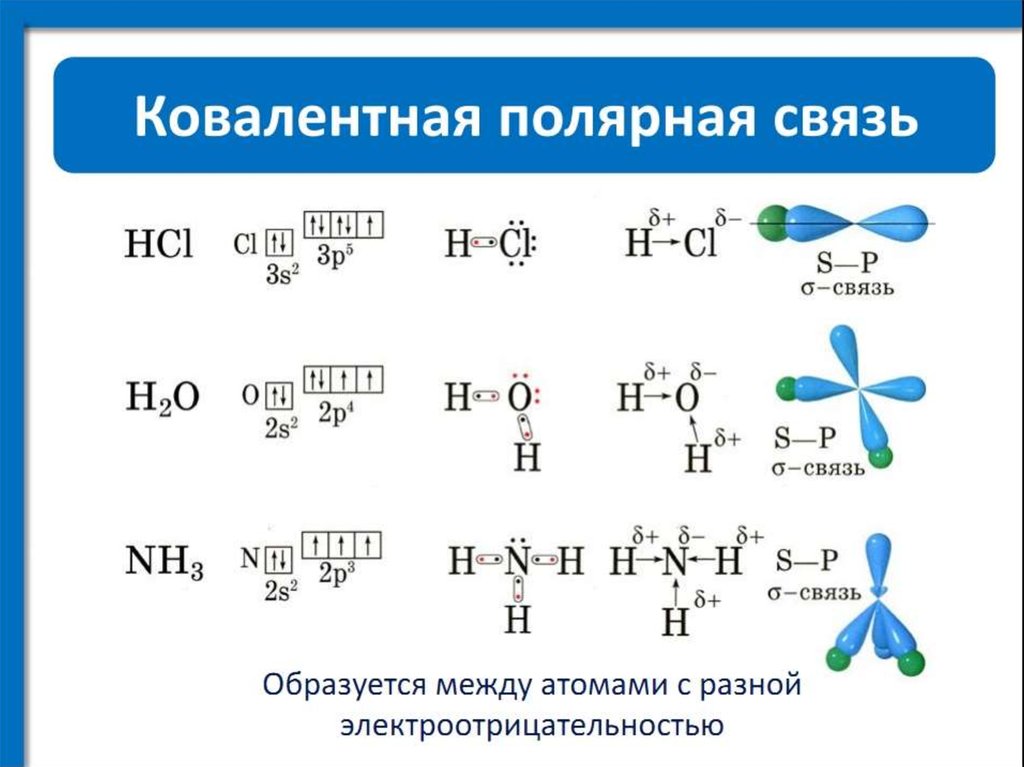
Целлюлоза также является полимером глюкозы. В ней заключено около 50 % углерода, содержащегося в растениях. По общей массе на Земле целлюлоза занимает первое место среди органических соединений. Форма молекулы (длинные цепи с выступающими наружу –OH-группами) обеспечивает прочное сцепление между соседними цепями. При всей своей прочности, макрофибриллы, состоящие из таких цепей, легко пропускают воду и растворённые в ней вещества и потому служат идеальным строительным материалом для стенок растительной клетки. Целлюлоза – ценный источник глюкозы, однако для её расщепления необходим фермент целлюлаза, сравнительно редко встречающийся в природе. Поэтому в пищу целлюлозу употребляют только некоторые животные (например, жвачные).
Иногда простые сахара вступают в реакцию с сахарными спиртами и кислотами. Образующиеся при этом вещества близки к полисахаридам и носят название мукополисахаридов. Муреин играет роль структурного компонента в клетках прокариот. Хитин близок к целлюлозе; он встречается у некоторых форм грибов, а также как важный компонент наружного скелета некоторых животных. Гликопротеины и гликолипиды определяют антигенные свойства клеток. Гиалуроновая кислота и хондроитинсульфат – важные компоненты соединительной ткани позвоночных. Камеди и слизи имеют важную защитную функцию в организмах растений и животных.
Смотрите также:
Математика,
Английский язык,
Химия,
Биология,
Физика,
География,
Астрономия.
А также: библиотека ЭОРов и образовательный онлайн-сервис с тысячами интерактивных работ «Облако знаний».
Химия материалов
Уважаемые мастера, работая с продукцией по моделированию ногтей, задумывались ли Вы, что наши материалы – это химические вещества. И для того, чтобы лучше понимать процессы (как происходит наращивание ногтей, что происходит с ноготком, когда он застывает, что нельзя делать и что нужно делать, что б он оставался таким же прочным), нужно знать основные химические понятия. Так вот, давайте окунемся в мир кристаллических решеток и химических связей.
Что такое полимеры? Что общего у искусственных и натуральных ногтей
В переводе с греческого «поли» означает «много». Звенья такого соединения (полимера), в свою очередь, носят название мономеров («моно» означает один). Продукция для ногтей состоит из миллионов мономеров сформированных в одну цепочку. Каждое звено цепочки- это мономер, а если цепочка состоит из миллиона мономеров, то это-полимер.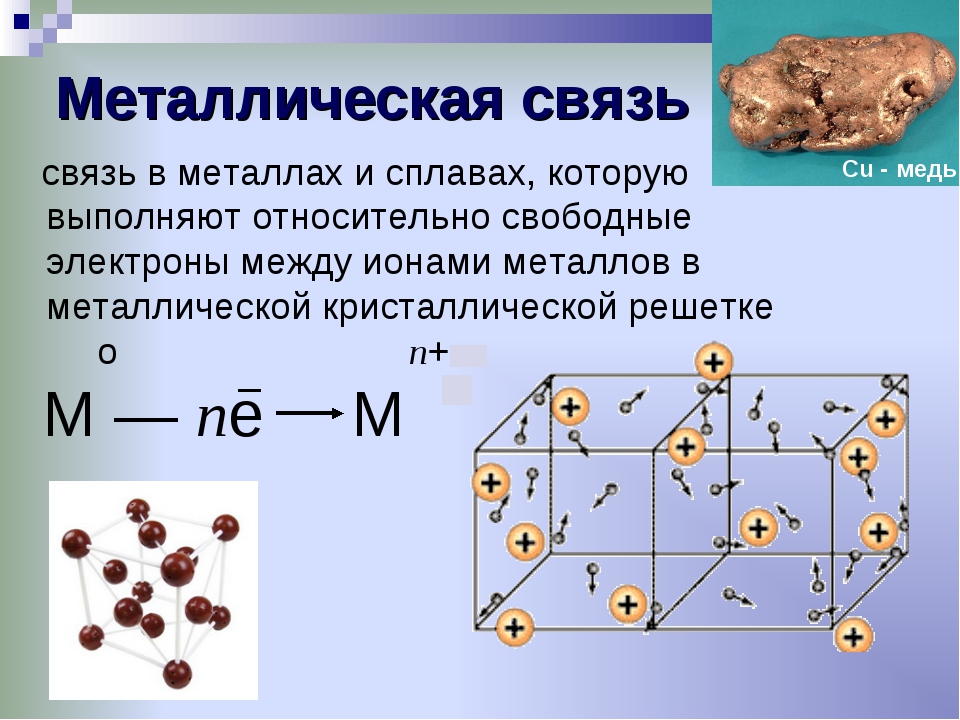 Мономеры имеют жидкое состояние, полимеры — твердое. Если соединить много мономеров, получится полимер.
Мономеры имеют жидкое состояние, полимеры — твердое. Если соединить много мономеров, получится полимер.
Каждый день в своей жизни мы сталкиваемся с полимерами. Полимеры бывают натурального и искусственного происхождения. Ногти – это полимеры натурального происхождения. Молекулы аминокислот при взаимодействии друг с другом образуют полимер – протеин, одна из разновидностей которого, кератин, и является основой натуральных ногтей.
Препараты для моделирования являются полимерами, полученными искусственным путем в результате реакции полимеризации непосредственно на ногте. Таким образом, общее для всех искусственных материалов, применяемых для укрепления и моделирования ногтей, является то, что все они – полимеры.
Структуры полимеров (какие бывают полимеры)
Самая простая и уязвимая структура линейная, которая представляет собой
цепочку выстроившихся друг за другом мономеров. Полимеры, имеющие подобное строение это лаки, клеи для типсов и тканей.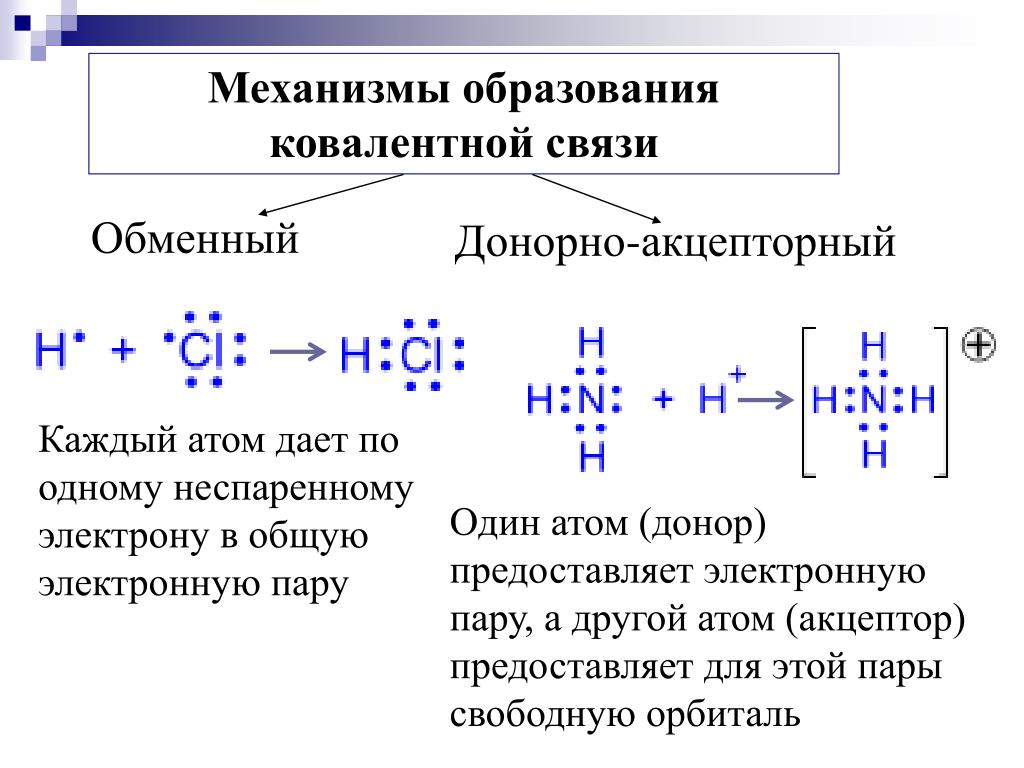 Все эти препараты легко разрушаются простым ацетоном в очень быстрый срок.
Все эти препараты легко разрушаются простым ацетоном в очень быстрый срок.
Сетевидную структуру имеют мономеры, способные создавать не простые полимерные цепи, а химические решетки, в которых используется перекрестная связь (т.е. они переплетены как сети между собой). Сетевидную структуру имеют акрилы первого поколения.
Усиленную сетевидную структуру имеют современные средства для моделирования и укрепления ногтей. В их основе лежат уже объемные решетки, похожие на вплетение полимерной веревки в пересекающуюся сеть. Это способствует значительному увеличению прочности. Используется в большинстве современных системах для моделирования ногтей.
Таким образом, становится очевидным, что посторонние примеси, вкрапления в виде воздушных пузырей, жира, пыли, пищи, ухудшают прочностные качества полимера, мешая соединению молекул мономера между собой.
Олигомеры-образуются в результате неоконченной реакции полимеризации. Имеют вид соединенных между собой молекул мономера в цепи.
Это уже не мономер, но еще и не полимер. Это вещество, имеющее промежуточное состояние. По этой причине олигомеры представляют собой густую, желеобразную субстанцию. Олигомерами являются гели.
Реакция полимеризации
Полимеризация — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле полимера. Молекула мономера, входящая в состав полимера, образует так называемое мономерное звено. Элементный состав (молекулярные формулы) мономера и полимера приблизительно одинаковые.
Обычно мономерами являются соединения, которые способны образовывать новые связи с другими молекулами, обеспечивая рост цепей.
Инициатор
Для того, чтобы началась реакция полимеризации, необходим толчок извне. Таким толчком является инициатор. Мономеры не могут соединиться друг с другом формируя цепь без инициатора.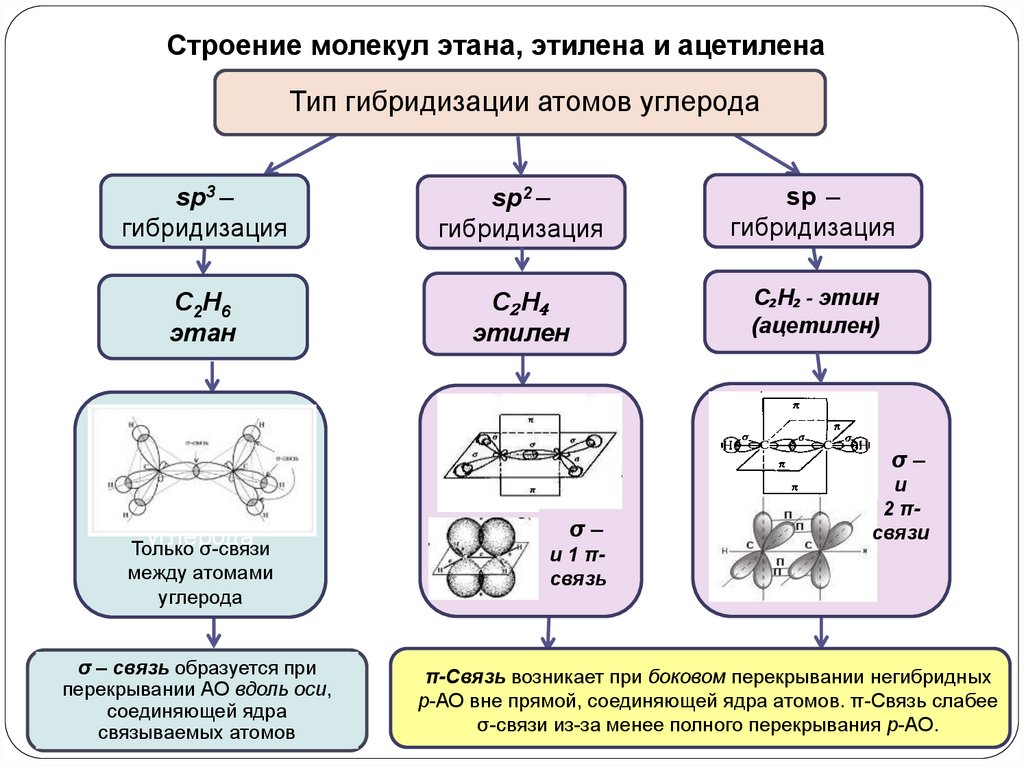
Молекула инициатора, несущая определенную энергию, соприкасается с молекулой мономера и возбуждает его зарядом энергии. Молекулы избавляются от этой энергии прикрепляя себя к другим молекулам и передавая энергию дальше. Во время этого процесса везде формируются цепи мономеров, связываясь и путаясь. Этот процесс называется полимеризацией и продолжается до тех пор, пока все мономеры не будут задействованы.
В результате происходит следующее: молекулы соединяются между собой в виде цепей.
Таких соединений становится все больше, протяженность их все длиннее.
Цепи, состоящие из сравнительно небольшого количества звеньев, называются олигомерами. Это уже не мономер, но еще и не полимер. Это вещество, имеющее промежуточное состояние.
По этой причине олигомеры представляют собой густую, желеобразную субстанцию.
Свободное движение цепочек сильно затруднено вследствие их большой протяженности и веса. Поэтому они начинают переплетаться, сплетаться в клубки, скорость движения цепей замедляется и материал твердеет.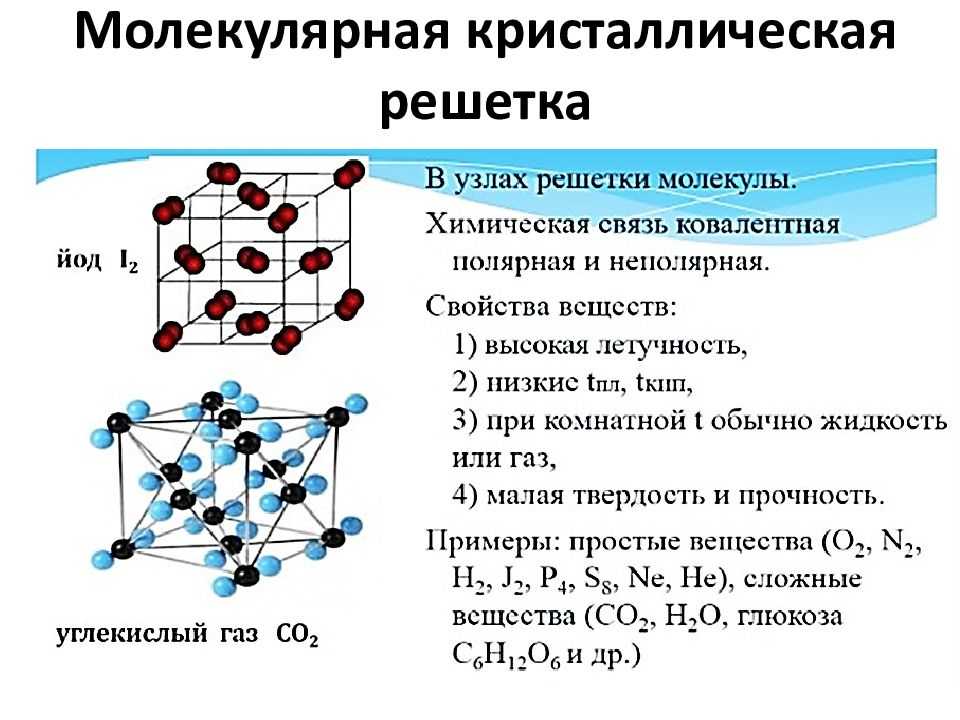 Таким образом заканчивается 1 цикл полимеризации (поверхностное отвердевание). Но реакция полимеризации считается законченной только после того, как последняя свободная молекула займет свое место в определенной цепи. Как мы знаем время полной реакции полимеризации составляет 24-72 часа.
Таким образом заканчивается 1 цикл полимеризации (поверхностное отвердевание). Но реакция полимеризации считается законченной только после того, как последняя свободная молекула займет свое место в определенной цепи. Как мы знаем время полной реакции полимеризации составляет 24-72 часа.
Катализатор
Из вышесказанного следует, что окончательно искусственный ноготь полимеризуется в зависимости от начально-заданных свойств фирмой-производителем до 72 часов. За это время внешние факторы, воздействующие на искусственное покрытие не делают его прочнее. Но давайте рассмотрим, что будет с искусственным ноготком, если реакция полимеризации будет проходить намного быстрее. Во-первых, быстрое отвердевание материалов на первом этапе поверхностного твердения ведет к некачественному результату (особенно у новичков), они просто не успеют распределить материал равномерно т.к. он быстро отвердеет (что ведет к отслоению искусственного покрытия от натуральной ногтевой пластины). Во-вторых с увеличением скорости реакции, увеличивается количество выделяемого тепла. Как известно, любая реакция полимеризации является экзотермической, то есть проходит с выделением тепла. Так же при увеличении скорости реакции, образуется большое количество коротких цепей и мало длинных. Материал получается излишне гибким, но не прочным.
Во-вторых с увеличением скорости реакции, увеличивается количество выделяемого тепла. Как известно, любая реакция полимеризации является экзотермической, то есть проходит с выделением тепла. Так же при увеличении скорости реакции, образуется большое количество коротких цепей и мало длинных. Материал получается излишне гибким, но не прочным.
По причинам, изложенным выше, в состав мономера катализатор входит в очень малых дозах, не более 1% от общей массы. Так что катализаторы тоже способны влиять на характеристику искусственных ногтей.
В статье были раскрыты основные понятия состава материалов, проанализирована молекулярная структура материалов для моделирования ногтей. Данная информация, я надеюсь, поможет мастерам сформировать понятие о процессах, которые происходят при наращивании ногтей, что позволит более эффективно использовать имеющийся инструмент, а так же добиться уменьшения времени наращивания, уменьшение расхода материала, а также увеличить прочность искусственного покрытия. И тем самым повысить свой профессиональный уровень и как следствие количество клиентов.
И тем самым повысить свой профессиональный уровень и как следствие количество клиентов.
Химические связи – MHCC Biology 112: Биология для медицинских работников
Перейти к содержимому
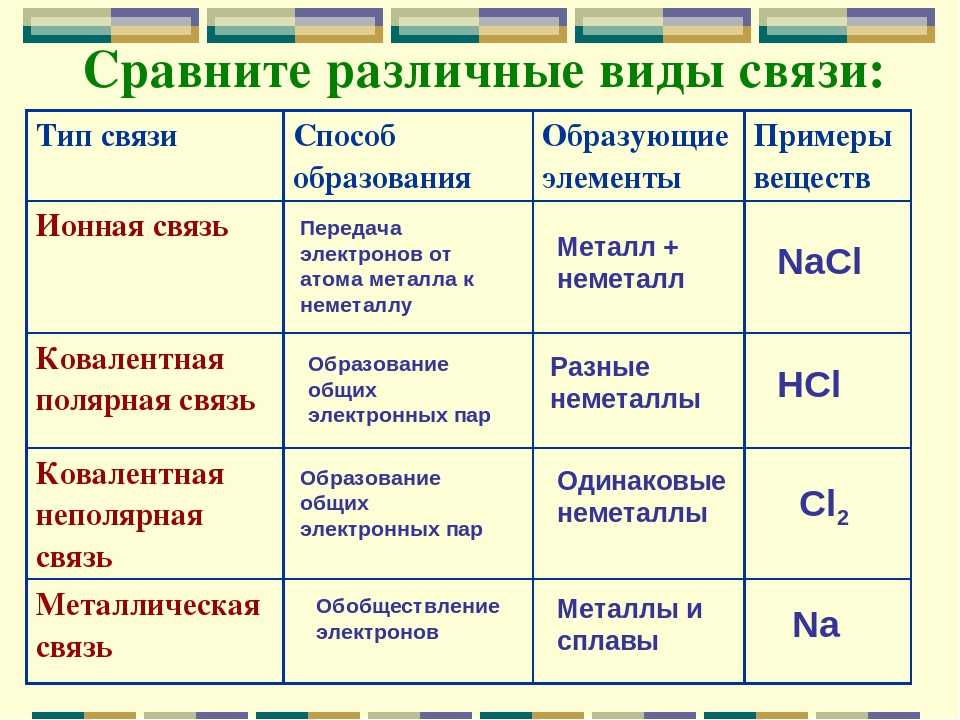
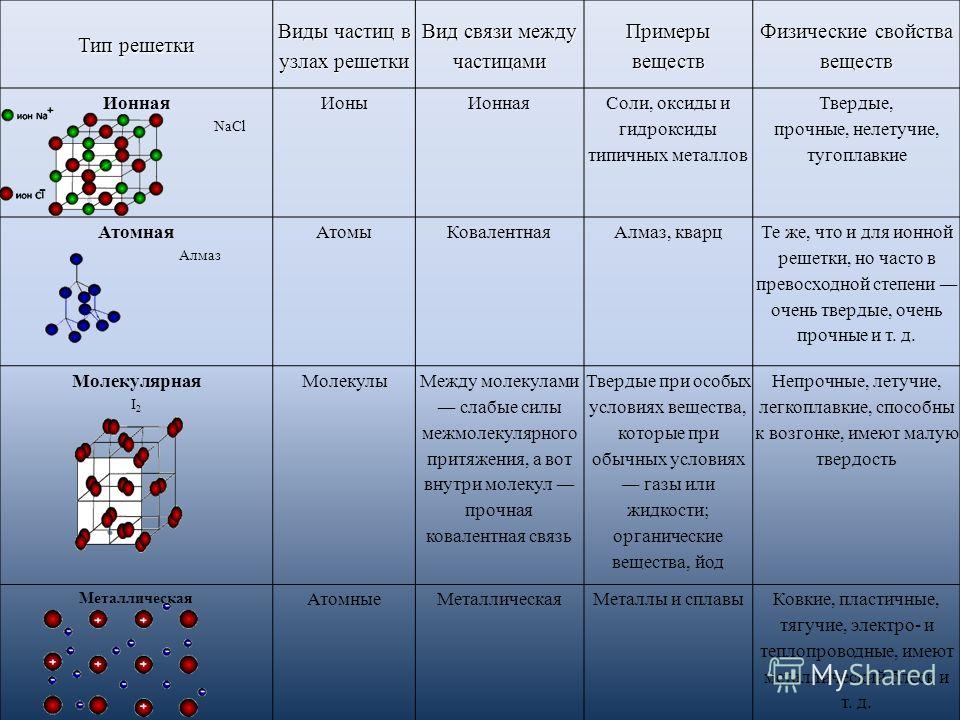
Атомы могут образовывать несколько типов химических связей. Эти связи представляют собой взаимодействия между двумя атомами, которые удерживают атомы вместе. Важно понимать различные типы связей, потому что они помогают определить, как различные молекулы функционируют в организме. Существует четыре типа связей или взаимодействий: ковалентные, ионные, водородные связи и взаимодействия Ван-дер-Ваальса.
Ковалентные связи
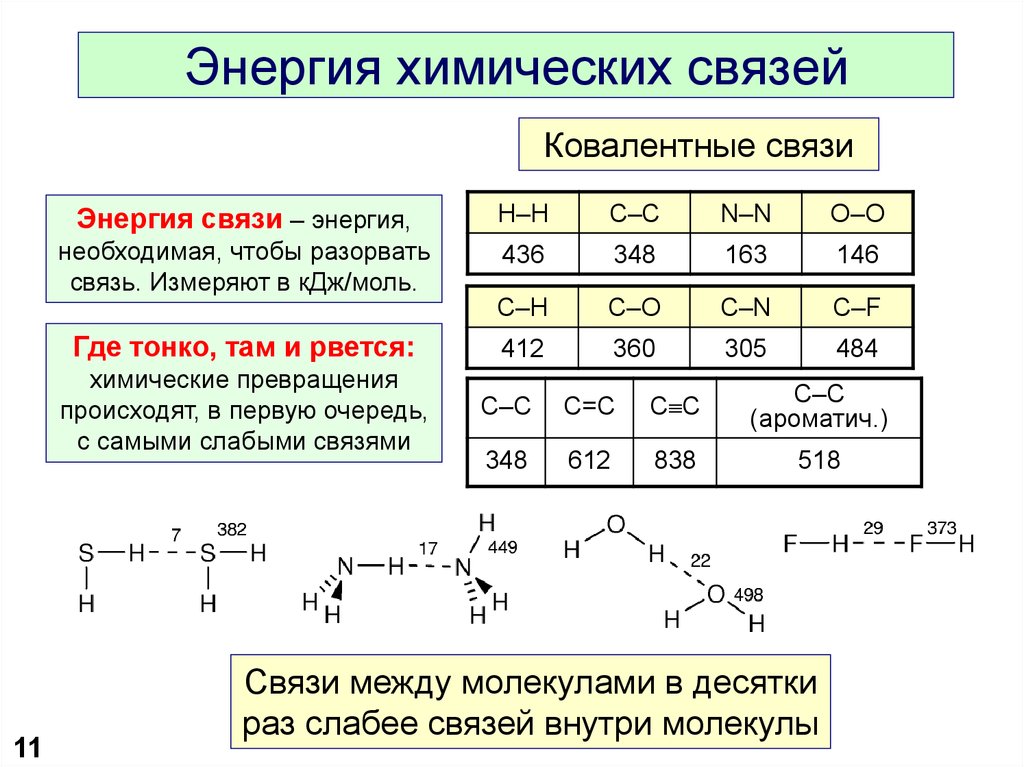
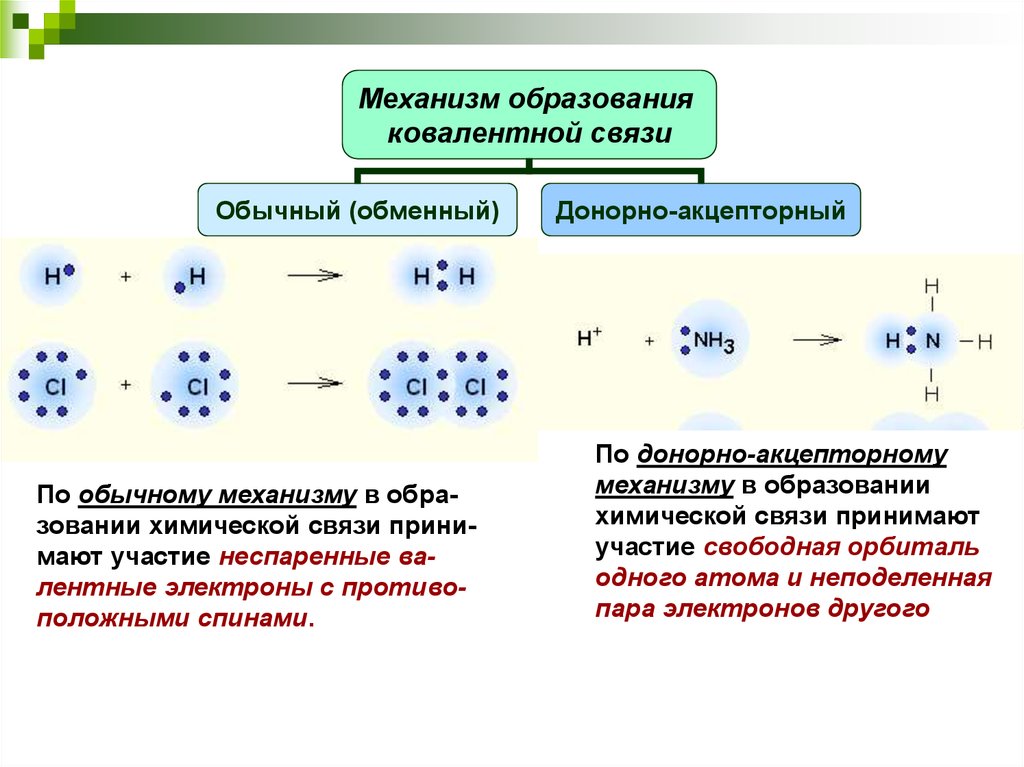
Другим типом сильной химической связи между двумя или более атомами является ковалентная связь . Эти связи образуются, когда электрон делится между двумя элементами. Ковалентные связи являются самой прочной (*см. примечание ниже) и наиболее распространенной формой химической связи в живых организмах.
Атомы водорода и кислорода, которые объединяются, образуя молекулы воды, связаны прочными ковалентными связями. Электрон от атома водорода делит свое время между атомом водорода и атомом кислорода. Чтобы атом кислорода был стабильным, необходимы два электрона от двух атомов водорода, отсюда индекс «2» в H 2 O. H 2 O означает, что 2 атома водорода связаны с 1 атомом кислорода (1 подразумевается под O в химической формуле). Это совместное использование делает атомы водорода и кислорода более химически стабильными.
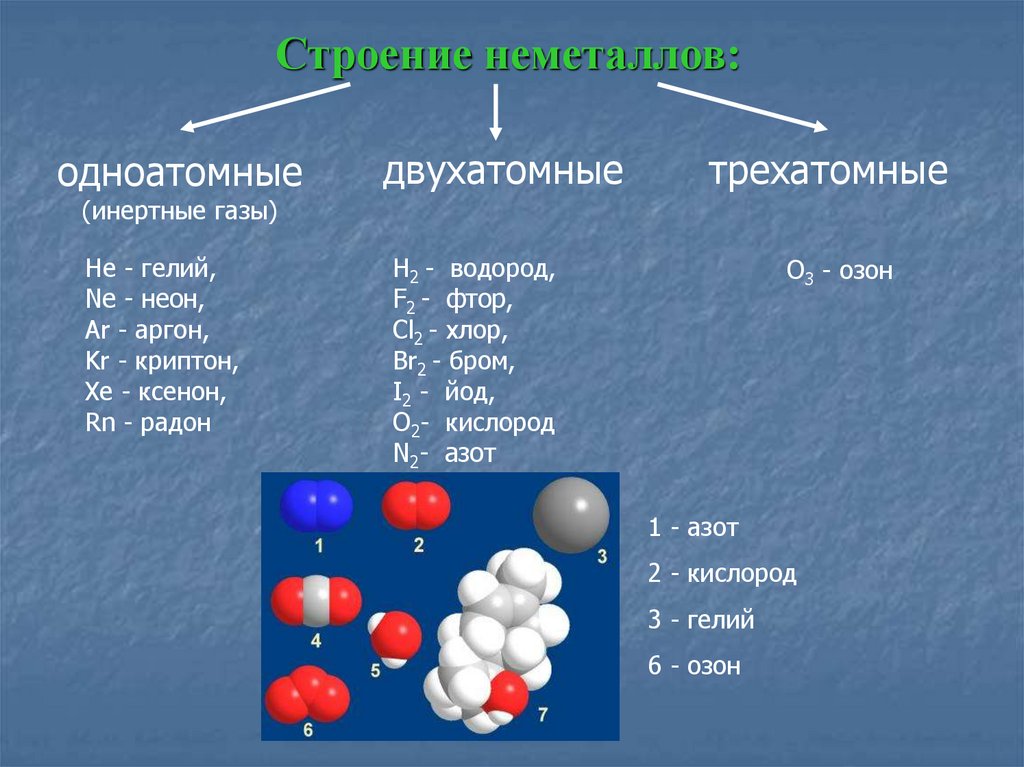 Атом углерода делит электроны с четырьмя атомами водорода. Атомы углерода и водорода делят электроны поровну, образуя четыре неполярные ковалентные связи (рис. 3).
Атом углерода делит электроны с четырьмя атомами водорода. Атомы углерода и водорода делят электроны поровну, образуя четыре неполярные ковалентные связи (рис. 3).В полярной ковалентной связи электроны, общие для атомов, проводят больше времени ближе к одному атому, чем к другому. Из-за неравномерного распределения электронов между атомами возникает слабоположительный (δ+) или слабоотрицательный (δ–) заряд. Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени рядом с кислородом, чем рядом с водородом. Это означает, что кислород имеет небольшой отрицательный заряд, а водород имеет небольшой положительный заряд.
Рисунок 3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом атомов водорода и слегка отрицательным зарядом кислорода. Примеры неполярных связей включают метан (в центре) и кислород (справа).*НО ПОДОЖДИТЕ! Из химии я узнал, что ионные связи прочнее ковалентных! Что с этим делать?
 Химики измеряют абсолютную прочность связи (что-то вроде теоретической прочности). При таком измерении ионные связи очень прочны. Биологов больше интересует, как ведет себя связь в биологической системе, которая обычно является водной (на водной основе). В воде ионные связи разрываются гораздо легче, чем ковалентные, поэтому биологи сказали бы, что они слабее.
Химики измеряют абсолютную прочность связи (что-то вроде теоретической прочности). При таком измерении ионные связи очень прочны. Биологов больше интересует, как ведет себя связь в биологической системе, которая обычно является водной (на водной основе). В воде ионные связи разрываются гораздо легче, чем ковалентные, поэтому биологи сказали бы, что они слабее.Так какой же правильный ответ? Зависит от того, учишься ли ты на уроке химии или биологии! Если вы заглянете в учебник по биологии, там почти всегда будет сказано, что ковалентные связи прочнее. Если вы посмотрите в учебнике по химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее рассматриваете.
Итак, какой ответ вы должны дать этому классу? Поскольку это урок биологии, вы должны сказать, что ковалентные связи прочнее ионных, потому что они действуют сильнее в водных растворах.
Ионные связи
Атомы обычно имеют одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд). Это означает, что атомы обычно не заряжены, потому что количество положительно заряженных частиц равно количеству отрицательно заряженных частиц. Когда атом не содержит одинакового количества протонов и электронов, он будет иметь суммарный заряд. Атом с суммарным зарядом называется ионом . Положительные ионы образуются в результате потери электронов. Отрицательные ионы образуются, приобретая электроны. Атомы могут терять и отдавать электроны, чтобы стать более стабильными.
Это означает, что атомы обычно не заряжены, потому что количество положительно заряженных частиц равно количеству отрицательно заряженных частиц. Когда атом не содержит одинакового количества протонов и электронов, он будет иметь суммарный заряд. Атом с суммарным зарядом называется ионом . Положительные ионы образуются в результате потери электронов. Отрицательные ионы образуются, приобретая электроны. Атомы могут терять и отдавать электроны, чтобы стать более стабильными.
Когда элемент отдает электрон со своей внешней оболочки, как в приведенном выше примере с атомом натрия, образуется положительный ион (рис. 2). Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительные и отрицательные заряды притягиваются, эти ионы остаются вместе и образуют ионную связь или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда Na и Cl объединяются с образованием NaCl, электрон от атома натрия остается с другими семью электронами в атоме хлора, образуя положительно заряженный ион натрия и отрицательно заряженный ион хлора. Ионы натрия и хлора притягиваются друг к другу.
Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда Na и Cl объединяются с образованием NaCl, электрон от атома натрия остается с другими семью электронами в атоме хлора, образуя положительно заряженный ион натрия и отрицательно заряженный ион хлора. Ионы натрия и хлора притягиваются друг к другу.
Водородные связи
Ионные и ковалентные связи являются сильными связями, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Также могут образовываться более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрыва которых не требуется много энергии. Часто встречаются две слабые связи: водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи обуславливают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положителен (δ+), он будет притягиваться к соседним отрицательным частичным зарядам (δ–). При этом происходит слабое взаимодействие между δ+ зарядом атома водорода одной молекулы и δ– зарядом другой молекулы. Это взаимодействие называется водородной связью. Этот тип связи распространен; например, жидкая природа воды обусловлена водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородные связи, вода была бы газом, а не жидкостью при комнатной температуре.
Рисунок 4 Водородные связи образуются между слегка положительным (δ+) и слегка отрицательным (δ–) зарядами полярных ковалентных молекул, таких как вода. Водородные связи могут образовываться между различными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, взаимодействия Ван-дер-Ваальса представляют собой слабое притяжение или взаимодействие между молекулами. Они возникают между полярными, ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, образующимися при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
Каталожные номера Если не указано иное, изображения на этой странице лицензированы OpenStax в соответствии с CC-BY 4.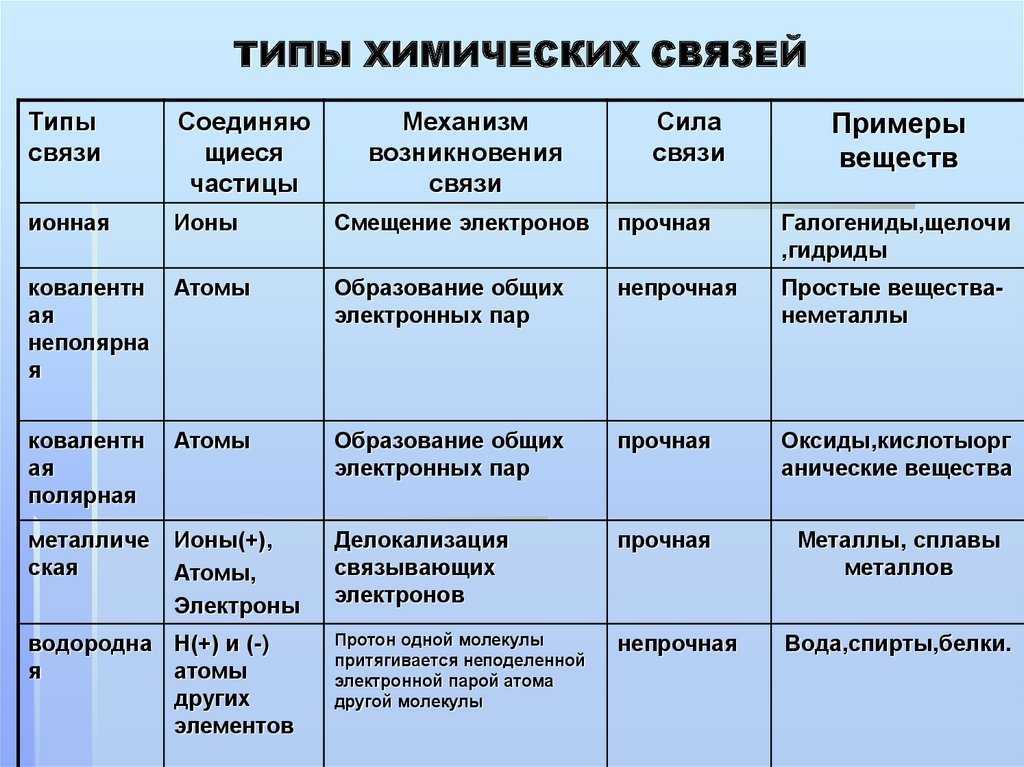 0.
0.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]:IBRqRY3C@8/The-Building-Blocks-of-Molecul
Лицензия
Поделиться этой книгой
Поделиться в Твиттере
Определение ковалентной связи в биологии.
(существительное)
Тип химической связи, при котором два атома соединяются друг с другом посредством совместного использования двух или более электронов.
Ковалентные связи и другие связи и взаимодействия
- Ковалентные связи также встречаются в неорганических молекулах, таких как h3O, CO2 и O2.
- Чем больше ковалентных связей между двумя атомами, тем прочнее их связь.
- Образование молекул воды является примером ковалентной связи .
- Существует два типа ковалентных связей : полярные и неполярные.
- Не все связи являются ионными или ковалентный ; более слабые связи также могут образовываться между молекулами.

Синтез обезвоживания
- В синтезе дегидратации мономеры объединяются друг с другом через ковалентных связей с образованием полимеров.
- Мономеры объединяются друг с другом с помощью ковалентных связей с образованием более крупных молекул, известных как полимеры.
- Удаление водорода из одного мономера и удаление гидроксильной группы из другого мономера позволяет мономерам обмениваться электронами и образовывать ковалентная связь .
- Однако способ, которым мономеры глюкозы соединяются друг с другом, особенно расположение ковалентных связей между соединенными мономерами и ориентация (стереохимия) ковалентных связей , приводит к образованию этих трех разных полисахаридов с различными свойствами и функции.
- В реакции синтеза дегидратации между двумя молекулами глюкозы гидроксильная группа первой глюкозы соединяется с водородом второй глюкозы, создавая ковалентная связь , которая связывает вместе два мономерных сахара (моносахарида) с образованием дисахарида мальтозы.

Водородная связь и силы Ван-дер-Ваальса
- Ионные и ковалентные связи между элементами требуют энергии для разрыва.
- Ионные связи не так прочны, как ковалентные , что определяет их поведение в биологических системах.
- Однако не все связи ионные или ковалентные связи .
- Когда полярные ковалентные связи содержат водород, водород в этой связи имеет слегка положительный заряд, потому что один электрон водорода сильнее притягивается к другому элементу и от водорода.
- Эти связей — наряду с ионными, ковалентными и водородными связями — вносят вклад в трехмерную структуру белков, которая необходима для их правильного функционирования.
Органические изомеры
- Структурные изомеры (такие как бутан и изобутан ) отличаются расположением ковалентных связей .
 Геометрические изомеры
Геометрические изомеры - , с другой стороны, имеют сходное расположение своих ковалентных связей , но различаются тем, как эти связи создаются с окружающими атомами, особенно в углерод-углеродных двойных связях .
- В простой молекуле бутена (C4H8) две метильные группы (Ch4) могут находиться по обе стороны от двойной ковалентная связь центральная в молекуле.
- Когда атомы углерода связаны на одной стороне двойной связи , это цис-конфигурация; если они находятся на противоположных сторонах двойной связи , это транс-конфигурация.
- (а) Структурные изомеры имеют другое ковалентное расположение атомов.
- Структурные изомеры (такие как бутан и изобутан ) отличаются расположением ковалентных связей .
Химическая основа жизни
- Углерод является наиболее важным элементом для живых существ, поскольку он может образовывать множество различных видов связывает и образует незаменимые соединения.
- Атом углерода обладает уникальными свойствами, которые позволяют ему образовывать ковалентных связей с четырьмя различными атомами, что делает этот универсальный элемент идеальным для использования в качестве основного структурного компонента или «основы» макромолекул.

- Таким образом, атомы углерода могут образовывать до четырех ковалентных связей с другими атомами, чтобы удовлетворить правилу октета.
- Каждый из его четырех атомов водорода образует один ковалентная связь с атомом углерода за счет общей пары электронов.
Гидролиз
- В реакциях дегидратационного синтеза молекула воды образуется в результате образования ковалентной связи между двумя мономерными компонентами в более крупном полимере.
- В реакциях гидролиза молекула воды расходуется в результате разрыва ковалентной связи , удерживающей вместе два компонента полимера.
- Реакции дегидратации и гидролиза — это химические реакции, которые катализируются или «ускоряются» специфическими ферментами; реакции дегидратации включают образование новых связей , требующих энергии, в то время как реакции гидролиза разрывают связей и высвобождают энергию.

- Одна глюкоза получает гидроксильную группу на месте бывшей ковалентной связи , другая глюкоза получает атом водорода.
Цель и процесс фотосинтеза
- Во время фотосинтеза молекулы в листьях захватывают солнечный свет и возбуждают электроны, которые затем накапливаются в ковалентных связях молекул углеводов.
- Эта энергия внутри этих ковалентных связей будет высвобождаться, когда они разрываются во время клеточного дыхания.
- Насколько долговечны и стабильны эти ковалентные связи ?
- Фотосинтез жизненно важен, потому что он развился как способ хранения энергии солнечного излучения («фото-» часть) в виде высокоэнергетических электронов в углерод-углеродном связывает молекул углеводов (часть «-синтез»).
Углеводороды
- Многочисленные ковалентные связи между атомами в углеводородах хранят большое количество энергии, которая высвобождается при сгорании (окислении) этих молекул.

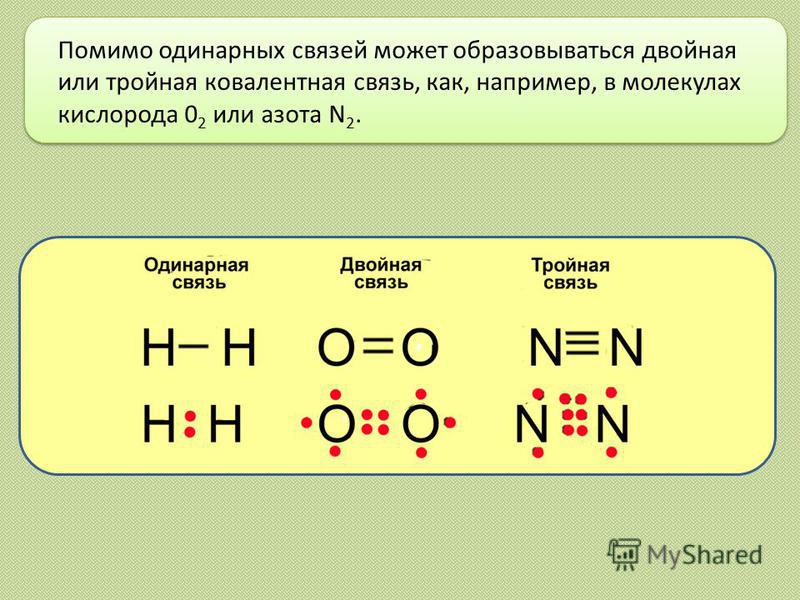
- Кроме того, отдельные углерод-углеродные связи могут быть одинарными, двойными или тройными ковалентными связями ; каждый вид облигаций определенным образом влияет на геометрию молекулы.
- Общая геометрия молекулы изменяется за счет различной геометрии одинарных, двойных и тройных ковалентных связей .
- Двойные и тройные связи изменяют геометрию молекулы: одинарные связи допускают вращение вдоль оси связи , тогда как двойные связи приводят к плоской конфигурации, а тройные связи к линейной.
- Одинарные связи , как и в этане, способны вращаться.
- Многочисленные ковалентные связи между атомами в углеводородах хранят большое количество энергии, которая высвобождается при сгорании (окислении) этих молекул.
Пептидная связь между аминокислотами
- Пептидная связь представляет собой амидную связь , которая связывает аминокислоты вместе с образованием белков.
- Связь , которая удерживает вместе две аминокислоты, представляет собой пептидную связь или ковалентную химическую связь между двумя соединениями (в данном случае двумя аминокислотами).

- Связь амида может быть разрушена только гидролизом амида, при котором связи расщепляются с добавлением молекулы воды.
- Связь пептида (обведена кружком) связывает вместе две аминокислоты.
- Связи пептида представляют собой амидные связи , характеризующиеся наличием карбонильной группы, присоединенной к амину.
Химические реакции и молекулы
- Химические реакции происходят, когда два или более атомов связывают вместе, образуя молекулы, или когда связанных атомов распадаются.
- Химические реакции происходят, когда два или более атома связывают вместе, образуя молекулы, или когда связанных атомов распадаются.
- Два или более атома могут связываться друг с другом, образуя молекулу.
- Когда два атома водорода и кислород делят электроны посредством ковалентных связей , образуется молекула воды.





Leave A Comment