Задание 10 из ЕГЭ по физике
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30
За это задание вы можете получить 2 балла на ЕГЭ в 2023 году
Разбор сложных заданий в тг-канале:
Посмотреть
Задача 1
Резиновый шарик заполнили гелием и отпустили. Из приведённого ниже списка на основании анализа этого процесса выберите два верных утверждения.
Из приведённого ниже списка на основании анализа этого процесса выберите два верных утверждения.
- Концентрация молекул не изменится, т…
Задача 2
При переходе идеального газа из состояния 1 в состояние 2 получили линейную зависимость давления газа от температуры. Масса газа в процессе остаётся постоянной. Из приведённого ниж…
Задача 3
При проведении эксперимента по изобарному нагреванию разреженного газа была получена следующая зависимость объёма газа V от его температуры T . Из приведённого ниже списка выберите…
Задача 4
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состояни…
Задача 5
В результате эксперимента по изучению циклического процесса, проводившегося с некоторым постоянным количеством одноатомного газа, который в условиях опыта можно было считать идеаль…
Задача 6
На pV -диаграмме изображены процессы перевода некоторой неизменной массы идеального газа из состояния 1 в состояние 3.
| V , мл | 50 | 55 | 60 | 65 | 70 |
| t, $°$C | 28 | 58 | …
Задача 9
На рисунке изображены графики зависимости изменения температуры от времени двух тел одинаковой массы. Первоначально тела находились в твёрдом состоянии. Выберите из предложенного п…
Задача 10
На рисунке показан график зависимости температуры вещества, первоначально находившегося в парообразном состоянии, от времени.
Выберите из предложенного перечня два верных утвержден…
Задача 11
В справочнике физических свойств различных веществ представлена следующая таблица.
| Вещество | Плотность в твёрдом состоянии, г/см3 | Температура плавления, $°$С | Удельная теплоёмкость,… |
Задача 12
Кружку с водой поставили на газовую горелку. Значения температуры воды в зависимости от времени представлены на графике. Выберите с помощью графика два верных утверждения.
Значения температуры воды в зависимости от времени представлены на графике. Выберите с помощью графика два верных утверждения.
- по исте…
Задача 13
В результате эксперимента по изучению циклического процесса, проводившегося с некоторым постоянным количеством одноатомного газа, который в условиях опыта можно было считать идеаль…
Задача 14
Тепловой двигатель работает по замкнутому циклу $Q_н$ — теплота, отданная нагретым телом за цикл, $Q_х$ — теплота, отданная холодильнику за цикл. Температура холодильника не изменяется…
Задача 15
Над газом, содержащим $ν$ молей, проводят процесс изотермического сжатия при температуре $T$, объём газа изменяется на $∆V$. Выберите два верных утверждения.
- Объём газа увеличивается.
- О…
Задача 16
Кастрюлю с водой поставили на газовую плиту. Газ горит постоянно. Зависимость температуры воды от времени представлена на графике. Выберите два верных утверждения на основании анал…
Зависимость температуры воды от времени представлена на графике. Выберите два верных утверждения на основании анал…
Задача 17
В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. На дне сосуда лежит шарик. Газ нагрели. Выберите два верных утверждения.
- Объёма …
Задача 18
Над одним молем идеального газа совершают процесс A–B. Выберите два верных утверждения.
- Работа газа на участке AB положительна.
- КПД процесса равно 0.
- Газ не совершает полезную раб…
Задача 19
На $ρV$ диаграмме отображена последовательность трёх процессов ($1 → 2 → 3$) изменения состояния идеального газа. На основании анализа этого циклического процесса выберите два верных у…
Задача 20
Два вещества одинаковой массы, первоначально находившиеся в твёрдом состоянии при температуре 50$°$C, равномерно нагревают на плитках одинаковой мощности в сосудах с пренебрежимо мал…
1 2
В десятом задании госэкзамена по физике школьнику требуется показать знания теплового равновесия и всего, что связано с этой темой. Кимы построены таким образом, что в 50% вариантов встречаются вопросы, касающиеся влажности (к примеру, нужно узнать, во сколько раз выросла концентрация молекул пара, если объем был изотермически уменьшен в два раза), и еще в 50% — касающиеся теплоемкости веществ. Последний тип вопросов включает графики, требующие ознакомления для верного ответа.
Кимы построены таким образом, что в 50% вариантов встречаются вопросы, касающиеся влажности (к примеру, нужно узнать, во сколько раз выросла концентрация молекул пара, если объем был изотермически уменьшен в два раза), и еще в 50% — касающиеся теплоемкости веществ. Последний тип вопросов включает графики, требующие ознакомления для верного ответа.
Десятый номер в ЕГЭ по физике относится к базовому уровню сложности. Лучше всего школьники справляются с упражнениями, где необходимо найти относительную влажность воздуха с использованием специальных таблиц. Зачастую ребята начинают решать номера с этого вопроса, поскольку на выполнение уходит не больше пары минут. Если школьнику выпадет именно эта версия задания десять, то он сможет быстрее перейти к более сложным номерам и успеет выполнить всё в срок.
Ответ на десятое упражнение в госэкзамене представляет собой число, которое следует округлить до десятых или сотых в соответствии с условиями теста.
<< Задание 9
Задание 11 >>
Популярные материалы
Составим твой персональный план подготовки к ЕГЭ
| |||||||||||||||||
| Специальный поиск | |||||||||||||||||
|
Физика Теория вероятностей и мат. Гидравлика Теор. механика Прикладн. механика Химия Электроника Витамины для ума |
Главная Поиск по сайту Формулы Все задачи Помощь Контакты Билеты |
||||||||||||||||
идеального газа Задача 10614 Вычислить киломольные (килоатомные) Cv и Ср и удельные cv и cp теплоемкости для кислорода и аргона, принимая эти газы за идеальные.
Задача 21312 Изобразить на диаграммах p—V и p—Т процесс, проводимый с идеальным газом, приведенный на рисунке.
Задача 50482 Как изменится объем идеального газа, если температура увеличится в 3 раза, а давление – в 4 раза?
Задача 26255 Один моль идеального газа переводят из состояния 1 в состояние 2 (см.
Задача 14035 На (P,V) — диаграмме показан процесс, производимый идеальным газом в изолированном сосуде. Начальное и конечное состояния будут соответствовать распределениям скоростей, изображенным на рисунке …
Задача 15321 Найти число степеней свободы идеального газа, для которого вязкость η = 8,6 мкПа·с, а теплопроводность λ = 89,33 мВт/(м·К).
Задача 17193 Чему равна вероятность обнаружить молекулу, имеющую скорость 100 м/с (идеальный газ в сосуде). Дать необходимые пояснения.
Задача 19740 На рисунке в координатах р, Т показан цикл, происходящий с 1 моль идеального газа.
Задача 19743 На рисунке дан график изменения состояния идеального газа в координатах p,V. Температура первого состояния T1 = 400 К. Температура второго состояния T2 = 600 К. Определить температуру третьего состояния Т3. Представить этот процесс на графиках в координатах р,Т и V,T.
Задача 20385 На рисунке изображено изменение состояния постоянной массы идеального газа. Температура газа в состоянии 1 равны 7°С. Какая температура соответствует состоянию 2?
Задача 20473 На рис. 2.2 изображен график процесса, проведенного с идеальным газом в координатах pV, участки 2–3 и 4–1 — гиперболы.
Задача 20499 Идеальный газ переведен из состояния 1 в состояние 2. Между температурой газа Т1 в начальном состоянии и температурой Т2 в конечном состоянии справедливо соотношение 1) Т1>Т2 2) Т1 = Т2 3) Т1<Т2 4) однозначного ответа дать нельзя.
Задача 20616 На рис. 2.6 изображен в координатах TV график процесса, проведенного с идеальным газом. Изобразить этот процесс в координатах pV и pT.
Задача 20647 При переходе из состояния 1 в состояние 4 внутренняя энергия одноатомного идеального газа … Дж. 1) увеличилась на 22,5 2) уменьшилась на 22,5 3) увеличилась на 37,5 4) уменьшилась на 37,5.
Задача 20671 На графике стрелками указаны направления процессов, протекающих в идеальном газе. В ходе какого процесса давление газа убывает?
Задача 20676 На рис. 2.4 изображен в координатах pV график процесса, проведенного с идеальным газом, участки 1–2 и 3–4 — гиперболы. Изобразить этот процесс в координатах pT и VT.
Задача 22699 На диаграмме P – V изображен цикл, проводимый одноатомным идеальным газом. КПД этого цикла равен … %.
| |||||||||||||||||
3.7: Сохранение массы – новой материи не существует
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47461
Может показаться, что горение уничтожает материю, но после костра остается то же количество или масса материи, что и раньше. Посмотрите на рисунок \(\PageIndex{1}\) ниже. Он показывает, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар. Газы улетучиваются в воздух, оставляя только пепел. Предположим, вы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Также предположим, что вы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы вы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Посмотрите на рисунок \(\PageIndex{1}\) ниже. Он показывает, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар. Газы улетучиваются в воздух, оставляя только пепел. Предположим, вы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Также предположим, что вы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы вы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Закон сохранения массы
Закон сохранения массы был открыт в 1789 году французским химиком Антуаном Лавуазье. Закон сохранения массы гласит, что материя не может быть создана или уничтожена в результате химической реакции. Например, при горении дерева масса сажи, золы и газов равна первоначальной массе древесного угля и кислорода, когда они вступали в реакцию. Таким образом, масса продукта равна массе реагента. Реагент — это химическая реакция двух или более элементов с образованием нового вещества, а продукт — это вещество, которое образуется в результате химической реакции (видео \(\PageIndex{1}\)). Материя и соответствующая ей масса не могут быть созданы или уничтожены, но могут изменять форму на другие вещества, такие как жидкости, газы и твердые тела.
Например, при горении дерева масса сажи, золы и газов равна первоначальной массе древесного угля и кислорода, когда они вступали в реакцию. Таким образом, масса продукта равна массе реагента. Реагент — это химическая реакция двух или более элементов с образованием нового вещества, а продукт — это вещество, которое образуется в результате химической реакции (видео \(\PageIndex{1}\)). Материя и соответствующая ей масса не могут быть созданы или уничтожены, но могут изменять форму на другие вещества, такие как жидкости, газы и твердые тела.
Если вы станете свидетелем того, как 300-килограммовое дерево сгорит дотла, после сожжения останется только пепел, и все они вместе весят 10 кг. Это может заставить вас задаться вопросом, куда делись остальные 290 кг. Недостающие 290 кг были выброшены в атмосферу в виде дыма, поэтому единственное, что вы можете увидеть, это 10 кг пепла. Если вы знаете закон сохранения массы, то знаете, что остальные 290 кг должен куда-то уйти, потому что он должен быть равен массе дерева до того, как оно сгорит.
Если вы знаете закон сохранения массы, то знаете, что остальные 290 кг должен куда-то уйти, потому что он должен быть равен массе дерева до того, как оно сгорит.
Пример \(\PageIndex{1}\)
Если при нагревании 10,0 г карбоната кальция (CaCO 3 ) образуется 4,4 г диоксида углерода (CO 2 ) и 5,6 г оксида кальция (CaO), покажите что эти наблюдения согласуются с законом сохранения массы.
Раствор
\[\begin{align*} \text{Масса реагентов} &= \text{Масса продуктов} \\[4pt] 10,0\, \text{г } \ce{CaCO3} &= 4,4 \,\text{г }\ce{CO2} + 5,6\, \text{г } \ce{CaO} \\[4pt] 10,0\,\text{г реагента} &= 10,0\ , \text{g товаров} \end{align*} \nonumber \]
Поскольку масса реагента равна массе продуктов, наблюдения согласуются с законом сохранения массы.
Упражнение \(\PageIndex{1}\)
Гидроксид калия (\(\ce{KOH}\)) легко реагирует с диоксидом углерода (\(\ce{CO2}\)) с образованием карбоната калия (\( \ce{K2CO3}\)) и вода (\(\ce{h3O}\)). Сколько граммов карбоната калия образуется, если 224,4 г \(\ce{KOH}\) реагирует с 88,0 г \(\ce{CO2}\)? Реакция также дает 36,0 г воды.
Сколько граммов карбоната калия образуется, если 224,4 г \(\ce{KOH}\) реагирует с 88,0 г \(\ce{CO2}\)? Реакция также дает 36,0 г воды.
- Ответить
- 276,4 г карбоната калия
Закон также применим как к химическим, так и к физическим изменениям. Например, если у вас есть кубик льда, который превращается в жидкость, и вы нагреваете эту жидкость, она становится газом. Кажется, что он исчез, но все еще там.
Резюме
- Горение и другие изменения в материи не разрушают материю.
- Масса материи всегда одинакова до и после того, как происходят изменения.
- Закон сохранения массы гласит, что материя не может быть создана или уничтожена.
Взносы и ссылки
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор@Генри Агнью
- автор@Мариса Альвиар-Агнью
- сохранение массы
- источник@https://www.ck12.org/c/chemistry/
14.2 Изменение температуры и теплоемкость – College Physics главы 1-17
14 Методы теплопередачи и переноса
Резюме
- Наблюдайте за теплопередачей и изменением температуры и массы.
- Рассчитать конечную температуру после теплопередачи между двумя объектами.
Одним из основных эффектов теплопередачи является изменение температуры: нагревание повышает температуру, а охлаждение снижает ее. Мы предполагаем, что фазового перехода нет и что над системой или системой не совершается никакой работы. Опыты показывают, что передаваемое тепло зависит от трех факторов — изменения температуры, массы системы, вещества и фазы вещества.
Опыты показывают, что передаваемое тепло зависит от трех факторов — изменения температуры, массы системы, вещества и фазы вещества.

Зависимость от изменения температуры и массы легко понять. Благодаря тому, что (средняя) кинетическая энергия атома или молекулы пропорциональна абсолютной температуре, внутренняя энергия системы пропорциональна абсолютной температуре и числу атомов или молекул. Благодаря тому, что переданное тепло равно изменению внутренней энергии, теплота пропорциональна массе вещества и изменению температуры. Переносимое тепло также зависит от вещества, так что, например, теплота, необходимая для повышения температуры, для спирта меньше, чем для воды. Для одного и того же вещества передаваемая теплота также зависит от фазы (газовая, жидкая или твердая).
ТЕПЛОПЕРЕДАЧА И ИЗМЕНЕНИЕ ЭНЕРГИИ
Количественная зависимость между теплопередачей и изменением температуры содержит все три фактора:
[латекс]\жирныйсимвол{Q=mc\Delta{T}},[/латекс]
где[латекс ]\boldsymbol{Q}[/latex]– обозначение теплопередачи, [latex]\boldsymbol{m}[/latex]– масса вещества, а [latex]\boldsymbol{\Delta{T}}[ /латекс] — изменение температуры. { \circ}\textbf{C)}}.[/latex]Напоминаем, что изменение температуры[latex]\boldsymbol{(\Delta{T})}[/latex]одинаково в единицах кельвина и градусах Цельсия. Если теплоотдачу измерять в килокалориях, то 9{\circ}\textbf{C)}}.[/латекс]
{ \circ}\textbf{C)}}.[/latex]Напоминаем, что изменение температуры[latex]\boldsymbol{(\Delta{T})}[/latex]одинаково в единицах кельвина и градусах Цельсия. Если теплоотдачу измерять в килокалориях, то 9{\circ}\textbf{C)}}.[/латекс]
Значения удельной теплоемкости обычно нужно искать в таблицах, потому что нет простого способа их рассчитать. В общем случае удельная теплоемкость также зависит от температуры. В таблице 1 приведены репрезентативные значения удельной теплоемкости для различных веществ. За исключением газов, зависимость теплоемкости большинства веществ от температуры и объема слабая. Из этой таблицы мы видим, что удельная теплоемкость воды в пять раз больше, чем у стекла, и в десять раз больше, чем у железа, а это значит, что требуется в пять раз больше теплоты, чтобы поднять температуру воды на ту же величину, что и для стекла, и в десять раз больше, чем для стекла. много тепла, чтобы поднять температуру воды, как для железа. На самом деле вода имеет одну из самых больших удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле. 9{\circ}\textbf{C}}.[/latex](a) Сколько тепла требуется? Какой процент тепла используется для повышения температуры (b) кастрюли и (c) воды?
9{\circ}\textbf{C}}.[/latex](a) Сколько тепла требуется? Какой процент тепла используется для повышения температуры (b) кастрюли и (c) воды?
Стратегия
Посуда и вода всегда имеют одинаковую температуру. Когда вы ставите кастрюлю на плиту, температура воды и сковороды увеличивается на одинаковую величину. Воспользуемся уравнением теплообмена при заданном изменении температуры и массы воды и алюминия. Удельные теплоемкости воды и алюминия приведены в табл. 1. 94\textbf{J}=27.0\textbf{кДж}}.[/latex]
[латекс]\boldsymbol{Q_{\textbf{Всего}}=Q_{\textbf{W}}+Q_{\textbf{Al}}=62,8\textbf{кДж}+ 27,0\textbf{кДж}=89,8\ textbf{кДж}}.[/латекс]
Таким образом, количество тепла, идущего на нагрев сковороды, равно
[латекс]\boldsymbol{\frac{27,0\textbf{кДж}}{89,8\textbf{кДж}}}[/latex][латекс]\boldsymbol {\times100\%=30,1\%},[/латекс]
, а количество, идущее на нагрев воды, равно
[латекс]\boldsymbol{\frac{62,8\textbf{кДж}}{89,8\textbf{кДж}}}[/latex][латекс]\boldsymbol{\times100 \%=69,9\%}. [/latex]
[/latex]
Обсуждение
В этом примере тепло, переданное контейнеру, составляет значительную долю от общего количества переданного тепла. Хотя масса кастрюли в два раза больше массы воды, удельная теплоемкость воды более чем в четыре раза больше, чем у алюминия. Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевой кастрюлей.
Рис. 2. Дымящиеся тормоза этого грузовика являются видимым свидетельством механического эквивалента тепла.Пример 2: Расчет повышения температуры на основе работы, проделанной над веществом: перегрев тормозов грузовика при движении под уклон тормозной материал. Это преобразование предотвращает преобразование потенциальной энергии гравитации в кинетическую энергию грузовика. Проблема заключается в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы достаточное количество тепла передавалось от тормозов в окружающую среду.
 9{\circ}\textbf{C}}[/latex], если материал удерживает 10% энергии от 10 000-килограммового грузовика, спускающегося с высоты 75,0 м (при вертикальном перемещении) с постоянной скоростью.
9{\circ}\textbf{C}}[/latex], если материал удерживает 10% энергии от 10 000-килограммового грузовика, спускающегося с высоты 75,0 м (при вертикальном перемещении) с постоянной скоростью.Стратегия
Если тормоза не задействованы, гравитационная потенциальная энергия преобразуется в кинетическую энергию. При торможении потенциальная энергия гравитации преобразуется во внутреннюю энергию тормозного материала. Сначала мы вычисляем гравитационную потенциальную энергию[латекс]\boldsymbol{(Mgh)}[/латекс], которую весь грузовик теряет при спуске, а затем находим повышение температуры только в тормозном материале. 9{\circ}\textbf{C}}.[/латекс]
Обсуждение
Эта температура близка к температуре кипения воды. Если бы грузовик какое-то время ехал, то непосредственно перед спуском температура тормозов, вероятно, была бы выше температуры окружающей среды. Повышение температуры при спуске, вероятно, повысит температуру тормозного материала выше точки кипения воды, поэтому этот метод нецелесообразен. Однако та же идея лежит в основе новейшей гибридной технологии автомобилей, где механическая энергия (потенциальная энергия гравитации) преобразуется тормозами в электрическую энергию (аккумулятор).
Однако та же идея лежит в основе новейшей гибридной технологии автомобилей, где механическая энергия (потенциальная энергия гравитации) преобразуется тормозами в электрическую энергию (аккумулятор).
| Вещества | Удельная теплоемкость ( c ) | |
|---|---|---|
| Твердые вещества | Дж/кг⋅ºC | ккал/кг⋅ºC 2 |
| Алюминий | 900 | 0,215 |
| Асбест | 800 | 0,19 |
| Бетон, гранит (средний) | 840 | 0,20 |
| Медь | 387 | 0,0924 |
| Стекло | 840 | 0,20 |
| Золото | 129 | 0,0308 |
| Тело человека (в среднем при 37 °C) | 3500 | 0,83 |
| Лед (средний, от -50°C до 0°C) | 2090 | 0,50 |
| Железо, сталь | 452 | 0,108 |
| Свинец | 128 | 0,0305 |
| Серебро | 235 | 0,0562 |
| Дерево | 1700 | 0,4 |
| Жидкости | ||
| Бензол | 1740 | 0,415 |
| Этанол | 2450 | 0,586 |
| Глицерин | 2410 | 0,576 |
| Меркурий | 139 | 0,0333 |
| Вода (15,0 °С) | 4186 | 1. 000 000 |
| Газы 3 | ||
| Воздух (сухой) | 721 (1015) | 0,172 (0,242) |
| Аммиак | 1670 (2190) | 0,399 (0,523) |
| Углекислый газ | 638 (833) | 0,152 (0,199) |
| Азот | 739 (1040) | 0,177 (0,248) |
| Кислород | 651 (913) | 0,156 (0,218) |
| Пар (100°C) | 1520 (2020) | 0,363 (0,482) |
| Таблица 1. Удельная теплоемкость 1 различных веществ | ||
Обратите внимание, что Пример 2 является иллюстрацией механического эквивалента тепла. В качестве альтернативы, повышение температуры может быть произведено с помощью паяльной лампы вместо механического. 9{\circ}\textbf{C}}.[/latex]Предположим, что кастрюля находится на изолированной подушке и что незначительное количество воды выкипает. При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
Стратегия
Кастрюля размещена на изолирующей подушке, чтобы обеспечить небольшой теплообмен с окружающей средой. Первоначально кастрюля и вода не находятся в тепловом равновесии: кастрюля имеет более высокую температуру, чем вода. Затем теплопередача восстанавливает тепловое равновесие, когда вода и кастрюля соприкасаются. Поскольку теплопередача между кастрюлей и водой происходит быстро, масса испаряемой воды пренебрежимо мала, а величина тепла, теряемого кастрюлей, равна теплу, приобретаемому водой. Обмен теплом прекращается, как только достигается тепловое равновесие между чашей и водой. Теплообмен можно записать как[латекс]\жирныйсимвол{|Q_{\textbf{горячий}}|=Q_{\textbf{холодный}}}.[/латекс] 9{\circ}\textbf{C})}.[/латекс]
 {\circ}\textbf{C}).} \end{массив}[/latex] 9{\circ}\textbf{C}}?[/latex]Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и, таким образом, претерпевает небольшое изменение температуры при заданной теплопередаче. Большому водоему, такому как озеро, требуется большое количество тепла, чтобы заметно повысить его температуру. Это объясняет, почему температура озера остается относительно постоянной в течение дня даже при больших изменениях температуры воздуха. Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).
{\circ}\textbf{C}).} \end{массив}[/latex] 9{\circ}\textbf{C}}?[/latex]Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и, таким образом, претерпевает небольшое изменение температуры при заданной теплопередаче. Большому водоему, такому как озеро, требуется большое количество тепла, чтобы заметно повысить его температуру. Это объясняет, почему температура озера остается относительно постоянной в течение дня даже при больших изменениях температуры воздуха. Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).ДОМАШНИЙ ЭКСПЕРИМЕНТ: ИЗМЕНЕНИЕ ТЕМПЕРАТУРЫ ЗЕМЛИ И ВОДЫ
Что нагревается быстрее, земля или вода?
Для изучения различий в теплоемкости:
- Поместите равные массы сухого песка (или почвы) и воды одинаковой температуры в два небольших сосуда. (Средняя плотность почвы или песка примерно в 1,6 раза выше, чем у воды, поэтому вы можете получить примерно равные массы, используя [латекс]\boldsymbol{50\%}[/латекс]больше воды по объему.


 статистика
статистика рисунок). Определите максимальную температуру Tmax газа в ходе процесса.
рисунок). Определите максимальную температуру Tmax газа в ходе процесса.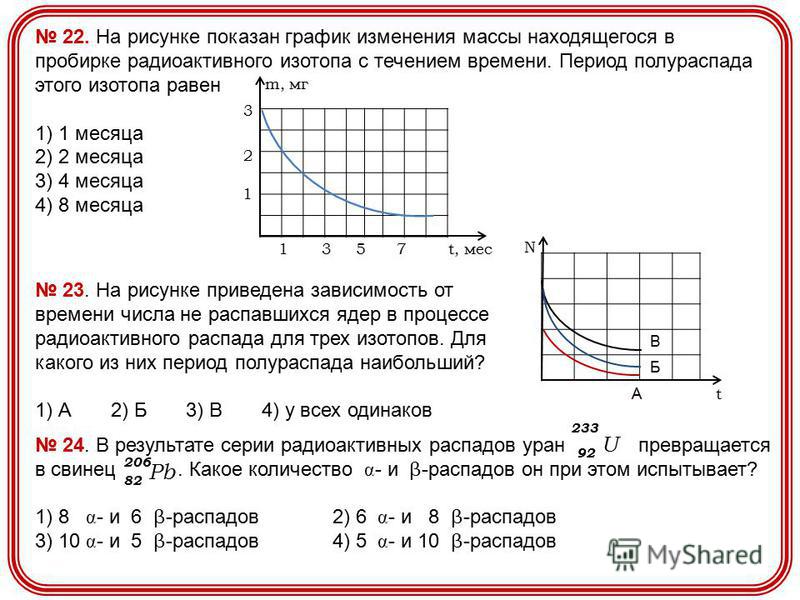 T1 = 450 К, Т2 = 900 К. Определить работу газа за цикл. Построить график этого цикла в координатах p,V и V,T.
T1 = 450 К, Т2 = 900 К. Определить работу газа за цикл. Построить график этого цикла в координатах p,V и V,T. Изобразить этот процесс в координатах pT и VT.
Изобразить этот процесс в координатах pT и VT.


Leave A Comment