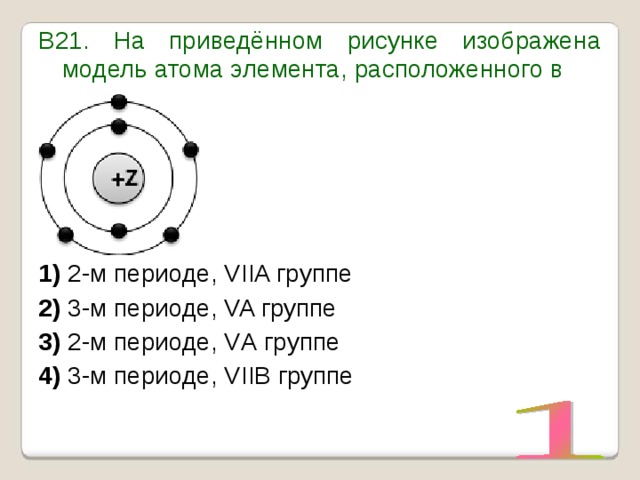
УМОЛЯЯЯЮ,ПОМОГИТЕ, ОЧЕНЬ СРОЧНОО На рисунке изображена модель электронного строения атома некоторого химического элемента: +30)2)8)1)8)2 На основании анализа предложенной модели — вопрос №4325513 — Учеба и наука
выполните следующие задания: 1) определите химический элемент, атом которого имеет такое электронное строение; 2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент; 3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
При исследовании болотной воды в ней были обнаружены следующие ионы: Nh5+, S2-, NO3-. Для проведения качественного анализа к этой воде добавили раствор соляной кислоты.
- Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа).
- Запишите сокращённое ионное уравнение протекающей химической реакции.

Дана схема окислительно-восстановительной реакции:
1) Составьте электронный баланс этой реакции;
2) Укажите окислитель и восстановитель;
3) Расставьте коэффициенты и запишите получившееся уравнение реакции.
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органических соединений. Запишите в таблицу номера, под которыми указаны эти соединения.
Ароматический углеводород
Альдегид
В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого перечня веществ в задании 11. Расставьте коэффициенты в полученных схемах.
Пропионовая кислота является типичным представителем карбоновых кислот. Её применяют для получения лекарственных препаратов и душистых веществ, в качестве консерванта в пищевой промышленности.
Впишите в заданную схему превращений структурную формулу вещества Х, выбрав его из предложенного перечня веществ в задании 11. Запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ.
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК хлора в воде плавательных бассейнов составляет 0,5 мг/м3.
Для хлорирования воды в дачном бассейне глубиной 1,0 м, шириной 1,5 м и длиной 2 м использовали 3,0 мг хлора.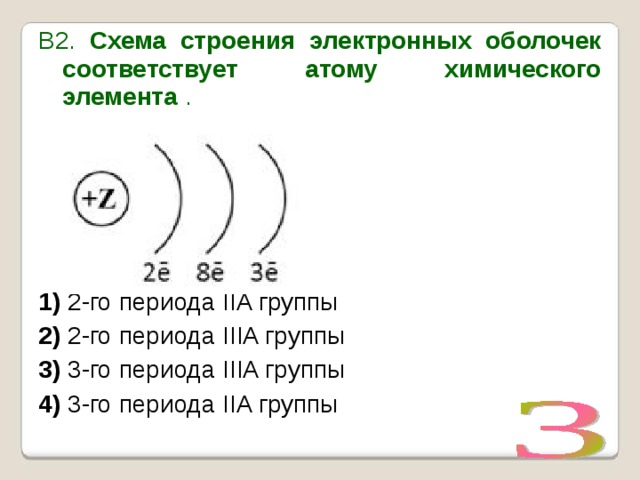
Решите задачу. Серная кислота применяется в качестве электролита при производстве свинцово-кислотных аккумуляторов для автомобилей. Массовая доля кислоты в электролите составляет 30%, остальное — дистиллированная вода. Рассчитайте массу серной кислоты и массу дистиллированной воды, которые взяты для приготовления 3 кг такого электролита. Запишите подробное решение задачи.
Публикация. Разработка задания по естественно-научной грамотности (по химии) для 9 класса. Илюшина Ксения Валерьевна.
Скачать публикацию
Язык издания: русский
Периодичность: ежедневно
Вид издания: сборник
Версия издания: электронное сетевое
Публикация: Разработка задания по естественно-научной грамотности (по химии) для 9 класса
Автор: Илюшина Ксения Валерьевна
РАЗРАБОТКА ЗАДАНИЯ ПО ЕСТЕСТВЕННО-НАУЧНОЙ ГРАМОТНОСТИ (ПО ХИМИИ) ДЛЯ 9 КЛАССАИлюшина Ксения Валерьевна, учитель химии МБОУ СОШ с УИОП №8 г.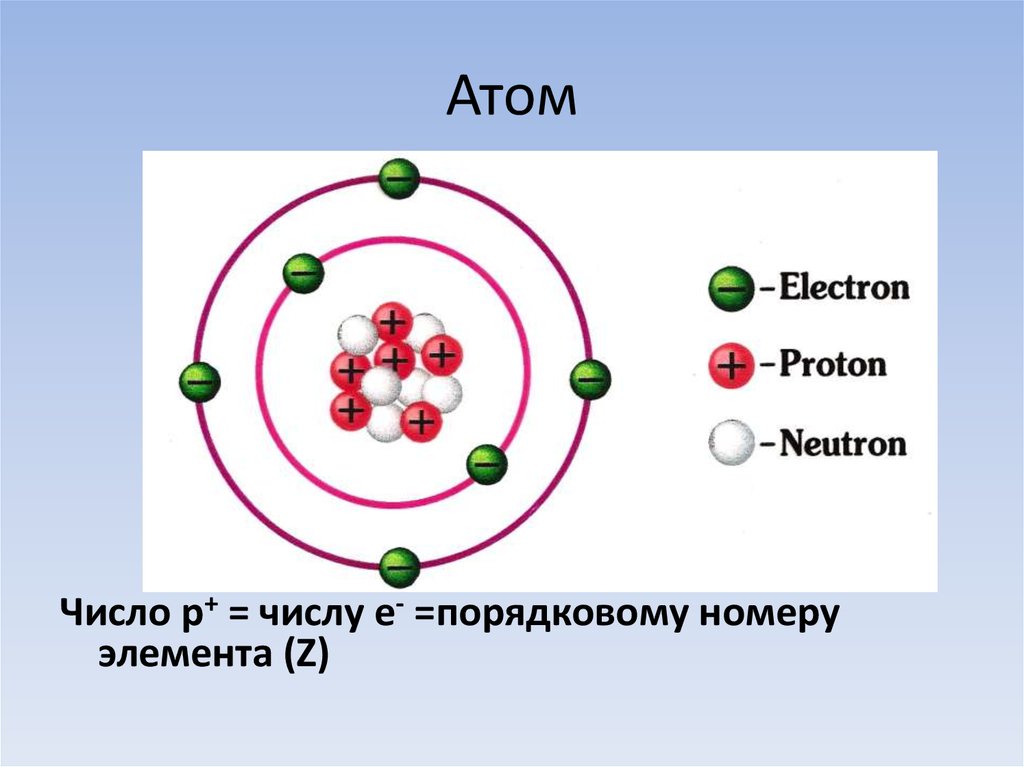
0+ Свидетельство о регистрации СМИ: СМИ ЭЛ № ФС 77 — 76928.
Лицензия на осуществление образовательной деятельности:
№Л035-01237-19/00257259 от 01. 02.2021 г.
02.2021 г.
Свидетельство о регистрации в Национальном центре ISSN (присвоен Международный стандартный номер сериального издания: № 2686-9985 от 7.11.2019)
Для улучшения работы сайта и его взаимодействия с пользователями мы используем файлы cookie. Продолжая работу с сайтом, Вы разрешаете использование cookie-файлов. Вы всегда можете отключить файлы cookie в настройках Вашего браузера.
Диаграммы Бора атомов и ионов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37159
Цели
- Вспомнить стабильность, связанную с атомом, который имеет полностью заполненную валентную оболочку
- Построить атом по модели Бора
Ключевые термины
- Правило октета: Правило, утверждающее, что атомы теряют, приобретают или делят электроны, чтобы иметь полную валентную оболочку из 8 электронов.

- Электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одно и то же главное квантовое число (представленное как орбита, по которой движутся электроны).
Электронные оболочки
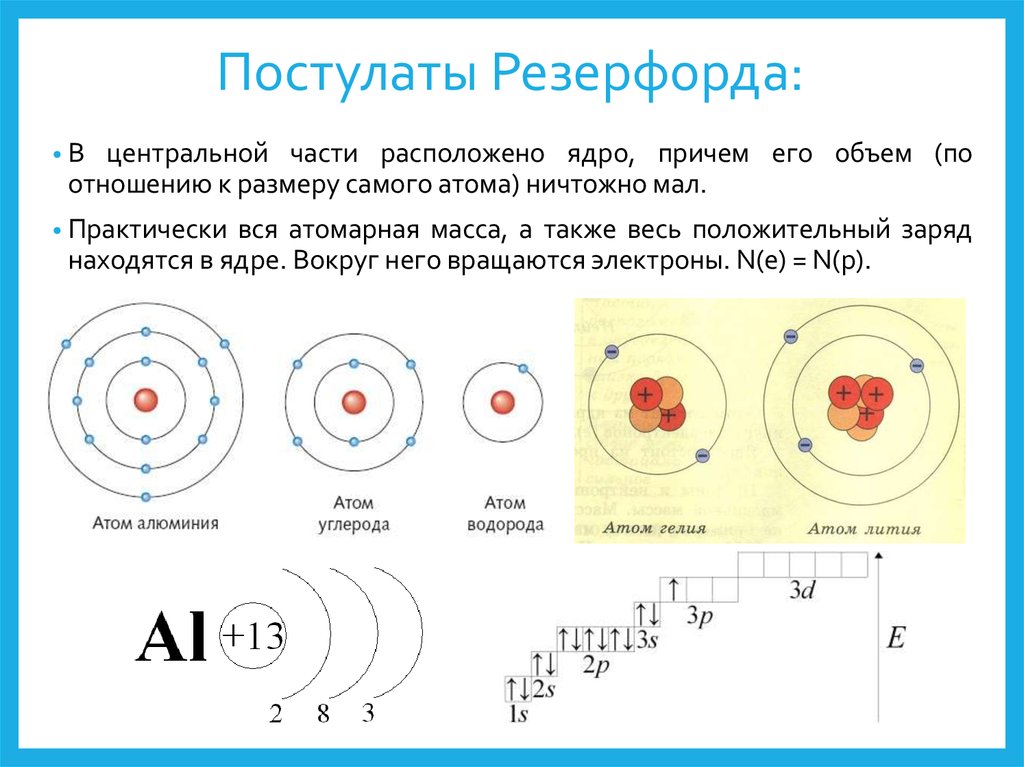
Нильс Бор предложил раннюю модель атома как центрального ядра, содержащего протоны и нейтроны, вращающиеся вокруг электронов в оболочках. Как обсуждалось ранее, существует связь между количеством протонов в элементе, атомным номером, который отличает один элемент от другого, и количеством электронов, которые он имеет. Во всех электрически нейтральных атомах количество электронов равно количеству протонов. Каждый элемент, когда он электрически нейтрален, имеет число электронов, равное его атомному номеру.
Ранняя модель атома была разработана в 1913 году датским ученым Нильсом Бором (1885–1962). Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны, с электронами на круговых орбитах на определенном расстоянии от ядра (рис.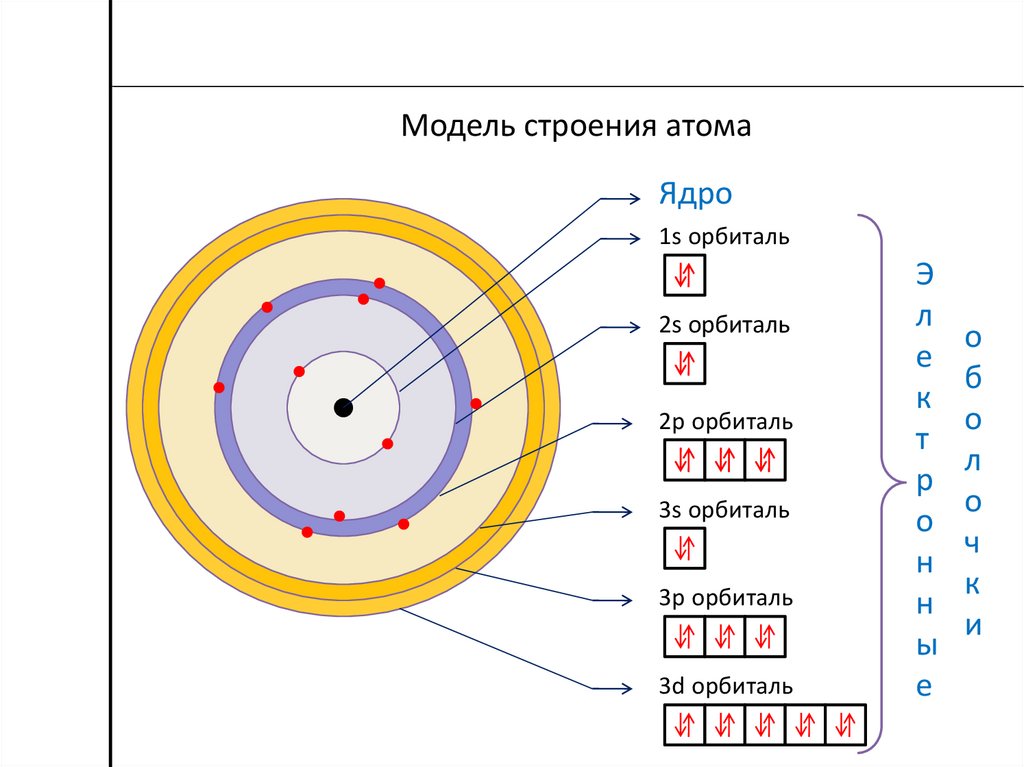 \(\PageIndex{1}\)). Эти орбиты образуют электронные оболочки или энергетические уровни, которые позволяют визуализировать количество электронов в различных оболочках. Эти энергетические уровни обозначаются числом и символом «n». Например, оболочка 1n представляет собой первый энергетический уровень, расположенный ближе всего к ядру.
\(\PageIndex{1}\)). Эти орбиты образуют электронные оболочки или энергетические уровни, которые позволяют визуализировать количество электронов в различных оболочках. Эти энергетические уровни обозначаются числом и символом «n». Например, оболочка 1n представляет собой первый энергетический уровень, расположенный ближе всего к ядру.
Электрон обычно существует в самой низкой доступной энергетической оболочке, которая находится ближе всего к ядру. Энергия фотона света может поднять его на более высокую энергетическую оболочку, но эта ситуация нестабильна, и электрон быстро распадается обратно в основное состояние.
Диаграммы Бора
Диаграммы Бора показывают, как электроны вращаются вокруг ядра атома, подобно планетам, вращающимся вокруг Солнца. В модели Бора электроны изображаются как движущиеся по кругу на разных оболочках, в зависимости от того, какой элемент у вас есть. На рисунке \(\PageIndex{2}\) показаны контрастные диаграммы Бора для атомов лития, фтора и алюминия. Ближайшая к ядру оболочка называется К-оболочкой, следующая — L-оболочкой, следующая — М-оболочкой.
На рисунке \(\PageIndex{2}\) показаны контрастные диаграммы Бора для атомов лития, фтора и алюминия. Ближайшая к ядру оболочка называется К-оболочкой, следующая — L-оболочкой, следующая — М-оболочкой.
Каждая оболочка может содержать только определенное количество электронов. У оболочки K может быть 2, у L может быть 8 электронов, у M может быть 18 электронов и так далее.
- Литий имеет три электрона:
- два идут в оболочку K и
- оставшийся идет в оболочку L.
- Его электронная конфигурация K(2), L(1)
- Фтор имеет девять электронов:
- два идут на K shell и
- остальные семь идут в оболочку L.
- Электронная конфигурация: K(2), L(7). Обратите внимание, что L может иметь 8 электронов.
- Алюминий имеет тринадцать электронов:
- два идут в оболочку К,
- восемь идут на корпус L, а
- остальные три идут в оболочку М.

- Электронная конфигурация: K(2), L(8), M(3). Обратите внимание, что М-оболочка может иметь 18 электронов.
Орбитали в модели Бора
Электроны заполняют оболочки орбит в последовательном порядке. В стандартных условиях атомы сначала заполняют внутренние оболочки (ближе к ядру), что часто приводит к различному количеству электронов на самой внешней оболочке. Самая внутренняя оболочка имеет максимум два электрона, но каждая из следующих двух электронных оболочек может иметь максимум восемь электронов. Это известно как правило октета, которое гласит, что, за исключением самой внутренней оболочки, атомы более энергетически стабильны, когда они имеют восемь электронов в своей валентной оболочке, самой внешней электронной оболочке. Примеры некоторых нейтральных атомов и их электронных конфигураций показаны на рисунке \(\PageIndex{3}\). Как показано, гелий имеет полную внешнюю электронную оболочку, причем два электрона заполняют его первую и единственную оболочку. Точно так же неон имеет полную внешнюю оболочку 2n, содержащую восемь электронов. Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильны, если бы следовали правилу октетов и имели восемь.
Точно так же неон имеет полную внешнюю оболочку 2n, содержащую восемь электронов. Напротив, хлор и натрий имеют семь и один электрон на своих внешних оболочках соответственно. Теоретически они были бы более энергетически стабильны, если бы следовали правилу октетов и имели восемь.
Диаграммы Бора
Диаграммы Бора показывают, сколько электронов заполняет каждую основную оболочку. Элементы группы 18 (показаны гелий, неон и аргон) имеют полную внешнюю, или валентную, оболочку. Полная валентная оболочка является наиболее стабильной электронной конфигурацией. Элементы других групп имеют частично заполненные валентные оболочки и приобретают или теряют электроны для достижения стабильной электронной конфигурации.
Атом может приобретать или терять электроны для достижения полной валентной оболочки, наиболее стабильной электронной конфигурации. Периодическая таблица организована в столбцы и строки в зависимости от количества электронов и того, где эти электроны расположены, что дает инструмент для понимания того, как электроны распределяются во внешней оболочке атома. Как показано на рисунке , атомы гелия (He), неона (Ne) и аргона (Ar) группы 18 имеют заполненные внешние электронные оболочки, что делает ненужным для них приобретение или потерю электронов для достижения стабильности; они очень стабильны как отдельные атомы. Их нереакционная способность привела к тому, что они были названы инертными газами (или благородными газами). Для сравнения, элементы группы 1, включая водород (H), литий (Li) и натрий (Na), имеют один электрон на своих внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон. В результате потери отрицательно заряженного электрона они превращаются в положительно заряженные ионы. Когда атом теряет электрон и становится положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например, Na 9—\). Таким образом, столбцы таблицы Менделеева представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их сходные химические характеристики.
Как показано на рисунке , атомы гелия (He), неона (Ne) и аргона (Ar) группы 18 имеют заполненные внешние электронные оболочки, что делает ненужным для них приобретение или потерю электронов для достижения стабильности; они очень стабильны как отдельные атомы. Их нереакционная способность привела к тому, что они были названы инертными газами (или благородными газами). Для сравнения, элементы группы 1, включая водород (H), литий (Li) и натрий (Na), имеют один электрон на своих внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки, отдав или потеряв электрон. В результате потери отрицательно заряженного электрона они превращаются в положительно заряженные ионы. Когда атом теряет электрон и становится положительно заряженным ионом, это обозначается знаком плюс после символа элемента; например, Na 9—\). Таким образом, столбцы таблицы Менделеева представляют потенциальное общее состояние внешних электронных оболочек этих элементов, которое отвечает за их сходные химические характеристики.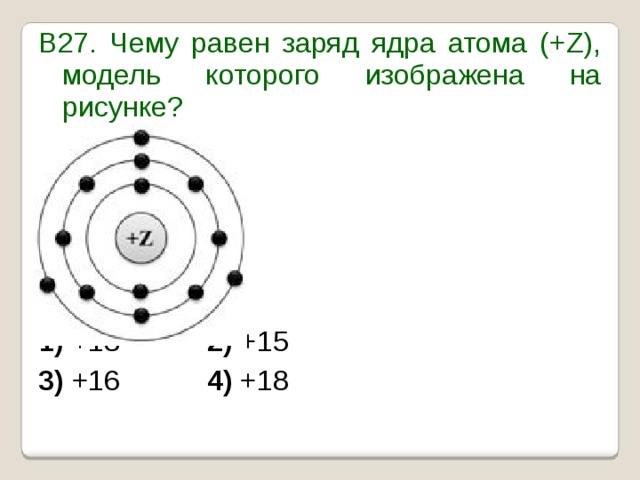
Символы Льюиса
Символы Льюиса представляют собой упрощенные диаграммы Бора, которые отображают только электроны на внешнем энергетическом уровне.
Резюме
- В модели атома Бора ядро содержит большую часть массы атома в его протонах и нейтронах.
- Вокруг положительно заряженного ядра вращаются отрицательно заряженные электроны, которые вносят небольшой вклад с точки зрения массы, но электрически эквивалентны протонам в ядре.
- В большинстве случаев электроны сначала заполняют орбитали с более низкой энергией, затем следующую орбиталь с более высокой энергией, пока она не заполнится, и так далее, пока не будут размещены все электроны.
- Атомы, как правило, наиболее стабильны с полной внешней оболочкой (та, которая после первой содержит 8 электронов), что приводит к тому, что обычно называют «правилом октетов».
- Свойства элемента определяются его самыми внешними электронами или электронами на орбите с самой высокой энергией.

- Атомы, которые не имеют полных внешних оболочек, имеют тенденцию приобретать или терять электроны, что приводит к полной внешней оболочке и, следовательно, стабильности.
Авторы и ссылки
Boundless (www.boundless.com)
- Маниш Бхардвадж
Bohr Diagrams of Atoms and Ions распространяется под лицензией CC BY-NC-SA 4.0 и был создан, переработан и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Бор Атом
- Диаграмма Бора
Строительные блоки материи – анатомия и физиология
Перейти к содержимому
Цели обучения
К концу этого раздела вы сможете:
- Обсудить отношения между материей, массой, элементами, соединениями, атомами и субатомными частицами
- Различие между атомным номером и массовым числом
- Определите ключевое различие между изотопами одного и того же элемента
- Объясните, как электроны занимают электронные оболочки и каков их вклад в относительную стабильность атома
Вещество вселенной — от песчинки до звезды — называется материей . Ученые определяют материю как все, что занимает пространство и имеет массу. Масса объекта и его вес — связанные понятия, но не совсем одно и то же. Масса объекта — это количество материи, содержащейся в объекте, и она одинакова, находится ли этот объект на Земле или в условиях невесомости космического пространства. С другой стороны, вес объекта — это его масса, на которую действует сила тяжести. Вес объекта больше там, где гравитация сильнее, чем там, где гравитация слабее. Например, объект определенной массы весит на Луне меньше, чем на Земле, потому что гравитация Луны меньше, чем земная. Другими словами, вес непостоянен и зависит от гравитации. Кусок сыра, который весит фунт на Земле, на Луне весит всего несколько унций.
Масса объекта и его вес — связанные понятия, но не совсем одно и то же. Масса объекта — это количество материи, содержащейся в объекте, и она одинакова, находится ли этот объект на Земле или в условиях невесомости космического пространства. С другой стороны, вес объекта — это его масса, на которую действует сила тяжести. Вес объекта больше там, где гравитация сильнее, чем там, где гравитация слабее. Например, объект определенной массы весит на Луне меньше, чем на Земле, потому что гравитация Луны меньше, чем земная. Другими словами, вес непостоянен и зависит от гравитации. Кусок сыра, который весит фунт на Земле, на Луне весит всего несколько унций.
Элементы и соединения
Вся материя в мире природы состоит из одной или нескольких из 92 основных субстанций, называемых элементами. Элемент — это чистое вещество, которое отличается от всех других веществ тем, что его нельзя создать или разрушить обычными химическими средствами. Хотя ваше тело может собирать многие химические соединения, необходимые для жизни, из составляющих их элементов, оно не может создавать элементы. Они должны исходить из окружающей среды. Знакомый пример элемента, который вы должны принимать, — это кальций (Ca ++). Кальций необходим для человеческого организма; он усваивается и используется для ряда процессов, в том числе для укрепления костей. Когда вы потребляете молочные продукты, ваша пищеварительная система расщепляет пищу на компоненты, достаточно мелкие, чтобы попасть в кровоток. Среди них кальций, который, поскольку он является элементом, не может подвергаться дальнейшему расщеплению. Таким образом, элементарный кальций в сыре такой же, как кальций, из которого состоят ваши кости. Некоторые другие элементы, с которыми вы, возможно, знакомы, это кислород, натрий и железо. Элементы в организме человека показаны на рис. 2.1.1, начиная с наиболее распространенных: кислорода (О), углерода (С), водорода (Н) и азота (N). Имя каждого элемента можно заменить однобуквенным или двухбуквенным символом; вы познакомитесь с некоторыми из них во время этого курса. Все элементы в вашем теле происходят из продуктов, которые вы едите, и воздуха, которым вы дышите.
Они должны исходить из окружающей среды. Знакомый пример элемента, который вы должны принимать, — это кальций (Ca ++). Кальций необходим для человеческого организма; он усваивается и используется для ряда процессов, в том числе для укрепления костей. Когда вы потребляете молочные продукты, ваша пищеварительная система расщепляет пищу на компоненты, достаточно мелкие, чтобы попасть в кровоток. Среди них кальций, который, поскольку он является элементом, не может подвергаться дальнейшему расщеплению. Таким образом, элементарный кальций в сыре такой же, как кальций, из которого состоят ваши кости. Некоторые другие элементы, с которыми вы, возможно, знакомы, это кислород, натрий и железо. Элементы в организме человека показаны на рис. 2.1.1, начиная с наиболее распространенных: кислорода (О), углерода (С), водорода (Н) и азота (N). Имя каждого элемента можно заменить однобуквенным или двухбуквенным символом; вы познакомитесь с некоторыми из них во время этого курса. Все элементы в вашем теле происходят из продуктов, которые вы едите, и воздуха, которым вы дышите.
В природе элементы редко встречаются поодиночке. Вместо этого они объединяются, образуя соединения. Соединение представляет собой вещество, состоящее из двух или более элементов, соединенных химическими связями. Например, составная глюкоза является важным топливом для организма. Он всегда состоит из одних и тех же трех элементов: углерода, водорода и кислорода. Более того, элементы, входящие в состав любого данного соединения, всегда встречаются в одних и тех же относительных количествах. В глюкозе на каждые двенадцать водородных единиц всегда приходится шесть углеродных и шесть кислородных единиц. Но что же представляют собой эти «единицы» элементов?
Атомы и субатомные частицы
Атом — это наименьшее количество элемента, которое сохраняет уникальные свойства этого элемента.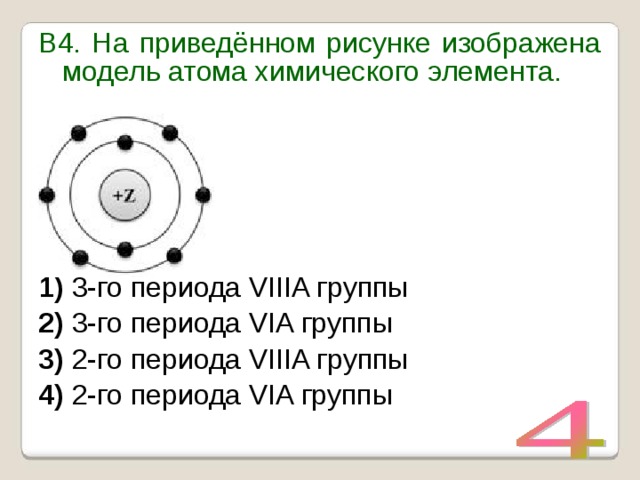 Другими словами, атом водорода — это единица водорода — наименьшее количество водорода, которое может существовать. Как вы могли догадаться, атомы почти непостижимо малы. Точка в конце этого предложения имеет ширину в миллионы атомов.
Другими словами, атом водорода — это единица водорода — наименьшее количество водорода, которое может существовать. Как вы могли догадаться, атомы почти непостижимо малы. Точка в конце этого предложения имеет ширину в миллионы атомов.
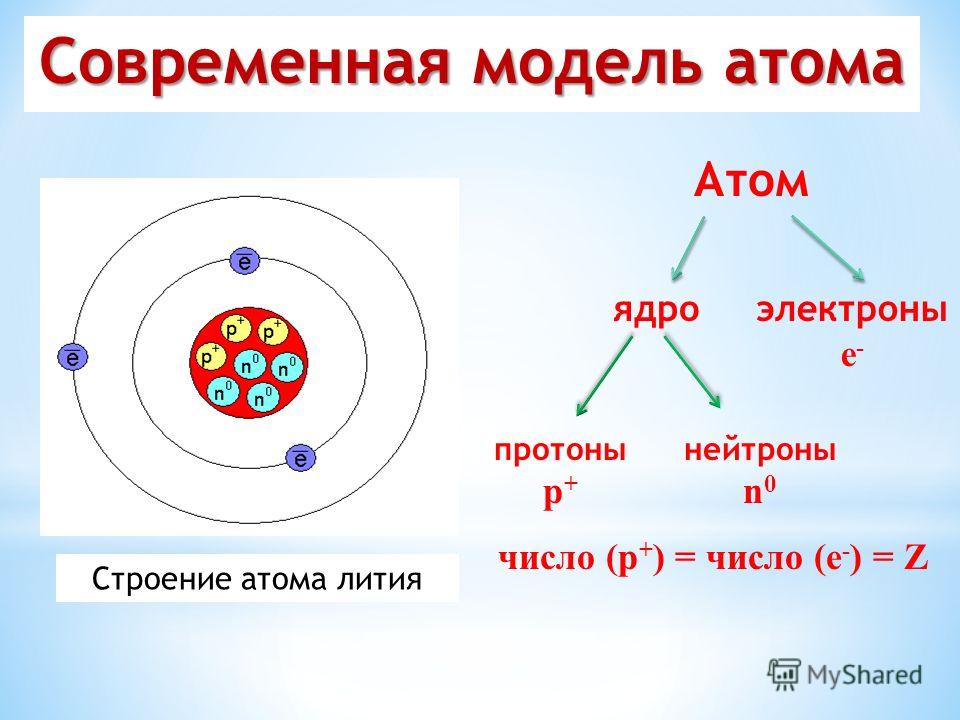
Атомная структура и энергия
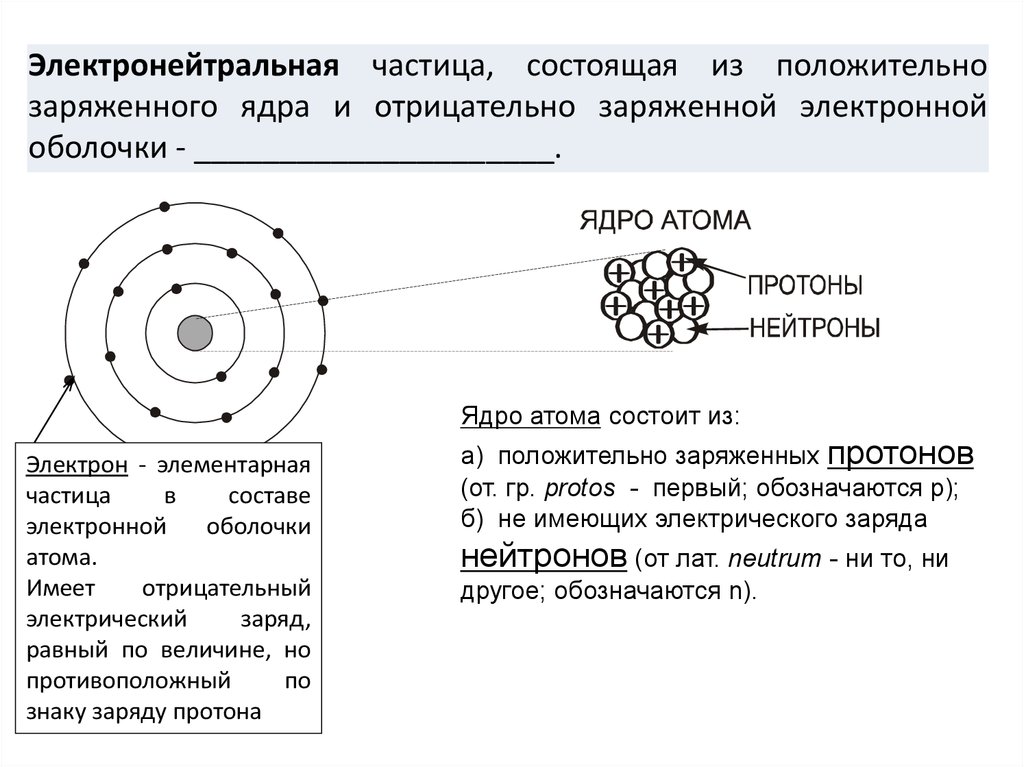
Атомы состоят из еще более мелких субатомных частиц, которые включают в себя три важных типа: протон , нейтрон и электрон . Количество положительно заряженных протонов и незаряженных («нейтральных») нейтронов придает атому массу, а количество каждого из них в ядре атома определяет элемент. Количество отрицательно заряженных электронов, которые «крутятся» вокруг ядра со скоростью, близкой к скорости света, равно количеству протонов. Электрон имеет примерно 1/2000 массы протона или нейтрона.
На рис. 2.1.2 показаны две модели, которые помогут вам представить структуру атома — в данном случае гелия (He). В планетарной модели два электрона гелия вращаются вокруг ядра по фиксированной орбите, изображенной в виде кольца. Хотя эта модель помогает визуализировать структуру атома, в действительности электроны не движутся по фиксированным орбитам, а беспорядочно вращаются вокруг ядра в так называемом электронном облаке.
Хотя эта модель помогает визуализировать структуру атома, в действительности электроны не движутся по фиксированным орбитам, а беспорядочно вращаются вокруг ядра в так называемом электронном облаке.
Протоны и электроны атома несут электрические заряды. Протоны с их положительным зарядом обозначаются p + . Электроны, имеющие отрицательный заряд, обозначаются e – . Нейтроны атома не имеют заряда: они электрически нейтральны. Так же, как магнит прилипает к стальному холодильнику, потому что их противоположные заряды притягиваются, положительно заряженные протоны притягивают отрицательно заряженные электроны. Это взаимное притяжение придает атому некоторую структурную устойчивость. Притяжение положительно заряженного ядра помогает электронам не уходить далеко. Количество протонов и электронов в нейтральном атоме одинаково, поэтому общий заряд атома уравновешен.
Это взаимное притяжение придает атому некоторую структурную устойчивость. Притяжение положительно заряженного ядра помогает электронам не уходить далеко. Количество протонов и электронов в нейтральном атоме одинаково, поэтому общий заряд атома уравновешен.
Атомный и массовый номер
Атом углерода уникален для углерода, но не протон углерода. Один протон ничем не отличается от другого, независимо от того, находится ли он в атоме углерода, натрия (Na) или железа (Fe). То же самое верно для нейтронов и электронов. Итак, что придает элементу его отличительные свойства — что отличает углерод от натрия или железа? Ответ — уникальное количество протонов, содержащихся в каждом из них. Углерод по определению — это элемент, атомы которого содержат шесть протонов. Ни один другой элемент не имеет ровно шесть протонов в своих атомах. Более того, Все атомов углерода, найденные в вашей печени или в куске угля, содержат шесть протонов. Таким образом, атомный номер , который представляет собой число протонов в ядре атома, идентифицирует элемент.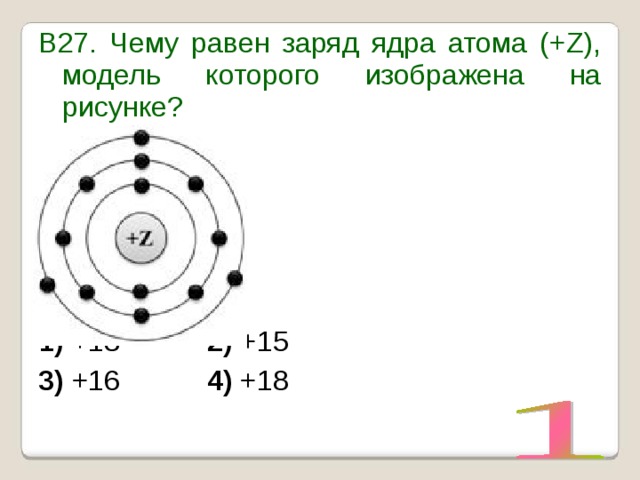 Поскольку атом обычно имеет такое же количество электронов, как и протоны, атомный номер также определяет обычное количество электронов.
Поскольку атом обычно имеет такое же количество электронов, как и протоны, атомный номер также определяет обычное количество электронов.
В своей наиболее распространенной форме многие элементы также содержат такое же количество нейтронов, как и протоны. Наиболее распространенная форма углерода, например, имеет шесть нейтронов, а также шесть протонов, всего 12 субатомных частиц в ядре. Массовое число элемента — это сумма количества протонов и нейтронов в его ядре. Таким образом, наиболее распространенной формой массового числа углерода является 12. Масса электронов настолько мала, что они не вносят заметного вклада в массу атома. Углерод — относительно легкий элемент; Уран (U), напротив, имеет массовое число 238 и относится к тяжелым металлам. Его атомный номер 92 (у него 92 протона), но содержит 146 нейтронов; он имеет наибольшую массу из всех встречающихся в природе элементов.
Периодическая таблица элементов , показанная на рис. 2.1.3, представляет собой диаграмму, идентифицирующую 92 элемента, встречающихся в природе, а также несколько более крупных нестабильных элементов, обнаруженных экспериментально. Элементы расположены в порядке их атомного номера: водород и гелий вверху таблицы, а более массивные элементы внизу. Периодическая таблица является полезным инструментом, поскольку для каждого элемента она определяет химический символ, атомный номер и массовое число, а элементы упорядочиваются в соответствии с их склонностью реагировать с другими элементами. Количество протонов и электронов в элементе равно. Число протонов и нейтронов может быть одинаковым для некоторых элементов, но не одинаковым для всех.
Элементы расположены в порядке их атомного номера: водород и гелий вверху таблицы, а более массивные элементы внизу. Периодическая таблица является полезным инструментом, поскольку для каждого элемента она определяет химический символ, атомный номер и массовое число, а элементы упорядочиваются в соответствии с их склонностью реагировать с другими элементами. Количество протонов и электронов в элементе равно. Число протонов и нейтронов может быть одинаковым для некоторых элементов, но не одинаковым для всех.
Внешний веб-сайт
Посетите этот веб-сайт для просмотра периодической таблицы. В периодической таблице элементов элементы в одном столбце имеют одинаковое количество электронов, которые могут участвовать в химической реакции. Эти электроны известны как «валентные электроны». Например, все элементы в первом столбце имеют один валентный электрон, электрон, который можно «пожертвовать» в химической реакции с другим атомом.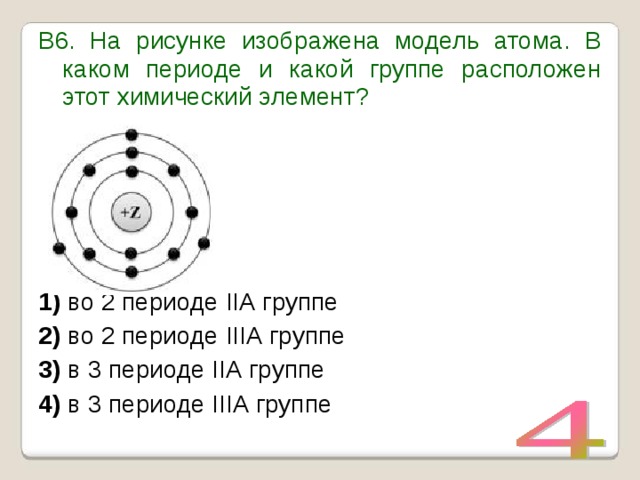 Что означает массовое число, указанное в скобках?
Что означает массовое число, указанное в скобках?
Изотопы
Хотя каждый элемент имеет уникальное количество протонов, он может существовать в виде разных изотопов. Изотоп — одна из различных форм элемента, отличающихся друг от друга разным количеством нейтронов. Стандартным изотопом углерода является 12С, обычно называемый углеродом двенадцать. 12C имеет шесть протонов и шесть нейтронов, что соответствует массовому числу двенадцать. Все изотопы углерода имеют одинаковое количество протонов; следовательно, 13C имеет семь нейтронов, а 14C — восемь нейтронов. Различные изотопы элемента также могут быть обозначены массовым числом через дефис (например, C-12 вместо 12C). Водород имеет три общих изотопа, показанных на рис. 2.1.4.
Рисунок 2.1.4 — Изотопы водорода: Протий, обозначенный 1H, имеет один протон и не содержит нейтронов. Это, безусловно, самый распространенный изотоп водорода в природе. Дейтерий, обозначенный 2H, имеет один протон и один нейтрон.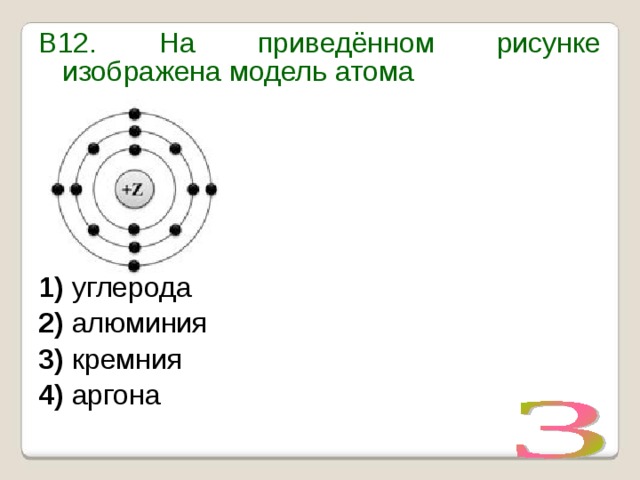 Тритий, обозначенный как 3H, имеет два нейтрона.
Тритий, обозначенный как 3H, имеет два нейтрона. Изотоп, который содержит большее, чем обычно, количество нейтронов, называется тяжелым изотопом. Например, 14С. Тяжелые изотопы, как правило, нестабильны, а нестабильные изотопы радиоактивны. Радиоактивный изотоп — это изотоп, ядро которого легко распадается, испуская субатомные частицы и электромагнитную энергию. Различные радиоактивные изотопы (также называемые радиоизотопами) различаются по периоду полураспада — времени, которое требуется для распада половины образца изотопа любого размера. Например, период полураспада трития — радиоизотопа водорода — составляет около 12 лет, что указывает на то, что для распада половины ядер трития в образце требуется 12 лет. Чрезмерное воздействие радиоактивных изотопов может повредить клетки человека и даже вызвать рак и врожденные дефекты, но когда воздействие контролируется, некоторые радиоактивные изотопы могут быть полезны в медицине. Для получения дополнительной информации см. Карьерные связи.
Карьерные связи.
Контролируемое использование радиоизотопов позволило улучшить медицинскую диагностику и лечение заболеваний. Интервенционные радиологи — это врачи, которые лечат заболевания с помощью минимально инвазивных методов, включающих облучение. Многие состояния, которые когда-то можно было лечить только длительной и травматичной операцией, теперь можно лечить без хирургического вмешательства, что снижает стоимость, боль, продолжительность пребывания в больнице и время восстановления для пациентов. Например, в прошлом единственными вариантами для пациента с одной или несколькими опухолями в печени были хирургическое вмешательство и химиотерапия (введение лекарств для лечения рака).
Однако к некоторым опухолям печени трудно получить доступ хирургическим путем, а в других случаях хирургу может потребоваться удалить слишком много печени; химиотерапия очень токсична для печени, и некоторые опухоли плохо реагируют на нее.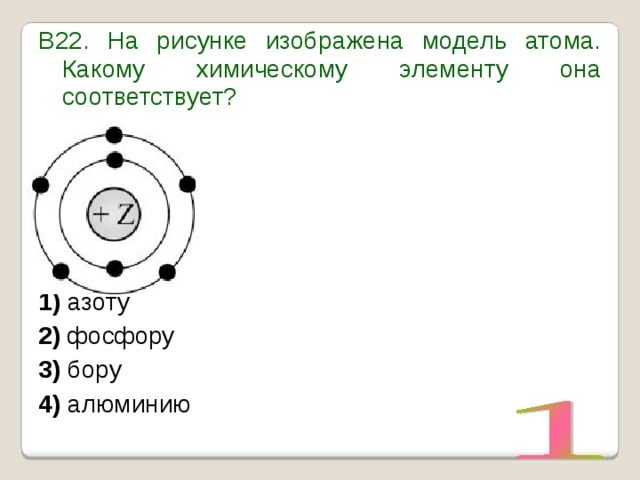 В некоторых таких случаях интервенционный радиолог может лечить опухоли, нарушая их кровоснабжение, которое им необходимо, чтобы они продолжали расти. В этой процедуре, называемой радиоэмболизацией, рентгенолог получает доступ к печени с помощью тонкой иглы, продетой через один из кровеносных сосудов пациента. Затем рентгенолог вводит крошечные радиоактивные «семена» в кровеносные сосуды, питающие опухоли. В течение нескольких дней и недель после процедуры излучение, испускаемое семенами, разрушает сосуды и непосредственно убивает опухолевые клетки в непосредственной близости от лечения.
В некоторых таких случаях интервенционный радиолог может лечить опухоли, нарушая их кровоснабжение, которое им необходимо, чтобы они продолжали расти. В этой процедуре, называемой радиоэмболизацией, рентгенолог получает доступ к печени с помощью тонкой иглы, продетой через один из кровеносных сосудов пациента. Затем рентгенолог вводит крошечные радиоактивные «семена» в кровеносные сосуды, питающие опухоли. В течение нескольких дней и недель после процедуры излучение, испускаемое семенами, разрушает сосуды и непосредственно убивает опухолевые клетки в непосредственной близости от лечения.
Радиоизотопы испускают субатомные частицы, которые можно обнаружить и отследить с помощью технологий визуализации. Одним из наиболее передовых применений радиоизотопов в медицине является позитронно-эмиссионный томограф (ПЭТ), который обнаруживает активность в организме очень маленькой инъекции радиоактивной глюкозы, простого сахара, который клетки используют для получения энергии. Камера ПЭТ показывает медицинской бригаде, какие ткани пациента поглощают больше всего глюкозы. Таким образом, наиболее метаболически активные ткани проявляются на изображениях в виде ярких «горячих точек» (рис. 2.1.5). ПЭТ может выявить некоторые раковые образования, потому что раковые клетки потребляют глюкозу с высокой скоростью, чтобы способствовать их быстрому размножению.
Таким образом, наиболее метаболически активные ткани проявляются на изображениях в виде ярких «горячих точек» (рис. 2.1.5). ПЭТ может выявить некоторые раковые образования, потому что раковые клетки потребляют глюкозу с высокой скоростью, чтобы способствовать их быстрому размножению.
Поведение электронов
В человеческом теле атомы не существуют как независимые сущности. Скорее, они постоянно реагируют с другими атомами, образуя и разрушая более сложные вещества. Чтобы полностью понять анатомию и физиологию, вы должны понять, как атомы участвуют в таких реакциях. Ключ в понимании поведения электронов.
Хотя электроны не следуют жестким орбитам на заданном расстоянии от ядра атома, они имеют тенденцию оставаться в определенных областях пространства, называемых электронными оболочками. Электронная оболочка представляет собой слой электронов, окружающих ядро на определенном энергетическом уровне.
Электронная оболочка представляет собой слой электронов, окружающих ядро на определенном энергетическом уровне.
Атомы элементов, обнаруженных в человеческом теле, имеют от одной до пяти электронных оболочек, и все электронные оболочки содержат восемь электронов, кроме первой оболочки, которая может содержать только два. Эта конфигурация электронных оболочек одинакова для всех атомов. Точное количество оболочек зависит от количества электронов в атоме. Водород и гелий имеют только один и два электрона соответственно. Если вы взглянете на периодическую таблицу элементов, то заметите, что водород и гелий расположены отдельно по обе стороны от верхнего ряда; это единственные элементы, имеющие только одну электронную оболочку (рис. 2.1.6). Вторая оболочка необходима для удержания электронов во всех элементах крупнее водорода и гелия.
Литий (Li), атомный номер которого равен 3, имеет три электрона. Два из них заполняют первую электронную оболочку, а третий переходит на вторую оболочку. На второй электронной оболочке может разместиться до восьми электронов. Углерод со своими шестью электронами полностью заполняет свою первую оболочку и наполовину заполняет вторую. С десятью электронами неон (Ne) полностью заполняет свои две электронные оболочки. Опять же, взгляд на периодическую таблицу показывает, что все элементы во втором ряду, от лития до неона, имеют только две электронные оболочки. Атомам с более чем десятью электронами требуется более двух оболочек. Эти элементы занимают третью и последующие строки таблицы Менделеева.
На второй электронной оболочке может разместиться до восьми электронов. Углерод со своими шестью электронами полностью заполняет свою первую оболочку и наполовину заполняет вторую. С десятью электронами неон (Ne) полностью заполняет свои две электронные оболочки. Опять же, взгляд на периодическую таблицу показывает, что все элементы во втором ряду, от лития до неона, имеют только две электронные оболочки. Атомам с более чем десятью электронами требуется более двух оболочек. Эти элементы занимают третью и последующие строки таблицы Менделеева.
Фактором, наиболее сильно определяющим склонность атома к участию в химических реакциях, является число электронов на его валентной оболочке. А валентная оболочка — это самая внешняя электронная оболочка атома. Если валентная оболочка заполнена, атом стабилен, а это означает, что его электроны вряд ли будут отрываться от ядра электрическим зарядом других атомов. Если валентная оболочка не заполнена, атом реактивен, а это означает, что он будет реагировать с другими атомами таким образом, что валентная оболочка будет заполнена. Рассмотрим водород, у которого один электрон лишь наполовину заполняет его валентную оболочку. Этот единственный электрон, вероятно, будет втянут в отношения с атомами других элементов, так что можно будет стабилизировать одновалентную оболочку водорода.
Все атомы (кроме водорода и гелия с их одноэлектронными оболочками) наиболее стабильны, когда в их валентной оболочке ровно восемь электронов. Этот принцип называется правилом октета и гласит, что атом будет отдавать, приобретать или делиться электронами с другим атомом, так что в итоге он окажется с восемью электронами в своей собственной валентной оболочке. Например, кислород с шестью электронами на валентной оболочке, скорее всего, будет реагировать с другими атомами таким образом, что к валентной оболочке кислорода присоединятся два электрона, в результате чего их число достигнет восьми. Когда два атома водорода делят свой единственный электрон с кислородом, образуются ковалентные связи, в результате чего образуется молекула воды H 2 О.
Например, кислород с шестью электронами на валентной оболочке, скорее всего, будет реагировать с другими атомами таким образом, что к валентной оболочке кислорода присоединятся два электрона, в результате чего их число достигнет восьми. Когда два атома водорода делят свой единственный электрон с кислородом, образуются ковалентные связи, в результате чего образуется молекула воды H 2 О.
В природе атомы одного элемента имеют тенденцию соединяться с атомами других элементов характерным образом. Например, углерод обычно заполняет свою валентную оболочку, соединяясь с четырьмя атомами водорода. При этом два элемента образуют простейшую из органических молекул — метан, который также является одним из самых распространенных и стабильных углеродсодержащих соединений на Земле. Как указано выше, другим примером является вода; кислороду нужно два электрона, чтобы заполнить его валентную оболочку. Он обычно взаимодействует с двумя атомами водорода, образуя H 2 O.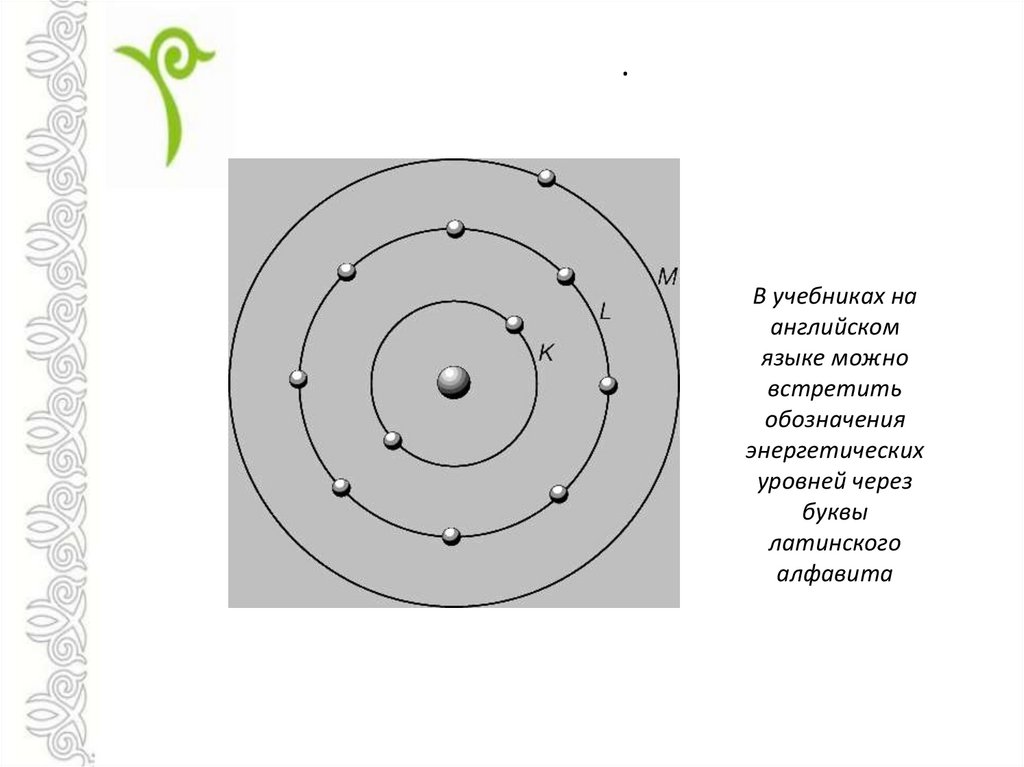 Кстати, название «водород» отражает его вклад в воду (hydro- = «вода»; -gen = «создатель»). Таким образом, водород является «производителем воды».
Кстати, название «водород» отражает его вклад в воду (hydro- = «вода»; -gen = «создатель»). Таким образом, водород является «производителем воды».
Человеческое тело состоит из элементов, наиболее распространенными из которых являются кислород (O), углерод (C), водород (H) и азот (N). Вы получаете эти элементы из пищи, которую едите, и воздуха, которым дышите. Наименьшая единица элемента, сохраняющая все свойства этого элемента, — это атом. Сами атомы содержат множество субатомных частиц, три наиболее важные из которых — протоны, нейтроны и электроны. Эти частицы не различаются по качеству от одного элемента к другому; скорее то, что придает элементу его отличительную идентификацию, — это количество его протонов, называемое его атомным номером. Протоны и нейтроны составляют почти всю массу атома; количество протонов и нейтронов является массовым числом элемента. В природе могут встречаться более тяжелые и более легкие версии одного и того же элемента, потому что эти версии имеют разное количество нейтронов. Различные версии элемента называются изотопами.
Различные версии элемента называются изотопами.
Склонность атома быть стабильным или легко реагировать с другими атомами во многом обусловлена поведением электронов внутри самой внешней электронной оболочки атома, называемой его валентной оболочкой. Гелий, как и более крупные атомы с восемью электронами в валентной оболочке, вряд ли будут участвовать в химических реакциях, поскольку они стабильны. Все остальные атомы склонны принимать, отдавать или делиться электронами в процессе, который доводит количество электронов в их валентной оболочке до восьми (или, в случае водорода, до двух).
Критические вопросыНаиболее распространенными элементами в продуктах и напитках, которые вы потребляете, являются кислород, углерод, водород и азот. Почему наличие этих элементов в расходных материалах может быть полезным?
Эти четыре элемента — кислород, углерод, водород и азот — вместе составляют более 95 процентов массы человеческого тела, а тело не может производить элементы, поэтому полезно иметь их в составе расходных материалов.
Кислород с атомным номером восемь имеет три стабильных изотопа: 16O, 17O и 18O. Объясните, что это означает с точки зрения числа протонов и нейтронов.
Кислород имеет восемь протонов. В своей наиболее распространенной стабильной форме он также имеет восемь нейтронов при массовом числе 16. Напротив, 17O имеет девять нейтронов, а 18O — 10 нейтронов.
Магний является важным элементом в организме человека, особенно в костях. Атомный номер магния — 12. Он стабилен или реактивен? Почему? Если бы он вступил в реакцию с другим атомом, с большей вероятностью он принял бы или отдал бы один или несколько электронов?
12 электронов магния распределены следующим образом: два на первой оболочке, восемь на второй оболочке и два на его валентной оболочке. Согласно правилу октета, магний нестабилен (реакционноспособен), потому что его валентная оболочка имеет всего два электрона. Поэтому он, вероятно, участвует в химических реакциях, в которых отдает два электрона.
Глоссарий
- атом
- наименьшая единица элемента, сохраняющая уникальные свойства этого элемента
- атомный номер
- число протонов в ядре атома
- компаунд
- вещество, состоящее из двух или более различных элементов, соединенных химическими связями
- электрон
- субатомных частиц, имеющих отрицательный заряд и почти не имеющих массы; найдено на орбите ядра атома
- электронная оболочка
- область пространства на заданном расстоянии от ядра атома, в которой сгруппированы электроны
- элемент
- вещество, которое нельзя создать или разрушить обычными химическими средствами
- изотоп
- одна из разновидностей элемента, в которой число нейтронов отличается друг от друга
- массовый номер
- сумма числа протонов и нейтронов в ядре атома
- материя
- физическое вещество; то, что занимает пространство и имеет массу
- нейтрон
- тяжелая субатомная частица, не имеющая электрического заряда и обнаруженная в ядре атома
- периодическая таблица элементов
- расположение элементов в таблице по их порядковому номеру; элементы, имеющие сходные свойства из-за их расположения электронов, составляют столбцы в таблице, в то время как элементы, имеющие одинаковое количество валентных оболочек, составляют строки в таблице .




Leave A Comment