Контрольная работа. 8 класс. Тепловые явления
Контрольные работы, задания, педагогические программы Постоянная ссылка | Все категории
Контрольная работа.
8 класс.
Первое полугодие.
Тепловые явления.
Вариант №1.
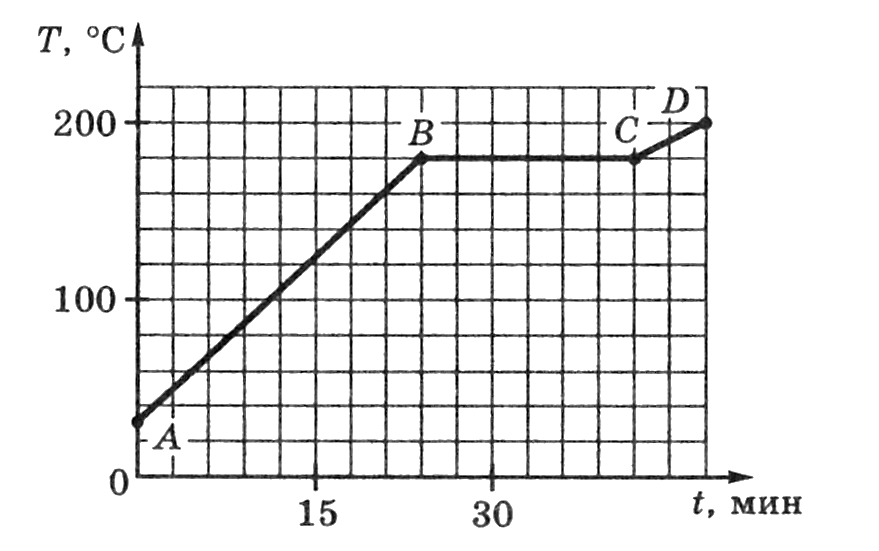
На рисунке изображен график изменения температуры олова.
-300 t (мин)
а) Как изменяется температура олова на участках АВ, ВС, и СD?
б) Какому состоянию олова соответствует отрезок графика ВС?
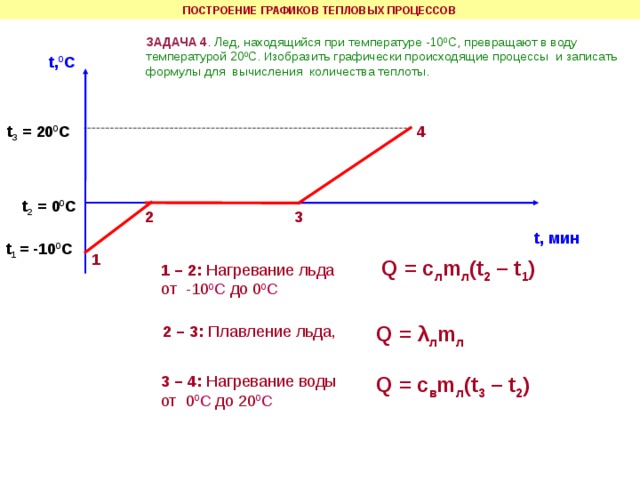
Медное жало паяльника массой 59 г остывает от 432 0С до 232 0С. 40% теплоты, выделяющийся при этом, полезно используется на плавление олова. Определите, какую массу олова, взятого при температуре плавления, можно расплавить за счет этой теплоты. Почему паровые турбины имеют больший КПД, чем паровые поршневые машины той же мощности? В кусок льда массой 100 г и температурой -10 0С влили 1,5 кг расплавленного свинца при температуре плавления. Сколько воды обратилось в пар, если свинец остыл до температуры 27 0С? Потерями энергии пренебречь.
Вариант №2.
На рисунке изображен график плавления льда и нагревания воды.
а) Какая температура была в конце наблюдения?
б) Через какое время после начала наблюдения вода закипела?
Железная гиря массой 5 кг остывает от 1127 0С до 327 0С. Сколько свинца, взятого при температуре 27 0С, можно расплавить за счет теплоты, выделившийся при остывании железной гири? Станет ли КПД тепловых машин равным 100%, если трение в частях машины свести к нулю? На электроплитке нагревали 1,2 л воды от 10 0С до 100 0С. При этом 3% ее обратились в пар. Сколько времени длилось нагревание, если мощность плитки 800 Вт, а ее КПД 65 %?
Примечание. Задача №4 может быть предложена учащимся в соответствии с уровнем их подготовки на усмотрение учителя.
Анализ.
Учащиеся умеют читать график нагревания, плавления и кипения. Учащиеся умеют пользоваться системой СИ. Учащиеся знают закон сохранения энергии в тепловых процессах. Учащиеся умеют пользоваться таблицами. Учащиеся знают формулу нагревания, охлаждения.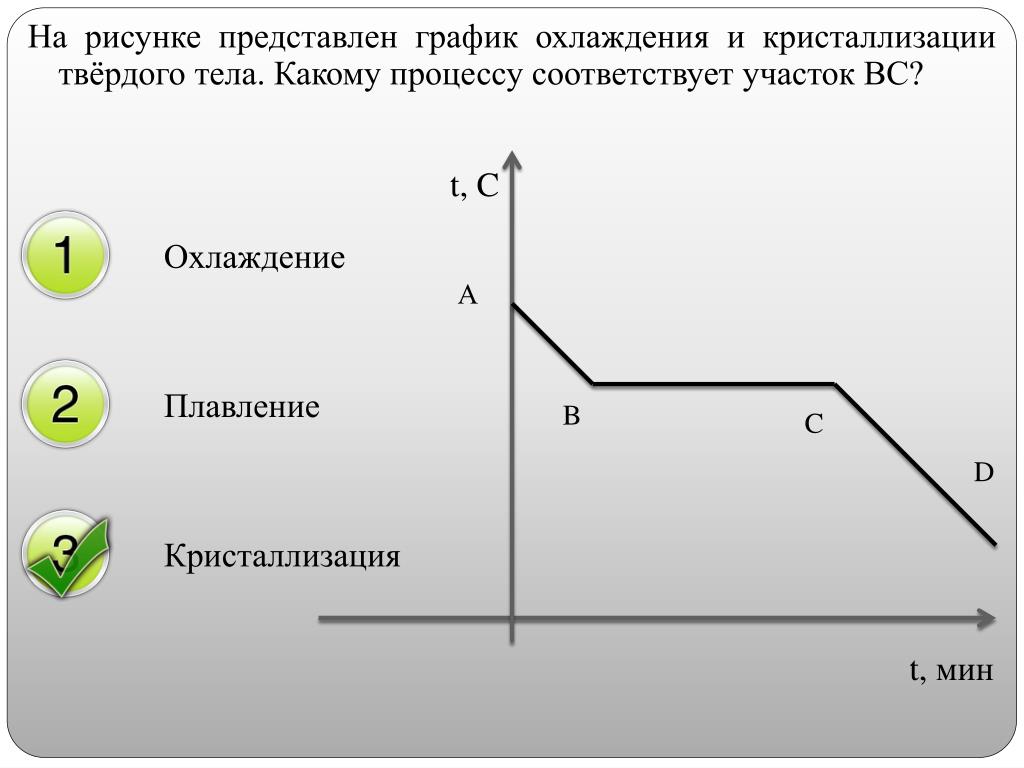 Учащиеся знают формулы плавления, отвердевания. учащиеся знают формулы кипения, конденсации. Учащиеся знают понятие КПД. Учащиеся знают понятие мощности. Учащиеся умеют производить действия с размерностью.
Учащиеся знают формулы плавления, отвердевания. учащиеся знают формулы кипения, конденсации. Учащиеся знают понятие КПД. Учащиеся знают понятие мощности. Учащиеся умеют производить действия с размерностью.
Просьба к учителям представлять анализ по схеме:
Школа | Оценка за работу (%) | % успеваемости | % качества | Анализ характерных ошибок (%) | ||||||||||||
Класс | «5» | «4» | «3» | «2» | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
Твитнуть Правообладателям | Сообщить о нарушении |
Архивы pandia. | |
| Алфавит: А • Б • В • Г • Д • Е • З • И • К • Л • М • Н • О • П • Р • С • Т • У • Ф • Ц • Ч • Ш • Э Я | |
|
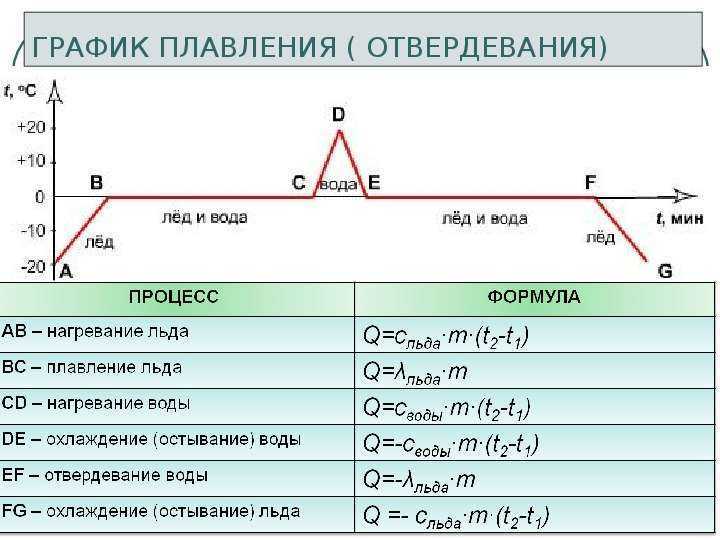
График плавления и отвердевания кристаллических тел | 8 класс
Содержание
Если вещество в твердом состоянии будет получать энергию — оно будет нагреваться.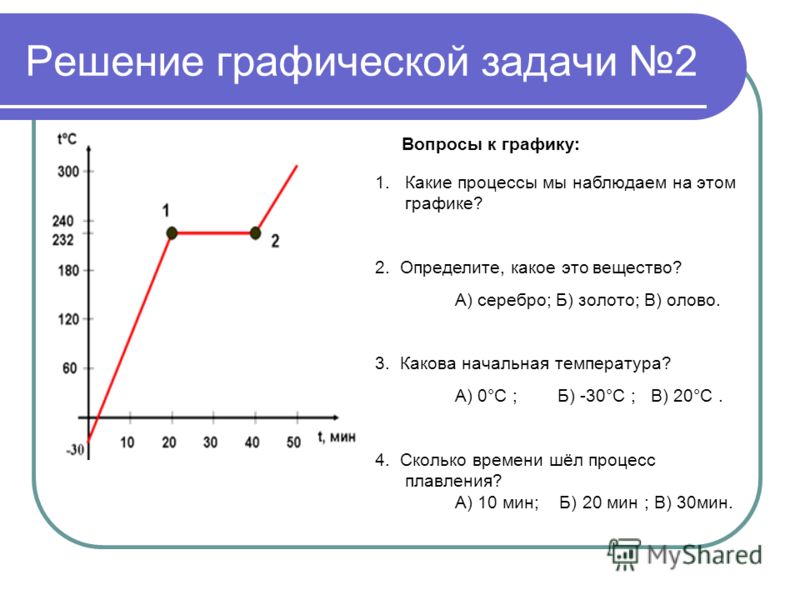 При этом с определенной температуры начинает происходить процесс плавления — тело переходит из твердого состояния в жидкое.
При этом с определенной температуры начинает происходить процесс плавления — тело переходит из твердого состояния в жидкое.
Если же жидкость будет отдавать энергию, то с определенной температуры начнется процесс отвердевания (кристаллизации). Жидкость перейдет в твердое состояние.
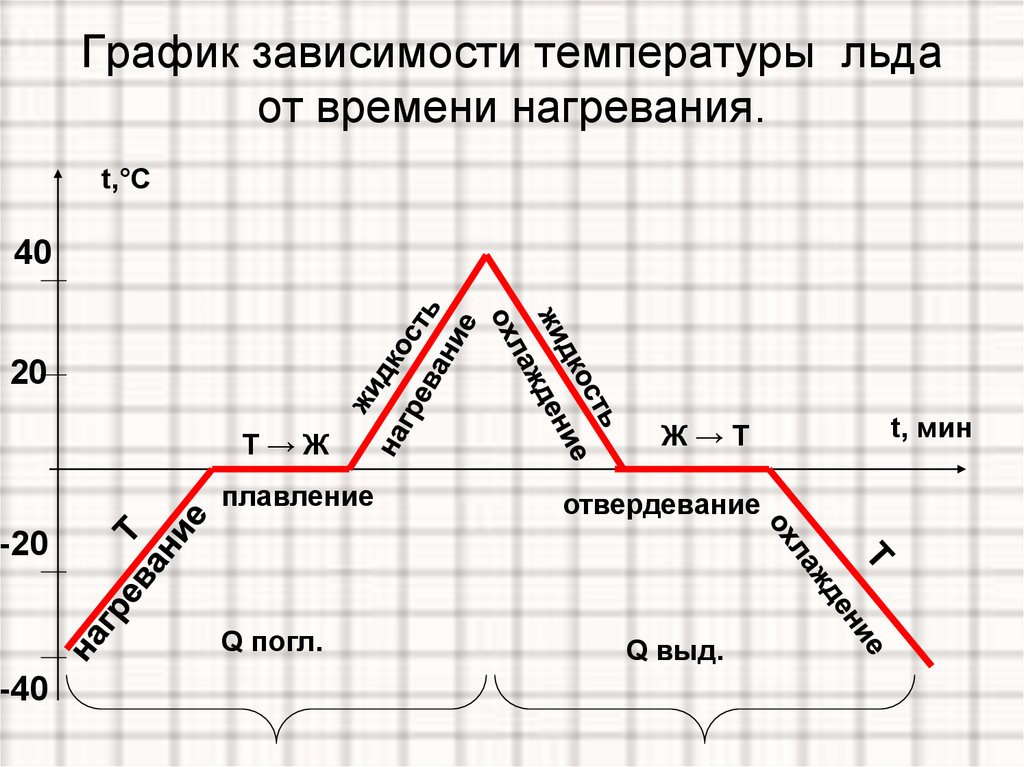
Процесс плавления кристаллического тела довольно сложный. Для того чтобы более детально его изучить, мы рассмотрим график зависимости температуры твердого тела от времени его последовательного нагревания и охлаждения.
График плавления льда и отвердевания воды
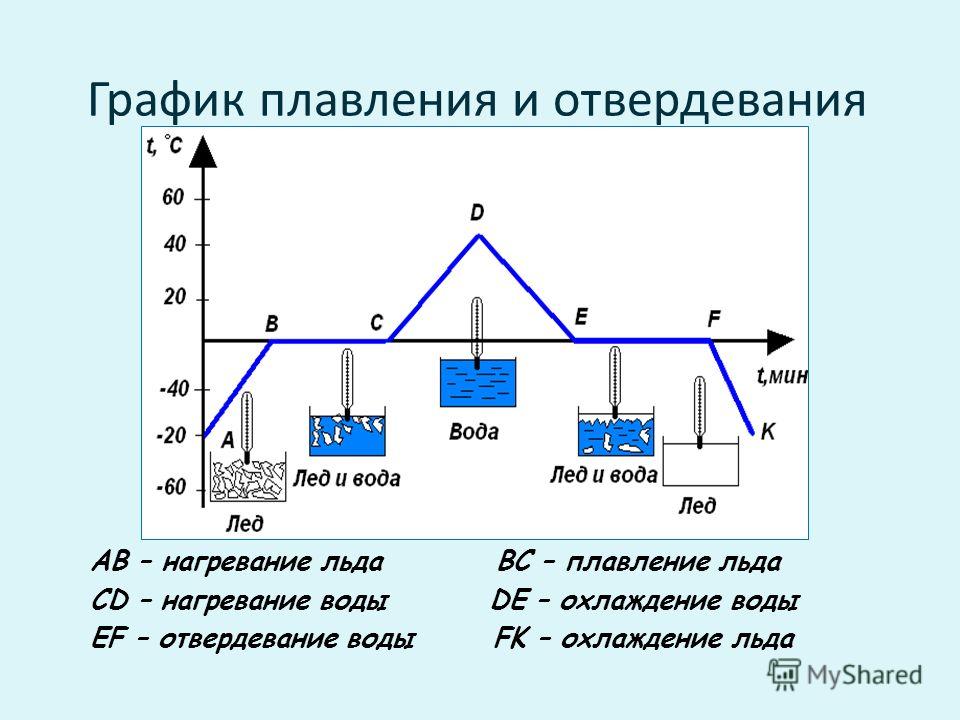
В качестве кристаллического тела будем рассматривать лёд. График плавления льда и отвердевания воды изображен на рисунке 1. Здесь по горизонтальной оси отложено время, а по вертикальной — температура льда. Для нагревания льда будем использовать обычную горелку.
Рисунок 1. График зависимости температуры льда от времени нагреванияРазберем каждый участок графика.
- Точка A
Это наша начальная точка, начало наблюдения за процессом. Здесь температура льда была равна $-40 \degree C$
Здесь температура льда была равна $-40 \degree C$
- Участок AB
Идет нагревание льда, его температура увеличивается с $-40 \degree C$ до $0 \degree C$
- Точка B
Достигнув температуры $0 \degree C$, лед начинает плавится. Это его температура плавления.
- Участок BC
Лед плавится, но его температура в это время не увеличивается. Процессу плавления соответствует именно этот участок графика.
Отметим, что
В течение всего времени плавления температура льда не меняется, хотя мы продолжаем его нагревать
- Точка C
В этот момент весь лед расплавился и превратился в воду
- Участок CD
На это участке графика идет нагревание воды до $+40 \degree C$
- Точка D
Вода имеет температуру $+40 \degree C$. В этот момент мы выключаем горелку
- Участок DE
Температура воды снижается, она охлаждается
- Точка E
Температуры воды достигает $0 \degree C$. Начинается ее отвердевание (кристаллизация)
Начинается ее отвердевание (кристаллизация)
- Участок EF
На этом участке графика идет процесс отвердевания (кристаллизации) воды.
Пока вся вода не затвердеет, ее температура не изменится
- Точка F
В этот момент вся вода превратится в лёд
- Участок FK
Температура льда понижается
{"questions":[{"content":"Участки графика BC и EF параллельны оси времени, потому что[[choice-1]]","widgets":{"choice-1":{"type":"choice","options":["они соответствуют плавлению и отвердеванию","во время процессов плавления и отвердевания температура не изменяется","они соответсвуют нагреванию и охлаждению","во время нагревания и охлаждения температура какое-то время не изменяется"],"answer":[0,1]}}}]}Графики плавления олова и свинца
На графиках часто указывают какой-то один процесс (либо отвердевание, либо плавление), но для нескольких веществ. Это делается для наглядного сравнениях их свойств.
Это делается для наглядного сравнениях их свойств.
Подобный график представлен на рисунке 2.
Рисунок 2. Графики для процесса плавлении олова и свинцаПроцесс плавления олова соответствует участку CD, а процесс плавления свинца — участку AB.
Участок AB находится выше участка CD. Это означает, что свинец имеет большую температуру плавления, чем олово. На графике отмечены эти температуры. Для свинца это $327 \degree C$, а для олова $232 \degree C$.
Также мы можем судить о времени процесса плавления. Участок AB имеет большую длину, чем участок CD. Значит, свинец плавился большее время, чем олово. При этом, свинец начал плавиться раньше.
{"questions":[{"content":"Сколько времени с начала эксперимента мы можем наблюдать свинец в твердом состоянии? [[input-1]] минуты.","widgets":{"input-1":{"type":"input","inline":1,"answer":"4"}}}]}5
Оценить урок
Поделиться уроком →
Что можно улучшить?
Изложение материала
Непонятное объяснение
Урок неполный, не хватает информации
Урок перегружен, слишком много информации
Тесты плохого качества
Тестов недостаточно
Тестов слишком много
Тесты слишком легкие
Тесты слишком сложные
Изображения
Изображения плохого качества
Изображений недостаточно
Изображений слишком много
Другое
Войдите, чтобы оценивать уроки
Что нужно исправить?
Спасибо, что помогаете нам стать лучше!
Проверим знания по теме?
Плавление и отвердевание
Евгения Семешева
Медицинский физик, преподаватель физики средней и старшей школы.
Кривая нагрева воды: значение и уравнение
Вода не зря называется средой нашей жизни. Без воды мы просто не сможем поддерживать жизнь. Именно вода способствует клеточным процессам, жизненно важным химическим реакциям и в основном функционированию всей нашей планеты. Вот почему изучение изменений энергии из-за нагревания или охлаждения воды важно для нас.
Итак, без лишних слов, давайте поговорим о кривой нагрева для воды !
Сначала рассмотрим кривую нагрева воды.
Далее мы рассмотрим значение кривой нагрева и базовый график кривой нагрева воды.
После этого мы рассмотрим кривую нагрева для уравнения воды.
Наконец, мы научимся рассчитывать изменения энергии для кривой нагрева воды.
Кривая нагрева воды Значение
Для начала рассмотрим значение кривой нагрева воды.
Кривая нагрева для воды используется, чтобы показать, как изменяется температура определенного количества воды при постоянном подводе тепла.
Кривая нагрева воды важна, поскольку она показывает взаимосвязь между количеством введенного тепла и изменением температуры вещества.
В данном случае это вода.
Для нас жизненно важно понимать фазовые переходы воды, которые можно удобно изобразить в виде диаграммы, поскольку они отображают характеристики, характерные для воды.
Например, полезно знать, при какой температуре тает лед или при какой температуре закипает вода, если вы хотите ежедневно готовить.
Рисунок 1: Чтобы вскипятить чашку чая, нам нужна кривая нагрева воды. Даниэла Лин, Изучайте умнее оригиналы.
Даже для того, чтобы заварить чашку чая, как показано выше, нужно кипятить воду. Для этого процесса важно знать температуру, при которой закипает вода. Здесь полезно графическое представление кривой нагрева воды.
Здесь полезно графическое представление кривой нагрева воды.
Построение графика нагрева воды
Чтобы построить график нагрева воды, нам сначала нужно рассмотреть определение кривой нагрева воды, которое мы упоминали ранее.
Это означает, что мы хотим, чтобы наш график отражал изменения температуры воды при добавлении определенного количества тепла.
Рис. 2: Показана кривая нагрева воды. Даниэла Лин, Изучайте умнее оригиналы.
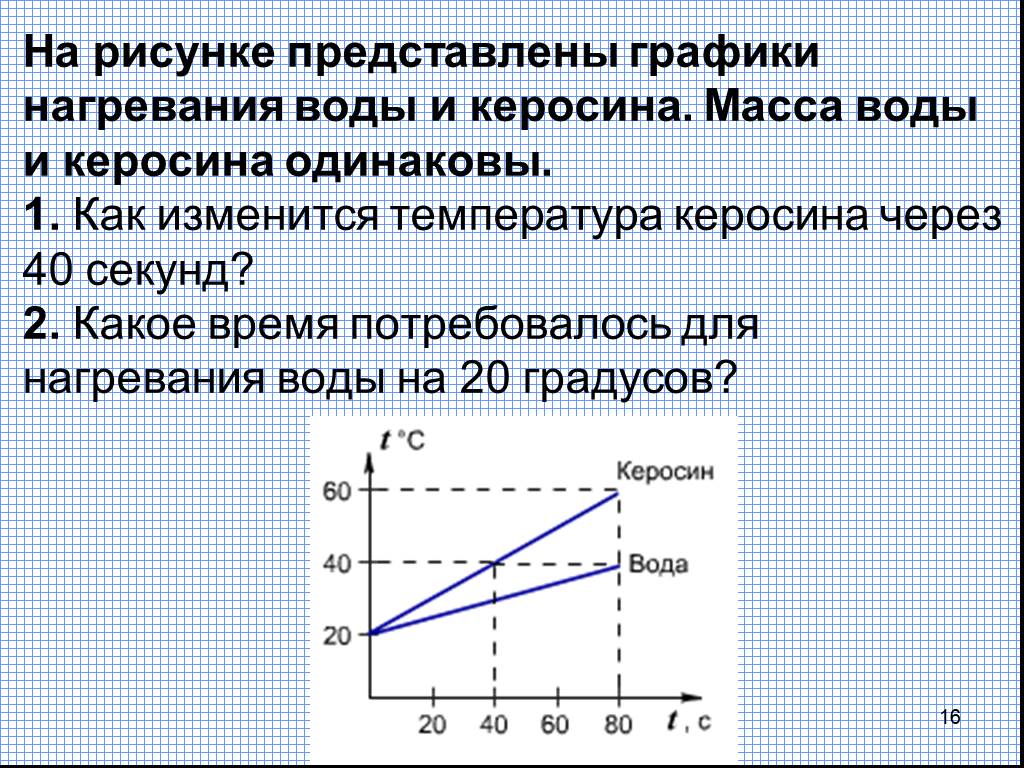
Наша ось X измеряет количество добавленного тепла. Между тем, наша ось Y имеет дело с изменениями температуры воды в результате того, что мы добавляем определенное количество тепла.
Поняв, как мы строим графики осей X и Y, нам также нужно узнать об изменениях фаз.
На рисунке ниже наша вода превращается в лед при температуре около -30 градусов по Цельсию (°C). Начнем с добавления тепла с постоянной скоростью. Как только наша температура достигает 0 ° C, наш лед вступает в процесс таяния. Во время фазовых переходов температура воды остается постоянной. Это обозначено горизонтальной пунктирной линией, показанной на нашем графике. Это происходит потому, что когда мы добавляем тепло в систему, это не меняет температуру смеси льда и воды. Обратите внимание, что теплота и температура — не одно и то же с научной точки зрения.
Во время фазовых переходов температура воды остается постоянной. Это обозначено горизонтальной пунктирной линией, показанной на нашем графике. Это происходит потому, что когда мы добавляем тепло в систему, это не меняет температуру смеси льда и воды. Обратите внимание, что теплота и температура — не одно и то же с научной точки зрения.
То же самое происходит позже, когда наша теперь уже жидкая вода начинает кипеть при температуре 100 °C. По мере того, как мы добавляем больше тепла в систему, мы получаем смесь воды и пара. Другими словами, температура остается на уровне 100 °C до тех пор, пока добавленное тепло не преодолеет силы притяжения водородных связей в системе и вся жидкая вода не превратится в пар. После этого продолжающийся нагрев нашего водяного пара приводит к повышению температуры.
Для лучшего понимания давайте еще раз пройдемся по графическому представлению кривой нагрева воды, но на этот раз с цифрами, детализирующими изменения.
Рис. 3: Графическое представление кривой нагрева воды с маркировкой фаз. Даниэла Лин, Изучайте умнее оригиналы.
3: Графическое представление кривой нагрева воды с маркировкой фаз. Даниэла Лин, Изучайте умнее оригиналы.
Из рисунка 3 видно, что:
1) Мы начинаем при -30 °C с твердым льдом и стандартным давлением (1 атм).
1-2) Далее, начиная с шагов 1-2, когда твердый лед нагревается, молекулы воды начинают вибрировать, поглощая кинетическую энергию.
2-3)Затем из шагов 2-3 происходит фазовый переход, когда лед начинает таять при 0 °C. Температура остается неизменной, так как постоянное добавление тепла помогает преодолеть силы притяжения между твердыми молекулами воды.
3) В точке 3 лед успешно растворился в воде.
3-4) Это означает, что начиная с шагов 3-4, поскольку мы продолжаем постоянно добавлять тепло, жидкая вода начинает нагреваться.
4-5) Затем шаги 4-5 включают еще одно фазовое изменение, когда жидкая вода начинает испаряться.
5) Наконец, когда силы притяжения между молекулами жидкой воды преодолеваются, вода становится паром или газом при 100 °C. Постоянное нагревание нашего пара является причиной того, что температура продолжает подниматься выше 100 °C.
Постоянное нагревание нашего пара является причиной того, что температура продолжает подниматься выше 100 °C.
Для получения дополнительной информации о силе притяжения обратитесь к нашей статье «Межмолекулярные силы» или «Типы межмолекулярных сил».
Примеры кривой нагрева воды
Теперь мы понимаем, как построить график кривой нагрева воды. Далее мы должны заняться реальными примерами того, как использовать кривую нагрева воды.
Кривая нагрева воды. Уравнение и эксперимент
Частью понимания того, как использовать кривую нагрева воды, является понимание соответствующих уравнений.
Наклон линии на нашей кривой нагревания зависит от массы и удельной теплоемкости вещества, с которым мы имеем дело.
Например, если мы имеем дело с твердым льдом, то нам нужно знать массу и удельную теплоемкость льда.
Удельная теплоемкость вещества (C) – это количество джоулей, необходимое для повышения температуры 1 г вещества на 1 градус Цельсия.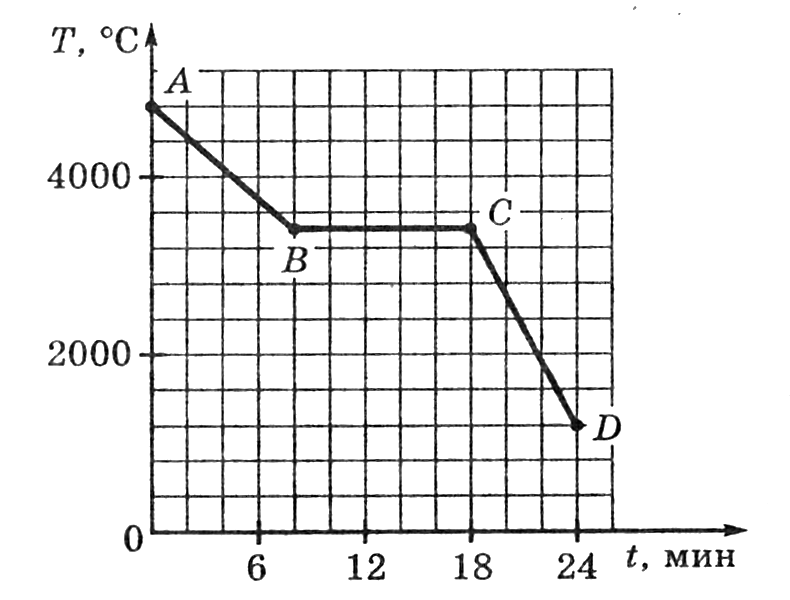
Рис. 4: Графическое представление кривой нагрева воды с несколькими формулами нагрева, помеченными для ясности. Объяснение каждого изменения приведено ниже. Даниэла Лин, Изучайте умнее оригиналы.
Изменения температуры происходят, когда наклон не является постоянной линией. Это означает, что они происходят из шагов 1-2, 3-4 и 5-6.
Уравнения, которые мы используем для расчета этих конкретных шагов:
Уравнение тепловой кривой воды
$$Q= m \times C \times \Delta T $$
где,
m= масса конкретного вещества в граммах (г)
C= удельная теплоемкость вещества (Дж/(г °C))
Удельная теплоемкость, С, также различна в зависимости от того, лед ли это, С с = 2,06 Дж/(г °С), или жидкая вода, С л = 4,184 Дж/(г °С), или пар, C v = 2,01 Дж/(г °C).
\(\Delta T \) = изменение температуры (в градусах Кельвина или Цельсия)
Это уравнение относится к участкам графика изменения температуры в зависимости от энергии. Поскольку на этих стадиях происходят изменения температуры, наше уравнение для нахождения теплообмена воды в этих конкретных точках включает массу, удельную теплоемкость и изменение температуры вещества, с которым мы имеем дело.
Поскольку на этих стадиях происходят изменения температуры, наше уравнение для нахождения теплообмена воды в этих конкретных точках включает массу, удельную теплоемкость и изменение температуры вещества, с которым мы имеем дело.
Обратите внимание, что Q означает количество тепла, переданного объекту и от него.
Напротив, фазовые изменения происходят, когда наклон равен нулю. Это означает, что они происходят из шагов 2-3 и 4-5. При этих фазовых изменениях нет изменения температуры, наше уравнение включает только массу вещества и удельную теплоту изменения.
Для шагов 2-3, поскольку температура не меняется, мы добавляем тепло, чтобы помочь преодолеть водородные связи внутри льда и превратить его в жидкую воду. Тогда наше уравнение имеет дело только с массой нашего конкретного вещества, которое на данном этапе расчета является льдом, и теплотой плавления или изменением энтальпии (H) плавления.
Это связано с тем, что теплота плавления связана с изменением тепла из-за энергии, выделяемой в виде постоянного тепла для сжижения льда.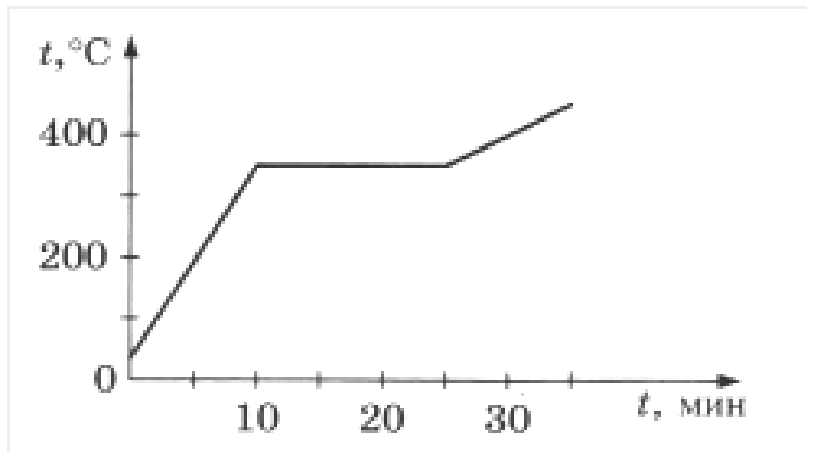
Между тем, шаги 4-5 аналогичны шагам 2-3, за исключением того, что мы имеем дело с изменением теплоты из-за испарения воды в пар или энтальпии испарения.
Уравнение тепловой кривой воды
$$Q = n \times \Delta H$$
где,
лед, ΔH f , или теплота парообразования для жидкой воды, ΔH v , в зависимости от того, какой фазовый переход мы рассчитываем.
Расчет изменений энергии для кривой нагрева воды
Теперь, когда мы рассмотрели уравнения, относящиеся ко всем изменениям кривой нагрева воды. Мы рассчитаем изменения энергии для кривой нагрева воды, используя уравнения, которые мы узнали выше.
Используя приведенную ниже информацию. Рассчитайте изменения энергии для всех шагов, показанных на кривой нагрева для воды до 150 °C.
Учитывая массу (m) 90 г льда и удельную теплоемкость для льда или C s = 2,06 Дж/(г °C), жидкой воды или C l = 4,184 Дж/(г °C) , и пара или C v = 2,01 Дж/(г °C).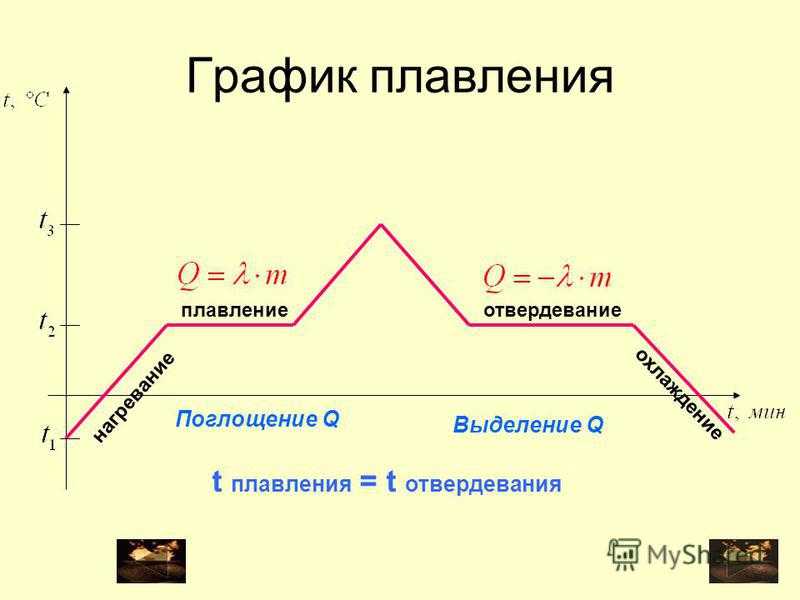 Найдите все количество теплоты (Q), необходимое для превращения 10 г льда при температуре -30 °С в пар при температуре 150 °С. Также потребуются значения энтальпии плавления, ΔH f = 6,02 кДж/моль, и энтальпии парообразования, ΔH v = 40,6 кДж/моль.
Найдите все количество теплоты (Q), необходимое для превращения 10 г льда при температуре -30 °С в пар при температуре 150 °С. Также потребуются значения энтальпии плавления, ΔH f = 6,02 кДж/моль, и энтальпии парообразования, ΔH v = 40,6 кДж/моль.
Решение:
Рис. 5: Графическое представление кривой нагрева воды с маркировкой, например. Даниэла Лин, Изучайте умнее оригиналы.
1-2) Нагревание льда: это изменение температуры, так как склон не является ровной горизонтальной линией.
\(Q_1 = m \times C_s \times \Delta T \)
\(Q_1\) = (90 г льда) x (2,06 Дж/(г °C)) x (0 °C-(- 30°C ))
\(Q_1\) = 5,562 Дж или 5,562 кДж
2-3) Тающий лед (точка таяния льда): Это фазовое изменение, так как наклон в этой точке равен нулю.
\( Q_2 = n \times \Delta H_f \)
Нам нужно перевести граммы в моли, учитывая, что 1 моль воды = 18,015 г воды.
\(Q_2\) = (90 г льда) x \( \frac {1 моль} {18,015 г} \) x 6,02 кДж/моль
\(Q_2\) = 30,07 кДж
3-4) Жидкая вода нагревается: это изменение температуры, поскольку наклон не является плоской горизонтальной линией.
\(Q_3 = m \times C_l \times \Delta T \)
\(Q_1\) = (90 г льда) x (4,184 Дж/(г °C)) x (100 °C-0° C )
\(Q_1\) = 37 656 Дж или 37,656 кДж
4-5) Испарение воды (точка кипения воды): Это фазовое изменение, поскольку наклон равен нулю.
\( Q_4 = n \times \Delta H_v \)
Нам нужно перевести граммы в моли, учитывая, что 1 моль воды = 18,015 г воды.
\(Q_2\) = (90 г льда) x \( \frac {1 моль} {18,015 г} \) x 40,6 кДж/моль = 202,83 кДж
5-6) Нагреваемый пар: это температура измениться, так как наклон не является плоской горизонтальной линией.
\(Q_5 = m \times C_v \times \Delta T \)
\(Q_1\) = (90 г льда) x ( 2,01 Дж/(г °C)) x (150 °C-100° В)
\(Q_1\) = 9045 Дж или 90,045 кДж
Таким образом, общее количество тепла равно сумме всех значений Q
Q total = \(Q_1 + Q_2 + Q_3 + Q_4 + Q_5\)
Q total = 5,562 кДж + 30,07 кДж + 37,656 кДж + 202,83 кДж + 9,045 кДж
Q total = 285,163 кДж
Количество теплоты (Q), необходимое для превращения 10 г льда при -30 °C в пар при 150 °C, составляет 285,163 кДж .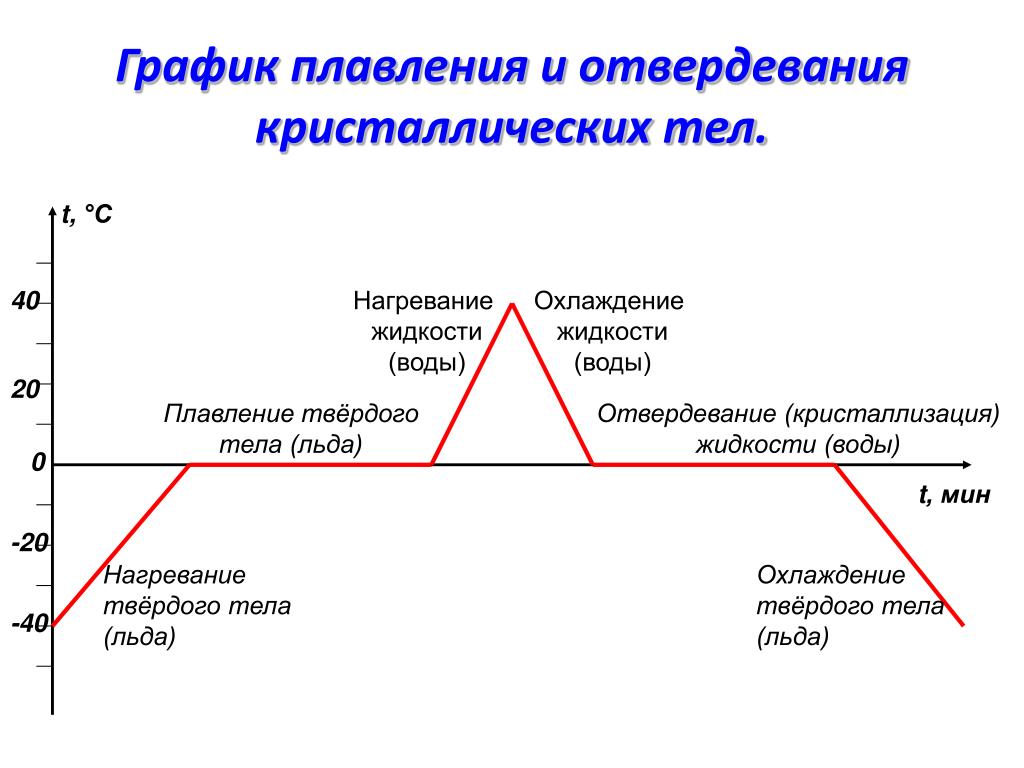
Вы дошли до конца этой статьи. К настоящему времени вы должны понимать, как построить кривую нагрева воды, почему важно знать кривую нагрева воды и как рассчитать связанные с ней изменения энергии.
Для большей практики используйте карточки, связанные с этой статьей!
Кривая нагрева воды – основные выводы
Кривая нагрева воды используется для отображения того, как температура определенного количества воды изменяется при постоянном добавлении тепла.
Кривая нагрева воды важна, поскольку она показывает взаимосвязь между количеством введенного тепла и изменением температуры вещества.
Нам жизненно важно понимать фазовые изменения воды, которые можно удобно изобразить в виде графика.
Наклон линии на нашей кривой нагревания зависит от массы, удельной теплоемкости и фазы вещества, с которым мы имеем дело.

Ссылки
- Либретексты. (2020, 25 августа). 11.7: Кривая нагрева воды. Химия LibreTexts.
- Учебное пособие по физике. Кабинет физики. (н.д.).
- Либретексты. (2021, 28 февраля). 8.1: Кривые нагрева и фазовые переходы. Химия LibreTexts.
Фазовый переход и скрытая теплота
Цели обучения
К концу этого раздела вы сможете:
- Изучить теплопередачу.
- Рассчитать конечную температуру по теплопередаче.
До сих пор мы обсуждали изменение температуры в результате теплопередачи. Никакого изменения температуры в результате теплопередачи не происходит, если лед тает и становится жидкой водой (т. е. во время фазового перехода). Например, рассмотрим воду, капающую с тающих сосулек на нагретую солнцем крышу. И наоборот, вода замерзает в лотке для льда, охлаждаемом более низкой температурой окружающей среды.
Рис. 1. Тепло от воздуха передается льду, вызывая его таяние.
Для плавления твердого тела требуется энергия, потому что когезионные связи между молекулами в твердом теле должны быть разрушены, так что в жидкости молекулы могут двигаться с сопоставимой кинетической энергией; таким образом, нет повышения температуры. Точно так же энергия необходима для испарения жидкости, потому что молекулы в жидкости взаимодействуют друг с другом через силы притяжения. Изменение температуры не происходит до тех пор, пока не завершится фазовый переход. Температура чашки содовой, изначально равная 0ºC, остается такой же, пока весь лед не растает. И наоборот, при замерзании и конденсации выделяется энергия, обычно в виде тепловой энергии. Работа совершается силами сцепления, когда молекулы сближаются. Соответствующая энергия должна быть выделена (рассеяна), чтобы позволить им оставаться вместе. Рисунок 2.
Энергия фазового перехода зависит от двух основных факторов: количества и прочности связей или силовых пар. Количество связей пропорционально количеству молекул и, следовательно, массе образца.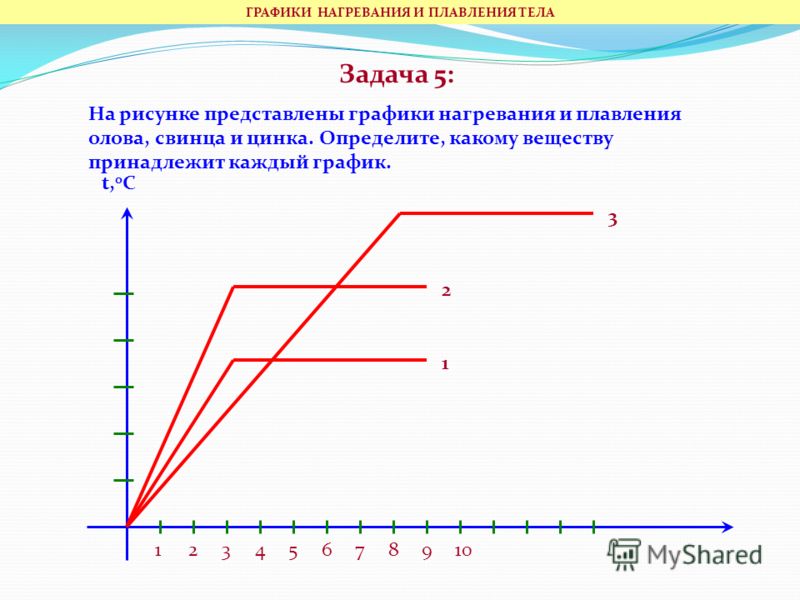 Сила сил зависит от типа молекул. Теплота Q , необходимая для превращения фазы образца массой м , равна
Сила сил зависит от типа молекул. Теплота Q , необходимая для превращения фазы образца массой м , равна
Q = мл f (плавление/замерзание,
Q 50294 mL
где скрытая теплота плавления, L f , и скрытая теплота парообразования, L v , являются материальными константами, которые определяются экспериментально. См. (табл. 1).
Рис. 2. (а) Энергия требуется для частичного преодоления сил притяжения между молекулами в твердом теле с образованием жидкости. Та же самая энергия должна быть удалена, чтобы произошло замораживание. (b) Молекулы разделяют большие расстояния при переходе из жидкости в пар, и для преодоления молекулярного притяжения требуется значительная энергия. Такая же энергия должна быть удалена, чтобы произошла конденсация. Изменение температуры не происходит до тех пор, пока не завершится фазовый переход.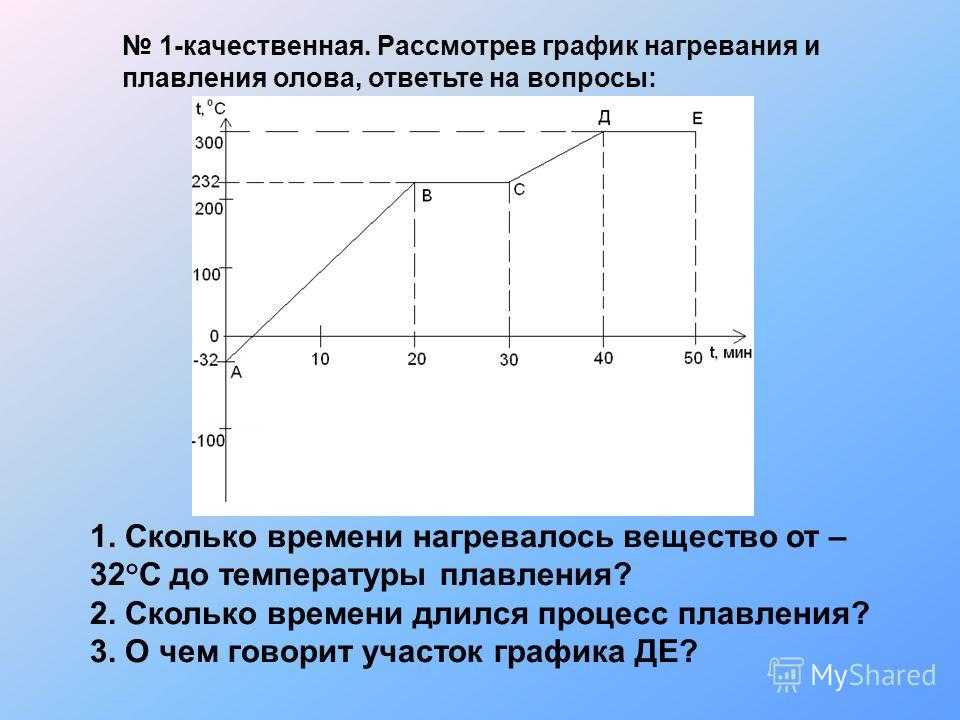
Скрытая теплота измеряется в Дж/кг. Как L f , так и L v зависят от вещества, особенно от силы его молекулярных сил, как отмечалось ранее. L f и L v вместе называются коэффициентами скрытой теплоты . Они латентные , или скрытые, потому что при фазовых переходах энергия входит в систему или выходит из нее, не вызывая изменения температуры в системе; так что, по сути, энергия скрыта. В таблице 1 перечислены репрезентативные значения 9.0294 L f и L v вместе с температурами плавления и кипения.
Таблица показывает, что в фазовые переходы затрачивается значительное количество энергии. Посмотрим, например, сколько энергии нужно, чтобы растопить килограмм льда при 0ºC, чтобы произвести килограмм воды при 0 ° C. Используя уравнение изменения температуры и значение для воды из табл. 1 , мы находим, что Q = мл f = (1,0 кг) (334 кДж/кг) = 334 кДж – это энергия, необходимая для плавления килограмма льда.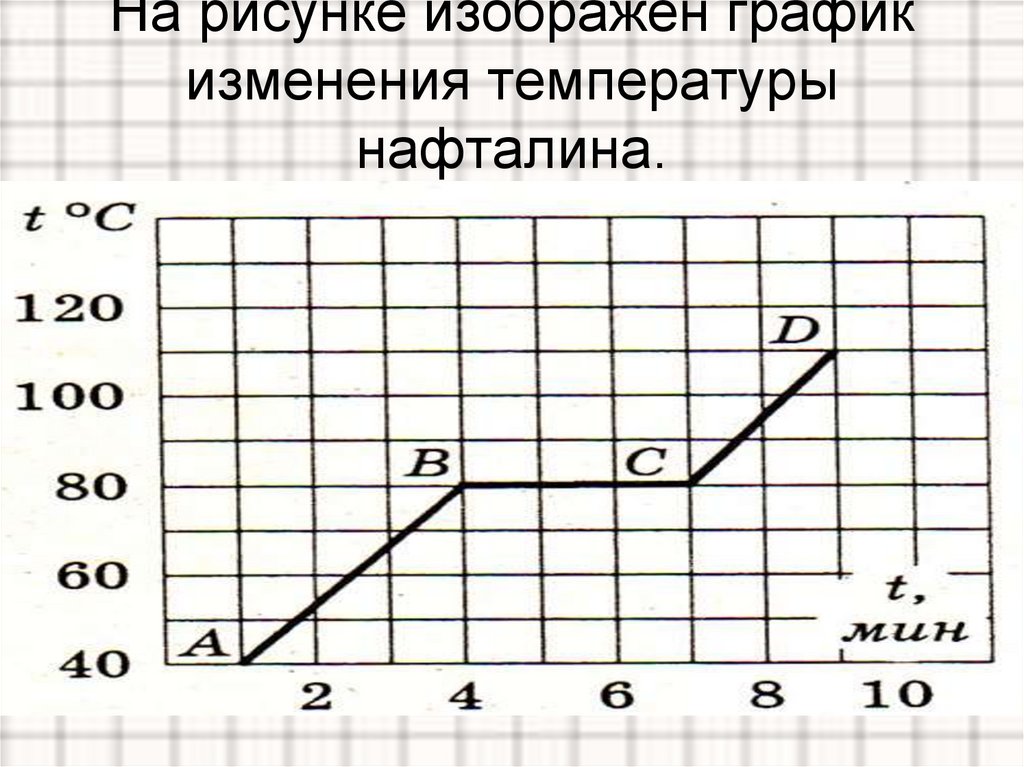 Это много энергии, так как она представляет такое же количество энергии, которое необходимо для повышения температуры 1 кг жидкой воды с 0ºC до 79.0,8ºС. Еще больше энергии требуется для испарения воды; для превращения 1 кг жидкой воды при нормальной температуре кипения (100ºC при атмосферном давлении) в пар (водяной пар) потребуется 2256 кДж. Этот пример показывает, что энергия фазового перехода огромна по сравнению с энергией, связанной с изменением температуры без фазового перехода.
Это много энергии, так как она представляет такое же количество энергии, которое необходимо для повышения температуры 1 кг жидкой воды с 0ºC до 79.0,8ºС. Еще больше энергии требуется для испарения воды; для превращения 1 кг жидкой воды при нормальной температуре кипения (100ºC при атмосферном давлении) в пар (водяной пар) потребуется 2256 кДж. Этот пример показывает, что энергия фазового перехода огромна по сравнению с энергией, связанной с изменением температуры без фазового перехода.
| Таблица 1. Теплоты плавления и парообразования [1] | ||||||
|---|---|---|---|---|---|---|
| л ф | Л v | |||||
| Вещество | Температура плавления (ºC) | кДж/кг | ккал/кг | Температура кипения (°С) | кДж/кг | ккал/кг |
| Гелий | −269,7 | 5,23 | 1,25 | −268,9 | 20,9 | 4,99 |
| Водород | −259,3 | 58,6 | 14,0 | −252,9 | 452 | 108 |
| Азот | −210,0 | 25,5 | 6,09 | −195,8 | 201 | 48,0 |
| Кислород | −218,8 | 13,8 | 3,30 | −183,0 | 213 | 50,9 |
| Этанол | −114 | 104 | 24,9 | 78,3 | 854 | 204 |
| Аммиак | −75 | 108 | −33,4 | 1370 | 327 | |
| Меркурий | −38,9 | 11,8 | 2,82 | 357 | 272 | 65,0 |
| Вода | 0,00 | 334 | 79,8 | 100,0 | 2256 [2] | 539 [3] |
| Сера | 119 | 38,1 | 9. 10 10 | 444,6 | 326 | 77,9 |
| Свинец | 327 | 24,5 | 5,85 | 1750 | 871 | 208 |
| Сурьма | 631 | 165 | 39,4 | 1440 | 561 | 134 |
| Алюминий | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Серебро | 961 | 88,3 | 21,1 | 2193 | 2336 | 558 |
| Золото | 1063 | 64,5 | 15,4 | 2660 | 1578 | 377 |
| Медь | 1083 | 134 | 32,0 | 2595 | 5069 | 1211 |
| Уран | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Вольфрам | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Фазовые превращения могут иметь огромный стабилизирующий эффект даже при температурах, не близких к точкам плавления и кипения, поскольку испарение и конденсация (превращение газа в жидкое состояние) происходят даже при температурах ниже точки кипения. Возьмем, к примеру, тот факт, что температура воздуха во влажном климате редко превышает 35,0ºC, поскольку большая часть теплопередачи идет на испарение воды в воздух. Точно так же температура во влажную погоду редко опускается ниже точки росы, потому что при конденсации водяного пара выделяется огромное количество тепла.
Возьмем, к примеру, тот факт, что температура воздуха во влажном климате редко превышает 35,0ºC, поскольку большая часть теплопередачи идет на испарение воды в воздух. Точно так же температура во влажную погоду редко опускается ниже точки росы, потому что при конденсации водяного пара выделяется огромное количество тепла.
Мы более точно изучим эффекты фазового перехода, рассматривая добавление тепла к образцу льда при температуре -20ºC (рис. 3). Температура льда растет линейно, поглощая тепло с постоянной скоростью 0,50 кал/г⋅ºC, пока не достигнет 0ºC. При такой температуре лед начинает таять до тех пор, пока весь лед не растает, поглощая 79,8 кал/г тепла. Температура остается постоянной на уровне 0ºC во время этого фазового перехода. Как только весь лед растаял, температура жидкой воды повышается, поглощая тепло с новой постоянной скоростью 1,00 кал/г⋅ºC. При 100ºC вода начинает кипеть и температура снова остается постоянной, пока вода поглощает 539кал/г тепла во время этого фазового перехода. Когда вся жидкость превратилась в пар, температура снова повышается, поглощая тепло со скоростью 0,482 кал/г⋅ºC.
Когда вся жидкость превратилась в пар, температура снова повышается, поглощая тепло со скоростью 0,482 кал/г⋅ºC.
Рис. 3. График зависимости температуры от добавленной энергии. Система сконструирована таким образом, что пар не испаряется, пока лед нагревается до жидкой воды, и чтобы при испарении пар оставался в системе. Длинные отрезки постоянных значений температуры при 0ºC и 100ºC отражают большую скрытую теплоту плавления и испарения соответственно.
Вода может испаряться при температуре ниже точки кипения. Энергии требуется больше, чем при температуре кипения, потому что кинетическая энергия молекул воды при температуре ниже 100ºC меньше, чем при 100ºC, следовательно, меньше энергии доступно от случайных тепловых движений. Возьмем, к примеру, тот факт, что при температуре тела пот с кожи требует подводимой теплоты 2428 кДж/кг, что примерно на 10% больше, чем скрытая теплота парообразования при 100°С. Это тепло исходит от кожи и, таким образом, обеспечивает эффективный механизм охлаждения в жаркую погоду. Высокая влажность препятствует испарению, поэтому температура тела может подняться, и на лбу останется неиспарившийся пот.
Высокая влажность препятствует испарению, поэтому температура тела может подняться, и на лбу останется неиспарившийся пот.
Пример 1. Расчет конечной температуры по фазовому переходу: охлаждение содовой с помощью кубиков льда
Три кубика льда используются для охлаждения содовой до 20ºC массой м содовой = 0,25 кг. Лед имеет температуру 0ºC, и каждый кубик льда имеет массу 6,0 г. Предположим, что сода хранится в контейнере из пенопласта, так что потерями тепла можно пренебречь. Предположим, что сода имеет такую же теплоемкость, как вода. Найдите конечную температуру, когда весь лед растает.
Стратегия
Кубики льда имеют температуру таяния 0ºC. Тепло передается от газировки льду для плавления. Плавление льда происходит в два этапа: сначала происходит фазовый переход и твердое тело (лед) переходит в жидкую воду при температуре плавления, затем температура этой воды повышается. Плавление дает воду при температуре 0ºC, поэтому от соды к этой воде передается больше тепла, пока система вода + сода не достигнет теплового равновесия, Q лед = − Q сода .
Теплота, переданная льду, равна 5 м лед в З ( Т f −0ºC).
Теплота, выделяемая содой, равна Q соды = m соды c W ( T f −20ºC). Так как тепло не теряется, Q лед = − Q сода , так что
m лед L f м лед ц W ( T f −0ºC) = – m сода c W ( T f −20ºC).
Приведите все условия, связанные с T 9{\ circ} \ text {C} \ right) -m _ {\ text {ice}} L _ {\ text {f}}} {\ left (m _ {\ text {газировка}} + m _ {\ text {лед} }\right)c_{\text{W}}}\\[/latex]
Решение
- Определите известные величины. Масса льда м льда = 3 × 6,0 г = 0,018 кг, а масса соды м соды = 0,25 кг.

- Рассчитайте члены в числителе: м сода c Вт (20ºC)=(0,25 кг)(4186 Дж/кг ⋅ ºC)(20ºC) = 20 930 Дж и 9{\ circ} \ text {C} \\ [/ латекс]
Обсуждение
Этот пример иллюстрирует огромные энергии, связанные с изменением фазы. Масса льда составляет около 7 процентов от массы воды, но приводит к заметному изменению температуры соды. Хотя мы предположили, что лед был при температуре замерзания, это неверно: типичная температура -6ºC. Однако эта поправка дает конечную температуру, практически идентичную найденному нами результату. Можете ли вы объяснить, почему?
Рисунок 4. Конденсат на стакане чая со льдом. (кредит: Дженни Даунинг)
Мы видели, что испарение требует передачи тепла жидкости из окружающей среды, так что окружающая среда высвобождает энергию. Конденсация – это обратный процесс, повышающий температуру окружающей среды. Это увеличение может показаться удивительным, поскольку мы связываем конденсацию с холодными предметами — например, со стеклом на рисунке.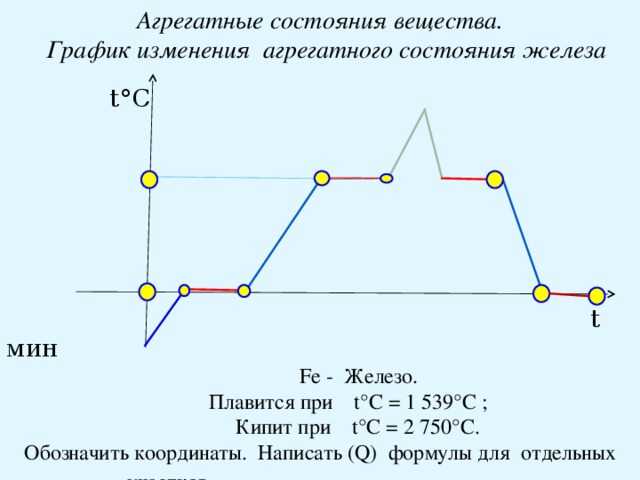 Однако энергия должна быть удалена от конденсирующихся молекул, чтобы заставить пар сконденсироваться. Энергия точно такая же, как требуется для осуществления фазового перехода в другом направлении, от жидкости к пару, поэтому ее можно рассчитать из Q = мл v .
Однако энергия должна быть удалена от конденсирующихся молекул, чтобы заставить пар сконденсироваться. Энергия точно такая же, как требуется для осуществления фазового перехода в другом направлении, от жидкости к пару, поэтому ее можно рассчитать из Q = мл v .
Конденсат образуется на рис. 4, потому что температура окружающего воздуха снижается ниже точки росы. Воздух не может содержать столько воды, сколько при комнатной температуре, поэтому вода конденсируется. Энергия высвобождается, когда вода конденсируется, ускоряя таяние льда в стакане.
Реальное применение
Энергия также высвобождается при замерзании жидкости. Это явление используется садоводами во Флориде для защиты апельсинов, когда температура близка к точке замерзания (0ºC). Садоводы распыляют воду на растения в садах, чтобы вода замерзала и тепло отдавалось растущим на деревьях апельсинам. Это предотвращает падение температуры внутри апельсина ниже точки замерзания, что может привести к повреждению плода.
Рисунок 14.11. Лед на этих деревьях выделял большое количество энергии при замерзании, помогая предотвратить падение температуры деревьев ниже 0ºC. Вода намеренно распыляется на сады, чтобы предотвратить сильные морозы. (кредит: Герман Хаммер)
Сублимация — это переход из твердого состояния в парообразное. Возможно, вы замечали, что снег может раствориться в воздухе без следа жидкой воды или исчезновение кубиков льда в морозильной камере. Верно и обратное: иней может образовываться на очень холодных окнах, не проходя стадию жидкости. Популярным эффектом является создание «дыма» из сухого льда, представляющего собой твердый углекислый газ. Сублимация происходит потому, что равновесное давление паров твердых тел не равно нулю. В некоторых освежителях воздуха используется сублимация твердого вещества для введения аромата в помещение. Шарики от моли являются слегка токсичным примером фенола (органического соединения), который возгоняется, в то время как некоторые твердые вещества, такие как четырехокись осмия, настолько токсичны, что их необходимо хранить в герметичных контейнерах, чтобы предотвратить воздействие на человека их сублимационных паров.
Рис. 5. Прямые переходы между твердым телом и паром распространены, иногда полезны и даже красивы. (а) Сухой лед сублимируется непосредственно в углекислый газ. Видимый пар состоит из капель воды. (кредит: Уинделл Оскей) (b) Фрост образует узоры на очень холодном окне, пример твердого тела, образованного непосредственно из пара. (кредит: Лиз Уэст)
Все фазовые переходы связаны с выделением тепла. В случае прямых переходов твердое тело-пар необходимая энергия определяется уравнением Q = мл с , где л с — это теплота сублимации , которая представляет собой энергию, необходимую для превращения 1,00 кг вещества из твердой фазы в паровую фазу. L s аналогичен L f и L v , и его значение зависит от вещества. Сублимация требует затрат энергии, поэтому сухой лед является эффективным хладагентом, в то время как обратный процесс (т. е. замораживание) высвобождает энергию. Количество энергии, необходимое для сублимации, того же порядка, что и для других фазовых переходов.
Количество энергии, необходимое для сублимации, того же порядка, что и для других фазовых переходов.
Материал, представленный в этом и предыдущем разделах, позволяет нам рассчитать любое количество эффектов, связанных с температурой и фазовым переходом. В каждом случае необходимо определить, какие температурные и фазовые изменения имеют место, а затем применить соответствующее уравнение. Имейте в виду, что теплообмен и работа могут вызывать как температурные, так и фазовые изменения.
Стратегии решения проблем с эффектами теплопередачи
- Изучите ситуацию, чтобы определить, есть ли изменение температуры или фазы. Осуществляется ли передача тепла в систему или из нее? Если наличие или отсутствие фазового перехода неочевидно, можно сначала решить задачу, как если бы фазовых переходов не было, и изучить полученное изменение температуры. Если этого достаточно, чтобы преодолеть точку кипения или плавления, вам следует вернуться назад и решить задачу поэтапно — изменение температуры, изменение фазы, последующее изменение температуры и так далее.

- Определите и перечислите все объекты, изменяющие температуру и фазу.
- Точно определите, что нужно определить в задаче (идентифицируйте неизвестные). Письменный список полезен.
- Составьте список того, что дано или что может быть выведено из поставленной задачи (укажите известное).
- Решите соответствующее уравнение для определяемой величины (неизвестной). При изменении температуры переданное тепло зависит от удельной теплоемкости (см. Таблицу 1 в разделе «Изменение температуры и теплоемкость»), тогда как при фазовом переходе переданное тепло зависит от скрытой теплоты. См. Таблицу 1.
- Подставьте известные числа вместе с их единицами измерения в соответствующее уравнение и получите численное решение с единицами измерения. Если процесс состоит из нескольких стадий (например, за изменением температуры следует фазовое изменение), вам потребуется выполнить это поэтапно.
- Проверьте ответ, чтобы убедиться, что он разумен: Имеет ли он смысл? Например, убедитесь, что изменение температуры не вызывает фазового перехода, который вы не учли.

Проверьте свое понимание
Почему снег остается на горных склонах даже при дневных температурах выше нуля?
Раствор
Снег образуется из кристаллов льда и, таким образом, является твердой фазой воды. Поскольку для фазовых переходов необходимо огромное количество тепла, для накопления этого тепла из воздуха требуется определенное время, даже если температура воздуха выше 0ºC. Чем теплее воздух, тем быстрее происходит этот теплообмен и тем быстрее тает снег.
Резюме раздела
- Большинство веществ могут существовать в твердой, жидкой и газообразной формах, которые называются «фазами».
- Фазовые превращения происходят при фиксированных температурах для данного вещества при данном давлении, и эти температуры называются точками кипения и замерзания (или плавления).
- Во время фазовых переходов поглощаемое или выделяемое тепло определяется по формуле: Q = мл , где L – коэффициент скрытой теплоты.

Концептуальные вопросы
- Теплопередача может вызывать температурные и фазовые изменения. Что еще может вызвать эти изменения?
- Каким образом скрытая теплота плавления воды помогает замедлить снижение температуры воздуха, возможно, предотвращая падение температуры значительно ниже ºC вблизи больших водоемов?
- Какова температура льда сразу после того, как он образовался замерзшей водой?
- Если вы поместите лед ºC в воду ºC в изолированном контейнере, что произойдет? Растает ли часть льда, замерзнет ли больше воды или не произойдет ни того, ни другого?
- Какое влияние оказывает конденсация на стакане ледяной воды на скорость таяния льда? Конденсация ускорит процесс плавления или замедлит его?
- В очень влажном климате, где есть многочисленные водоемы, например, во Флориде, температура редко поднимается выше 35ºC (95ºF). Однако в пустынях температура может подняться намного выше. Объясните, как испарение воды помогает ограничить высокие температуры во влажном климате.

- Зимой в Сан-Франциско часто теплее, чем в соседнем Сакраменто, находящемся в 150 км от побережья. Летом в Сакраменто почти всегда жарче. Объясните, как водоемы, окружающие Сан-Франциско, смягчают экстремальные температуры.
- Накрытие крышки на кипящую кастрюлю значительно снижает теплопередачу, необходимую для поддержания кипения. Объяснить, почему.
- Сублимированные продукты были обезвожены в вакууме. Во время процесса пища замерзает и должна быть нагрета, чтобы облегчить обезвоживание. Объясните, как вакуум ускоряет обезвоживание и почему продукты в результате замерзают.
- Когда неподвижный воздух охлаждается за счет излучения ночью, температура не может опускаться ниже точки росы. Объяснить, почему.
- На демонстрации в классе физики инструктор надувает воздушный шар ртом, а затем охлаждает его жидким азотом. В холодном состоянии сморщенный шар содержит небольшое количество светло-голубой жидкости, а также несколько кристаллов, похожих на снег.
 При нагревании жидкость закипает, часть кристаллов возгоняется, часть кристаллов задерживается на некоторое время, а затем превращается в жидкость. Определите синюю жидкость и два твердых тела в холодном шаре. Обоснуйте свои идентификации, используя данные из таблицы 1.
При нагревании жидкость закипает, часть кристаллов возгоняется, часть кристаллов задерживается на некоторое время, а затем превращается в жидкость. Определите синюю жидкость и два твердых тела в холодном шаре. Обоснуйте свои идентификации, используя данные из таблицы 1.
Задачи и упражнения
- Какая теплопередача (в килокалориях) требуется для оттаивания упаковки замороженных овощей массой 0,450 кг при исходной температуре 0°С, если их теплота плавления такая же, как у воды?
- Пакет со льдом 0ºC намного эффективнее поглощает энергию, чем пакет, содержащий такое же количество воды 0ºC. (a) Какая теплопередача необходима для повышения температуры 0,800 кг воды с 0ºC до 30,0ºC? (b) Какая теплопередача требуется, чтобы сначала растопить 0,800 кг льда с температурой 0ºC, а затем повысить его температуру? (c) Объясните, как ваш ответ подтверждает утверждение о том, что лед более эффективен.
- (a) Какая теплопередача требуется, чтобы поднять температуру алюминиевого горшка весом 0,750 кг, содержащего 2,50 кг воды, с 30,0°C до точки кипения, а затем выкипятить 0,750 кг воды? (b) Сколько времени это займет, если скорость теплопередачи составляет 500 Вт 1 Вт = 1 Дж/сек (1 Вт = 1 Дж/сек)?
- Образование конденсата на стакане ледяной воды приводит к тому, что лед тает быстрее, чем в противном случае.
 Если на стакане воды и 200 г льда образуется 8,00 г конденсата, сколько граммов льда при этом растает? Предположим, что другой передачи тепла не происходит.
Если на стакане воды и 200 г льда образуется 8,00 г конденсата, сколько граммов льда при этом растает? Предположим, что другой передачи тепла не происходит. - В поездке вы замечаете, что мешка со льдом весом 3,50 кг хватает в холодильнике в среднем на один день. Какова средняя мощность в ваттах, поступающая в лед, если он начинается при 0ºC и полностью тает до 0ºC воды ровно за один день 1 ватт = 1 джоуль/сек (1 Вт = 1 Дж/сек)?
- В определенный сухой солнечный день температура в бассейне поднялась бы на 1,50ºC, если бы не испарение. Какая часть воды должна испариться, чтобы унести достаточно энергии, чтобы поддерживать постоянную температуру?
- (a) Какая теплопередача необходима для повышения температуры куска льда массой 0,200 кг с −20,0°C до 130°C, включая энергию, необходимую для фазовых переходов? (b) Сколько времени требуется для каждой стадии при постоянной скорости теплопередачи 20,0 кДж/с? (c) Постройте график зависимости температуры от времени для этого процесса.

- В 1986 году от шельфового ледника Росса в Антарктиде откололся гигантский айсберг. Это был примерно прямоугольник длиной 160 км, шириной 40,0 км и толщиной 250 м. а) Какова масса этого айсберга, если плотность льда равна 917 кг/м 3 ? (б) Сколько теплоты (в джоулях) необходимо для его плавления? (c) Сколько лет потребуется только солнечному свету, чтобы растопить лед такой толщины, если лед поглощает в среднем 100 Вт/м 2 , 12,00 ч в день?
- Сколько граммов кофе должно испариться из 350 г кофе в 100-граммовой стеклянной чашке, чтобы охладить кофе с 95,0°С до 45,0°С? Вы можете предположить, что кофе имеет те же термические свойства, что и вода, и что средняя теплота парообразования составляет 2340 кДж/кг (560 кал/г). (Вы можете пренебречь изменением массы кофе по мере его охлаждения, что даст вам ответ, который немного больше правильного.)
- (a) Трудно потушить пожар на танкере с сырой нефтью, потому что каждый литр сырой нефти выделяет 2,80 × 10 7 Дж энергии при сгорании.
 Чтобы проиллюстрировать эту трудность, подсчитайте количество литров воды, которое необходимо затратить, чтобы поглотить энергию, выделяющуюся при сжигании 1,00 л сырой нефти, если температура воды повышается с 20,0 °С до 100 °С, она закипает, а образующийся пар подняли до 300ºC. (b) Обсудите дополнительные сложности, вызванные тем фактом, что сырая нефть имеет меньшую плотность, чем вода.
Чтобы проиллюстрировать эту трудность, подсчитайте количество литров воды, которое необходимо затратить, чтобы поглотить энергию, выделяющуюся при сжигании 1,00 л сырой нефти, если температура воды повышается с 20,0 °С до 100 °С, она закипает, а образующийся пар подняли до 300ºC. (b) Обсудите дополнительные сложности, вызванные тем фактом, что сырая нефть имеет меньшую плотность, чем вода. - Энергия, высвобождаемая при конденсации во время грозы, может быть очень большой. Рассчитайте энергию, выделившуюся в атмосферу при небольшой грозе радиусом 1 км, предполагая, что 1,0 см дождя выпадает равномерно на этой территории.
- Чтобы предотвратить повреждение от мороза, на фруктовое дерево распыляют 4,00 кг воды с температурой 0ºC. (а) Сколько тепла происходит при замерзании воды? (b) Насколько уменьшится температура 200-килограммового дерева, если это количество тепла будет передано от дерева? Примем удельную теплоемкость равной 3,35 кДж/кг · ºC и предположим, что фазового перехода не происходит.

- Алюминиевая миска массой 0,250 кг, вмещающая 0,800 кг супа при температуре 25,0°C, помещается в морозильную камеру. Какова будет конечная температура, если от миски и супа будет передано 377 кДж энергии, если предположить, что тепловые свойства супа такие же, как у воды?
- Кубик льда весом 0,0500 кг при температуре -30,0°C помещают в 0,400 кг воды при температуре 35,0°C в хорошо изолированном контейнере. Какая конечная температура?
- Если вы выльете 0,0100 кг воды с температурой 20,0 ºC на кусок льда массой 1,20 кг (который изначально имеет температуру -15,0 ºC), какова будет конечная температура? Вы можете предположить, что вода остывает так быстро, что влияние окружающей среды можно пренебречь.
- Коренные жители иногда готовят пищу в водонепроницаемых корзинах, помещая горячие камни в воду, чтобы довести ее до кипения. Какую массу камня с температурой 500°С нужно поместить в 4,00 кг воды с температурой 15,0°С, чтобы довести ее температуру до 100°С, если 0,0250 кг воды выделится в виде пара из начального шипения? Вы можете пренебречь влиянием окружающей среды и принять среднюю удельную теплоемкость горных пород за удельную теплоемкость гранита.

- Какой была бы конечная температура кастрюли и воды в расчете конечной температуры при передаче тепла между двумя телами: заливка холодной воды в горячую кастрюлю, если бы 0,260 кг воды было помещено в кастрюлю и 0,0100 кг воды немедленно испарилось , оставив остаток доходить до общей температуры со сковородой?
- В некоторых странах жидкий азот используется на молоковозах вместо механических холодильников. Для 3-часовой доставки требуется 200 л жидкого азота плотностью 808 кг/м 3 . (a) Рассчитайте теплопередачу, необходимую для испарения этого количества жидкого азота и повышения его температуры до 3,00ºC. (Используйте c p и предположите, что оно постоянно во всем диапазоне температур.) Это значение представляет собой степень охлаждения подачи жидкого азота. (б) Какова эта скорость теплопередачи в киловатт-часах? (c) Сравните степень охлаждения, полученную при плавлении идентичной массы льда при температуре 0ºC, с охлаждающей способностью при испарении жидкого азота.

- Некоторые любители оружия изготавливают свои собственные пули, которые включают плавление и отливку свинцовых пуль. Какая теплопередача необходима, чтобы поднять температуру и расплавить 0,500 кг свинца, начиная с 25,0°С?
Глоссарий
теплота сублимации: энергия, необходимая для превращения вещества из твердой фазы в паровую
коэффициент скрытой теплоты: физическая постоянная, равная количеству тепла, переданному на каждый 1 кг вещества при изменении фазы вещества
сублимация: переход из твердой фазы в паровую
Избранные решения задач и упражнений
1. 35,9 ккал
3. (а) 591 ккал; (б) 4,94 × 10 3 s
5. 13,5 Вт
7. (а) 148 ккал; (б) 0,418 с, 3,34 с, 4,19 с, 22,6 с, 0,456 с
9, 33,0 г
10, (а) 9,67 л; (b) Сырая нефть менее плотна, чем вода, поэтому она плавает поверх воды, тем самым подвергая себя воздействию кислорода воздуха, который она использует для сжигания.

 Здесь температура льда была равна $-40 \degree C$
Здесь температура льда была равна $-40 \degree C$ Начинается ее отвердевание (кристаллизация)
Начинается ее отвердевание (кристаллизация)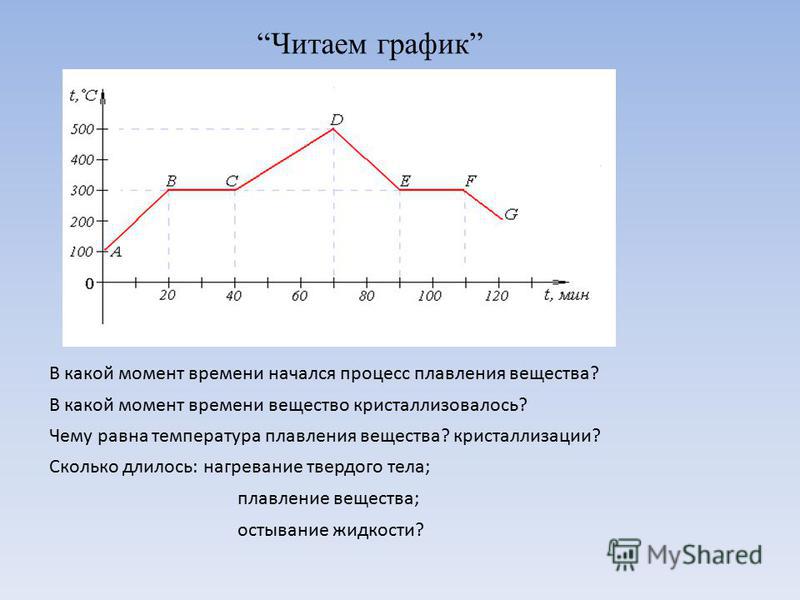



 При нагревании жидкость закипает, часть кристаллов возгоняется, часть кристаллов задерживается на некоторое время, а затем превращается в жидкость. Определите синюю жидкость и два твердых тела в холодном шаре. Обоснуйте свои идентификации, используя данные из таблицы 1.
При нагревании жидкость закипает, часть кристаллов возгоняется, часть кристаллов задерживается на некоторое время, а затем превращается в жидкость. Определите синюю жидкость и два твердых тела в холодном шаре. Обоснуйте свои идентификации, используя данные из таблицы 1. Если на стакане воды и 200 г льда образуется 8,00 г конденсата, сколько граммов льда при этом растает? Предположим, что другой передачи тепла не происходит.
Если на стакане воды и 200 г льда образуется 8,00 г конденсата, сколько граммов льда при этом растает? Предположим, что другой передачи тепла не происходит.
 Чтобы проиллюстрировать эту трудность, подсчитайте количество литров воды, которое необходимо затратить, чтобы поглотить энергию, выделяющуюся при сжигании 1,00 л сырой нефти, если температура воды повышается с 20,0 °С до 100 °С, она закипает, а образующийся пар подняли до 300ºC. (b) Обсудите дополнительные сложности, вызванные тем фактом, что сырая нефть имеет меньшую плотность, чем вода.
Чтобы проиллюстрировать эту трудность, подсчитайте количество литров воды, которое необходимо затратить, чтобы поглотить энергию, выделяющуюся при сжигании 1,00 л сырой нефти, если температура воды повышается с 20,0 °С до 100 °С, она закипает, а образующийся пар подняли до 300ºC. (b) Обсудите дополнительные сложности, вызванные тем фактом, что сырая нефть имеет меньшую плотность, чем вода.
Leave A Comment