Свойства муравьиной кислоты
А. Реакция серебряного зеркала. Готовят в пробирке аммиачный раствор оксида серебра. Для этого к 1 – 2 мл водного раствора нитрата серебра добавляют по каплям разбавленный раствор аммиака до растворения, образовавшегося осадка. К полученному раствору приливают 0,5 мл муравьиной кислоты или формиата натрия. Пробирку с реакционной смесью нагревают несколько минут на водяной бане при 60 – 700С. Металлическое серебро выделяется в виде зеркального налета на стенках пробирки или в виде темного осадка.
Напишите уравнения проведенных реакций.
Б. Окисления перманганатом
калия. В пробирку с
газоотводной трубкой наливают 0,5 – 1 мл
муравьиной кислоты или ее соли, 1 мл
разбавленной серной кислоты и 1 – 2 мл
раствора перманганата калия. Конец
газоотводной трубки погружают в другую
пробирку (почти до дна), содержащую 1 –
2 мл известковой воды, и осторожно
нагревают смесь до начала кипения.
Какие изменения в пробирке вы наблюдаете? Напишите уравнения реакции и подберите коэффициент.
В. Разложение муравьиной кислоты (тяга!). В пробирке с гибкой газоотводной трубкой осторожно смешивают 1 мл концентрированной серной кислоты и 1 мл муравьиной кислоты или 1 г ее соли. Пробирку осторожно нагревают. Муравьиная кислота разлагается с образованием оксида углерода (II) и воды. Оксид углерода (II) поджигают у отверстия газоотводной трубки. Обратите внимание на характер пламени. После окончания работы пробирку с реакционной смесью необходимо охладить, чтобы прекратит выделение ядовитого СО.
Напишите уравнение реакции разложения муравьиной кислоты в условиях описания опыта.
Образование нерастворимых солей. Для обнаружения карбоновых кислот используют также способность их образовывать нерастворимые свинцовые, серебренные и бариевые соли.
К 1 мл исследуемого раствора прибавляют
раствор гидроксида натрия до рН 7 – 8
(по универсальному индикатору).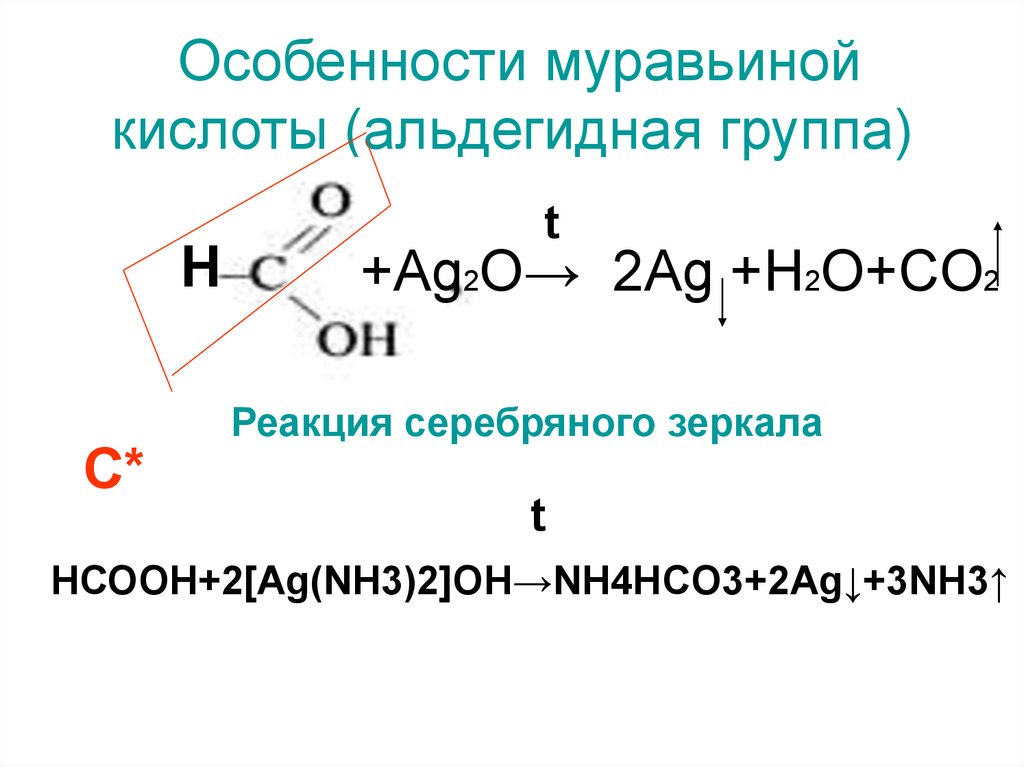 К раствору
полученной натриевой соли добавляют
по каплям концентрированный раствор
нитрата свинца, серебра или хлорида
бария. Выпадение осадка указывает на
наличие карбоновой кислоты.
К раствору
полученной натриевой соли добавляют
по каплям концентрированный раствор
нитрата свинца, серебра или хлорида
бария. Выпадение осадка указывает на
наличие карбоновой кислоты.
При анализе сложных эфиров используют их способность омыляться под действием щелочей:
RCOO + NaOH RCOONa + ROH
В пробирке растворяют 0,5 г анализируемого вещества в 5 мл спирта. Прибавляют несколько капель фенолфталеина 0,1 н раствор гидр оксида натрия в метаноле до появления малинового окрашивание смеси. Пробирку нагревают на водяной бане до 40 – 500С. Исчезновение окрашивания указывает на связывание щелочи кислотой, образовавшейся в результате гидролиза сложного эфира. Эта реакция является положительной пробой на присутствие в образе сложного эфира.
Амины
Бромирование анилина
К 5 мл воды приливают 2 – 3 капли анилина
и смесь сильно встряхивают.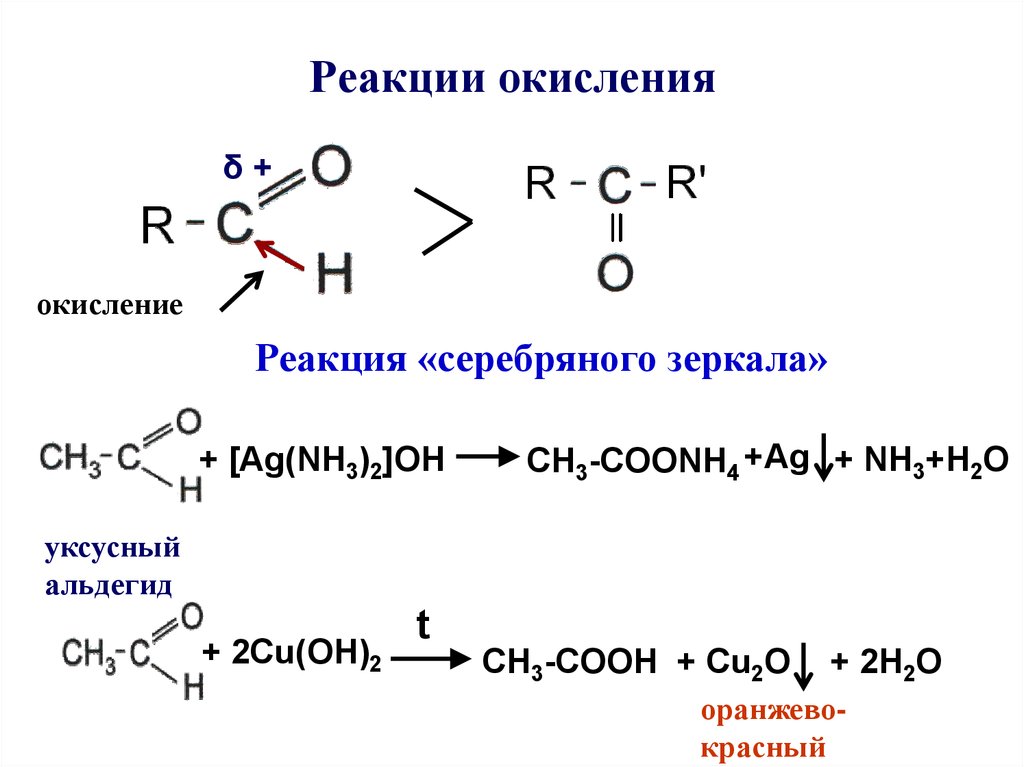 К полученной
эмульсии по каплям прибавляют бромную
воду. Смесь обесцвечивается, и выпадает
белый осадок триброманилина.
К полученной
эмульсии по каплям прибавляют бромную
воду. Смесь обесцвечивается, и выпадает
белый осадок триброманилина.
Введение в ароматическое кольцо аминогруппы резко повышает подвижность атомов водорода при атомах углерода бензольного кольца, поэтому анилин очень легко бромируется даже в разбавленном водном растворе с образованием малорастворимого в воде 2, 4, 6 – триброманилина:
В результате бромирования слабые основные свойства анилина еще больше ослабевают, и триброманилин почти нерастворим в разбавленных кислотах.
Окисление анилина
К 1мл анилиновой воды добавляют 2 – 3 капли раствора бихромата калия и 0,5 мл разбавленной серной кислоты. Жидкость окрашивается в интенсивный темно – зеленый цвет, переходящий в синий, а затем в черный.
Окисление анилина протекает очень
легко, и в зависимости от условий и
характера окислителя образуются
различные соединения: азобензол,
азаоксибензол, нитробензол, бензохинон
и т.
дает различные сложные окрашенные соединения, содержащие хиноидную группу. Продукт окисления анилина бихроматом – черный анилин – очень стоек к кислотам и щелочам, его часто применяют для крашения волокна, а также в лабораториях для окрашивания рабочих столов.
Карбоновые кислоты – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
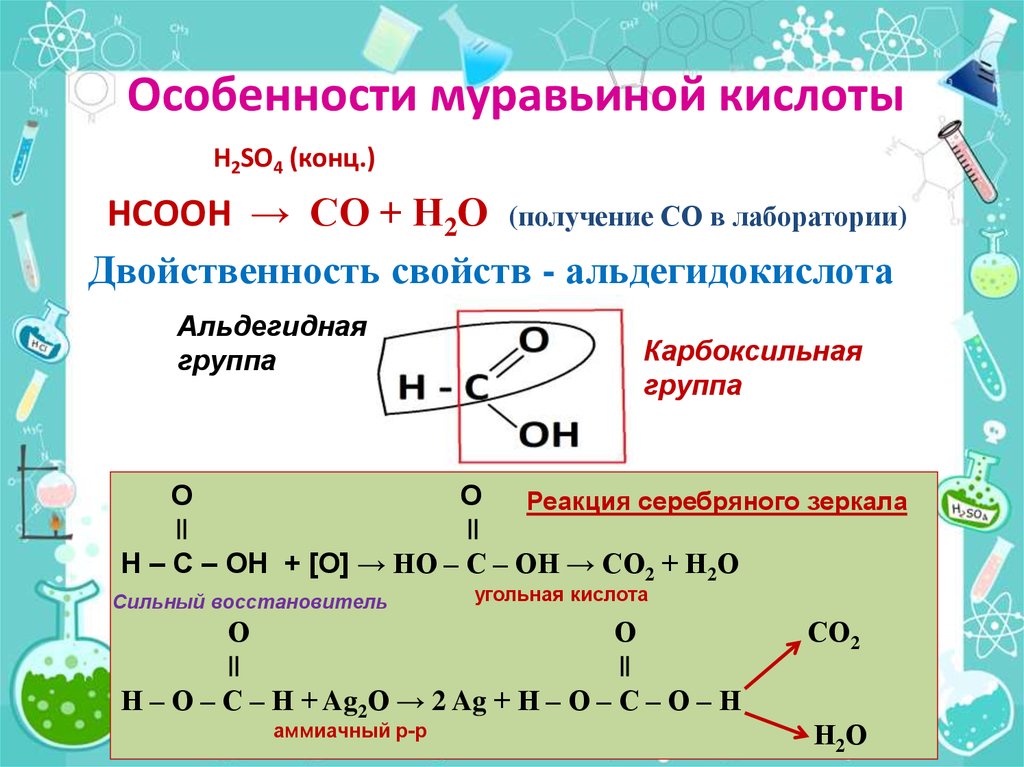
Если внимательно посмотреть на представленные химические формулы, во всех можно заметить общую часть , при записи химических формул используется буквенное обозначение СООН .
Эта часть называется карбоксильной группой, именно она определяет общие свойства, характерные для всей группы карбоновых кислот.
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Определение
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Классификация
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
-
одноосновные (муравьиная)
-
двухосновные (щавелевая)
-
многоосновные (лимонная)
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
-
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
-
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
-
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.

В группу карбоновых кислот входят вещества с различными углеводородными радикалами. Если количество атомов углерода в составе радикала больше шести — карбоновую кислоту называют жирной.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
3. Добавить -овая кислота.
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту.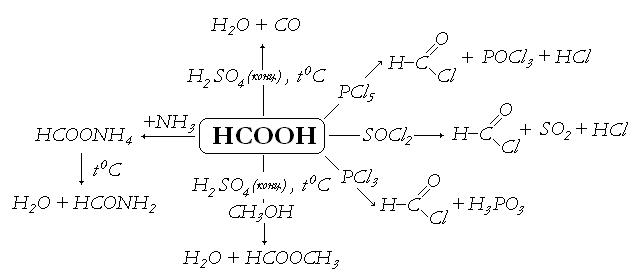 Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
C2H5OH + O2 —> CH3COOH + H2O
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
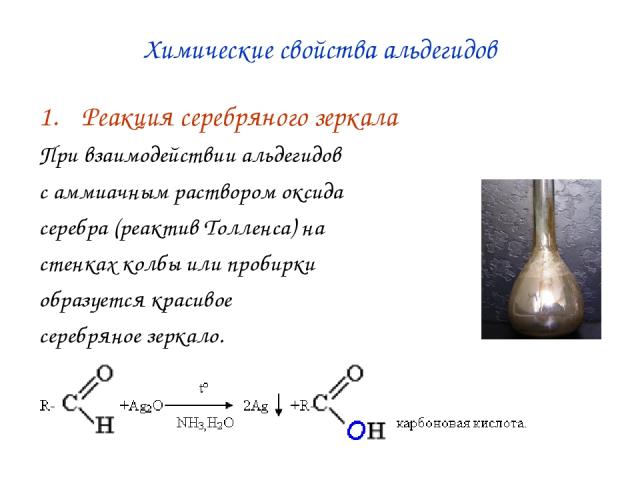
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) CO2 + H2O + 2Ag
Больше интересных материалов:
- Массовая доля вещества
- Технология критического мышления на уроке химии
- Почему лимон кислый?
- Ведение нормативной документации в кабинете химии
- Методическая помощь учителю химии
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O22 RCOOH
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 RCOOH + H2O
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 4 CH3COOH + 2 H2O
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
-
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
-
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
-
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.

Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
HCOOH HCOO- + H+
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Mg + 2 CH3COOH —> (CH3COO)2Mg + H2
CaO + 2 CH3COOH —> (CH3COO)2Mg + H2
NaOH + CH3COOH —> CH3COONa + H2O
K2CO3 + 2 CH3COOH —> 2 CH3COOK + H2O + CO2
3. Сложные эфиры образуются в реакциях карбоновых кислот со спиртами.
Сложные эфиры образуются в реакциях карбоновых кислот со спиртами.
#ADVERTISING_INSERT#
При нагревании муравьиной кислоты с аммиачной селитрой, продукт
Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , пожалуйста, включите JS , чтобы это приложение заработало.0014
More Related Question & Answers
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3.0k LIKES
3.0k VIEWS
1.5 K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K Просмотр
1,5K Акции
3,0K Likes
3,01K
. k НРАВИТСЯ
k НРАВИТСЯ3,0K Просмотр
1,5K Акции
3,0K Like
3,0K Просмотр
1,5K Акции
3.0K Like
3,0K Views
1.5K Шарес.
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K VIVERS
1,5K Shares
3,0K Like
1,5K1010101.0101011.01014 9.01011.0141.014 9.010101.014 9.010101.014
3.0k НРАВИТСЯ
3,0K Просмотр
1,5K Акции
3,0K лайки
3,0K просмотр
1,5K Акции
3,0K Like
3,0K VISE
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K View
1. 5K ОССЫЕ ОСОБЕННЫЕ
5K ОССЫЕ ОСОБЕННЫЕ
4 DLOCKEL ON SISE
.. Dospell Ismeler..... Пользовательский. , Doubtnut не владеет и не контролирует характер и содержание этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.Подобные вопросы пользователей
При нагревании муравьиной кислоты с аммиачной селитрой образуется продукт а) формальдегид б) мет…
При нагревании ацетальдегида с раствором аммиачной селитры получаем а) НСНО б) Ацетат серебра …
Hypo используется в фотографии для … [Pb CET 1989] а) восстанавливают зерна AgBr до металлического серебра b) Conv…
Какое утверждение неверно в случае ацетальдегида и ацетона? Какое утверждение неверно…
Соединение «X» (молекулярная формула C3H8O) обрабатывают подкисленным дихроматом калия с образованием пр. ..
..
Реагент, который можно использовать для различения фенола и этановой кислоты, представляет собой а) Раствор Фелинга…
Щавелевую кислоту можно отличить от винной кислоты по а) NaHCO3 б) лакмусовая бумажка c) аммиачный си…
Положение двойной связи в алкенах можно определить по .. [DEC 2001] а) бромная вода б) Аммоний…
Значения наблюдаемой и расчетной молекулярной массы нитрата серебра равны 92,64 и 170 относительно…
Углеводород, обесцвечивающий щелочной раствор KMnO4, но не дающий осадка при …
Серебряное зеркало с реактивом Толленса образуется путем а) ацетон б) этаналь в) этилацетат г) клей…
В качестве фиксирующего вещества в фотографии тиосульфат натрия используется для .. [Pb.CET 1989] a) Растворение о…
Серебряная соль жирной кислоты при кипячении с алкилгалогенидом дает . .. ..[ Karnataka CET 2004…
.. ..[ Karnataka CET 2004…
В химической реакции Ag2O + h3O + 2e- ? 2Ag + 2OH- [Керала ЦВЕ 2000] а) вода окисляется б) Э…
Основным органическим соединением, образующимся в результате реакции 1,1,1-трихлорэтана с порошком серебра, является …..
Какое из следующих утверждений неверно? Какое из следующих утверждений неверно? а) Бензальде…
Q329) Работа выхода серебра и натрия составляет 4,6 и 2,3 эВ соответственно. Соотношение сл…
Электрохимический эквивалент серебра 0,001118 г. При подаче электрического тока силой 0,5 ампер…
Какая из них настоящая рыба? Какая настоящая рыба? ? [ДЖИПМЕР 2002] а) каракатица б) рыба-собака в) Ж…
Серебряное зеркало — тест на а) альдегид б) тиоспирты в) кислоты г) Этар
Увлажнения 15,5-лекции Демонстрационных демонстраций Уважения химии Массачусетса Амхерст
Демонстрации ›Равновесия› 15,5
СПЕЦИАЛЬНОЕ ИСПОЛЬЗОВАНИЕ И ОРУЖИЕ
9002 15,5 СВЕТОВЫЕ СЕЛЕЙСКИЙ ИСКЛЮЧИРИЛИИ. , реакции преципитации, комплексные ионы, принцип Ле Шатье
, реакции преципитации, комплексные ионы, принцип Ле Шатье
Описание: Осадок хлорида серебра растворяется при добавлении прозрачной жидкости. Добавление второй прозрачной жидкости снова дает осадок.
Материалы (в шкафу — без корзины):
- 200 мл воды
- Стакан 500 мл
- 10 мл 0,1 М нитрат серебра‡
- 30 мл 1,0 М хлорида натрия‡
- 35 мл 6,0 М водного раствора аммиака‡
- Уксусная кислота
- Мешалка
- Платформа для перемешивания*
- 2 мерных цилиндра (1 50 мл, 1 10 мл)
‡Решения находятся на полках с решениями. Аммиак и уксусная кислота находятся в шкафах под вытяжкой.
*Общий предмет: находится в верхнем ящике центральной скамьи напротив шкафов для хранения химикатов.
Предварительная подготовка:
1. Приготовить осадок хлорида серебра. Поместите 200 мл воды в химический стакан на 600 мл. Добавьте 10 мл 0,1 М нитрата серебра и 30 мл 1,0 хлорида натрия в химический стакан, чтобы образовался осадок.
Поместите 200 мл воды в химический стакан на 600 мл. Добавьте 10 мл 0,1 М нитрата серебра и 30 мл 1,0 хлорида натрия в химический стакан, чтобы образовался осадок.
Процедура:
1. Добавьте аммиак, чтобы растворить хлорид серебра и получить растворимый комплексный ион серебра и аммиака.
2. Предложите учащимся предположить, что произойдет при добавлении уксусной кислоты. Добавьте уксусную кислоту.
Обсуждение:
Этап 1 (этап перед классом): Добавление хлорида натрия к раствору нитрата серебра приводит к образованию осадка хлорида серебра.
AgNO 3 (водн.) –> Ag + (водн.) + NO 2 — (водн.)
AgNO 3 (водн.) + NaCl (водн.) –> AgCl(тв) + NaNO 3 (водн.)
AgCl(тв) <–> Ag + + + (водн.) + Cl — (водн.) Ksp =1,8 x 10 -10
Стадия 2: При добавлении водного аммиака осадок хлорида серебра растворяется в пользу образования комплексного иона серебра и аммиака.
Ag + (водн.) + 2NH 3 (водн.) <–> [Ag(NH 3 ) 2+ ] (водн.) Kf = 1,6 x 10 7
Чистая реакция: AgCl(s) + 2NH 3 (водн.) <–> [Ag(NH 3 ) (водн.) + 2 3+ Cl — (водн.)
Knet = Ksp x Kf = (1,8 x 10 -10 )(1,6 x 10 7 ) = 2,9 x 10 -3
x1 = 2 0 6
Knet = 2 0 6 9013 x1 = {[Ag(NH 3 ) 2+ ](Cl — )}/ [NH 3 ] 2
Использование большой концентрации Nh4 приведет к получению большой концентрации комплексного иона в растворе, поэтому растворимость хлорида серебра в водном растворе аммиака намного выше, чем в воде.
Стадия 3: Добавляют уксусную кислоту, возвращая реакцию обратно к реагенту, хлориду серебра, реформируя осадок.
[Ag(NH 3 ) 2 ] + (водн.) + Cl — + 2CH 3 CO 2 H(водн. ) 1 + 2 2 2 CH 6 9 O 9 O 9 O Ag CO 2 NH 4 (водн.)
) 1 + 2 2 2 CH 6 9 O 9 O 9 O Ag CO 2 NH 4 (водн.)
Принцип ЛеШатлье гласит, что система изменится, чтобы уменьшить или противодействовать последствиям изменения условий равновесия. В этом случае в раствор добавляли уксусную кислоту, нарушающую равновесие хлорида серебра и аммиака. Ионы ацетата реагируют с ионами аммиака с образованием ацетата аммония, увеличивая концентрацию ионов серебра, что приводит к общему ионному эффекту. Исключение аммиака и уксусной кислоты из уравнения дает исходное уравнение диссоциации хлорида серебра. Увеличение концентрации ионов серебра сдвигает реакцию влево, создавая более нерастворимый хлорид серебра.
AgCl(s) <–> Ag + (водн.) + Cl — (водн.)
Безопасность:
Нитрат серебра и его растворы, а также концентрированные растворы аммиака могут вызывать раздражение кожи и вызывать раздражение. горит. При выполнении этих экспериментов используйте надлежащее защитное снаряжение, включая перчатки и очки.


Leave A Comment