СПЕКТРАЛЬНАЯ ЗАВИСИМОСТЬ ОБРАЗОВАНИЯ ИОНОВ НИТРИТА ПРИ ФОТОЛИЗЕ НИТРАТОВ КАЛИЯ И НАТРИЯ Текст научной статьи по специальности «Химические науки»
СПЕКТРАЛЬНАЯ ЗАВИСИМОСТЬ ОБРАЗОВАНИЯ ИОНОВ НИТРИТА ПРИ ФОТОЛИЗЕ НИТРАТОВ КАЛИЯ И НАТРИЯ
М.Б. Миклин, В. А. Власкин, Л. Д. Кригер, В. А. Невоструев
Исследована спектральная зависимость квантового выхода образования ионов нитрита при фотолизе при 300 К кристаллического нитрата калия. Изучено влияние температуры на скорость образования ионов нитрита при возбуждении иона нитрата в разные электронные состояния. Оценены соответствующие энергии активации в диапазоне от комнатной температуры до температуры плавления. Показано, что направление и эффективность химической деградации электронного возбуждения определяется симметрией возбужденного состояния и структурой кристалла.
ВВЕДЕНИЕ
Нитрат-ион относится к точечной группе йзь и его верхние занятые молекулярные ор-битали имеют симметрию а2′, е’, е», а низшие свободные молекулярные орбитали — а/, а/, причем последняя в кристаллах в результате небольшого смешивания с э — орбиталями катиона образует первую зону проводимости имеющую в основном анионный характер. е» (Хтах ~ 200 нм, \ ~ 10-1).
е» (Хтах ~ 200 нм, \ ~ 10-1).
В настоящее время фотолиз кристаллических нитратов щелочных металлов довольно подробно изучен только при действии света с Хтах = 253,7 нм при возбуждении нитрат-иона, в основном, в состояние симметрии Е’ (см. [5-8] и ссылки в них). Показано, что конечными продуктами фотолиза являются ион нитрита, Ы02-, кислород и ион пероксонитри-та, 0Ы00- — перекисный изомер иона нитрата.
Цель настоящей работы изучить спектральную зависимость фотолиза кристаллических нитратов натрия и калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали нитраты натрия и калия марки «ХЧ», трижды перекристаллизованные из бидистиллата. Монокристаллы выращивали охлаждением насыщенных растворов солей. Из порошков прессовали таблетки диаметром 16 мм и толщиной, соответствующей полному поглощению фотолизующего света в
каждом конкретном эксперименте.
Фотолиз образцов проводили в термостатированной ячейке. В качестве источников света использовали: 1) ртутную лампу среднего давления в комплекте со светосильным монохроматором для изучения спектральной зависимости квантового выхода; 2) X = 253,7 нм — ртутная лампа низкого давления с увио-левым баллоном; 3) X > 310 нм — ртутная лампа высокого давления в комплекте со светофильтром, пропускающим свет с X > 310 нм. Интенсивность света измеряли калориметром ИМО-2Н.
Интенсивность света измеряли калориметром ИМО-2Н.
Содержание Ы02- в образцах определяли спектрофотометрией [9], образуемого нитрит-ионами азосоеденения (е435 = 2400 м М-1) после растворения образца в воде при рН=7. Определение 0Ы00- осуществляли потенциометрическим титрованием раствором перманганата [10] после растворения образца в 1М растворе КОН.
Для учета термического разложения нитратов проводили параллельные эксперименты в отсутствие освещения. Далее в тексте экспериментальные данные по фотохимическому образованию ЫО2- приводятся за вычетом его концентрации, обусловленной термическим разложением.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Возбуждение состояния симметрии Л1//. Длительное облучение образцов КЫ03 светом с X > 310 нм в течении 48 часов в диапазоне температур 290 — 395 К не приводит к образованию ионов 0Ы00- и Ы02-. С учетом спектра излучения лампы, спектра пропускания светофильтра и спектра поглощения нитрата реально поглощается только свет с длиной волны 334 нм. Фотохимическое разложение нитрат-ионов с образованием нитрита под действием этого света наблюдается только при температуре выше 400 К
Фотохимическое разложение нитрат-ионов с образованием нитрита под действием этого света наблюдается только при температуре выше 400 К
(рис.1). Пероксонитрит-ион в этих условиях не обнаружен. Накопление Ы02- происходит с постоянной скоростью, температурная зависимость которой хорошо описывается уравнением Аррениуса с энергией активации 0,57±0,03 эВ (рис. 2). Влияние кислотности (рН) раствора, в котором производили растворение фотолизованных образцов, на выход нитрит-ионов не обнаружено.
400
1, мин
Рис. 1. Накопление Ы02 при фотолизе КЫ03 (Х>310 нм) при температурах:1 -413 К, 2-453 К, 3-493 К, 4-533 К, 5-573 К
1п(УТ)
1,6 1,8 2,0 2,2 2,4 2,6
1000/Т
Рис. 2. Зависимость скорости образования Ы02- от температуры при фотолизе КЫ03 светом с Х>310 нм
Возбуждение состояния симметрии Б7. При облучении КЫ03 светом с Х=253,7 нм в интервале доз 0-2,8 Дж/см2 концентрация образующегося ЫО2- пропорциональна поглощенной энергии только в диапазоне температур 290 -395 К.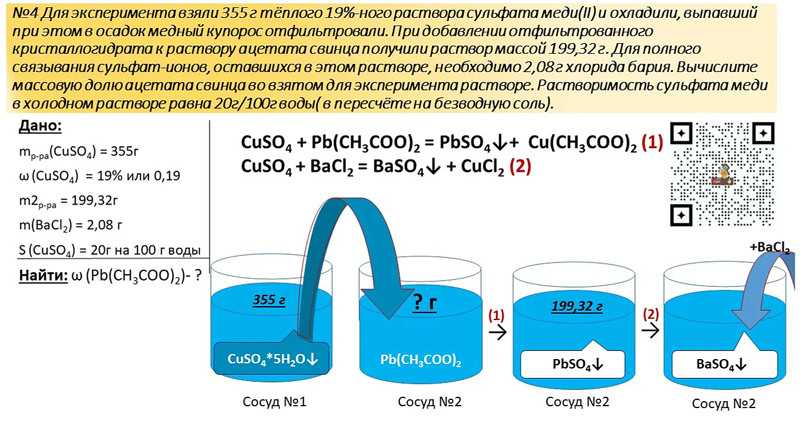 В температурном диапазоне 400-560 К накопление ЫО2- происходит с уменьшающейся во время фотолиза скоростью. В этом диапазоне температур, для определения квантового выхода, ЫО2- определяли одновременным измерением его концентрации в 50 образцах, получивших по 9.2 мДж световой энергии на каждую из двух поверхностей образца. Полученная температурная зависимость квантового выхода опи-
В температурном диапазоне 400-560 К накопление ЫО2- происходит с уменьшающейся во время фотолиза скоростью. В этом диапазоне температур, для определения квантового выхода, ЫО2- определяли одновременным измерением его концентрации в 50 образцах, получивших по 9.2 мДж световой энергии на каждую из двух поверхностей образца. Полученная температурная зависимость квантового выхода опи-
сывается уравнением Аррениуса (рис. 3). Накопление пероксонитрита в КЫ03, как и во всех нитратах щелочных металлов, быстро замедляется и при дозах более 1-2 Дж/см2 рост его концентрации практически прекращается [5, 7], но ни начальный выход, ни концентрация на участке насыщения, по результатам оптических измерений в фотолизован-ных кристаллах КЫ03, в диапазоне 300-370 К не обнаруживают сколько-нибудь заметной температурной зависимости. При температуре выше 400 К 0Ы00- в КЫ03 быстро и полностью отжигается [6].
Г4 2,5
о»
2,0
3,51000/Т
Рис. 3. Температурная зависимость квантового выхода ЫО2- при фотолизе К1\Юэ светом с длиной волны 253,7 нм
Концентрация ЫО2-, образующегося при облучении №N0:3 светом с Х=253,7 нм в исследованном диапазоне доз 0-1,55 Дж/см2, пропорциональна поглощенной энергии только при температуре 286 К. ~ 4 эВ (ЕА = 0.57 эВ) однозначно не дискриминирован, и, как вероятные могут рассматриваться следующие версии: 1) термоактивируемая диссоциация из состояния симметрии 3А1//; 2) термоактивируемая диссоциация из состояния симметрии Б/; 3) фотоактивируемый термолиз.
~ 4 эВ (ЕА = 0.57 эВ) однозначно не дискриминирован, и, как вероятные могут рассматриваться следующие версии: 1) термоактивируемая диссоциация из состояния симметрии 3А1//; 2) термоактивируемая диссоциация из состояния симметрии Б/; 3) фотоактивируемый термолиз.
Рассмотрим подробнее.
Версия 1. Теоретическое рассмотрение [12] показывает необходимость возбуждения, по крайней мере, трех колебаний симметрии Б/ для протекания диссоциации нитрат-иона в
3 »
триплетном состоянии симметрии А1 . Колебания нитрата симметрии Е’ в КЫ03 имеют волновые числа v4 = 716 см-1 и v3 = 1355 см-1. Колебание v4 приводит, в основном, к изменению валентных углов, а колебание v3 к растяжению связи, способствующему образованию нитрита. Можно предположить, что именно колебания v3 вызывают диссоциацию, а это предполагает наличие термической активации около 0,5 эВ.
Версия 2. КЫ03 при 400 К претерпевает фазовый переход [13], поэтому возможно скачкообразное красное смещение максимума или увеличение полуширины высокоэнергетической полосы поглощения, так что действующий свет начинает возбуждать электронное состояние Ы03- симметрии Е’, вызывающее диссоциацию Ы03- до Ы02- или изомеризацию в 0Ы00-. 0) = 0,34 эВ — температурный коэффициент, рассчитанный для длины волны 334 нм по данным [14]. Можно показать, что для случая диссоциации возбужденного иона нитрата энергия активации образования ионов нитрита должна представлять сумму этого температурного коэффициента и энергии активации образования Ы02- из состояния Е’, которая, как показано выше, составляет 0,27 эВ. Таким образом, величина ЕА составит 0,61 эВ. Ион пероксонитрита эффективно образующийся при возбуждении состояния Е’, быстро отжигается выше 400 К без образования нитрит-ионов.
0) = 0,34 эВ — температурный коэффициент, рассчитанный для длины волны 334 нм по данным [14]. Можно показать, что для случая диссоциации возбужденного иона нитрата энергия активации образования ионов нитрита должна представлять сумму этого температурного коэффициента и энергии активации образования Ы02- из состояния Е’, которая, как показано выше, составляет 0,27 эВ. Таким образом, величина ЕА составит 0,61 эВ. Ион пероксонитрита эффективно образующийся при возбуждении состояния Е’, быстро отжигается выше 400 К без образования нитрит-ионов.
Версия 3. Известно, что предварительная обработка образцов (механическое, радиационное воздействие, допирование и др.) ускоряет термолиз, поэтому, видимо, нельзя исключить как вариант и фотоактивацию в процессе термического разложения нитрата калия. Для КЫ03 по нашим данным в этом диапазоне температур энергия активации термического разложения с образованием ионов нитрита составляет 0,74 эВ.
Дискриминация любой из предложенных версий исходя из имеющихся пока экспериментальных данных невозможна.
Как можно видеть при фотолизе светом
с Х=253,7 нм температурная зависимость квантового выхода Ы02- в нитратах калия и натрия состоит из двух участков: низко- и высокотемпературного, причем на втором участке, Еа образования Ы02- существенно выше, чем на первом. В КЫ03 при 400К[13], а в ЫаЫ03 при 548К [15] наблюдается структурный фазовый переход. Сопоставление данных работы и температур фазовых переходов в нитратах калия и натрия позволяет предположить, что значение ЕА образования Ы02- в данных солях определяется видом процесса, при котором он образуется, а также параметрами кристаллической решетки. Сопоставление энергий активации образования Ы02- в нитратах калия и натрия при фотолизе светом с Х=253,7 нм для любого из температурных участков с величинами свободного объема этих матриц показывает их взаимосвязь, аналогичную найденной для радиолиза кристаллических нитратов [16]. В соответствии с этим, для конкретной матрицы переход из низкотемпературной фазы в высокотемпературную, сопровождающийся увеличением свободного объема кристаллов должен показывать уменьшение ЕА образования Ы02-, что противоречит наблюдаемым результатам. Таким образом, свободный объем кристалла не является фактором, однозначно определяющим величину ЕА. Данные работы [17] показывают, что природа катиона слабо влияет на энергетику Ы03- в кристалле, но от нее существенно зависит эффективность образования Ы02- при фотолизе и радиолизе. Вероятно, причина термической активации связана с необходимостью разделения осколков диссоциации, для предотвращения рекомбинации, что может достигаться миграцией незаряженного осколка в соседнее междоузлие.
Таким образом, свободный объем кристалла не является фактором, однозначно определяющим величину ЕА. Данные работы [17] показывают, что природа катиона слабо влияет на энергетику Ы03- в кристалле, но от нее существенно зависит эффективность образования Ы02- при фотолизе и радиолизе. Вероятно, причина термической активации связана с необходимостью разделения осколков диссоциации, для предотвращения рекомбинации, что может достигаться миграцией незаряженного осколка в соседнее междоузлие.
Данные, приведенные в работе, показывают, что Еа уменьшается с ростом энергии поглощаемых квантов при одновременном повышении квантового выхода Ы02-. Исходя из этого, мы предполагаем, что образование Ы02- протекает через стадию миграции осколочного атома кислорода из «клетки» через окружающую сферу, для чего требуется некоторая кинетическая энергия. Это и является причиной наблюдаемой термической активации образования Ы02-, при этом, чем выше энергия воздействующих на нитрат квантов, тем большей кинетической энергией обладает осколочный атом кислорода и тем меньше наблюдаемая в эксперименте Еа образования Ы02-.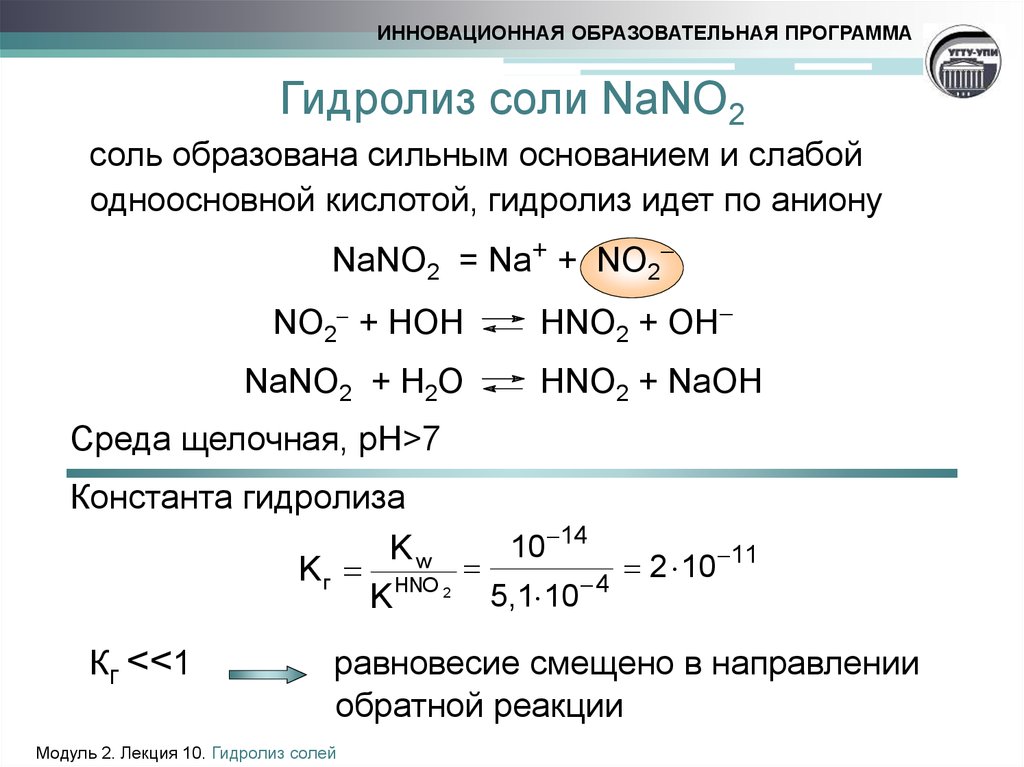
ЗАКЛЮЧЕНИЕ
Экспериментальные результаты данной работы позволяют утверждать, что направление и эффективность химической деградации энергии электронного возбуждения неорганических многоатомных частиц в твердой фазе определяются симметрией возбужденного состояния и структурой кристалла.
Работа поддержана грантами президентской программы поддержки ведущих научных школ (грант НШ-20.2003.3), ФЦП «Интеграция» (проект Б-0021), программы «Университеты России» (проект УР.06.01.007).
СПИСОК ЛИТЕРАТУРЫ
1. Невоструев В.А. // Изв. АН Латв.ССР. Сер. Физ. 1987. N 5. С.81-88.
2. Дзюбенко Ф.А., Журавлев Ю.Н., Колесников Л.В., Поплавной А.С.// Журн.прикл.спектр. 1988. Т.49. N2. С.337.
3. Vinogradov A.S., Akimov V.N. // Phys. Low-Dim. Struct. 1994. N 4/5. P.63-68.
4. Anan’ev V., Miklin M. // Optical Materials. 2000. V.14, №4. P.303-311.
5. Юрмазова Т.А., Коваль Л.Н., Сериков Л.В. // Хим.высок. энерг. 1983. Т.17. N2. С.151-154.
6. Миклин М.Б., Кригер Л. Д., Ананьев В.А., Невоструев В.А. // Хим. высок. энерг. 1989. Т.23. N6. С.506-509.
Д., Ананьев В.А., Невоструев В.А. // Хим. высок. энерг. 1989. Т.23. N6. С.506-509.
7. Ананьев В.А., Власкин В.А., Кригер Л.Д., М.Б. Миклин // Химия высоких энергий, 1997. Т.31. N2. С.114-117.
8. Edwards J.O., Plumb R.C. // Progr. Inorg. Chem. V.41. P.599-635.
9. Уильямс У.Дж. Определение анионов. М.: Химия, 1982, с.145.
10. Papee H.M., Petriconi G.L. // Nature. 1964. V.204. N1. P.142-144.
11. Petriconi G.L., Papee H. M. // J. Inorg. Nud. Chem. 1968. V. 30. № 9. P. 1525-1535.
12. Невоструев В.А. // Хим.высок.энерг. 1986. Т.20. №5. С.425-429.
13. Fermor J.H., Kjekshus A. // Acta Chem. Scand. 1973. V.27. P.915-923.
14. Kawashima R., Katsuki K., Suzuki K. // Phys.Stat.Sol.(b). 1985. V. 129. N2. P.697-705.
15. Terauchi H., Yamada Y.// J.Phys.Soc.Japan. 1972. V.33. P.446-454.
16. Йиргена Т.С., Бугаенко Л.Т., Тиликс Ю.Е.// Хим. высок. энерг. 1981. Т.15. №5. С.422-425.
17. Беленькая Е.Н., Кириллов С.А., Агулян-ский А.И. // Теор.эксперим. химия. 1977. Т.13. №4. С.512-517.
химия. 1977. Т.13. №4. С.512-517.
Изомеризация и диссоциация пероксонитрит иона при растворении кристаллического нитрата калия, облученного светом длиной волны 253. 7 нм Текст научной статьи по специальности «Химические науки»
УДК 541.14
ИЗОМЕРИЗАЦИЯ И ДИССОЦИАЦИЯ ПЕРОКСОНИТРИТ ИОНА ПРИ РАСТВОРЕНИИ КРИСТАЛЛИЧЕСКОГО НИТРАТА КАЛИЯ, ОБЛУЧЕННОГО СВЕТОМ ДЛИНОЙ ВОЛНЫ 253.7 НМ
Е. П. Дягилева, М. Б. Миклин
ISOMERIZATION AND DISSOCIATION OF THE PEROXYNITRITE ION FORMED BY DISSOLVING CRYSTALLINE POTASSIUM NITRATE IRRADIATED WITH 253.7 NMLIGHT
E. P. Dyagileva, M. B. Miklin
Работа выполнена при поддержке государственного задания № 2015/64.
Показано, что наведенный фотолизом пероксонитрит в нитрате калия устойчив после растворения в сильнощелочных растворах (рН > 13). При повышении рН растворения образцов от 10.5 до 14 отмечается увеличение устойчивости пероксонитрита. Растворение образцов в диапазоне рН 3 — 14 приводит к потерям пероксонитрита в разной степени, причем в интервале рН 6 ~ 13. ) и ее аниону — пероксонитрит иону (ONOO-). Это связано с установлением его важной роли в физиологических процессах (дыхании, регуляции кровяного давления, росте опухолевых клеток и др.), химии атмосферы (как компонента фотохимического смога, полярных атмосферных облаков) и природных вод [1]. Пероксонитрит в живых клетках образуется в результате взаимодействия монооксида азота Ш-с супероксид-анион радикалом О2—[1 — 4]. Образуясь в биологических системах, пероксонитрит оказывает на них повреждающее действие: окисляет липиды и белки, участвует в реакциях нитрования аминокислот и ферментов в присутствие катализаторов, 0N00- про-тонируется при физиологических условиях с последующим гомолизом до высокоактивных гидроксиль-ных радикалов и оксида азота и др. [1].
) и ее аниону — пероксонитрит иону (ONOO-). Это связано с установлением его важной роли в физиологических процессах (дыхании, регуляции кровяного давления, росте опухолевых клеток и др.), химии атмосферы (как компонента фотохимического смога, полярных атмосферных облаков) и природных вод [1]. Пероксонитрит в живых клетках образуется в результате взаимодействия монооксида азота Ш-с супероксид-анион радикалом О2—[1 — 4]. Образуясь в биологических системах, пероксонитрит оказывает на них повреждающее действие: окисляет липиды и белки, участвует в реакциях нитрования аминокислот и ферментов в присутствие катализаторов, 0N00- про-тонируется при физиологических условиях с последующим гомолизом до высокоактивных гидроксиль-ных радикалов и оксида азота и др. [1].
Для изучения взаимодействия пероксонитрит иона с различными биомишенями его синтезируют в водных щелочных растворах [1; 2]. Получение пероксонитрита также возможно в твердой фазе, например, в результате фотолиза кристаллических нитратов [5 — 8].
Согласно данным квантово-механических расчетов, приведенных в работе [9], пероксонитрит ион -плоская молекула, которая может существовать в виде цис- и транс-изомеров, причем цис-изомер энергетически наиболее выгоден. Существование двух изомеров возможно за счет наличие частичного п-связы-вания для связи N-O [10].
Установлено, что пероксонитрит ион, полученный в водном растворе, существует в виде цис-изомера, максимум поглощения пероксонитрит иона приходится на 302 нм [11]. В работах [12 — 14] сделан вывод о том, что цис-пероксонитрит ион устойчив при рН среды более 10; а при рН ~ 2.2 при температуре 5 °С осуществляется ~ 99 % изомеризация пероксонитрит иона в нитрат ион [12].
В работе [2] сделано предположение, что пероксо-нитрит в клетках образуется в виде транс-изомера.
Таким образом, вопрос о конформациях пероксонит-рита является весьма актуальным. Одна из причин -сложности, возникающие при объяснении механизмов взаимодействия биологических мишеней и пероксо-нитрита при физиологических условиях. Например, известно [2], что пероксонитрит ион, синтезированный в сильнощелочном растворе, взаимодействует с СО2 (в диапазоне рН от 5 до 11, при 22°С) с образованием нестабильного нитрозопероксикарбоната, который нитрует тирозин с образованием 3-нитротирози-на. Однако, данные процессы отсутствуют, если пе-роксонитрит, образован в результате взаимодействия NO с О2—при физиологических условиях (рН 7.4, 38 °С). Для объяснения причины отсутствия указанных реакций авторы работы сделали следующие предположения: в первом случае, продуктом синтеза является цис-пероксонитрит (рКа 6.8), который участвует в реакциях; во втором случае, продуктом является транс-пероксонитрит, рКа которого равен 8.0, поэтому при рН 7.4 происходит протонирование транс-перокснитрит иона с образованием транс-кислоты, которая не взаимодействует с СО2 и, соответственно, нитрование аминокислоты не происходит.
Например, известно [2], что пероксонитрит ион, синтезированный в сильнощелочном растворе, взаимодействует с СО2 (в диапазоне рН от 5 до 11, при 22°С) с образованием нестабильного нитрозопероксикарбоната, который нитрует тирозин с образованием 3-нитротирози-на. Однако, данные процессы отсутствуют, если пе-роксонитрит, образован в результате взаимодействия NO с О2—при физиологических условиях (рН 7.4, 38 °С). Для объяснения причины отсутствия указанных реакций авторы работы сделали следующие предположения: в первом случае, продуктом синтеза является цис-пероксонитрит (рКа 6.8), который участвует в реакциях; во втором случае, продуктом является транс-пероксонитрит, рКа которого равен 8.0, поэтому при рН 7.4 происходит протонирование транс-перокснитрит иона с образованием транс-кислоты, которая не взаимодействует с СО2 и, соответственно, нитрование аминокислоты не происходит.
Конформация пероксонитрит иона, образующегося при фотолизе кристаллических нитратов -вопрос, который пока не имеет однозначного ответа.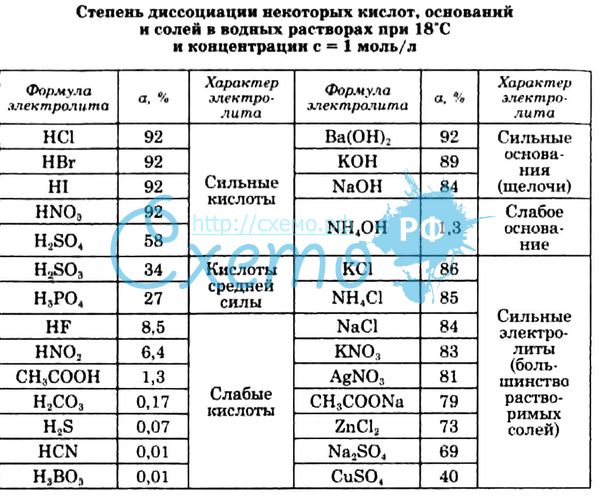 В работе [15] сделано предположение, что при фотолизе кристаллических щелочных нитратов наиболее вероятным является образование транс-изомера пе-роксонитрит иона, поскольку прямое образование цис-изомера из электронно-возбужденного нитрат иона в плотноупакованной кристаллической решетке нитратов требует значительных энергетических затрат. Сравнение квантово-механических расчетов [16] и экспериментальных данных [17] о положениях частот колебаний в ИК и КР спектрах пероксонитрита привели авторов [17] к заключению об образовании при фотолизе твердого нитрата калия цис-изомера пероксонитрита.
В работе [15] сделано предположение, что при фотолизе кристаллических щелочных нитратов наиболее вероятным является образование транс-изомера пе-роксонитрит иона, поскольку прямое образование цис-изомера из электронно-возбужденного нитрат иона в плотноупакованной кристаллической решетке нитратов требует значительных энергетических затрат. Сравнение квантово-механических расчетов [16] и экспериментальных данных [17] о положениях частот колебаний в ИК и КР спектрах пероксонитрита привели авторов [17] к заключению об образовании при фотолизе твердого нитрата калия цис-изомера пероксонитрита.
Сложность изучения химических реакций ONOOH и ONOO- связана с их высокой реакционной способностью, разнообразием путей превращения, влиянием на скорость реакций и механизмы распада многих факторов: кислотность среды, температура, наличие комплексов металлов и углекислого газа, присутствие органических соединений, концентрация ONOO- [12, 18].
Целью настоящей работы является исследование влияния рН растворения облученных кристаллических образцов нитрата калия на стабильность и пути превращения пероксонитрит иона в растворе.
Экспериментальная часть
Фотолиз нитратов. В работе использовали нитрат калия марки «х. ч.», трижды перекристаллизовын-ный из бидистиллята. Полученные кристаллы измельчали в фарфоровой ступке, помещали тонким слоем в чашку Петри и облучали нефильтрованным светом ртутной лампы низкого давления с длиной волны 253.7 нм при периодическом перемешивании. Интенсивность излучения составила 1.6-1015 квангсм-2-с-1.
Определение пероксонитрит ионов. Концентрацию ионов определяли спектрофотометрически, метод основан на взаимодействии пероксонитрит иона с иодидом калия [19].
Определение зависимости выхода пероксонитрит ионов от рН растворения. Навеску облученного нитрата (0.2 г) вносили в колбу вместимостью 25 мл, содержащую 3 мл растворителя — HCl или KOH заданной концентрации, и растворяли в течение 3 минут, затем добавляли смесь (5 мл 5 % KI, 10 мл фосфатного буфера рН 6.86, 3 мл нейтрализатора определенной концентрации). Раствор доводили до метки, перемешивали и через 15 минут фотометрировали относительно «холостой» пробы при 355 нм. бензол-сульфокислоты равен (23500 ± 700) М-1 •см-1.
бензол-сульфокислоты равен (23500 ± 700) М-1 •см-1.
Регистрация УФ спектров. Спектры регистрировали на спектрофотометре «ShimadzuUV-1700». Для этого навеску (0.2 г) облученного нитрата, помещали в колбу, содержащую 15 мл 0.1 М KOH, и проводили измерения. Регистрацию спектров поглощения проводили только после полного растворения облученных образцов и окончания газовыделения из раствора.
Контроль среды проводили с помощью рН-метра «рН-340» (рабочий электрод — стеклянный ЭСЛ 43-07, электрод сравнения — хлорсеребряный).
Все эксперименты выполнены при комнатной температуре.
Результаты эксперимента На рис. 1 показаны результаты химического определения пероксонитрит ионов в растворах, полученных после растворения облученных образцов нитрата калия при различных значениях рН растворения. Как видно, до рН < 10 пероксонитрит в растворе не регистрируется. При рН > 10.5 концентрация пероксонит-рита резко возрастает. При рН ~ 14 его концентрация приближается к значению, определенному в условиях методики [19] с иодидом калия в буферированном растворе. В работе [19] показано, что для получения корректных результатов следует проводить химическое определение пероксонитрита с применением «быстрых» реакций, подобных реакции с иодидом.
В работе [19] показано, что для получения корректных результатов следует проводить химическое определение пероксонитрита с применением «быстрых» реакций, подобных реакции с иодидом.
Зависимости выхода пероксонитрита от рН растворения при введении нитрат бария до конечной концентрации в растворе 5-10-4 М и этилендиаминтет-раацетат натрия до концентрации 3-10-3 М представлены на рис. 1.
4.0 3.5
.с
С 3.0 о 2
„ — 2.5 о
iL 2.0 о
о 1.5
О
1.0 0.5 0.0
Ü
Ü
U
ЧН
2 4 6
10
12
РН
Рис. 1. Зависимость выхода пероксонитрит ионов от рН растворения облученных образцов нитрата
калия (◊ — с добавками этилендиаминтетрааце-тата натрия, о — с добавками нитрата бария, ■ -без добавок, пунктир — концентрация пероксонитрит ионов, определенная в условиях методики) [19]
На рис. 2 приведена зависимость выхода нитрит ионов от рН растворения облученных образцов нитрата калия. Как нам видится, наблюдается значительный разброс полученных экспериментальных данных в диапазоне рН растворения от 6. 5 до 12. Наибольшее увеличение концентрации нитрит ионов наблюдается в диапазоне рН 10 — 11, при рН более 11 концентрация нитрит ионов уменьшается.
5 до 12. Наибольшее увеличение концентрации нитрит ионов наблюдается в диапазоне рН 10 — 11, при рН более 11 концентрация нитрит ионов уменьшается.
На рис. 3 показана полоса поглощения, обусловленная пероксонитритом, полученная при растворении облученного нитрата калия при рН 13. Максимум поглощения пероксонитрита приходится на 302 нм, что характерно для цис-изомера.
Результаты исследования кинетики пероксонит-рита показывают, что только в сильнощелочных растворах (рН 13, 14) он устойчив в течение часа; при растворении облученных образцов при значениях рН < 13 наблюдается уменьшение интенсивности полосы поглощения (рис. 4).
Рис. 2. Зависимость выхода нитрит ионов от рН растворения облученных образцов нитрата калия (пунктир — концентрация нитрит иона, определенная в условиях методики) [20]
Рис. 3. Полоса поглощения, обусловленная пероксо-нитритом (растворение облученного нитрата калия в растворе при рН 13)
Рис. 4. Кинетические кривые убыли пероксонитрита при выдержке облученных образцов в растворах с разным значением рН среды: 1) 11, 2) 11.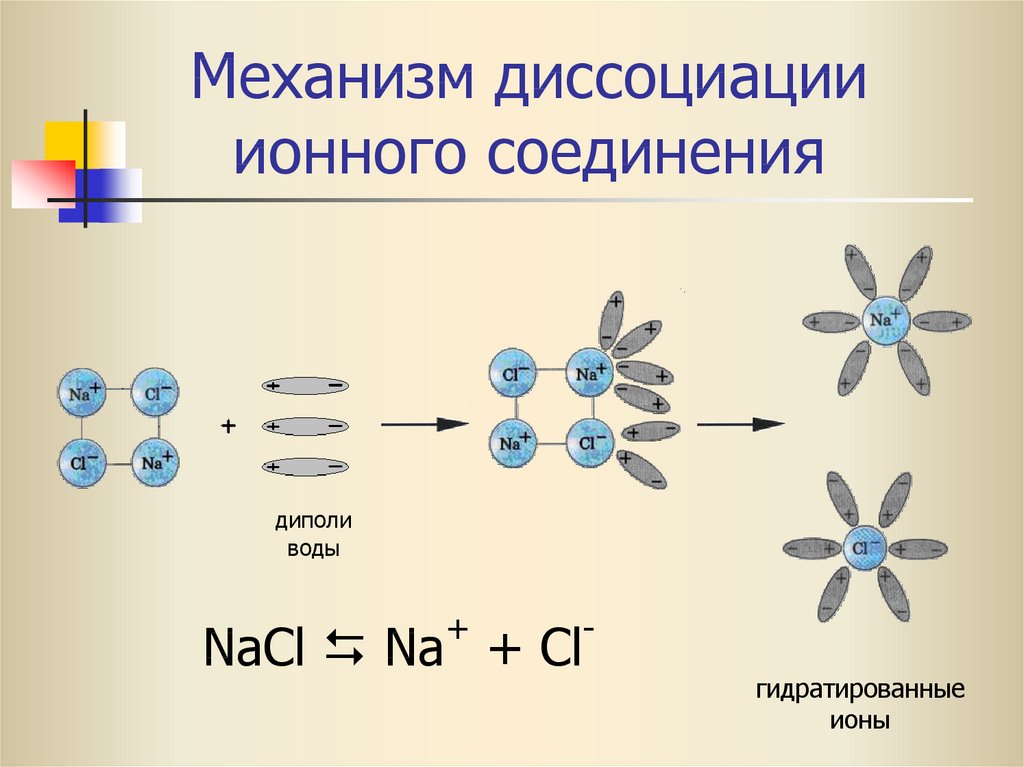 5, 3) 11.8, 4) 13, 5) 14
5, 3) 11.8, 4) 13, 5) 14
Обсуждение результатов
Из экспериментальных результатов, приведенных на рис. 1, видно, что потери пероксонитрита происходят даже при растворении в сильнощелочных растворах. Предполагаемые причины разложения и/или изомеризации пероксонитрита в условиях данного эксперимента при рН > 12 могут быть связаны с выделением теплоты при проведении реакции нейтрализации сильнощелочных растворов соответствующими количествами кислоты. Другой возможной причиной, влияющей на поведение пероксонитрита в растворе могут
быть конкурирующие реакции, а именно СО2 — катализируемая изомеризация пероксонитрита (рН независимая реакция, k = 3-104 М-1 •с-1 [18]) и его изомеризация в присутствии ионов тяжелых J-металлов в нитрат ион [21]. Совокупность экспериментальных данных, приведенных на рис. 1, позволяет сделать вывод о том, что при определении пероксонитрита с применением методики с иодидом калия [19] эти факторы не оказывают влияния на скорость процессов разложения и/или изомеризации.
Данные приведенные на рис. 2 показывают, что наибольшее увеличение концентрации нитрита на-блююдается при рН ~ 10, что, очевидно, обусловлено высокой степенью разложения пероксонитрита до нитрита и молекулярного кислорода. Если растворение образцов проводить при рН менее 6, то пероксонитрит не дает вклада в анализ на нитрит ион, так как, по-видимому, практически полностью переходит в нитрат ион, как и в случае изомеризации цис-изомера перок-сонитрит иона в аналогичных условиях [21]. При рН более 10.5 концентрация нитрит ионов уменьшается, вероятно, это связано с увеличением стабильности пе-роксонитрита в этих условиях.
Экспериментально полученная рН зависимость при определении выхода пероксонитрита в облученных образцах нитрата калия, приведенная на рис. 1, смещена относительно экспериментально полученных рН зависимостей для цис-изомера пероксонитрита, приведенных в литературе [17, 22, 23], в более щелочную область. Исходя из данных на рис. 1 и 2, можно примерно оценить значение рКа для пероксоазотистой кислоты — значение находится в диапазоне от 10 до 12. В литературе приводятся следующие значения констант кислотно-основного равновесия: для цис-формы пероксоазотистой кислоты рКа~6.8 [17, 22, 23], и для транс-формы пероксоазотистой кислоты предполагаются значения рКа от 8 и выше [17; 23]. Таким образом, можно предположить, что при фотолизе нитрата калия образуется транс-изомер.
В литературе приводятся следующие значения констант кислотно-основного равновесия: для цис-формы пероксоазотистой кислоты рКа~6.8 [17, 22, 23], и для транс-формы пероксоазотистой кислоты предполагаются значения рКа от 8 и выше [17; 23]. Таким образом, можно предположить, что при фотолизе нитрата калия образуется транс-изомер.
По-нашему мнению, наблюдаемый сдвиг выхода пероксонитрита от рН растворения облученных образцов в щелочную область (рис. 1), примерно оцененное значение рКа и наблюдаемый максимум поглощения пероксонитрита при 302 нм (рис. 3), можно объяснить образованием транс-изомера пероксонитрита при фотолизе нитратов щелочных металлов, который переходит в цис-изомер при растворении облученных образцов. Возможный механизм, происходящий при растворении облученного нитрата калия, можно представить следующими процессами:
N03 + hv —> trans-ONOO- — облучение, ( 1 )
trans-ONOO- —> eis- ONOO» — растворение, (2) trans-ONOO» + H+ trans-ONOOH, (3)
trans-ONOO HN03. (4)
(4)
Однако в настоящее время теоретические или экспериментальные значения констант скорости реакции не установлены.
Заключение
Совокупность экспериментальных данных, полученных в настоящей работе, позволяет сделать предположение, что при фотолизе нитрата калия наиболее вероятным является образование транс-изомера перок-сонитрита, который при растворении облученных образцов нитрата изомеризуется в цис-изомер. Устойчи-
вость транс-пероксонитрита ниже по сравнению с устойчивостью цис-пероксонитрита, так как трансизомер начинает гибнуть в растворе при рН < 13, а цис-изомер — при рН < 10 [12 — 14]. Очевидно, что цис- и транс-изомеры пероксонитрита в растворах различной кислотности проявляют различную реакционную спо-
собность. Это весьма важно и может использоваться при обсуждении механизмов реакций пероксонитрита с различными биологическими молекулами, протекающих в физиологических условиях, поскольку при их установлении активно рассматривают реакции с участием как цис-, так и транс- изомеров пероксонитрита.
Литература
1. Лобачев В. Л., Рудаков Е. С. Химия пероксинитрита. Кинетика и механизм реакций // Успехи химии. 2006. Т. 75. № 5. С. 422 — 444.
2. Pfeiffer S., Mayer B. Lack of Tyrosine Nitration by Peroxynitrite Generated at Physiological pH // J. Biolog. Chem. 1998. V. 273. № 42. P. 27280 — 27285.
3. Khan A. U., Kovacic D., Kolbanovskiy A. [et al.]. The decomposition of peroxynitrite to nitroxyl anion (NO-) and oxygen in aqueous solution // PNAS. 2000. V. 97. № 7. P. 2984 — 2989.
4. Jourd’heuil D., Jourd’heuil F. L., Kutchukian P. S. Reaction of Superoxide and Nitric Oxide with Peroxynitrite //J. Biolog. Chem. 2001. V. 276. № 31. P. 28799 — 28805.
5. Ананьев В. А., Миклин М. Б., Власкин В. А., Кригер Л. Д. Фотолиз нитратов щелочных металлов // Химия высоких энергий. 1997. Т. 31. № 2. С. 114 — 117.
6. Кригер Л. Д., Миклин М. Б., Дягилева Е. П., Ананьев В. А. Фотолиз нитратов щелочно-земельных металлов // Журнал физической химии. 2013. Т. 87. № 2. ppenol W. H. Product Distribution of Peroxynitrite Decay as a Function of pH, Temperature, and Concentration // J. Am. Chem. Soc. 2002. V. 124. № 2. P. 234 — 239.
ppenol W. H. Product Distribution of Peroxynitrite Decay as a Function of pH, Temperature, and Concentration // J. Am. Chem. Soc. 2002. V. 124. № 2. P. 234 — 239.
13. Logager T., Sehested K. Formation and Decay of Peroxynitrous Acid: A Pulse Radiolysis Study // J. Phys. Chem. 1993. V. 97. P. 6664 — 6669.
14. Beckman J. S., Beckman T. W., Chen J. [et al.]. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide // Proc. Natl. Acad. Sci. USA. 1990. V. 87. P. 1620 — 1624.
15. Миклин М. Б., Невоструев В. А. О механизме образования и конформациях пероксонитрита // Журнал научной и прикладной фотографии. 2002. Т. 47. № 5. С. 3 — 7.
16. Liang В., Andrews L. Infrared Spectra of cis- and trans-Peroxynitrite Anion, OONO-, in Solid Argon // J. Am. Chem. Soc. 2001. V. 123. № 40. P. 9848 — 9854.
17. Tsai J. H. M., Harrison J. G., Martin J. C. [et al.]. Role of Conformation of Peroxynitrite Anion (ONOO-) with Its Stability and Toxicity // J. Am. Chem. Soc. 1994. V. 116. № 9. P. 4115 — 4116.
Am. Chem. Soc. 1994. V. 116. № 9. P. 4115 — 4116.
18. Lymar S. V., Hurst J. K. Rapid Reaction between Peroxonitrite Ion Carbon Dioxide: Implication of Biological Activity // J. Am. Chem. Soc. 1995. V. 117. № 34. P. 8867 — 8868.
19. Шрайбман Г. Н., Дягилева Е. П., Скибина А. В. Спектрофотометрические методики определения пероксонитрита и нитрита // Вестник КемГУ. 2011. № 1(45). С. 200 — 206.
20. Уильямс У. Дж. Определение анионов. М.: Химия, 1982. 148 с.
21. Plumb R. C., Edwards J. O. Problem of Concurrent Measurements of Peroxonitrite and Nitrite Contents // Analyst. 1992. V. 117. P. 1639 — 1641.
22. Koppenol W. H. The basic chemistry of nitrogen monoxide and peroxynitrite // Free Radic. Biol. Med. 1998. V. 25. № 4/5. P. 385 — 391.
23. Crow J. P., Spruell C., Chen J. [et al.]. On the pH-dependent yield of hydroxyl radical products from peroxynitrite // Free Radical Biol. Med. 1994. V. 16. P. 331 — 338.
Информация об авторах:
Дягилева Елена Павловна — кандидат химических наук, доцент кафедры физической, коллоидной, аналитической и органической химии КемГМА, dyagilevaep@mail. ru.
ru.
Elena P. Dyagileva — Candidate of Chemistry, Assistant Professor at the Department of Physical, Colloidal, Analytical and Organic Chemistry, Kemerovo State Medical Academy.
Миклин Михаил Борисович — кандидат химических наук, старший научный сотрудник кафедры физической химии КемГУ, [email protected].
Mikhail B. Miklin — Candidate of Chemistry, Senior Research Associate at the Department of Physical Chemistry, Kemerovo State University.
Статья поступила в редколлегию 21.09.2015 г.
термодинамика — Какова система и окружение при растворении нитрата натрия в воде?
спросил
Изменено 3 года, 10 месяцев назад
Просмотрено 2к раз
$\begingroup$
Когда нитрат натрия ($\ce{NaNO3}$) растворяется в воде при комнатной температуре, раствор остывает.
$\Delta H$ положительна, так как в процессе в систему поступает тепло.
Хотя я думал, что если вода остынет, то вода будет окружающей средой, так как теплота отбирается из воды в растворе для растворения $\ce{NaNO3}$, однако мой профессор сказал:
Система — калориметр и его содержимое, включая все вода/ $\ce{NaNO3}$. Окружение — это все, что находится за пределами калориметра (комната и т. д.)
Тут я немного запутался.
Почему тепло поступает в систему, если вода является частью системы?
- термодинамика
- энергия
$\endgroup$
5
$\begingroup$
Это основной принцип охлаждения системы. например, когда вода охлаждается в глиняном кувшине, тепло берется из воды, кувшина и атмосферы для преобразования поверхностных молекул в пары.
$\endgroup$
2
$\begingroup$
Система и окружение — обозначения, помогающие упростить вселенную. Есть вещи, на которых нужно сосредоточиться, и детали, которые нужно игнорировать. Это, соответственно, очень грубые определения того, что такое система и окружение.
С химической точки зрения интерес представляет система, в которой происходит химия. Растворение – это процесс, происходящий при взаимодействии растворенного вещества и растворителя. Поэтому было бы ошибкой рассматривать растворенное вещество или растворитель только при изучении процесса растворения. По крайней мере, оба этих компонента должны быть в системе.
Окружение обычно считается достаточно большим, чтобы быть более или менее фиксированным или неизменным. Тем не менее, если есть тепло, переданное в окружающую среду или из нее, даже если это не может изменить температуру окружающей среды, это изменит энтропию.
Для калориметрии необходимо ограничить теплопередачу, чтобы можно было точно измерить изменение энтальпии системы. Калориметр помогает сделать это, но теперь он является теплоотводом, и его необходимо учитывать в ваших расчетах. Поскольку его температура значительно меняется, его следует включать не в окружение, а как часть системы.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie

помогите! мне нужно знать, как сделать это на тесте!
Химия
Ботан Н.
спросил 26.11.15С веществом, изначально нагретым до 20,00°С, 5,00 г твердого нитрата натрия растворили в 100,0 г воды в калориметре, и температура полученного раствора составила 14,80°С. Удельная теплоемкость водного раствора составила 4,20 Дж/ г Кл, теплоемкость калориметра 40,0 Дж/Кл.
а. напишите химическое уравнение растворения твердого нитрата натрия в воде
(это 2NaNO3 (водн.) + h3O —>
b. Было ли растворение нитрата натрия в воде эндотермическим, экзотермическим, ни то, ни другое или не может быть определено? обоснуйте свой выбор
(является ли он эндотермическим? т.к. вы добавляете тепло для его растворения? )
c. рассчитать изменение энергии на моль нитрата натрия при растворении твердого нитрата натрия в воде
понятия не имею. …
…
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Автор: ЛучшиеНовыеСамыеСтарые
Джордж А. ответил 27.11.15
Репетитор
4,8 (10)
Детально ориентированный, терпеливый репетитор по математике, химии, программированию
Смотрите таких репетиторов
Смотрите таких репетиторов
а) NaNo3 не реагирует с водой, а растворяется и ионизируется подобно (NaCl)
NaNO3 —> Na+ + NO3-
б) Он эндотермический, так как температура снижается.
c)
молекулярная масса NaNO3 составляет 85 г
Соответствующее уравнение для изменения теплоты:0005
, где q — теплота, m — масса, c — удельная теплоемкость, t — температура.

 $\Delta H$ положительна, так как в процессе в систему поступает тепло.
$\Delta H$ положительна, так как в процессе в систему поступает тепло.
Leave A Comment