16-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А6 ЕГЭ по химии —
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Темы, которые нужно знать:
Давайте определим свойства веществ молекулярного строения и немолекулярного.
| Вещества молекулярного строения | Вещества немолекулярного строения |
|
|
Типы кристаллических решеток
- Ионная кристаллическая решетка — характерна для соединений с ионной связью, в узлах решетки находятся, соответственно, ионы. Связи очень прочные, поэтому и температуры плавления высокие. Ее образуют неорганические
- Атомная кристаллическая решетка — связь — ковалентная, очень прочная. Примером может служить алмаз — вещество, имеющее максимальный показатель твердости, очень низкая растворимость, малореакционноспособны.
Характерна для B, Si, Ge, силициды (Si4- ), карбиды и нитриды бора, SiO2 - Молекулярная кристаллическая решетка — состоит из молекул, которые удерживаются между собой межмолекулярными связями, поэтому они непрочные — низкие температуры плавления, неэлектропроводны. Молекулярную кристаллическую решетку имеют все твердые вещества с полярной или неполярной ковалентной связью: J
- Металлическая кристаллическая решетка — в узлах содержит атомы и ионы металлов. Очень прочная металлическая связь со всеми характерными свойствами: делокализованное электронное облако, электро- и теплопроводность, металлический блеск, пластичность, ковкость.
Получается, что металлическая и атомарная кристаллические решетки схожи, но есть основное отличие — вещества с металлической решеткой проводят электрический ток и пластичны.
Для определения типа кристаллической решетки необходимо сначала определить — имеет вещество молекулярное или немолекулярное строение, затем уже определить вид химической связи и по нему уже выбирать вариант решетки.
Еще на эту тему:
Обсуждение: «Молекулярное и немолекулярное строение»
(Правила комментирования)Существуют вещества с молекулярным и немолекулярным строением.
Между молекулами возникают силы взаимного притяжения и отталкивания. Наиболее выражены эти силы в твёрдых веществах, а наименее — в газах.
Силы взаимодействия между молекулами слабые, поэтому молекулярные вещества летучи, имеют низкие температуры плавления и кипения. Все газообразные и жидкие при обычных условиях вещества состоят из молекул. Молекулярные вещества могут быть и твёрдыми, но узнать их можно по легкоплавкости.
Обрати внимание!
Газы, жидкости и легкоплавкие твёрдые вещества имеют молекулярное строение.
Все вещества, имеющие запах, имеют молекулярное строение.
Атомы могут соединяться друг с другом и другим способом. Так, в кристаллах алмаза, графита, песка все атомы соединены в единое целое, и молекулу выделить в них невозможно.

Строение алмаза
Подобное строение имеют железо, медь, цинк, алюминий и другие металлы.
В некоторых сложных веществах атомы превращаются в заряженные частицы — ионы — и тоже молекул не образуют. Противоположно заряженные ионы притягиваются друг к другу и образуют твёрдое тугоплавкое вещество. Такое строение имеют поваренная соль, мел, питьевая сода, медный купорос, щёлочь.
Строение поваренной соли
Такие вещества называют немолекулярными
Оглавление
- Молекулярное и немолекулярное строение веществ
- Твердые вещества: аморфные и кристаллические
- Атомные кристаллические решетки
- Молекулярные кристаллические решетки
- Металлические кристаллические решетки
- Шпаргалки
- Задания для самопроверки
Молекулярное и немолекулярное строение веществ. Строение вещества
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения. Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl
Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).Атомные кристаллические решетки
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Металлическая кристаллическая решеткаШпаргалки
Взаимосвязь между типом кристаллической решетки и типом связи в веществеСправочный материал для прохождения тестирования:
Таблица Менделеева Таблица растворимостиСтроение веществ » HimEge.ru
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществ
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2S04), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, КОН). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: кристаллические и аморфные
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки
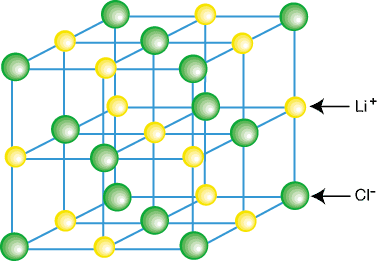
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Сl—, так и сложные S042-, ОН—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl—, образующих решетку в форме куба.
Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки
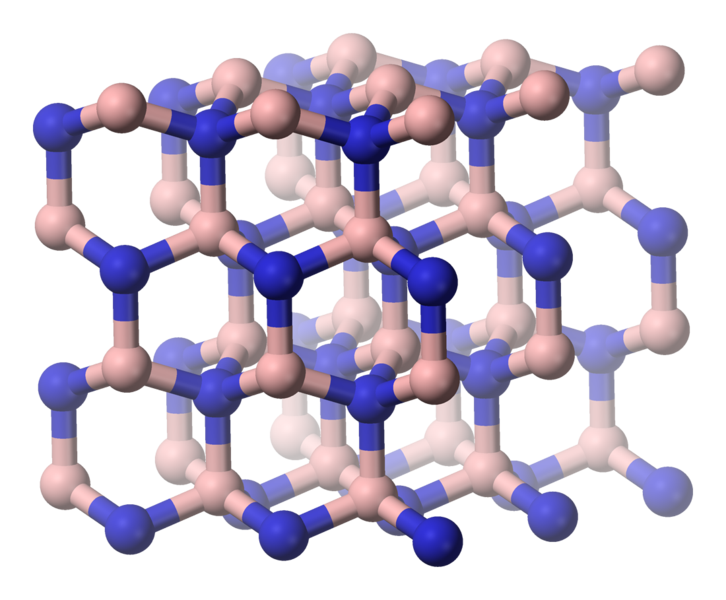
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
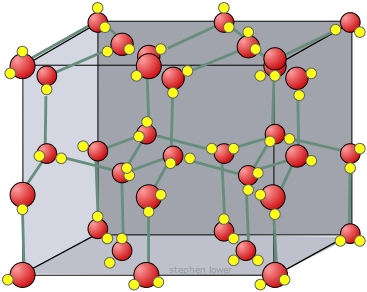
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.
Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н2O), и неполярными (N2, О2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки.
Металлическая кристаллическая решетка
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Видеоурок: Типы кристаллических решёток
Лекция: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
 Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества
По строению химические вещества делятся на две группы: те, которые состоят из молекул называются молекулярными, а содержащие атомы и ионы – немолекулярными.
Молекулярные вещества имеют низкие t плавления/кипения. Они могут находится в трех агрегатных состояниях: жидком, твердом, газообразном. К этой группе относятся большинство простых веществ неметаллов, а также их соединений друг с другом. Связи между атомами молекулярных веществ являются ковалентными.
Немолекулярные вещества имеют высокие t плавления/кипения. Находятся в твердом состоянии. Это, как вы догадались, простые вещества металлы, их соединения с неметаллами, из неметаллов относятся бор, углерод – алмаз, фосфор (черный и красный), кремний. Немолекулярные вещества образуют ионные, атомные, молекулярные кристаллы, расположение частиц которых имеет четкую последовательность и образует решетку.
 Типы кристаллических решеток
Типы кристаллических решетокСуществуют четыре типа кристаллических решеток, зависящих от располагающихся в узлах решетки типов частиц:
1) Ионная кристаллическая решетка характерна для соединений с ионным типом химической связи. В узлах решетки располагаются катионы и анионы. Примерами веществ с данным типом кристаллической решетки являются соли, оксиды и гидроксиды типичных металлов. Это твердые, но хрупкие вещества. Им свойственна тугоплавкость. Растворяются в воде и обладают электропроводностью.
2) Атомная решетка имеет в узлах атомы. Частицы образуют ковалентную неполярную и полярную связи. Из простых веществ данный тип кристаллической решетки принадлежит углероду в состоянии графита и алмаза, бору, кремнию, германию. Из сложных веществ атомной решеткой обладают, к примеру, оксиду кремния (кварц, горный хрусталь). Это очень твердые тугоплавкие вещества, мало распространенные в природе. Не растворяются в воде.
3) Молекулярная кристаллическая решетка образуется молекулами, удерживаемые слабыми силами межмолекулярного притяжения. Поэтому вещества данного типа решетки отличаются малой твердостью, непрочностью и низкими t плавления. К примеру, это вода в ледяном состоянии. Большинство твердых органических соединений имеют этот тип решетки. Тип связи в соединении – ковалентная.

4) Металлическая. В узлах расположены атомы и катионы металла. Это металлы и их сплавы, соединения с металлической связью. А, как известно, атомы металла легко расстаются со своими электронами на внешнем уровне. Поэтому такой тип решетки определяет пластичность и ковкость веществ.
Главный критерий природы – разнообразие. Оно поражает и заставляет задуматься: почему вокруг так много веществ, различных по своему строению и свойствам? Ответ лежит в области элементарных частиц, из которых они состоят. Молекулы, атомы или ионы — это те кирпичики, из которых склеены соединения, составляющие основу проявленного мира. Наша статья будет посвящена особенностям свойств веществ молекулярного и немолекулярного строения, а примеры, которые мы приведем, проиллюстрируют их.
Самый дорогой и самый твердый
Да, это все о нем, об алмазе. Неважно, украшает он корону английской королевы или служит элементом инструмента для резки бетона, алмаз имеет атомное строение. Строгость и изящество тетраэдрического строения кристалла восхищают. У него каждый атом углерода окружен четырьмя другими атомами, лежащими в направлениях от центра геометрического тела к вершинам. Таким образом возникают четыре сигма-связи. Они и являются причиной исключительной твердости, низкой теплопроводности, отсутствия электропроводности и значительной плотности алмаза.

Аллотропная модификация углерода
Немолекулярное строение имеет вещество, хорошо известное даже школьнику – графит. Вместе с алмазом и карбином он представляет собой одну из аллотропных форм углерода. Стержни карандаша, твелы в атомных реакторах, электроды в гальванической ванне состоят из графита. Жирный на ощупь, темно-серый кристаллический материал со слабым металлическим блеском – он так же, как и алмаз, состоит из атомов углерода. Они собраны в слои, имеющие вид правильных шестиугольников. Пространство кристалла графита заполнено свободно движущимися электронами, создающими электронный газ. Благодаря этому графит, подобно металлам, проводит электрический ток и тепло. Расстояние между слоями вещества составляет примерно 0,335 нм, поэтому они легко отрываются друг от друга, оставляя на поверхности при надавливании чешуйчатый серый след. Описание веществ немолекулярного строения, примеры которых мы привели, подтверждают тот факт, что свойства химических соединений определяются формой их кристаллических решеток и зависят от того, как их атомы, молекулы или ионы соединены между собой.

Парниковый эффект: кто виноват?
Глобальное потепление, с угрюмым упрямством надвигающееся на нашу планету, вызывается по многим причинам. Главная из них, как считают экологи, связана с резким подъемом концентрации таких веществ, имеющих молекулярное строение, как углекислый и угарный газ, в воздушной оболочке Земли. Неполярные молекулы углекислоты имеют линейное строение. В узлах кристаллической решетки находятся электронейтральные частицы – молекулы. Молекулярное кристаллическое строение обуславливает низкую температуру кипения и высокую летучесть соединения.
Вещество включается в важные природные органические циклы, например, служит акцептором в реакциях цикла Кальвина, происходящих в процессе фотосинтеза. При высоких температурах соединение проявляет окислительные свойства и в промышленности цветных металлов применяется для восстановления металлов из их оксидов. Человек применяет углекислый газ во многих сферах: в сахарном производстве, в огнетушителях, а в виде сухого льда – для хранения быстро портящихся пищевых продуктов. Далее мы приведем еще примеры веществ молекулярного строения, играющих ключевые роли в нашей природе.
Источник жизни
Есть ли еще какое-то другое химическое соединение, по значимости сопоставимое с водой? Это колыбель, в которой возникли первые живые объекты, а также основной компонент биосферы, незаменимая химический компонент практически любого биологического объекта. Ее полярные молекулы могут растворить в себе огромное количество различных веществ, а аномальные свойства, такие, как удельная теплоемкость, позволяет воде накапливать и удерживать огромные запасы тепловой энергии.
Это способствует регуляции средних температур на поверхности суши и предотвращает опасность ее резкого переохлаждения в суровые зимы или перегревания летом. В организме животных и человека вода, входящая в состав цитоплазмы клеток, тканевой и межклеточной жидкости, способствует равномерному распределению тепловой энергии межу системами тканей, прежде всего, благодаря кровеносным сосудам. Все важнейшие биохимические процессы, составляющие основу обмена веществ, протекают в водных растворах. Поступление соединений в клетку и удаление продуктов распада происходит также только в растворенном состоянии. Рассмотрим далее еще примеры веществ молекулярного строения.

Сахароза
Рассмотрим пример органического соединения, относящегося к олигосахаридам. Это сахароза, иначе называемая тростниковым, или свекловичным сахаром. Важнейший и всеми любимый продукт питания, обладающий хорошей усваиваемостью и высокой калорийностью. В процессе гидролиза, благодаря ферментам поджелудочного сока, прежде всего амилазе, сахароза расщепляется на молекулы глюкозы и фруктозы. Установлено, что молекулы веществ молекулярного и немолекулярного строения по-разному ведут себя по отношению к поляризованному свету.
Сахароза является оптически активным соединением за счет присутствия в своих молекулах асимметричных атомов углерода. Вещество имеет невысокую температуру плавления -186 ºС, переходя при этом в вид тягучей массы коричневого цвета – карамели. Молекулярная кристаллическая решетка обуславливает и другие свойства сахарозы: низкую температуру кипения, неспособность проводить ток и плохую теплопроводность.

Молекулярная теория строения веществ
Химия как наука имеет свое основание в виде главных законов и постулатов. Созданная М. В. Ломоносовым атомно-молекулярная теория, а также изучение таких явлений, как броуновское движение и диффузия, стали причиной появления целой серии исследований. Они касались изучения строения химических соединений. Опыты Л. Больцмана и Д. Максвелла ускорили появление молекулярной теории строения вещества. Она перекликается с декартовыми представлениями о корпускулярном устройстве мира и положениями теории М. Ломоносова. Так, в ней говорится о том, что материальные объекты имеют атомный, молекулярный или ионный состав, постоянно движутся и в этот момент могут взаимодействовать между собой путем упругих столкновений. В современной науке теория имеет в основном прикладной характер и была использована при становлении таких дисциплин, как статическая механика и физическая кинетика.

Соединения ионного типа
Завершим изучение веществ молекулярного и немолекулярного строения, рассмотрев соединения, чья кристаллическая решетка состоит из ионов.
К ним относятся все соли. Физические свойства: твердость и прочность, одновременно сопутствующие хрупкости, а также способность их растворов проводить электрический ток, обусловлены строением кристаллической решетки. Так, в узлах кристалла поваренной соли находятся разноименно заряженные ионы натрия и хлора. Как раствор, так и расплав вещества хорошо проводит электрический ток и относится к электролитам. Именно поэтому, благодаря направленному движению катионов и анионов, соли являются проводниками второго рода, что подтверждается основными положениями теории электрической диссоциации.
В нашей статье мы рассмотрели строение и свойства веществ молекулярного и немолекулярного строения, а также привели примеры, иллюстрирующие их.
1. Приведите примеры веществ с молекулярным и немолекулярным строением. Как эти вещества различаются по свойствам?
Вещества с молекулярным строением: кислород, азот, йод, вода, спирт, уксусная кислота, сахар, сера…
Молекулярное строение обеспечивает низкие температуры плавления и кипения. Часто такие вещества находятся в газообразном или жидком агрегатном состоянии. Это связано с тем, что молекулы удерживаются рядом друг с другом водородными связями и/или слабыми Ван-дер-Ваальсовыми силами.
Вещества с немолекулярным (атомным, ионным) строением: алмаз, графит, поваренная соль, кварц…
В таких веществах взаимодействие между частицами (атомами, ионами) гораздо сильнее. Поэтому, как правило, они имеют высокие температуры плавления и кипения, нелетучи, находятся в твердом агрегатном состоянии.
2. Обсудите с соседом по парте вопрос, можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное.
Признаки молекулярного строения: низкие температуры плавления и кипения, газообразное или жидкое состояние. Иногда имеют запах.
Признаки немолекулярного строения: высокие температуры плавления и кипения, твердое агрегатное состояние.
3. Какие типы кристаллических решеток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решетки. Составьте схему «Типы кристаллических решеток».
| Кристаллические решетки | ||
| Атомные | Ионные | Молекулярные |
| Алмаз, графит, сажа. | Большинство неорганических солей. Например, поваренная соль. | Йод, сахар, лед (вода). |
4. Углекислый газ при нормальном давлении переходит в твердое состояние при температуре около -70° C, а речной песок (кремнезём) плавится при температуре около 1 700° C. Какие выводы о строении этих веществ в твердом состоянии можно сделать.
Можно спокойно сделать вывод о том, что в твердом агрегатном состоянии углекислый газ имеет молекулярную кристаллическую решетку, а кремнезём — атомную или ионную. См. ответ на вопрос №2.
Тестовые задания
1. Для углекислого газа характерна кристаллическая решетка:
1) молекулярная
2) атомная
3) ионная
Ответ: 1) молекулярная. См. вопрос №4.
2. Установите соответствие между типом кристаллической решетки вещества и его свойствами.
1) молекулярная
2) ионная
3) атомная
А. твёрдое, тугоплавкое, не растворяется в воде
Б. хрупкое, легкоплавкое, не проводит электрический ток
В. твёрдое, тугоплавкое, хорошо растворяется в воде
Ответы: 1) — Б, 2) — В, 3) — А.
— Elsevier
Журнал молекулярной структуры посвящен публикации полнометражных статей и обзорных статей, в которых содержится важная новая структурная информация по всем типам химических веществ, включая:
• Стабильные и нестабильные молекулы во всех типах среды (пар, молекулярный пучок, жидкость, раствор …
Читать далееЖурнал молекулярной структуры посвящен публикации полнометражных статей и обзорных статей, в которых содержится важная новая структурная информация по всем типам химических веществ, включая:
• Стабильные и нестабильные молекулы во всех типах окружающая среда (пар, молекулярный пучок, жидкость, раствор, жидкий кристалл, твердое состояние, матричная изоляция, поверхностное поглощение и т. д.)
• Химические промежуточные продукты
• Молекулы в возбужденных состояниях
• Биологические молекулы
• Полимеры .
Используемые методы могут включать любую комбинацию спектроскопических и неспектроскопических методов, например:
• Инфракрасная спектроскопия (средняя, дальняя, ближняя)
• Рамановская спектроскопия и нелинейные рамановские методы (CARS и т. Д.)
• Электронная абсорбционная спектроскопия
• Оптическая вращательная дисперсия и круговой дихроизм
• Методы флуоресценции и фосфоресценции
• Электронная спектроскопия (PES, XPS), EXAFS и др.
• Микроволновая спектроскопия
• Электронограмма
• Спектроскопия ЯМР и ЭПР
• Мессбауэровская спектроскопия
• Рентгеновская кристаллография
• Анализ плотности заряда
• Вычислительные исследования (в дополнение к экспериментальным методам)
Мы приветствуем публикации, сочетающие теоретические и экспериментальные , Структурная информация, полученная в результате исследований, должна быть соотнесена со свойствами, активностью и / или реакционной способностью исследуемой молекулы, и следует обсудить актуальность этой молекулы и ее последствия.
ВАЖНОЕ ПРИМЕЧАНИЕ: Документы, описывающие рутинные исследования, имеющие незначительное структурное значение (например, рукописи, касающиеся только стеклообразных материалов, характеристики частиц и материалов с использованием методов микроскопии, в которых сообщаются по существу кристаллические данные, сопровождаемые рутинными спектроскопическими исследованиями и / или теоретической структурой анализ, выполненный для изолированных молекул, и обычные спектроскопические исследования для коммерчески доступных соединений) не приемлемы. То же относится и к рукописям, в основном посвященным процедурам синтеза или оценке биологической активности химических веществ.Только теоретические исследования должны быть представлены в вычислительной и теоретической химии.
Скрыть полный Цели и сфера ,физических свойств молекулярных веществ
Размер точки плавления или кипения будет зависеть от силы межмолекулярных сил. Наличие водородной связи поднимет температуры плавления и кипения. Чем больше молекула, тем больше возможностей Ван-дер-Ваальса — и им также потребуется больше энергии, чтобы разрушиться.
Растворимость в воде
Большинство молекулярных веществ нерастворимы (или только очень мало растворимы) в воде.Те, которые растворяются, часто реагируют с водой или способны образовывать водородные связи с водой.
Почему метан, CH 4 , не растворяется в воде?
Метан сам по себе не проблема. Метан — это газ, и поэтому его молекулы уже отделены друг от друга — вода не должна отделять их друг от друга.
Проблема в водородных связях между молекулами воды. Если бы метан растворился, ему пришлось бы пробиться между молекулами воды и таким образом разорвать водородные связи.Это стоит разумного количества энергии.
Единственное возможное притяжение между молекулами метана и воды — гораздо более слабые силы Ван-дер-Ваальса, и при их установке выделяется не так много энергии. Смешивать метан и воду энергетически невыгодно.
Почему аммиак, NH 3 , растворяется в воде?
Аммиак обладает способностью образовывать водородные связи. Когда водородные связи между молекулами воды разрываются, они могут быть заменены эквивалентными связями между молекулами воды и аммиака.
Часть аммиака также реагирует с водой с образованием ионов аммония и ионов гидроксида.
Обратимые стрелки показывают, что реакция не заканчивается. В любой момент времени только около 1% аммиака фактически вступило в реакцию с образованием ионов аммония. Растворимость аммиака в основном обусловлена водородными связями, а не реакцией.
Другие распространенные вещества, которые легко растворимы в воде, потому что они могут водородно связываться с молекулами воды, включают этанол (спирт) и сахарозу (сахар).
Растворимость в органических растворителях
Молекулярные вещества часто растворимы в органических растворителях, которые сами являются молекулярными. Как растворенное вещество (вещество, которое растворяется), так и растворитель, вероятно, имеют молекулы, притягиваемые друг к другу силами Ван-дер-Ваальса. Хотя эти влечения будут нарушены, когда они смешиваются, они заменяются аналогичными между двумя различными типами молекул.
Электропроводность
Молекулярные вещества не будут проводить электричество.Даже в тех случаях, когда электроны могут быть делокализованы в конкретной молекуле, между молекулами нет достаточного контакта, чтобы позволить электронам проходить через все твердое тело или жидкость.
Йод, я 2
Йод представляет собой темно-серое кристаллическое твердое вещество с фиолетовым паром. Температура плавления: 114 ° C. B.Pt: 184 ° C. Он очень, очень мало растворим в воде, но свободно растворяется в органических растворителях.
Йод, следовательно, является твердым веществом с низкой температурой плавления.Кристалличность предполагает регулярную упаковку молекул.
Структура описывается как кубических центрированных граней — это куб молекул йода с другой молекулой в центре каждой грани.
Ориентация молекул йода в этой структуре довольно трудно нарисовать (не говоря уже о помнить!). Если ваша учебная программа и прошлые экзаменационные работы предполагают, что вам нужно запомнить ее, внимательно посмотрите на следующую последовательность диаграмм, показывающих слои.
,Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra

Leave A Comment