а) Li и F б) C и O в) S и CI г) Si и H а) Mg(OH)2б) Nh5NO3в) K2SO4г) h3CO3 а) оксид натрия б) сульфат меди в) гидроксид кальция г) сероводород а) ртуть б) хлор в) сера г) кремний а) водород б) гидрид кальция в) уксусная кислота г) пропан а) атомную б) молекулярную в) ионную г) металлическую а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8.(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Положение элемента 1)38р, 50п, 38ē; А) 5-й период IIБ группы; р, 64п, 48ē; Б) 5-й период VIA группы; 3)42р, 54n, 42ē; В) 5-й период IIA группы; 4)52 р, 76п, 72ē. Г) 5-й период VIБ группы. 9.(4 балла). Установите соответствие между типом элемента и химическим элементом. 1)s;А) кальций; 2)р; Б) ванадий; 3)d.В) теллур; Г) молибден. 10.(3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Агрегатное состояние дисперсной фазы / 1)чугун;А) твёрдое вещество / газ; 2) смог;Б) газ / твердое вещество; 3)пористый шоколад .
 В) твердое вещество /
твердое вещество. — Знания.site
В) твердое вещество /
твердое вещество. — Знания.site1. а)
2. б)
3. б)
4. а)
6. в)
7. в)
8. 1-в; 2-а; 3-г; 4-б
9. 1-а; 2-в; 3-б,г
Автор:
iyana
Оценить ответ:
0
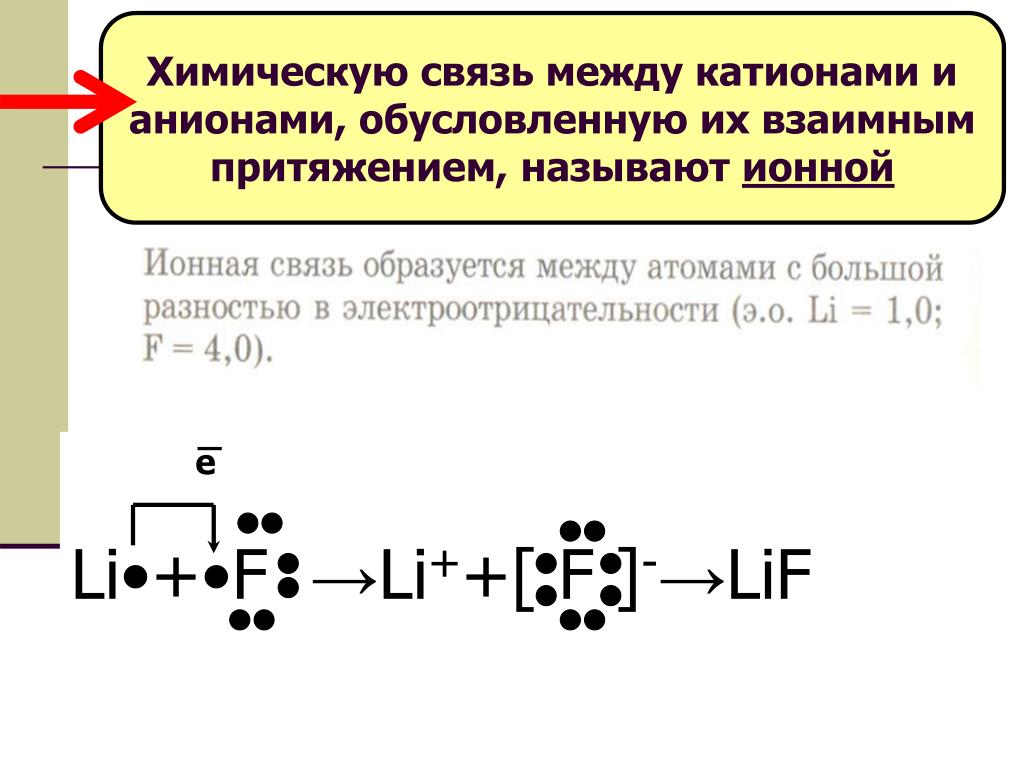
1.Между атомами каких элементов химическая связь будет иметь ионный характер :
а) Li и F
2.Только ковалентная связь наблюдается в соединении с формулой:
г) h3CO3
3.Только ионные связи наблюдается в веществе:
а) оксид натрия
4.Найдите вещество, имеющее металлический тип связи:
а) ртуть
5.Укажите название вещества, молекулы которого способны к образованию водородных связей:
в) уксусная кислота
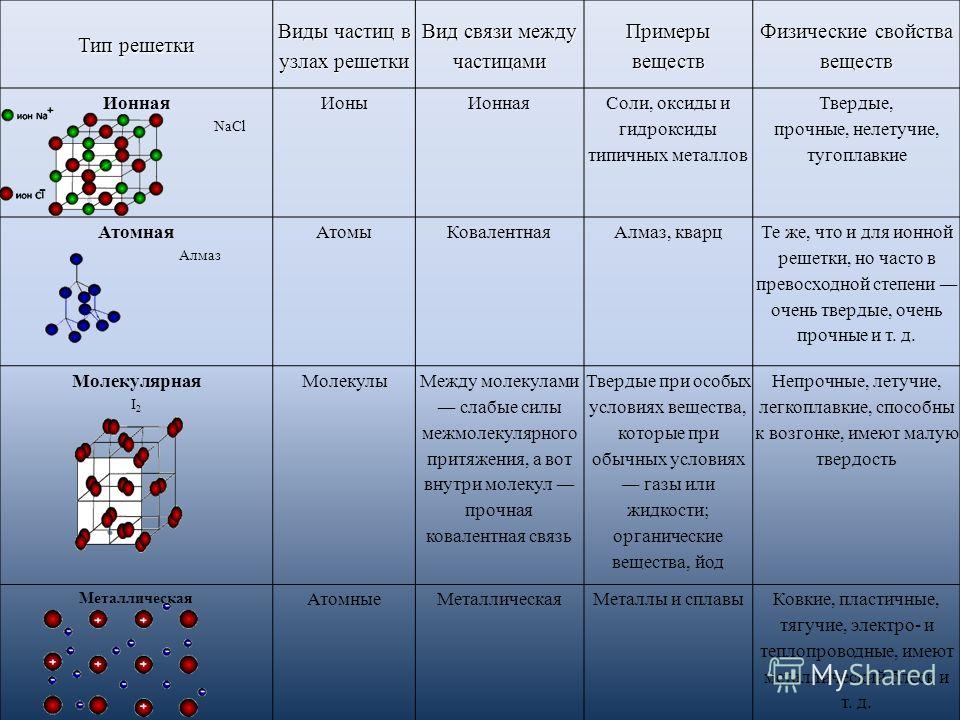
6. Вещество, образованное элементами с порядковыми номерами 35 и 12, имеет кристаллическую решетку:
Вещество, образованное элементами с порядковыми номерами 35 и 12, имеет кристаллическую решетку:
в) ионную
7.Метан имеет строение:
в) газообразное
8. Установите соответствие между составом атома и положением элемента в Периодической системе.
Состав атома: Положение элемента в Периодической системе:
1)38р⁺, 49n⁰, 38ē; В) 5-й период IIA группа;
2)48р⁺, 64n⁰, 48ē; А) 5-й период IIБ группа;
3)42р⁺, 54n⁰, 42ē; Б) 5-й период VIA группа;
4)52р⁺, 76n⁰, 52ē. Б) 5-й период VIA группа;
9. Установите соответствие между типом элемента и химическим элементом.
Тип элемента:Химический элемент:
1) s;А) кальций;
2) р; В) теллур;
3) d.Б) ванадий;
4) d. Г) молибден.
10. Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды.
Дисперсная система:
Агрегатное состояние дисперсной фазы / дисперсионной среды:
1)чугун; В) твердое вещество / твердое вещество.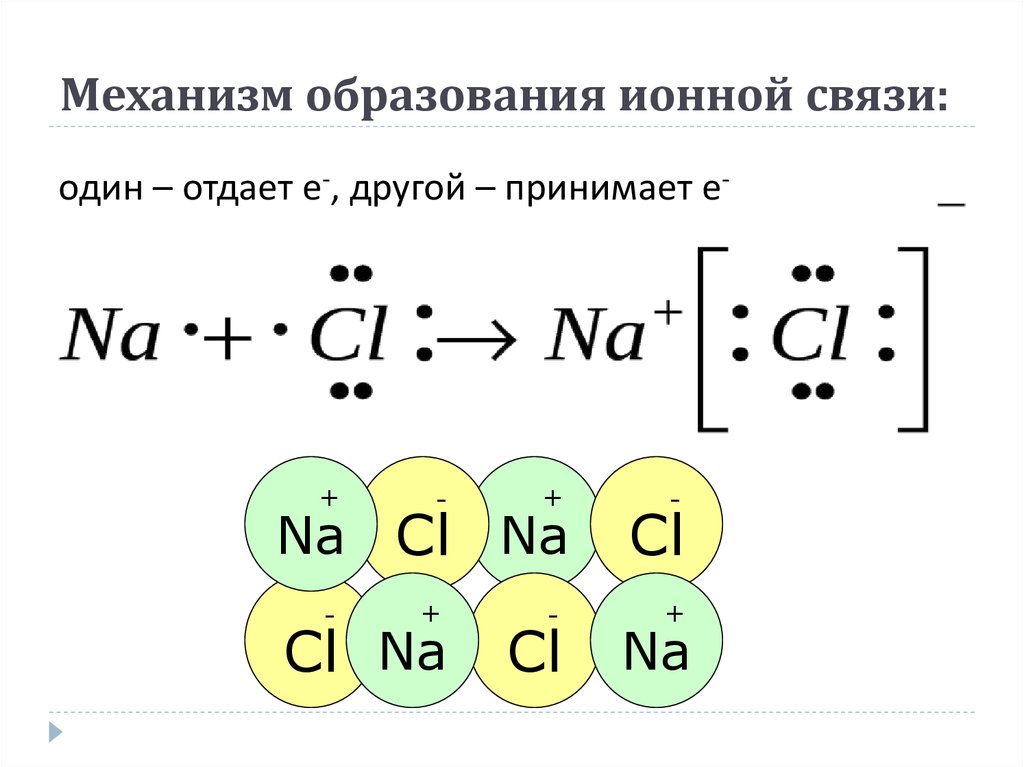
2) смог; Б) газ / твердое вещество;
3) пористый шоколад А) твёрдое вещество / газ;
Автор:
niko49
Оценить ответ:
0
1.(2 балла).Между атомами каких частей хим связь будет иметь ионный характер
Вопросы-ответы » Химия
1.(2 балла).Меж атомами каких частей хим связь будет иметь ионный нрав :
а) Li и F б) C и O в) S и CI г) Si и H
2.(2 балла).Только ковалентная связь наблюдается в соединении с формулой:
а) Mg(OH)2б) Nh5NO3в) K2SO4г) h3CO3
3.(2 балла).Только ионные связи наблюдается в веществе:
а) оксид натрия б) сульфат меди
в) гидроксид кальция г) сероводород
4.(2 балла).Найдите вещество, имеющее железный тип связи:
а) ртуть б) хлор в) сера г) кремний
5. (2 балла).Укажите заглавие вещества, молекулы которого способны к образованию водородных связей:
(2 балла).Укажите заглавие вещества, молекулы которого способны к образованию водородных связей:
а) водород б) гидрид кальция
в) уксусная кислота г) пропан
6.(2 балла).Вещество, интеллигентное элементами с порядковыми номерами 35 и 12, имеет кристаллическую решетку:
а) атомную б) молекулярную
в) ионную г) железную
7.(2 балла).Метан имеет строение:
а) жесткое кристаллическое б) жидкое
в) газообразное г) твердое бесформенное
8.(4 балла). Установите соответствие меж составом атома и положением элемента в Повторяющейся системе.
Состав атома: Положение элемента
в Периодической системе:
1)38р, 50п, 38; А) 5-й период IIБ группы;
р, 64п, 48; Б) 5-й период VIA группы;
3)42р, 54n, 42; В) 5-й период IIA группы;
4)52 р, 76п, 72. Г) 5-й период VIБ группы.
9.(4 балла). Установите соответствие меж типом элемента и химическим элементом.
Тип элемента:Хим элемент:
1)s;А) кальций;
2)р; Б) ванадий;
3)d. В) теллур;
В) теллур;
Г) молибден.
10.(3 балла). Установите соответствие меж дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды.
Дисперсная система:Агрегатное состояние
дисперсной фазы /
дисперсионной среды:
1)чугун;А) твёрдое вещество / газ;
2) сумел;Б) газ / жесткое вещество;
3)пористый шоколад . В) жесткое вещество /
твердое вещество.
2 ответа
Аситашвили Геннадий
1.Меж атомами каких элементов хим связь будет иметь ионный нрав :
а) Li и F
2.Только ковалентная связь наблюдается в соединении с формулой:
г) h3CO3
3.Только ионные связи наблюдается в веществе:
а) оксид натрия
4.Найдите вещество, имеющее металлический тип связи:
а) ртуть
5.Укажите заглавие вещества, молекулы которого способны к образованию водородных связей:
в) уксусная кислота
6.
в) ионную
7.Метан имеет строение:
в) газообразное
8. Установите соответствие между составом атома и положением элемента в Повторяющейся системе.
Состав атома: Положение элемента в Периодической системе:
1)38р, 49n, 38; В) 5-й период IIA группа;
2)48р, 64n, 48; А) 5-й период IIБ группа;
3)42р, 54n, 42; Б) 5-й период VIA группа;
4)52р, 76n, 52. Б) 5-й период VIA группа;
9. Установите соответствие между типом элемента и хим элементом.
Тип элемента:Хим элемент:
1) s;А) кальций;
2) р; В) теллур;
3) d.Б) ванадий;
4) d. Г) молибден.
10. Установите соответствие меж дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды.
Дисперсная система:
Агрегатное состояние дисперсной фазы / дисперсионной среды:
1)чугун; В) жесткое вещество / жесткое вещество.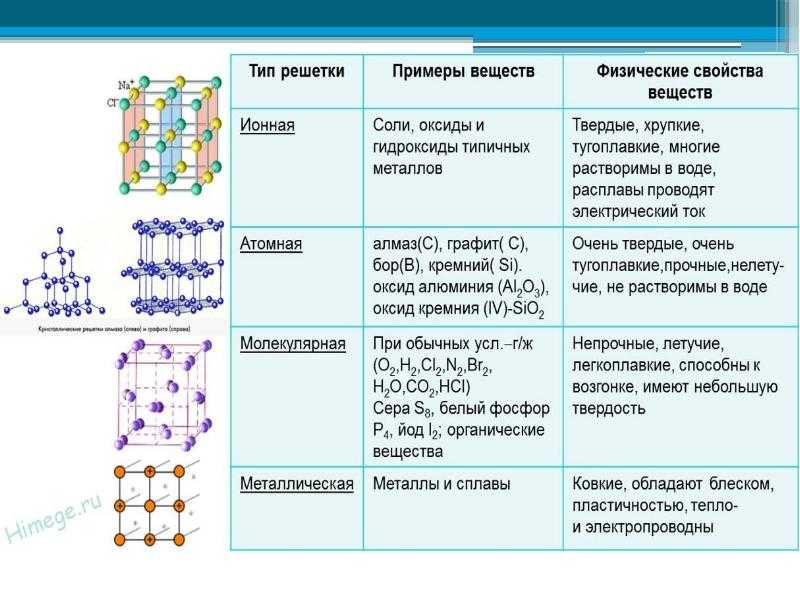
2) сумел; Б) газ / жесткое вещество;
3) пористый шоколад А) твёрдое вещество / газ;
Славик Душанов
1. а)
2. б)
3. б)
4. а)
6. в)
7. в)
8. 1-в; 2-а; 3-г; 4-б
9. 1-а; 2-в; 3-б,г
CES Information Guide — Materials Science Engineering
Атомная связь
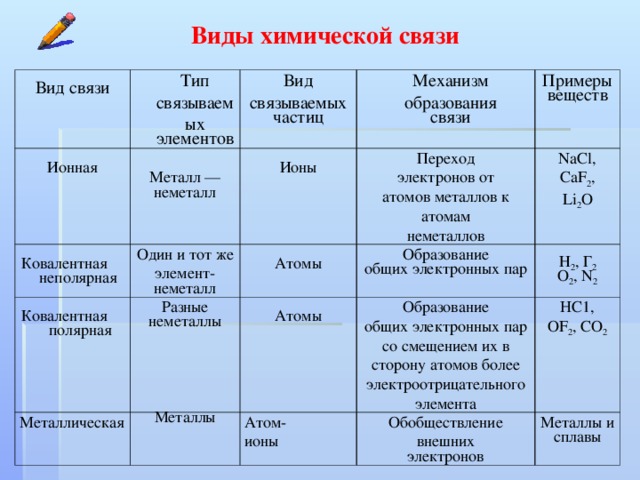
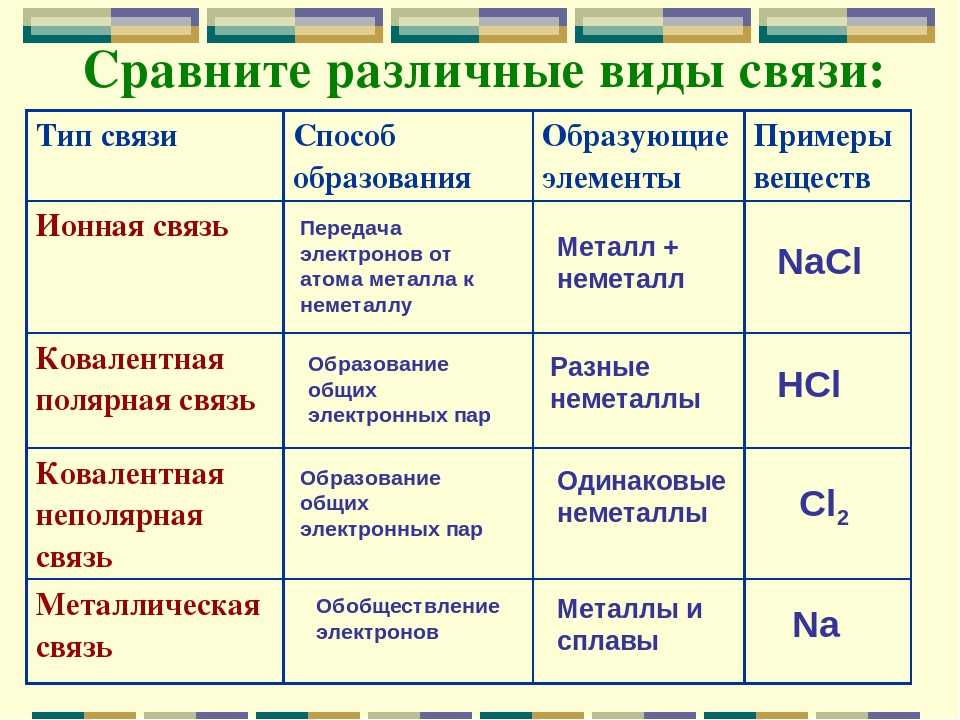
Существует три основных типа связи: ионная, ковалентные и металлические.
Ионная
склеивание
Определение: Ан ионная связь образуется при переносе валентных электронов от одного атома к другому, чтобы завершить внешнюю электронную оболочку. | Пример: типичным материалом с ионной связью является NaCl (соль): Атом натрия (Na) теряет свою валентность
электрон для завершения внешней оболочки атома хлора (Cl). |
Ковалентная склеивание
Определение: ковалентная связь образуется при совместном использовании валентных электронов одного атома между двумя или более отдельными атомами. | Пример: Многие соединения имеют ковалентная связь, например полимеры. Пример нейлоновой веревки. материала, состоящего из полимеров. Полимерные конструкции обычно представляют собой длинные цепочки ковалентно связанных углерода и водорода атомы в различном расположении. |
Металлик склеивание
Определение: Металлическая связка
образуется, когда валентные электроны не связаны с
определенный атом или ион, но существуют как «облако»
электроны вокруг центров ионов. Металлические материалы обладают хорошими электрическими и теплопроводность по сравнению с материалами с ковалентной или ионная связь. Металл, такой как железо, имеет металлическую связь. | Пример: В реальный и несовершенный мир, большинство материалов не имеют чистого металлическая, чисто ковалентная или чисто ионная связь; они могут имеют и другие виды связи. Например, железо имеет преимущественно металлическая связь, но также имеет место и ковалентная связь. Этот ключ, найденный в автомагазине в Малайзии,
подвергался жестокому обращению и явно проявляет признаки
возраста. В его нынешнем состоянии признаки ржавчины показывают, что,
на молекулярном уровне его металлическая связь не идеальна и
изгиб указывает на то, что исходный кристаллический
структура изменена. |
Химические связи – анатомия и физиология
Химический уровень организации
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Объяснять связь между молекулами и соединениями
- Различать ионы, катионы и анионы
- Определите основное различие между ионной и ковалентной связью
- Различают неполярные и полярные ковалентные связи
- Объясните, как молекулы воды соединяются водородными связями
Атомы, разделенные большим расстоянием, не могут соединиться; скорее, они должны подойти достаточно близко, чтобы электроны в их валентных оболочках могли взаимодействовать. Но соприкасаются ли когда-нибудь атомы друг с другом? Большинство физиков сказали бы «нет», потому что отрицательно заряженные электроны в своих валентных оболочках отталкиваются друг от друга. Никакая сила в человеческом теле или где-либо еще в мире природы не может преодолеть это электрическое отталкивание. Поэтому, когда вы читаете об атомах, соединяющихся друг с другом или сталкивающихся друг с другом, имейте в виду, что атомы не сливаются в физическом смысле.
Поэтому, когда вы читаете об атомах, соединяющихся друг с другом или сталкивающихся друг с другом, имейте в виду, что атомы не сливаются в физическом смысле.
Вместо этого атомы соединяются, образуя химическую связь. Связь — это слабое или сильное электрическое притяжение, которое удерживает атомы в одном и том же месте. Новая группа, как правило, более стабильна (с меньшей вероятностью снова прореагирует), чем атомы, входящие в ее состав, когда они были разделены. Более или менее стабильная группа из двух или более атомов, соединенных химическими связями, называется молекулой. Связанные атомы могут быть одного и того же элемента, как в случае H 2 , который называется молекулярным водородом или газообразным водородом. Когда молекула состоит из двух или более атомов разных элементов, она называется химическим соединением. Таким образом, единица воды, или H 2 O представляет собой соединение, как и отдельная молекула газообразного метана, или CH 4 .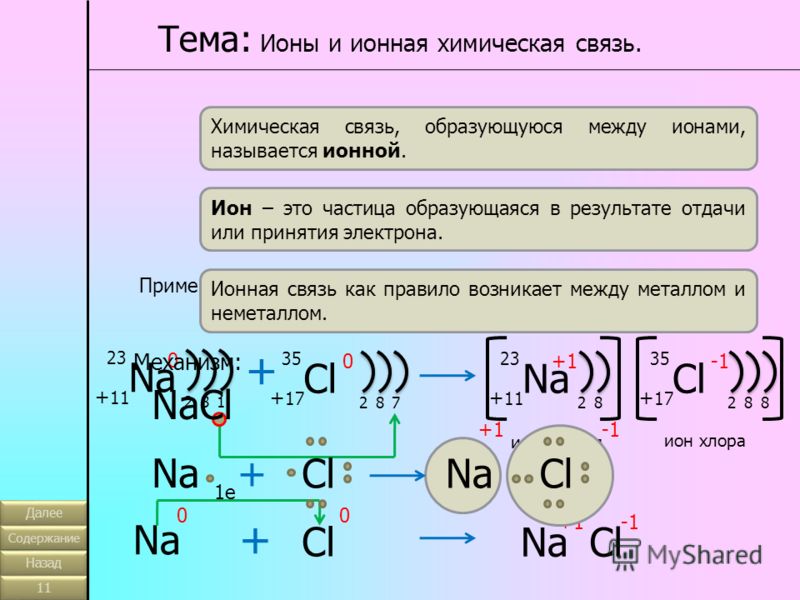
Три типа химических связей важны в физиологии человека, потому что они удерживают вместе вещества, которые используются организмом для важнейших аспектов гомеостаза, передачи сигналов и производства энергии, и это лишь некоторые из важных процессов. Это ионные связи, ковалентные связи и водородные связи.
Вспомните, что атом обычно имеет одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Пока сохраняется эта ситуация, атом электрически нейтрален. Но когда атом участвует в химической реакции, которая приводит к отдаче или принятию одного или нескольких электронов, атом становится положительно или отрицательно заряженным. Это часто происходит для большинства атомов, чтобы иметь полную валентную оболочку, как описано ранее. Это может произойти либо путем получения электронов для заполнения оболочки, заполненной более чем наполовину, либо путем отдачи электронов для опустошения оболочки, заполненной менее чем наполовину, в результате чего следующая меньшая электронная оболочка остается новой, полной валентностью. оболочка. Атом, имеющий электрический заряд — положительный или отрицательный — является ионом.
оболочка. Атом, имеющий электрический заряд — положительный или отрицательный — является ионом.
Посетите этот веб-сайт, чтобы узнать об электрической энергии и притяжении/отталкивании зарядов. Что происходит с заряженным электроскопом, когда между его пластиковыми листами перемещается проводник, и почему?
Калий (K), например, является важным элементом во всех клетках организма. Его атомный номер — 19. В его валентной оболочке всего один электрон. Эта характеристика делает калий весьма вероятным для участия в химических реакциях, в которых он отдает один электрон. (Калию легче отдать один электрон, чем получить семь электронов.) Потеря приведет к тому, что положительный заряд протонов калия будет более влиятельным, чем отрицательный заряд электронов калия. Другими словами, полученный ион калия будет слегка положительным. Ион калия записывается K + , что указывает на то, что он потерял один электрон. Положительно заряженный ион известен как катион.
Теперь рассмотрим фтор (F), компонент костей и зубов. Его атомный номер девять, и у него семь электронов в его валентной оболочке. Таким образом, весьма вероятно, что фтор свяжется с другими атомами таким образом, что фтор примет один электрон (фтору легче получить один электрон, чем отдать семь электронов). Когда это произойдет, его электронов будет на один больше, чем его протонов, и он будет иметь общий отрицательный заряд. Ионизированная форма фтора называется фторидом и записывается как F – . Отрицательно заряженный ион известен как анион.
Его атомный номер девять, и у него семь электронов в его валентной оболочке. Таким образом, весьма вероятно, что фтор свяжется с другими атомами таким образом, что фтор примет один электрон (фтору легче получить один электрон, чем отдать семь электронов). Когда это произойдет, его электронов будет на один больше, чем его протонов, и он будет иметь общий отрицательный заряд. Ионизированная форма фтора называется фторидом и записывается как F – . Отрицательно заряженный ион известен как анион.
Атомы, которые могут отдать или принять более одного электрона, получат более сильный положительный или отрицательный заряд. Катион, отдавший два электрона, имеет суммарный заряд +2. Используя в качестве примера магний (Mg), это можно записать как Mg ++ или Mg 2+ . Анион, принявший два электрона, имеет суммарный заряд -2. Ионная форма селена (Se), например, обычно записывается Se 2–.
Противоположные заряды катионов и анионов вызывают умеренно сильное взаимное притяжение, которое удерживает атомы в непосредственной близости, образуя ионную связь. Ионная связь — это постоянная тесная ассоциация между ионами противоположного заряда. Поваренная соль, которой вы посыпаете еду, обязана своим существованием ионной связи. Как показано в [ссылка], натрий обычно отдает электрон хлору, становясь катионом Na + . Когда хлор принимает электрон, он становится анионом хлорида, Cl — . Эти два иона с их противоположными зарядами сильно притягиваются друг к другу.
Ионная связь — это постоянная тесная ассоциация между ионами противоположного заряда. Поваренная соль, которой вы посыпаете еду, обязана своим существованием ионной связи. Как показано в [ссылка], натрий обычно отдает электрон хлору, становясь катионом Na + . Когда хлор принимает электрон, он становится анионом хлорида, Cl — . Эти два иона с их противоположными зарядами сильно притягиваются друг к другу.
Ионная связь
(a) Натрий легко отдает единственный электрон в своей валентной оболочке хлору, которому требуется только один электрон, чтобы иметь полную валентную оболочку. (b) Противоположные электрические заряды образующихся катиона натрия и аниона хлорида приводят к образованию связи притяжения, называемой ионной связью. в) притяжение многих ионов натрия и хлора приводит к образованию больших групп, называемых кристаллами.
Вода является важным компонентом жизни, поскольку она способна разрушать ионные связи в солях, освобождая ионы. На самом деле в биологических жидкостях большинство отдельных атомов существует в виде ионов. Эти растворенные ионы производят электрические заряды внутри тела. Поведение этих ионов создает следы работы сердца и мозга, наблюдаемые в виде волн на электрокардиограмме (ЭКГ или ЭКГ) или электроэнцефалограмме (ЭЭГ). Электрическая активность, возникающая в результате взаимодействия заряженных ионов, является причиной того, что их также называют электролитами.
На самом деле в биологических жидкостях большинство отдельных атомов существует в виде ионов. Эти растворенные ионы производят электрические заряды внутри тела. Поведение этих ионов создает следы работы сердца и мозга, наблюдаемые в виде волн на электрокардиограмме (ЭКГ или ЭКГ) или электроэнцефалограмме (ЭЭГ). Электрическая активность, возникающая в результате взаимодействия заряженных ионов, является причиной того, что их также называют электролитами.
В отличие от ионных связей, образованных притяжением между положительным зарядом катиона и отрицательным зарядом аниона, молекулы, образованные ковалентной связью, имеют общие электроны во взаимно стабилизирующих отношениях. Подобно ближайшим соседям, чьи дети тусуются сначала в одном доме, а затем в другом, атомы не теряют и не приобретают электроны постоянно. Вместо этого электроны перемещаются взад и вперед между элементами. Из-за близкого расположения пар электронов (по одному электрону от каждого из двух атомов) ковалентные связи прочнее ионных.
Неполярные ковалентные связи
[ссылка] показывает несколько распространенных типов ковалентных связей. Обратите внимание, что два ковалентно связанных атома обычно имеют только одну или две общие электронные пары, хотя возможны и более крупные общие пары. Важная концепция, которую следует извлечь из этого, заключается в том, что в ковалентных связях электроны в самой внешней валентной оболочке используются совместно, чтобы заполнить валентные оболочки обоих атомов, в конечном итоге стабилизируя оба вовлеченных атома. При одинарной ковалентной связи два атома делят один электрон, а при двойной ковалентной связи два атома делят между собой две пары электронов. Существуют даже тройные ковалентные связи, когда три атома являются общими.
Ковалентная связь
Вы можете видеть, что ковалентные связи, показанные на [ссылка], сбалансированы. Разделение отрицательных электронов относительно равно, как и электрическое притяжение положительных протонов в ядрах вовлеченных атомов. Вот почему ковалентно связанные молекулы, которые электрически сбалансированы таким образом, описываются как неполярные; то есть ни одна область молекулы не является ни более положительной, ни более отрицательной, чем любая другая.
Вот почему ковалентно связанные молекулы, которые электрически сбалансированы таким образом, описываются как неполярные; то есть ни одна область молекулы не является ни более положительной, ни более отрицательной, чем любая другая.
Полярные ковалентные связи
Группы законодателей с совершенно противоположными взглядами на тот или иной вопрос авторы новостей часто называют «поляризованными». В химии полярная молекула — это молекула, которая содержит области с противоположными электрическими зарядами. Полярные молекулы возникают, когда атомы неравномерно делят электроны в полярных ковалентных связях.
Наиболее известным примером полярной молекулы является вода ([ссылка]). Молекула состоит из трех частей: одного атома кислорода, ядро которого содержит восемь протонов, и двух атомов водорода, ядра которых содержат только по одному протону. Поскольку каждый протон обладает одинаковым положительным зарядом, ядро, содержащее восемь протонов, создает заряд, в восемь раз больший, чем ядро, содержащее один протон. Это означает, что отрицательно заряженные электроны, присутствующие в молекуле воды, сильнее притягиваются к ядру кислорода, чем к ядрам водорода. Таким образом, единственный отрицательный электрон каждого атома водорода мигрирует к атому кислорода, делая кислородный конец их связи немного более отрицательным, чем водородный конец их связи.
Это означает, что отрицательно заряженные электроны, присутствующие в молекуле воды, сильнее притягиваются к ядру кислорода, чем к ядрам водорода. Таким образом, единственный отрицательный электрон каждого атома водорода мигрирует к атому кислорода, делая кислородный конец их связи немного более отрицательным, чем водородный конец их связи.
Полярные ковалентные связи в молекуле воды
Что верно для связей, верно и для молекулы воды в целом; то есть область кислорода имеет слегка отрицательный заряд, а области атомов водорода имеют слегка положительный заряд. Эти заряды часто называют «частичными зарядами», потому что сила заряда меньше, чем один полный электрон, как это происходит в ионной связи. Как показано на [ссылка], области слабой полярности обозначаются греческой буквой дельта (δ) и знаком плюс (+) или минус (–).
Несмотря на то, что одна молекула воды невообразимо мала, она имеет массу, и противоположные электрические заряды на молекуле притягивают эту массу таким образом, что она создает форму, напоминающую треугольную палатку (см.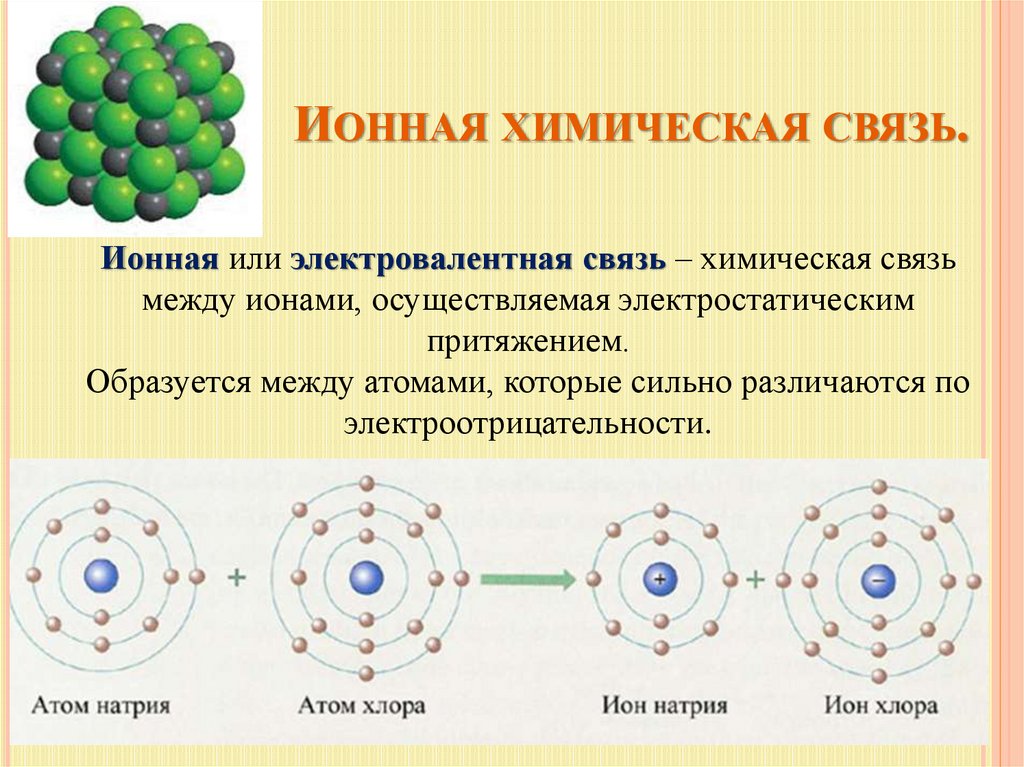 [ссылка] b ) . Этот диполь с положительным зарядом на одном конце, образованным атомами водорода на «дне» палатки, и отрицательным зарядом на противоположном конце (атомом кислорода на «верху» палатки) делает заряженные области весьма вероятными. взаимодействовать с заряженными областями других полярных молекул. Для физиологии человека образующаяся связь является одной из важнейших, образованных водой, — водородной связью.
[ссылка] b ) . Этот диполь с положительным зарядом на одном конце, образованным атомами водорода на «дне» палатки, и отрицательным зарядом на противоположном конце (атомом кислорода на «верху» палатки) делает заряженные области весьма вероятными. взаимодействовать с заряженными областями других полярных молекул. Для физиологии человека образующаяся связь является одной из важнейших, образованных водой, — водородной связью.
Водородная связь образуется, когда слабоположительный атом водорода, уже связанный с одним электроотрицательным атомом (например, кислородом в молекуле воды), притягивается к другому электроотрицательному атому другой молекулы. Другими словами, водородные связи всегда включают водород, который уже является частью полярной молекулы.
Самый распространенный пример водородной связи в природе возникает между молекулами воды. Это происходит на ваших глазах всякий раз, когда две капли дождя сливаются в большую бусинку или ручей переливается в реку.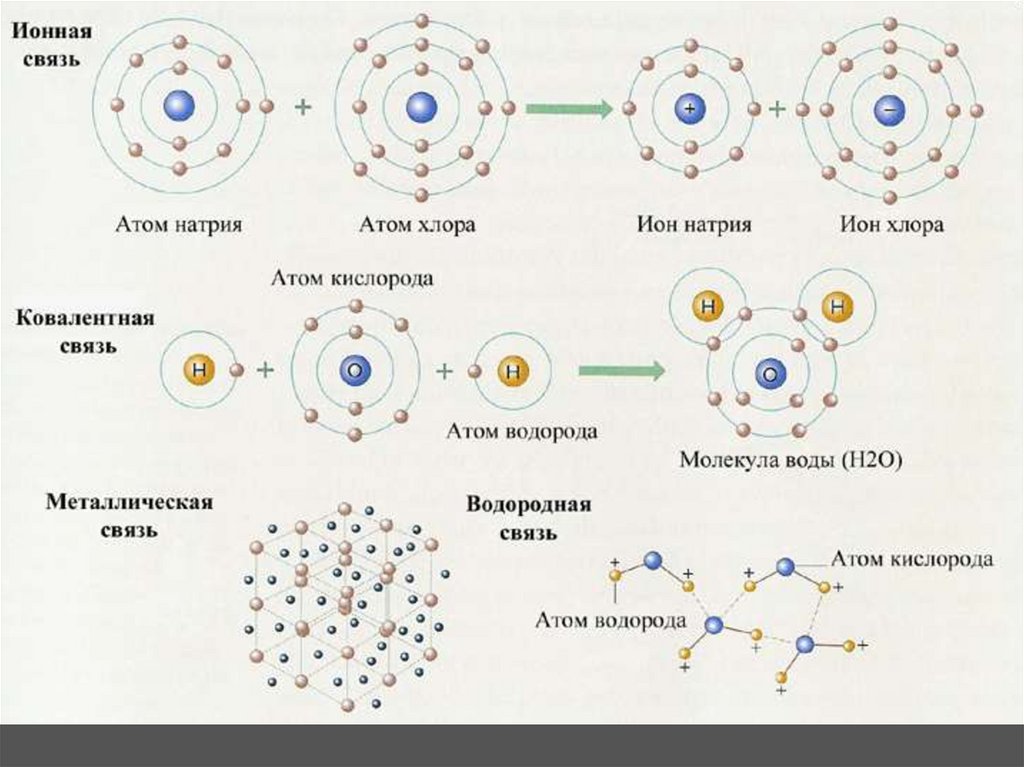 Водородная связь возникает из-за того, что слабоотрицательный атом кислорода в одной молекуле воды притягивается к слабоположительным атомам водорода двух других молекул воды ([ссылка]).
Водородная связь возникает из-за того, что слабоотрицательный атом кислорода в одной молекуле воды притягивается к слабоположительным атомам водорода двух других молекул воды ([ссылка]).
Водородные связи между молекулами воды
Обратите внимание, что связи возникают между слабо положительным зарядом атомов водорода и слабо отрицательным зарядом атомов кислорода. Водородные связи относительно слабы и поэтому обозначены пунктирной (а не сплошной) линией.
Молекулы воды также сильно притягивают другие типы заряженных молекул, а также ионы. Это объясняет, почему «поваренная соль», например, на самом деле представляет собой молекулу, называемую в химии «солью», состоящую из равных количеств положительно заряженного натрия (Na + ) и отрицательно заряженный хлорид (Cl – ), так легко растворяются в воде, в этом случае образуя диполь-ионные связи между водой и электрически заряженными ионами (электролитами). Молекулы воды также отталкивают молекулы с неполярными ковалентными связями, такие как жиры, липиды и масла.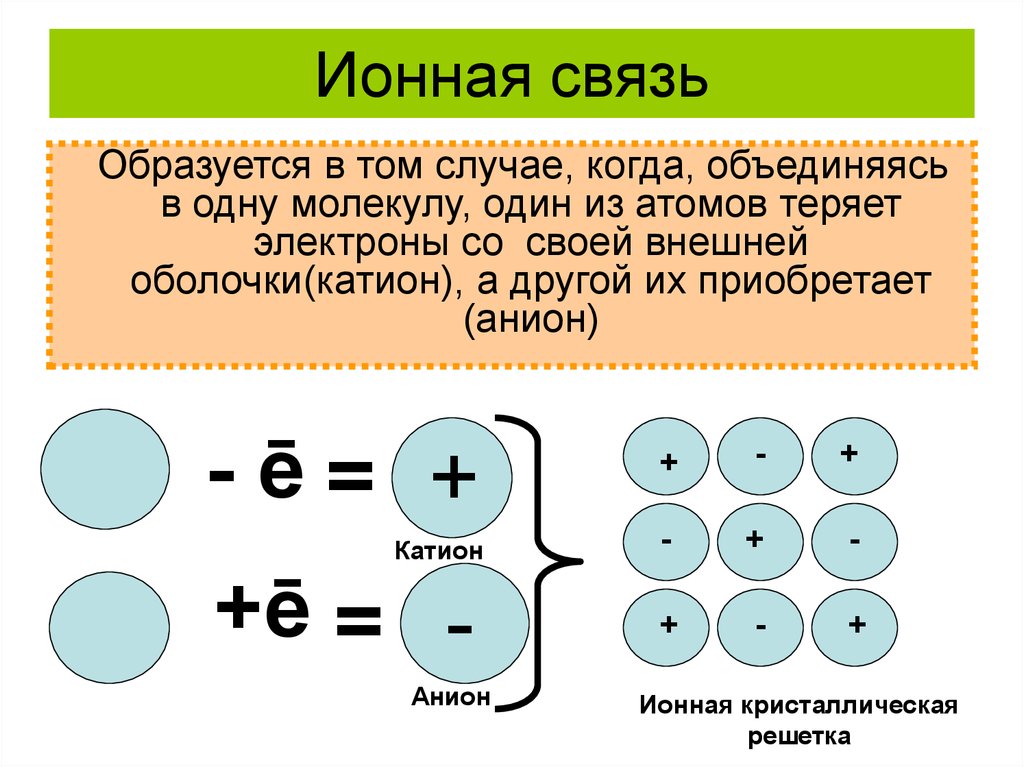 Вы можете продемонстрировать это с помощью простого кухонного эксперимента: налейте чайную ложку растительного масла, соединения, образованного неполярными ковалентными связями, в стакан с водой. Вместо того, чтобы мгновенно растворяться в воде, масло образует отчетливую каплю, потому что полярные молекулы воды отталкивают неполярное масло.
Вы можете продемонстрировать это с помощью простого кухонного эксперимента: налейте чайную ложку растительного масла, соединения, образованного неполярными ковалентными связями, в стакан с водой. Вместо того, чтобы мгновенно растворяться в воде, масло образует отчетливую каплю, потому что полярные молекулы воды отталкивают неполярное масло.
Каждый момент жизни атомы кислорода, углерода, водорода и других элементов человеческого тела создают и разрывают химические связи. Ионы — это заряженные атомы, которые образуются, когда атом отдает или принимает один или несколько отрицательно заряженных электронов. Катионы (ионы с положительным зарядом) притягиваются к анионам (ионам с отрицательным зарядом). Это притяжение называется ионной связью. В ковалентных связях участвующие атомы не теряют и не приобретают электроны, а делят их между собой. Молекулы с неполярными ковалентными связями электрически сбалансированы и имеют линейную трехмерную форму. Молекулы с полярными ковалентными связями имеют «полюса» — области слабо положительного и отрицательного заряда — и имеют треугольную трехмерную форму. Атом кислорода и два атома водорода образуют молекулы воды посредством полярных ковалентных связей. Водородные связи связывают атомы водорода, уже участвующие в полярных ковалентных связях, с анионами или электроотрицательными областями других полярных молекул. Водородные связи связывают молекулы воды, что приводит к свойствам воды, важным для живых существ.
Атом кислорода и два атома водорода образуют молекулы воды посредством полярных ковалентных связей. Водородные связи связывают атомы водорода, уже участвующие в полярных ковалентных связях, с анионами или электроотрицательными областями других полярных молекул. Водородные связи связывают молекулы воды, что приводит к свойствам воды, важным для живых существ.
Посетите этот веб-сайт, чтобы узнать об электрической энергии и притяжении/отталкивании зарядов. Что происходит с заряженным электроскопом, когда между его пластиковыми листами перемещается проводник, и почему?
Пластиковые листы прыгают на гвоздь (проводник), потому что проводник принимает электроны от электроскопа, уменьшая силу отталкивания двух листов.
Что из следующего является молекулой, но не соединением?
- Н 2 О
- 2 Н
- Н 2
- Н +
C
Молекула аммиака содержит один атом азота и три атома водорода.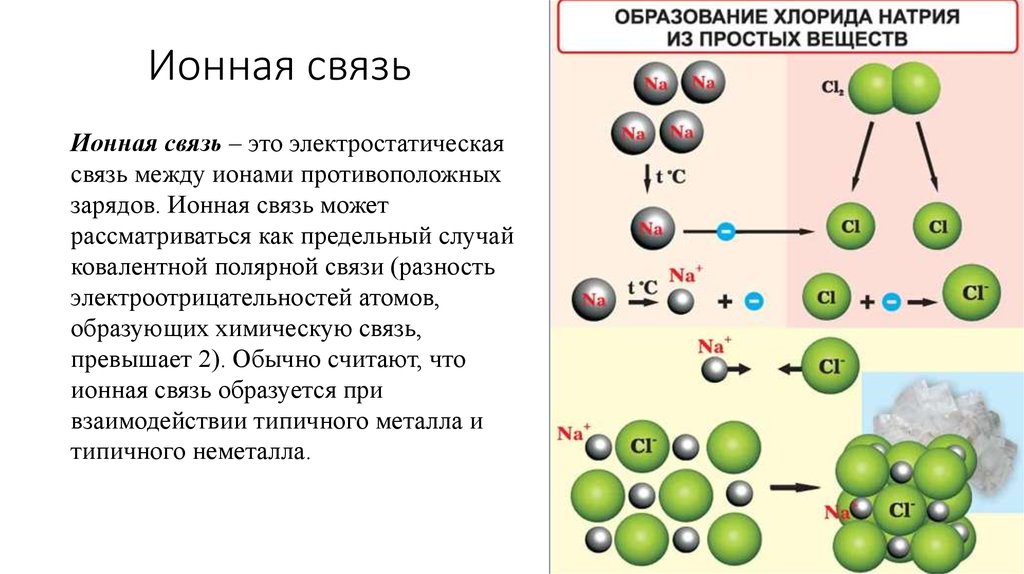 Они связаны с ________.
Они связаны с ________.
- ионные связи
- неполярные ковалентные связи
- полярные ковалентные связи
- водородные связи
C
Когда атом отдает электрон другому атому, он становится
- ионом
- анион
- неполярный
- все вышеперечисленное
A
Вещество, состоящее из кристаллов равного числа катионов и анионов, удерживаемых вместе ионными связями, называется a(n) ________.
- благородный газ
- соль
- электролит
- диполь
B
Какое из следующих утверждений о химических связях верно?
- Ковалентные связи прочнее ионных.
- Водородные связи возникают между двумя атомами водорода.
- Связывание легко происходит между неполярными и полярными молекулами.

- Молекула воды вряд ли свяжется с ионом.
А
Объясните, почему CH 4 является одной из самых распространенных молекул в природе. Связь между атомами ионная или ковалентная?
Атом углерода имеет четыре электрона на валентной оболочке. Согласно правилу октета, он будет легко участвовать в химических реакциях, в результате которых его валентная оболочка будет иметь восемь электронов. Водород с одним электроном завершает свою валентную оболочку с двумя. Обмен электронами между атомом углерода и четырьмя атомами водорода отвечает требованиям всех атомов. Связи ковалентны, потому что электроны являются общими: хотя водород часто участвует в ионных связях, углерод не участвует, потому что маловероятно, что он отдает или принимает четыре электрона.
Однажды в спешке вы просто ополоснули водой посуду. Когда вы сушите салатницу, вы замечаете, что на ней все еще есть масляная пленка. Почему вода сама по себе не очистила чашу?
Вода представляет собой полярную молекулу.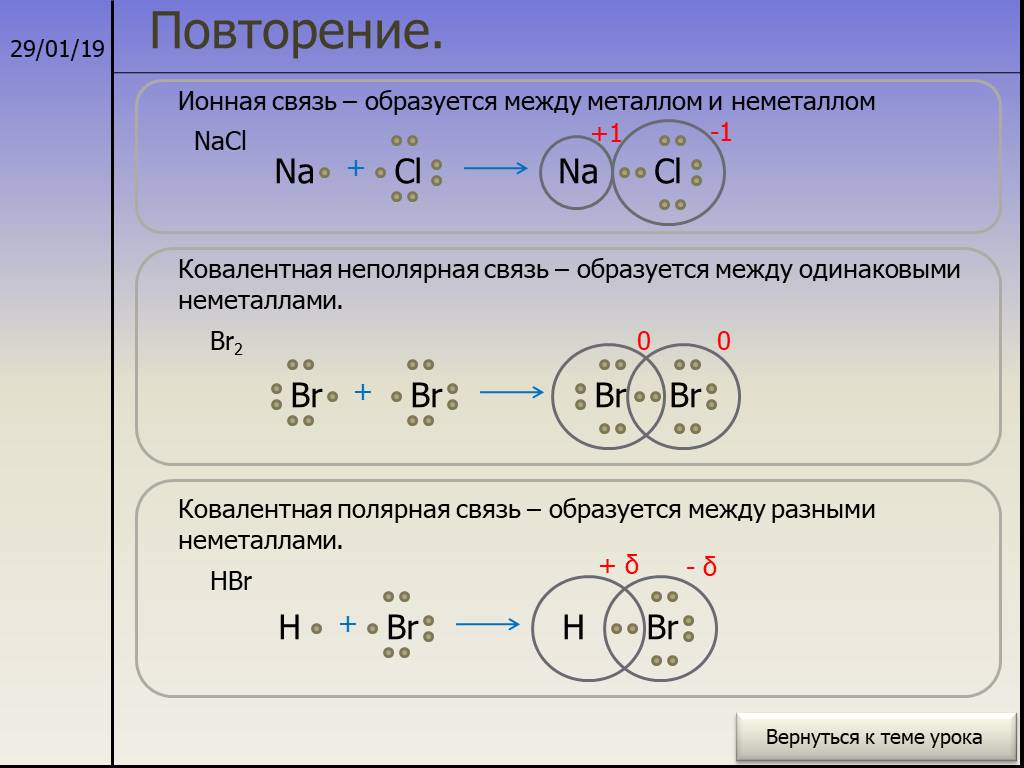

 Ионные материалы, как правило, очень хрупкие, и большие силы
существуют между двумя ионами.
Ионные материалы, как правило, очень хрупкие, и большие силы
существуют между двумя ионами.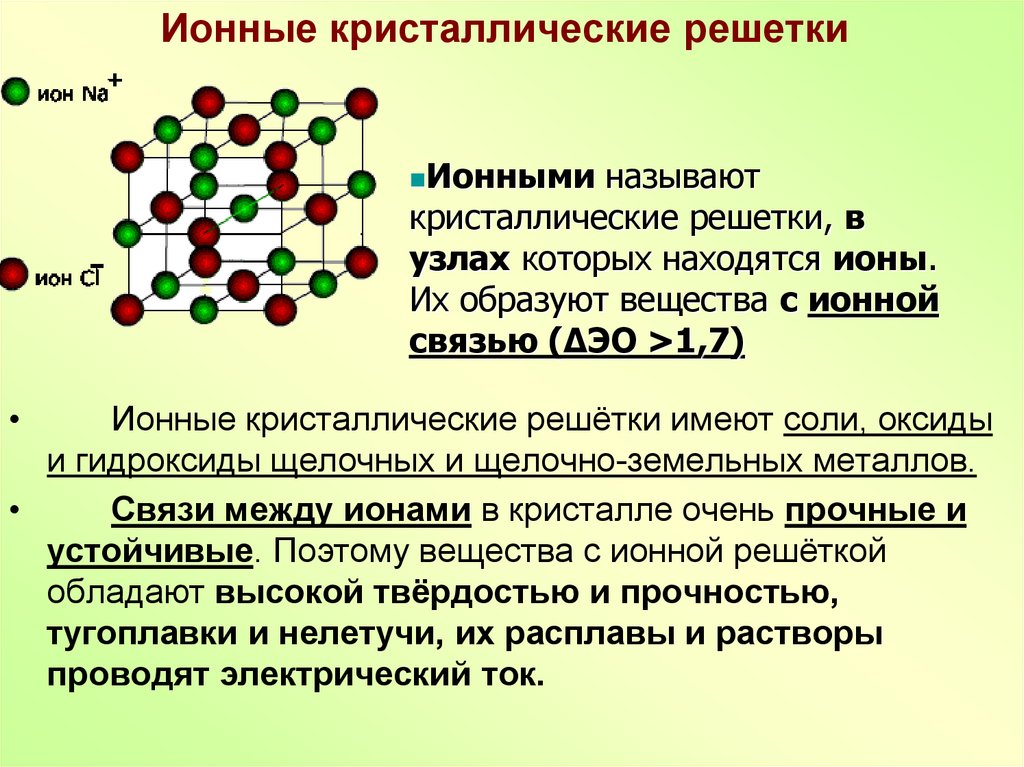


Leave A Comment