Свойства метана – физико-химическая основа молекулы
4.2
Средняя оценка: 4.2
Всего получено оценок: 406.
Обновлено 22 Июля, 2021
4.2
Средняя оценка: 4.2
Всего получено оценок: 406.
Обновлено 22 Июля, 2021
Метан – первый представитель ряда алканов с формулой СН4. Это бесцветный природный газ без запаха. Благодаря физическим и химическим свойствам метан используется в качестве топлива.
Строение
Молекула метана представляет собой тетраэдр, в середине которого находится углерод, соединённый простыми (одинарными) σ-связями с атомами водорода. Строение и свойства молекулы метана важны для понимания всей органической химии, так как большинство органических соединений содержит метильные группы -СН2.
Рис. 1. Строение молекулы метана.Метан образует гомологический ряд алканов. Каждый последующий гомолог отличается от предыдущего на одну группу -СН2.
Из-за тетраэдрической конфигурации длинные молекулы алканов имеют вид изогнутых цепочек.
Получение
Метан – распространённый газ во Вселенной. Он находится в природном и попутном газе, образуется на дне морей, выделяется как конечный продукт жизнедеятельности кишечных бактерий. Метан входит в состав атмосферы планет-гигантов. На поверхности Титана – спутника Сатурна – находятся этан-метановые озёра и реки.
Рис. 2. Спутник Титан.В промышленности метан выделяют из природного газа и получают при коксовании (прокаливании) каменного угля.
В лаборатории метан образуется при нагревании сухого гидроксида натрия с уксусной кислотой, а также при плавлении ацетата с гидроксидом натрия:
- 2NaOH + CH3COOH → Na2CO3 + H
- CH3COONa + NaOH → CH4 + Na2CO3.
Впервые метан обнаружил на болотах физик Алессандро Вольта в 1776 году. Два года спустя он выделил из болотного газа чистый метан.
Свойства
Основные физические свойства:
- легче воздуха;
- без запаха и вкуса;
- плохо растворяется в воде;
- молекулярная масса – 16;
- температура плавления – -182,49°С;
- температура кипения – -161,56°С;
- температура вспышки – -188°С;
- температура самовоспламенения – 537,8°С.

Метан определяет физико-химические свойства гомологического ряда алканов. При обычных условиях метан и его гомологи малоактивны и вступают в реакции под действием высокой температуры и катализатора. Дополнительные условия необходимы для расщепления связи С-Н.
Основные реакции метана:
- нитрование:
CH4 + HONO2 → CH3-NO2 + H2O;
- галогенирование:
CH4 + Cl2 → CH3Cl + HCl;
- сульфохлорирование:
CH4 + SO2 + Cl2 → CH3-SO2Cl + HCl↑;
- каталитическое окисление под действием солей меди и марганца:
- полное окисление (горение):
CH4 + 2O2→ CO2 + 2H2O + Q;
- окисление водяным паром:
CH4 + H2O → CO + 3H2;
- крекинг (метод переработки нефти):
2CH4 → HC≡CH + 3H2.

Концентрация метана в воздухе более 4 % взрывоопасна. Поэтому метану специально придают запах, смешивая газ с тиолами, содержащими серу. Это помогает контролировать утечку бытового газа.
Что мы узнали?
Метан – простейший представитель класса алканов, образующий гомологический ряд. Это бесцветный горючий газ, выделяемый из природного газа и получаемый при коксовании угля. Метан используется в качестве топлива. При высокой температуре самовоспламеняется. Газ подвержен нитрованию, галогенированию, сульфохлорированию, окислению под действием катализатора, водяного пара, горения, а также крекингу, используемого в переработке нефти.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Анна Раевская
5/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 406.
А какая ваша оценка?
Метан (Methan) — Словарь полезных терминов
НКПР 4,4 об. %. (ГОСТ Р 51330.19-99, МЭК 60079-20-96)
%. (ГОСТ Р 51330.19-99, МЭК 60079-20-96)
ВКПР 17 об% (ГОСТ Р 51330.19-99, МЭК 60079-20-96)
Температура самовоспламенения, 537 °С (ГОСТ Р 51330.19-99, МЭК 60079-20-96)
Группа взрывоопасной смеси Т1 (ГОСТ Р 51330.5)
Категория взрывоопасной смеси IIA (ГОСТ Р 51330.11)
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м3. (ГН 2.2.5.1313-03)
Преимущественное агрегатное состояние в воздухе в условиях производства — П (Пары и/или газы) (ГН 2.2.5.1313-03)
Класс опасности — 4 (ГН 2.2.5.1313-03)
CAS 74-82-8
1ppm = 0.67 мг/м3;
1мг/м3=1,5 ррm.
Простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа.Накапливаясь в закрытом помещении, метан взрывоопасен. Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %. Наиболее взрывоопасная концентрация 9,5 %.На промышленных производствах эту роль выполняют датчики, и во многих случаях метан для лабораторий и промышленных производств остаётся без запаха.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %. Наиболее взрывоопасная концентрация 9,5 %.На промышленных производствах эту роль выполняют датчики, и во многих случаях метан для лабораторий и промышленных производств остаётся без запаха.
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения (галогенирования, сульфохлорирования, сульфоокисления, нитрования и др.), но обладает меньшей реакционной способностью.
Специфична для метана реакция с парами воды, которая протекает на Ni/Al2O3 при 800—900 °C или без катализатора при 1400—1600 °C; образующийся синтез-газ может быть использован для синтеза метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Сэр Гемфри Дэви (учёный-химик) ещё в 1813 г. заключил из своих анализов, что рудничный газ есть смесь метана Ch5 с небольшим количеством азота N2 и угольного ангидрида СО2 — т. е., что он качественно тождественен по составу с газом, выделяющимся из болот. Основной компонент природного газа (77—99 %), попутных нефтяных газов (31—90 %), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
е., что он качественно тождественен по составу с газом, выделяющимся из болот. Основной компонент природного газа (77—99 %), попутных нефтяных газов (31—90 %), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан. Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси. Велика доля метановых льдов и на поверхности Седны.
Физиологическое действие
Метан нетоксичен и неопасен для здоровья человека. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему. Является наркотиком; действие ослабляется ничтожной растворимостью в воде и крови.
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе, с высокой концентрацией метана можно только от недостатка кислорода в воздухе для дыхания при очень высоких концентрациях метана. Так, при содержании в воздухе 25—30 % метана появляются первые признаки асфиксии (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому весьма редки случаи гибели людей от вдыхания смеси метана с воздухом от асфиксии.
Первая помощь при тяжелой асфиксии: удаление пострадавшего из вредной атмосферы.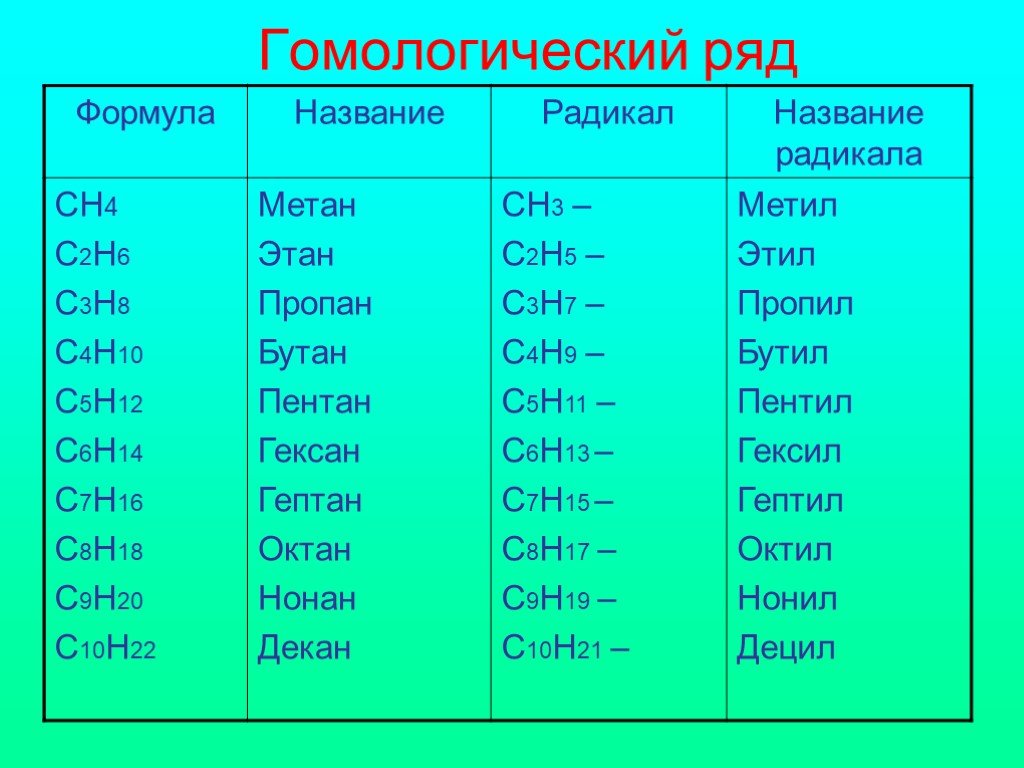 При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана у людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазосердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за весьма слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира. Биологическая роль Показано, что эндогенный метан способен вырабатываться не только метаногенной микрофлорой кишечника, но и клетками эукариот, и что его образование значительно возрастает при экспериментальном вызывании клеточной гипоксии, например, при нарушении работы митохондрий при помощи отравления организма экспериментального животного азидом натрия, известным митохондриальным ядом.
Высказывается предположение, что образование метана клетками эукариот, в частности животных, может быть внутриклеточным или межклеточным сигналом испытываемой клетками гипоксии. Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс). Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов. Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры.
Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс). Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов. Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры.
Метан и экология
Является парниковым газом, в этом отношении, более сильным, чем углекислый газ, из-за наличия глубоких вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объема метана составит 21-25 единиц.
Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объема метана составит 21-25 единиц.
Темы Газовый анализ
Предыдущая статья
Следующая статья
Метан | Определение, свойства, использование и факты
метановый цикл
Смотреть все СМИ
- Ключевые люди:
- Алессандро Вольта
- Похожие темы:
- натуральный газ парниковый газ биогаз воздух трифенилметан
Просмотреть весь связанный контент →
Последние новости
5 мая 2023 г., 17:57 по восточному времени (AP)
Новое правило агентства по трубопроводам, направленное на сокращение утечек метанаФедеральное агентство, которое регулирует трубопроводы, объявило о новых правилах, направленных на сокращение утечек метана, мощного парникового газа, из сети почти 3 миллионов миль газопроводов, которые пересекают страна
метан , бесцветный газ без запаха, широко распространенный в природе и являющийся продуктом определенных видов деятельности человека. Метан является простейшим представителем парафинового ряда углеводородов и одним из самых мощных парниковых газов. Его химическая формула CH 4 .
Метан является простейшим представителем парафинового ряда углеводородов и одним из самых мощных парниковых газов. Его химическая формула CH 4 .
Химические свойства метана
Метан легче воздуха и имеет удельный вес 0,554. Он мало растворим в воде. Легко горит на воздухе с образованием углекислого газа и водяного пара; пламя бледное, слегка светящееся и очень горячее. Температура кипения метана составляет -162 ° C (-259,6 ° F), а температура плавления составляет -182,5 ° C (-296,5 ° F). Метан в целом очень стабилен, но смеси метана и воздуха с содержанием метана от 5 до 14 процентов по объему взрывоопасны. Взрывы таких смесей часто происходили на угольных шахтах и угольных шахтах и были причиной многих аварий на шахтах.
More From Britannica
глобальное потепление: метан
Источники метана
Понять процессы производства и выделения метанового газа в заболоченных местах
Посмотреть все видео к этой статье В природе метан образуется в результате анаэробного бактериального разложения растительного вещества под водой (где его иногда называют болотным газом или болотный газ). Водно-болотные угодья являются основным естественным источником метана, производимого таким образом. Другими важными природными источниками метана являются термиты (в результате процессов пищеварения), вулканы, жерла на дне океана и залежи гидрата метана, которые встречаются вдоль континентальных окраин, подо льдом Антарктиды и вечной мерзлотой Арктики. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент рудничного газа (горючего газа) вдоль угольных пластов.
Водно-болотные угодья являются основным естественным источником метана, производимого таким образом. Другими важными природными источниками метана являются термиты (в результате процессов пищеварения), вулканы, жерла на дне океана и залежи гидрата метана, которые встречаются вдоль континентальных окраин, подо льдом Антарктиды и вечной мерзлотой Арктики. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается как компонент рудничного газа (горючего газа) вдоль угольных пластов.
Производство и сжигание природного газа и угля являются основными антропогенными (антропогенными) источниками метана. Такие виды деятельности, как добыча и переработка природного газа и деструктивная перегонка битуминозного угля при производстве угольного и коксового газа, приводят к выбросу значительного количества метана в атмосферу. Другие виды деятельности человека, связанные с производством метана, включают сжигание биомассы, животноводство и управление отходами (где бактерии производят метан, разлагая осадок на очистных сооружениях и разлагающиеся вещества на свалках).
Использование метана
Метан является важным источником водорода и некоторых органических химических веществ. Метан реагирует с паром при высоких температурах с образованием монооксида углерода и водорода; последний используется в производстве аммиака для удобрений и взрывчатых веществ. Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. При неполном сгорании метана образуется сажа, которая широко используется в качестве армирующего агента в резине для автомобильных шин.
Роль парникового газа
Метан, который производится и выбрасывается в атмосферу, поглощается стоками метана, которые включают почву и процесс окисления метана в тропосфере (самая нижняя область атмосферы). Большая часть природного метана компенсируется его поглощением в естественные поглотители. Однако антропогенное производство метана может привести к более быстрому увеличению концентрации метана, чем его поглотители. С 2007 года концентрация метана в атмосфере Земли увеличивалась на 6,8–10 частей на миллиард (ppb) в год. К 2022 году содержание метана в атмосфере достигло 1908,61 частей на миллиард, что примерно в три раза превышает доиндустриальные уровни, которые колебались на уровне 600–700 частей на миллиард.
С 2007 года концентрация метана в атмосфере Земли увеличивалась на 6,8–10 частей на миллиард (ppb) в год. К 2022 году содержание метана в атмосфере достигло 1908,61 частей на миллиард, что примерно в три раза превышает доиндустриальные уровни, которые колебались на уровне 600–700 частей на миллиард.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас Увеличение концентрации метана в атмосфере способствует возникновению парникового эффекта, при котором парниковые газы (особенно двуокись углерода, метан и водяной пар) поглощают инфракрасное излучение (чистую тепловую энергию) и повторно излучают его обратно на поверхность Земли, потенциально улавливая тепло и вызывая существенные изменения климата. Повышенное содержание метана в атмосфере также косвенно способствует парниковому эффекту. Например, при окислении метана гидроксильные радикалы (ОН — ) удаляют метан, реагируя с ним с образованием двуокиси углерода и водяного пара, а по мере увеличения концентрации атмосферного метана концентрации гидроксильных радикалов уменьшаются, эффективно продлевая время жизни метана в атмосфере.
Формула метана – структура, свойства, использование, примеры вопросов
Соединение метана состоит из 4 атомов водорода и атома углерода. Углерод является неметаллическим химическим элементом с атомным номером 6 и представлен символом C. Он принадлежит к группе-14 в периодической таблице. Это неметаллический и четырехвалентный металл, делающий четыре электрона доступными для образования химических связей. Водород — бесцветный, не имеющий запаха, нетоксичный и легковоспламеняющийся газ. Это самый легкий элемент с атомным номером 1. Водород является двухатомным с формулой H 9.0031 2 .
Метан
Метан — простейший насыщенный углеводород с химической формулой CH 4 . Это простейший алкан, содержащий один атом углерода и четыре атома водорода. Метан был впервые научно идентифицирован Алессандро Вольта, итальянским физиком в 1776 году. Это был бесцветный, горючий и нетоксичный газ без запаха. Метан представляет собой тетраэдрическую молекулу, так как имеет четыре эквивалентные связи C-H. Вырабатывается кишечными анаэробами.
Это был бесцветный, горючий и нетоксичный газ без запаха. Метан представляет собой тетраэдрическую молекулу, так как имеет четыре эквивалентные связи C-H. Вырабатывается кишечными анаэробами.
Структура метана
Свойства метана
- Метан легче воздуха. (гравитация 0,554)
- Когда метан горит, пламя его слегка бледное, светящееся и очень горячее.
- Метан является одним из наиболее важных парниковых газов, так что почти 70% выбросов метана связано с деятельностью человека.
- Метан представляет собой сопряженную кислоту метанида.
Химическая формула | CH 4 |
Молекулярный вес | 16,04 г/моль | 9 0111
Температура плавления | -182,5 o C |
Температура кипения | -161,5 o C |
Плотность 901 04 | 0,656 кг/м 3 |
Растворимость | Растворим в воде |
Использование метана 9 0030
- Метан — источник энергии.
 Поэтому он используется в печах, водонагревателях и автомобилях в качестве топлива.
Поэтому он используется в печах, водонагревателях и автомобилях в качестве топлива. - Используется для выработки электроэнергии.
- Метан в очищенной жидкой форме используется в качестве топлива для ракет.
- Используется в качестве антифриза в промышленности.
- Метан является наиболее распространенным компонентом удобрений.
- Используется для дезинфекции продуктов, чтобы избавиться от бактерий.
- Используется при тестировании газового оборудования.
- Используется в газовых плитах.
- Неполное сгорание метана дает технический углерод, который используется в качестве армирующего агента в резине при производстве автомобильных шин.
Примеры вопросов
Вопрос 1. Опасен ли газ метан для окружающей среды?
Ответ:
Да, это вредно для окружающей среды. Если он выливается из прохудившейся трубы до ее использования, то он поглощает тепло солнца, что приводит к повышению температуры атмосферы и вызывает парниковый эффект.
Вопрос 2: Какова основная причина выброса метана?
Ответ:
Метан выделяется при добыче нефти, угля и природного газа. Деградация сельскохозяйственных отходов на городских свалках твердых бытовых отходов также приводит к выбросу метана.
Вопрос 3: Метан вреден для человека?
Ответ:
Метан сам по себе не токсичен. Но когда он вступает в реакцию с другими газами, он становится смертельным. Метан вытесняет кислород, вызывая удушье, которое вызывает головокружение и головную боль, но это часто остается незамеченным до тех пор, пока мозг не подаст сигнал телу, хватающему ртом воздух.
Вопрос 4: Можно ли извлекать метан из атмосферы?
Ответ:
Да бактерии используются для извлечения метана из воздуха. Поскольку это парниковый газ, ликвидация метана финансово конкурентоспособна с улавливанием углерода, даже если сами технологии более дороги.
Вопрос 5: Каков тетраэдрический валентный угол метана?
Ответ:
Тетраэдрический валентный угол метана равен 109,5°. Согласно теории отталкивания электронных пар валентной оболочки, это молекулярная структура с минимальным взаимным отталкиванием.
Вопрос 6: Чем отличается метан от двуокиси углерода в качестве парникового газа?
Ответ:
Метан гораздо менее распространен, чем двуокись углерода, но это очень мощная молекула для молекулы парникового газа, если учесть разницу в концентрациях и количество поглощаемого света метана примерно на треть. такой же мощный, как CO 2 в потеплении атмосферы.
Вопрос 7: Какое химическое соединение используется для удаления метана из атмосферы?
Ответ:
Поскольку метан является парниковым газом, его необходимо удалять из атмосферы.



 Поэтому он используется в печах, водонагревателях и автомобилях в качестве топлива.
Поэтому он используется в печах, водонагревателях и автомобилях в качестве топлива.


Leave A Comment