Углерод: формула, химические свойства, характеристики
Поможем понять и полюбить химию
Начать учиться
В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.

Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Название | Содержание углерода |
|---|---|
Антрацит | |
Бурые угли | 72% |
Каменные угли | 84% |
Горючие сланцы | 60% |
Нефть | 80% |
Горючие природные газы | До 99% метана |
Торф | 50% |
 В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.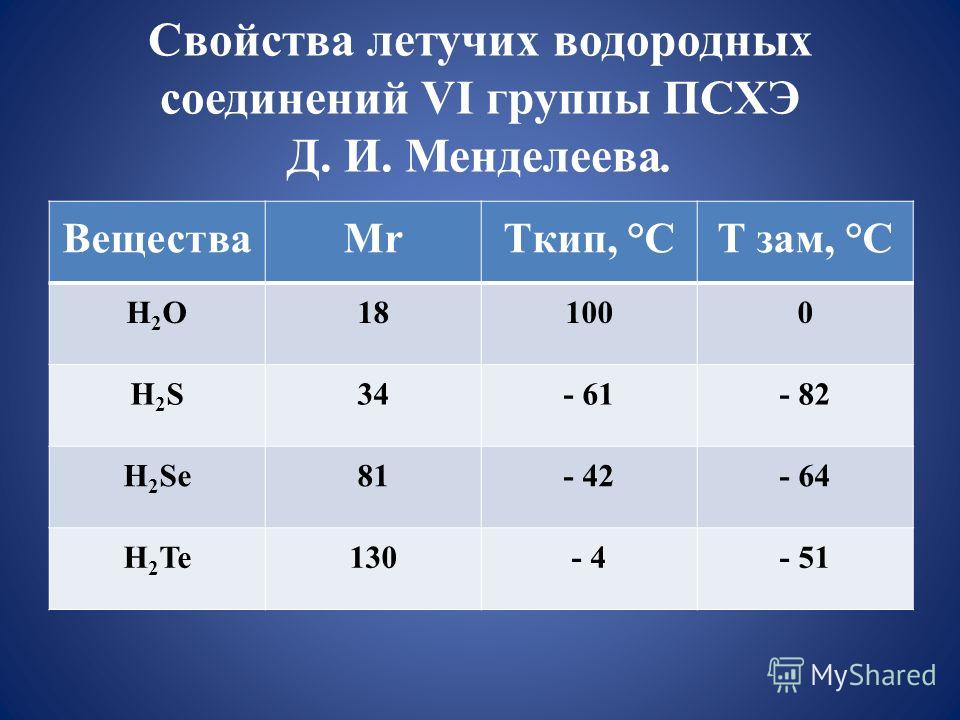
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д.
 И. Менделеева.
И. Менделеева.Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
Углерод является окислителем в реакции с:
Кислородом
Хлором
Водородом
Серой
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
В виде каких соединений углерод находится в природе?
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
Опишите физические свойства графена и карбина.
Для чего используют карботермию?
Чем обусловлено наличие аллотропных видоизменений углерода?
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир. Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Татьяна Сосновцева
К предыдущей статье
Химия сероводорода
К следующей статье
Простые и сложные вещества
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Ответы | § 35. Характеристика химического элемента по его положению в периодической системе — Химия, 8 класс
а) Литий
1) Название химического элемента — литий, химический знак Li, относительная атомная масса 7. -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов. -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Углеводороды
УглеводородыУглеводороды
Органические молекулы:
Органическая химия изучает свойства соединений углерода. Все соединения углерода, за исключением нескольких неорганических соединений углерода, являются органическими. Неорганические соединения углерода включают оксиды углерода, бикарбонаты и карбонаты ионов металлов, цианиды металлов и некоторые другие.
Углеводороды
Простейшие органические соединения состоят только из атомов углерода и водорода. Соединения только углерода и водорода называются Углеводороды .
Алканы
Простейший углеводород – метан, CH 4 . Это простейший член ряда углеводородов. Каждый последующий член ряда имеет на один атом углерода больше, чем предыдущий член. Этот ряд соединений называется алканов ( С n H 2n+2 ) . Более легкие газы и используются в качестве топлива. Средние (от 7 углеродов до 12 углеродов) — это жидкости, используемые в бензине (бензине). Высшие представляют собой воскообразные твердые вещества. Свечной воск представляет собой смесь алканов. Алканы являются насыщенными, что означает, что они содержат максимальное количество атомов водорода на углерод и не содержат двойных или тройных связей.
Наименование органических соединений относится к органической номенклатуре .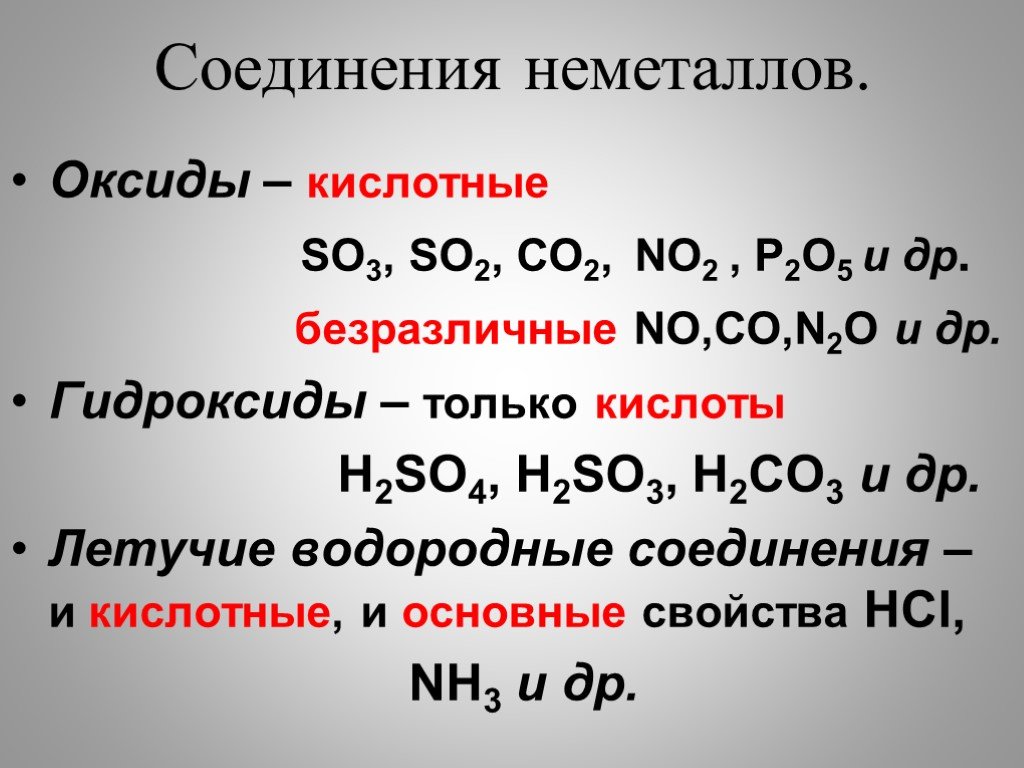 Существует множество правил именования органических соединений, систематизированных Международным союзом теоретической и прикладной химии 9.0003
Существует множество правил именования органических соединений, систематизированных Международным союзом теоретической и прикладной химии 9.0003
Правила ИЮПАК для номенклатуры алканов
1. Найдите и назовите самую длинную непрерывную углеродную цепь.
2. Определите и назовите группы, присоединенные к этой цепочке.
3. Последовательно пронумеруйте цепь, начиная с конца, ближайшего к группе заместителей.
4. Обозначьте расположение каждой группы заместителей соответствующим номером и названием.
5. Соберите название, перечислив группы в алфавитном порядке.
Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Количество атомов углерода | Префикс | Структура |
1 | Мет ан | CH 4 |
2 | Эт ан | CH 3 CH 3 |
3 | Опора ан | CH 3 CH 2 CH 3 |
4 | Бут ане | CH 3 (CH 2 ) 2 CH 3 |
5 | Пент ан | CH 3 (CH 2 ) 3 CH 3 |
6 | Шестигранник Ане | Ч 3 (CH 2 ) 4 CH 3 |
7 | Гепт ане | CH 3 (CH 2 ) 5 CH 3 |
8 | октябрь ан | CH 3 (CH 2 ) 6 CH 3 |
9 | Не ан | CH 3 (CH 2 ) 7 CH 3 |
10 | декабрь ан | CH 3 (CH 2 ) 8 CH 3 |
11 | Ундец ан | CH 3 (CH 2 ) 9 CH 3 |
12 | Додек ане | CH 3 (CH 2 ) 10 CH 3 |
Изомерия
Все алканы с 4 и более атомами углерода проявляют структурную изомерию . Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Это означает, что для каждой молекулярной формулы можно нарисовать две или более различных структурных формул.
Например, C 4 H 10 может быть любой из этих двух разных молекул:
Они называются соответственно бутан и 2-метилпропан .
Наименование структурных изомеров алканов
Номенклатура усложняется, если алкан разветвляется. В таком случае есть несколько правил, которым вы должны следовать, чтобы дать алкану правильное название.
- Найдите самую длинную углеродную цепь в молекуле. Количество атомов углерода в самой длинной цепи становится родительским именем (см. таблицу выше)
- Найдя исходную цепь, вы нумеруете исходную цепь, начиная с конца, ближайшего к первому заместителю (заместителем является любой фрагмент, выступающий за пределы основной цепи).

- Далее определите названия всех заместителей . Заместители называются так, как если бы часть была отдельной молекулой, за исключением того, что используется суффикс yl, а не ane. Таким образом, двухуглеродный заместитель будет этильным заместителем (а не этановым заместителем).
- Поместите заместители в алфавитном порядке (т.е. этил перед метилом) перед названием родителя.
- Затем определите положение всех заместителей в названии, поместив перед ним число атомов углерода, в котором заместитель присоединяется к исходной цепи. Например, 2-метилгептан указывает на то, что метильный заместитель присоединен к углероду номер 2.
Применение правил
Теперь попробуйте применить эти правила, чтобы назвать следующую молекулу (это не так сложно, как может показаться).
Действуйте шаг за шагом, как описано выше.
1) Найдите самую длинную углеродную цепь в молекуле. Во-первых, найдите исходную цепь в молекуле, то есть максимально длинную цепочку соединяющих атомов углерода. Обратите внимание, что родительская цепочка не обязательно является цепочкой, которая просто следует слева направо. Например, если бы вы посчитали количество атомов углерода в этой молекуле слева направо, вы бы получили 7 атомов углерода. Однако это не родительская цепочка! Если вы начнете слева, а затем подсчитаете, где молекула разветвляется, вы обнаружите, что в ней 8 атомов углерода. Это самая длинная цепь (не дайте себя обмануть профессорам, прячущим атомы углерода в ответвлениях), и, таким образом, исходной цепью является октан (см. таблицу выше).
2) Номер родительской цепочки. Второй шаг — пронумеровать атомы углерода в исходной цепи, начиная с конца, ближайшего к первому заместителю. Важно нумеровать молекулу с правильного конца (другими словами, в этом примере вы нумеруете алкан справа налево или слева направо). Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
Следуя этому правилу, на этой молекуле вы нумеруете справа налево, так как 2-углеродный заместитель находится ближе к этому концу.
| | |
| Правильная нумерация | Неправильная нумерация |
3. Назовите все заместители. Затем вы определяете имена заместителей. В этом случае единственным заместителем является 2-углеродная группа у 4-го атома углерода. Это этильная группа.
4. Расположите заместители в алфавитном порядке. Следующим шагом является расположение заместителей в алфавитном порядке (т.е. этил перед метилом), но так как есть только один заместитель, в этом нет необходимости.
5. Найдите заместитель в родительском изменении, присвоив ему номер . Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Таким образом, правильная номенклатура этого алкана — 4-этилоктан. Обратите внимание, что тире используется для отделения числа от заместителя.
Циклоалканы снова содержат только углерод-водородные связи и углерод-углеродные одинарные связи, но на этот раз атомы углерода соединены в кольцо. Наименьшим циклоалканом является циклопропан.
Если вы посчитаете атомы углерода и водорода, вы увидите, что они больше не соответствуют общей формуле C n H 2n+2 . Соединяя атомы углерода в кольцо, вы должны были потерять два атома водорода.
Вряд ли он вам когда-нибудь понадобится, но общая формула циклоалкана C н Н 2 н .
Не думайте, что это все плоские молекулы. Все циклоалканы от циклопентана и выше существуют в виде «сморщенных колец».
Циклогексан, например, имеет кольцевую структуру, которая выглядит следующим образом:
Эта форма циклогексана известна как «кресло» из-за его формы, отдаленно напоминающей стул.
Правила ИЮПАК для номенклатуры циклоалканов
1. Для монозамещенного циклоалкана кольцо дает название корня, а группа-заместитель называется, как обычно. Номер места необязателен.
2. Если алкильный заместитель большой и/или сложный, кольцо может быть названо замещающей группой алкана.
3. Если в кольце присутствуют два разных заместителя, они перечислены в алфавитном порядке, и первый указанный заместитель соответствует углероду №1. Затем нумерация атомов углерода в кольце продолжается в направлении (по часовой стрелке или против часовой стрелки), которое дает второму заместителю меньший возможный номер положения.
4. Если в кольце присутствует несколько заместителей, они перечислены в алфавитном порядке. Номера положений присваиваются заместителям таким образом, что один из них находится у углерода № 1, а другие положения имеют наименьшие возможные номера, считая либо по часовой стрелке, либо против часовой стрелки.
5. Название собирается, перечисляя группы в алфавитном порядке и присваивая каждой группе (если их две или более) номер местоположения. Приставки ди, три, тетра и т. д., используемые для обозначения нескольких однородных групп, при алфавитном алфавите не учитываются.
Алкены
Другая серия соединений называется алкенов . Они имеют общую формулу: C n H 2n . Алкены содержат меньше атомов водорода, чем алканы. Оставшиеся дополнительные валентности возникают в виде двойных связей между парой атомов углерода. Двойные связи более реакционноспособны, чем одинарные связи, что делает алкены химически более реакционноспособными.
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов
1. Суффикс ен (окончание) указывает на алкен или циклоалкен.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода двойной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода двойной связи . Если двойная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода двойной связи, используется в качестве локатора двойной связи. Если присутствует более одной двойной связи, соединение называется диеновым, триеновым или эквивалентным префиксом, указывающим количество двойных связей, и каждой двойной связи присваивается локаторный номер.
5. В циклоалкенах атомам углерода двойной связи отведены кольцевые позиции №1 и №2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
6. Группы заместителей, содержащие двойные связи:
H 2 C=CH– Винильная группа
H 2 C=CH–CH 2 – Аллильная группа
Алкины
Третьей серией являются алкины .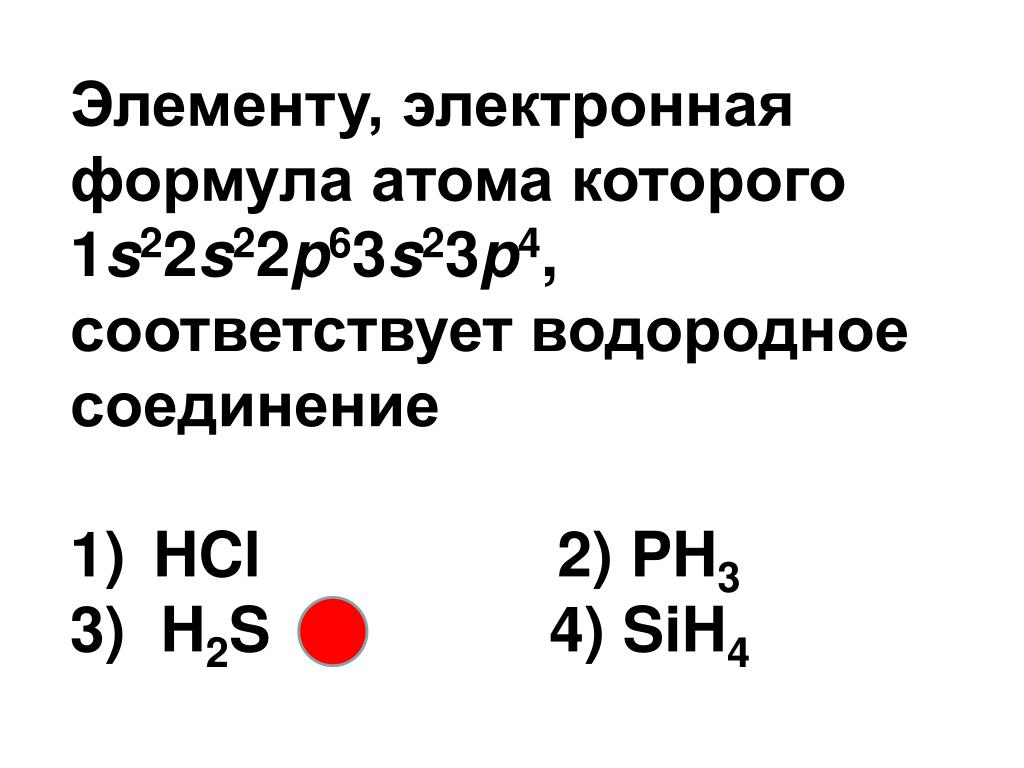 Они имеют следующую формулу: C n H 2n-2 .
Они имеют следующую формулу: C n H 2n-2 .
Алкины имеют два атома углерода, соединенных тройной связью. Это очень реакционноспособно, что делает эти соединения нестабильными.
Правила ИЮПАК для номенклатуры алкинов
1. Суффикс yne (окончание) указывает на алкин или циклоалкин.
2. Самая длинная цепь, выбранная для корневого названия, должна включать 90 551 оба атома углерода тройной связи 90 552 .
3. Корневая цепь должна быть пронумерована с конца, ближайшего к атому углерода тройной связи . Если тройная связь находится в центре цепи, для определения конца, с которого начинается нумерация, используется правило ближайшего заместителя.
4. Меньшее из двух чисел, обозначающих атомы углерода тройной связи, используется в качестве локатора тройной связи.
5. Если присутствует несколько множественных связей, каждой из них должен быть присвоен номер локатора. Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
Двойные связи предшествуют тройным связям в названии IUPAC, но цепочка нумеруется с конца, ближайшего к кратной связи, независимо от ее природы.
6. Поскольку тройная связь является линейной, она может быть размещена только в кольцах размером более десяти атомов углерода. В простых циклоалкинах атомам углерода тройной связи назначаются кольцевые положения № 1 и № 2. Какой из двух является номером 1, можно определить по правилу ближайшего заместителя.
7. Группы заместителей, содержащие тройные связи:
HC≡C– Этинильная группа
HC≡CH–CH 2 – Пропаргильная группа
Проблемы:
Нарисуйте структурную формулу 2-бром-4,4-дихлор-5,5-диметилгептана
Нарисуйте структурную формулу 4-бром-1-этилциклопентена
Нарисуйте структурную формулу 7-метил-6-октен-1,3-диина
Токсичность углеводородов — StatPearls — Книжная полка NCBI
Непрерывное обучение
Углеводороды — это соединения, содержащие водород и углерод. Обычно они являются основными компонентами многих видов топлива. Они могут быть в виде газа, жидкости, твердого вещества или полимеров. Воздействие этих веществ может вызвать значительный риск для здоровья. Токсичность зависит от множества переменных, включая свойства соединения, вязкость, поверхностное натяжение, летучесть и добавки. В этом мероприятии рассматриваются патофизиология, оценка и лечение токсичности углеводородов, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Обычно они являются основными компонентами многих видов топлива. Они могут быть в виде газа, жидкости, твердого вещества или полимеров. Воздействие этих веществ может вызвать значительный риск для здоровья. Токсичность зависит от множества переменных, включая свойства соединения, вязкость, поверхностное натяжение, летучесть и добавки. В этом мероприятии рассматриваются патофизиология, оценка и лечение токсичности углеводородов, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Определите этиологию токсичности углеводородов.
Опишите типичную клиническую картину пациента с отравлением углеводородами.
Опишите доступные варианты обработки и управления при токсичности углеводородов.
Опишите стратегии межпрофессиональной бригады по улучшению координации помощи и коммуникации для улучшения лечения токсичности углеводородов и улучшения результатов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Углеводороды представляют собой соединения, состоящие из водорода и углерода. Они классифицируются как ароматические (циклические) или алифатические (прямоцепочечные). Обычно они являются основными компонентами многих видов топлива и продуктов, используемых каждый день. Они могут быть в виде газа, жидкости, твердого вещества или полимеров. Воздействие этих веществ может вызвать значительный риск для здоровья. Токсичность зависит от множества переменных, включая свойства соединения, вязкость, поверхностное натяжение, летучесть и добавки.[1][2][3][4]
Этиология
Углеводороды делятся на четыре структурных класса.
Ароматические — содержат бензольное кольцо (наиболее токсичные) и используются в растворителях и клеях, а также в красках и растворителях.
Алифатические — нефтяные дистилляты, содержащиеся в полиролях, маслах для ламп и жидкости для зажигалок.
Галогенированные — фторированные, хлорированные или бромированные, используются для охлаждения (фреон), а также в качестве инсектицидов и гербицидов.

Терпен — содержится в скипидаре и сосновом масле. Некоторые из этих углеводородов можно найти в различных смешанных формах и использовать в качестве пропеллента для аэрозольных распылителей.
Способность углеводородов вызывать заболевания зависит от трех факторов.
Путь воздействия
Возможен прямой контакт с кожей, вызывающий местное раздражение кожи и, редко, системное заболевание. Однако длительное воздействие может привести к разрушению тканей и поверхностным химическим ожогам частичной толщины. Тяжелые, сплошные химические ожоги могут приводить к абсорбционным и острым системным токсическим проявлениям. Также может происходить проглатывание и вдыхание/аспирация углеводородов, что может указывать на заболевание и приводить к системной токсичности, заболеваемости и смертности.
Химические свойства
Химические свойства углеводородов, в том числе их летучесть, вязкость и поверхностное натяжение, влияют на болезнетворный потенциал углеводородов. Летучесть относится к скорости, с которой углеводород может испаряться или существовать в виде газа. Химические вещества с высокой летучестью имеют повышенный риск легочной абсорбции и могут привести к угнетению центральной нервной системы (ЦНС). Вязкость относится к способности сопротивляться потоку. Низкая вязкость обеспечивает более глубокое проникновение в легкие. Способность молекул прилипать к поверхности жидкости называется поверхностным натяжением. Низкое поверхностное натяжение позволяет соединениям легко распределяться по большим площадям.
Летучесть относится к скорости, с которой углеводород может испаряться или существовать в виде газа. Химические вещества с высокой летучестью имеют повышенный риск легочной абсорбции и могут привести к угнетению центральной нервной системы (ЦНС). Вязкость относится к способности сопротивляться потоку. Низкая вязкость обеспечивает более глубокое проникновение в легкие. Способность молекул прилипать к поверхности жидкости называется поверхностным натяжением. Низкое поверхностное натяжение позволяет соединениям легко распределяться по большим площадям.
Количество экспозиции
Воздействие углеводородов в однократной или кумулятивной дозе может определять системное воздействие на ЦНС у пациента.
Эпидемиология
Воздействие углеводородов на пациента с симптомами обычно происходит тремя путями. Во-первых, непреднамеренное проглатывание детьми продуктов домашнего обихода. Во-вторых, кожное или ингаляционное профессиональное воздействие. Наконец, преднамеренное рекреационное вдыхание углеводородов подростками и взрослыми. В отчете за 2016 год Американская ассоциация токсикологических центров сообщает, что воздействие углеводородов входит в число 25 наиболее часто встречающихся воздействий, показывая 29796 облучений с 24 смертельными исходами. Методы, используемые при преднамеренном вдохе, включали в себя фырканье, пыхтение и создание мешков. Нюхание относится к вдыханию непосредственно из контейнера или альтернативного контейнера, в который было добавлено вещество. Пыхтение означает пропитку полотенца или ткани веществом и наложение его на рот и нос, чтобы вдохнуть его. Бэггинг — это когда насильник помещает вещество в пластиковый или бумажный пакет и вдыхает, максимально увеличивая концентрацию. Воздействие может повлиять не только на дыхательную систему и ЦНС , но и на сердечно-сосудистую систему, желудочно-кишечный тракт и почки. Воздействие, приводящее к судорогам и смерти, обычно вызывается дыхательной недостаточностью, аритмиями (внезапная смерть от вдыхания) или тяжелыми поражениями ЦНС.[5]
В отчете за 2016 год Американская ассоциация токсикологических центров сообщает, что воздействие углеводородов входит в число 25 наиболее часто встречающихся воздействий, показывая 29796 облучений с 24 смертельными исходами. Методы, используемые при преднамеренном вдохе, включали в себя фырканье, пыхтение и создание мешков. Нюхание относится к вдыханию непосредственно из контейнера или альтернативного контейнера, в который было добавлено вещество. Пыхтение означает пропитку полотенца или ткани веществом и наложение его на рот и нос, чтобы вдохнуть его. Бэггинг — это когда насильник помещает вещество в пластиковый или бумажный пакет и вдыхает, максимально увеличивая концентрацию. Воздействие может повлиять не только на дыхательную систему и ЦНС , но и на сердечно-сосудистую систему, желудочно-кишечный тракт и почки. Воздействие, приводящее к судорогам и смерти, обычно вызывается дыхательной недостаточностью, аритмиями (внезапная смерть от вдыхания) или тяжелыми поражениями ЦНС.[5]
Патофизиология
Воздействие углеводородов может быть системным, поражая многие системы органов. [6][7][8][9]
[6][7][8][9]
Легочные эффекты
Вдыхание или аспирация могут привести к астмоподобному реактивному синдрому дыхательных путей, а также к химическому пневмониту. Углеводород имеет низкое поверхностное натяжение и малую вязкость, поэтому проникает глубоко в легкие. Это приводит к тяжелой некротизирующей пневмонии. Химические вещества могут также разрушать сурфактант, эпителий дыхательных путей, альвеолярные перегородки и легочные капилляры, что приводит к воспалению, ателектазу и лихорадке. Симптомы обычно проявляются в виде кашля и/или одышки.
Эффекты ЦНС
Воздействие на ЦНС может быть как краткосрочным, так и долгосрочным. В острой ситуации генерализованная депрессия может проявляться невнятной речью, дезориентацией, головной болью, головокружением, атаксией, обмороками, тошнотой, галлюцинациями, возбуждением, агрессивным поведением и судорожной активностью. Точный механизм воздействия углеводородов на ЦНС точно неизвестен; однако некоторые исследования показывают, что углеводороды могут влиять на NMDA, серотониновые, никотиновые, глутаматные рецепторы, потенциалзависимые ионные каналы и пути дофамина и ГАМК в головном мозге. Некоторые эффекты также могут быть связаны с метаболизмом углеводорода в нейротоксин. Длительное воздействие, например, на рабочем месте, также может привести к невропатии, уменьшению размера мозга и энцефалопатии. Воздействие на сердечно-сосудистую систему
Некоторые эффекты также могут быть связаны с метаболизмом углеводорода в нейротоксин. Длительное воздействие, например, на рабочем месте, также может привести к невропатии, уменьшению размера мозга и энцефалопатии. Воздействие на сердечно-сосудистую систему
Воздействие может вызвать аритмии. Углеводороды, в основном в галогенированной форме, могут повышать чувствительность миокарда к адреналину, что приводит к неперфузионному ритму. Они также могут оказывать отрицательное инотропное действие, а также дромотропное и хронотропное действие на миокард. Точный механизм неизвестен, но, по-видимому, связан с измененной функцией кальциевых, калиевых и натриевых каналов в миокарде. У хронических насильников могут быть шумы, связанные с легочной гипертензией, такие как нагрузка S2.[10] Воздействие на желудочно-кишечный тракт
Проглатывание может вызвать раздражение желудочно-кишечного тракта и разрушение эпителия, вызывая тошноту, рвоту, боль в животе и кровавую рвоту.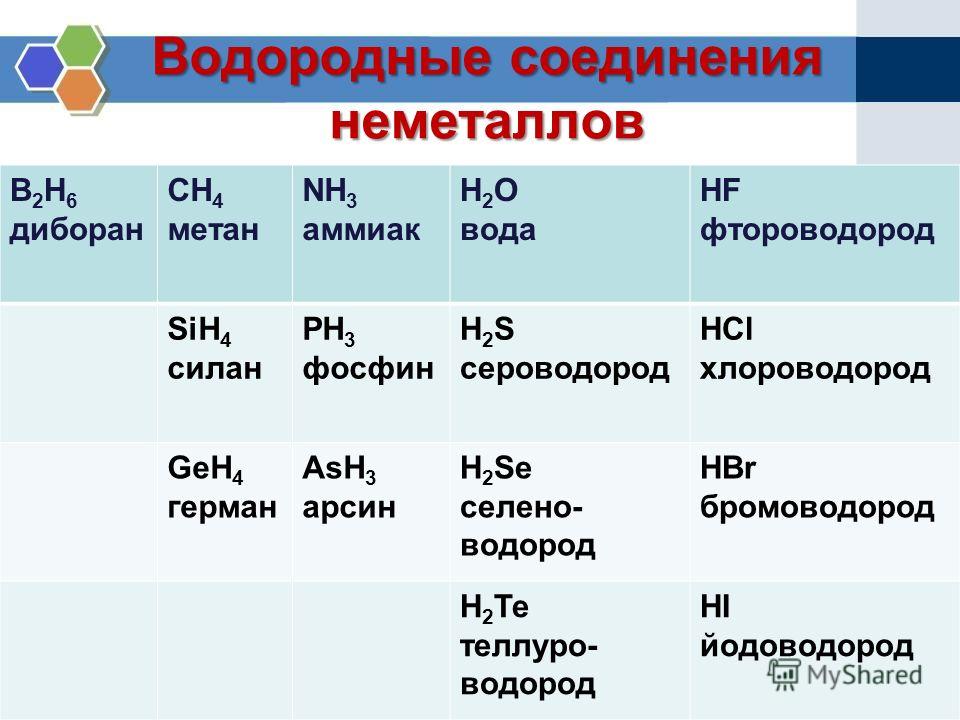 Некоторые растворители могут вызывать гепатотоксичность. Рвота углеводородами может привести к аспирации и пневмониту. Почечные эффекты
Некоторые растворители могут вызывать гепатотоксичность. Рвота углеводородами может привести к аспирации и пневмониту. Почечные эффекты
Углеводороды (в основном из-за толуола) могут вызывать метаболический ацидоз, приводящий к ацидозу почечных канальцев, мочекаменной болезни, гломерулонефриту, гиперхлоремии и гипокалиемии. Жестокое обращение может привести к повреждению как проксимальных, так и дистальных канальцев. Дерматологические эффекты
Воздействие на кожу может вызвать легкое раздражение или, при длительном воздействии, химические ожоги, варьирующиеся от поверхностных до ожогов на всю толщину. Полнослойные ожоги могут привести к системным симптомам. Раздражение кожи, обнаруженное периорально, известно как «сыпь при отравлении клеем». Поражения кожи могут проявляться в виде пузырей или волдырей. Другие кожные проявления включают желтуху и/или раздражение слизистых оболочек.
Исторический и физический
Воздействие углеводородов может проявляться по-разному. Подробная история инцидента необходима для определения характера воздействия. У пациентов без сознания необходимо опросить лиц, осуществляющих уход, службы неотложной медицинской помощи и прохожих, чтобы получить полную картину воздействия. Если возможно, попытайтесь получить контейнер или бутылку, которые использовались для точного определения химических веществ, воздействию которых подвергался пациент. Необходим тщательный анамнез с подробным медицинским и психологическим анамнезом. Просмотр медицинских карт пациентов также может помочь определить, есть ли в анамнезе жестокое обращение. Первоначальное физическое обследование должно быть сосредоточено на вдохе/аспирации. Больной может кашлять и испытывать затрудненное дыхание и одышку. Оценка основных показателей жизнедеятельности может выявить тахикардию, тахипноэ, гипоксию и лихорадку. Физический осмотр должен быть тщательным и включать респираторный, сердечно-сосудистый, неврологический и дерматологический осмотр. При дыхательном исследовании могут присутствовать хрипы.
Подробная история инцидента необходима для определения характера воздействия. У пациентов без сознания необходимо опросить лиц, осуществляющих уход, службы неотложной медицинской помощи и прохожих, чтобы получить полную картину воздействия. Если возможно, попытайтесь получить контейнер или бутылку, которые использовались для точного определения химических веществ, воздействию которых подвергался пациент. Необходим тщательный анамнез с подробным медицинским и психологическим анамнезом. Просмотр медицинских карт пациентов также может помочь определить, есть ли в анамнезе жестокое обращение. Первоначальное физическое обследование должно быть сосредоточено на вдохе/аспирации. Больной может кашлять и испытывать затрудненное дыхание и одышку. Оценка основных показателей жизнедеятельности может выявить тахикардию, тахипноэ, гипоксию и лихорадку. Физический осмотр должен быть тщательным и включать респираторный, сердечно-сосудистый, неврологический и дерматологический осмотр. При дыхательном исследовании могут присутствовать хрипы. Пациент с эффектами ЦНС может проявлять эйфорию, возбуждение, галлюцинации или спутанность сознания, которые затем могут прогрессировать до угнетения ЦНС или судорог. Эта первоначальная оценка поможет определить наилучший следующий шаг. Признаки пыхтения, фырканья или мешковатости могут присутствовать, например, в виде остатков периоральной боли или дерматита.
Пациент с эффектами ЦНС может проявлять эйфорию, возбуждение, галлюцинации или спутанность сознания, которые затем могут прогрессировать до угнетения ЦНС или судорог. Эта первоначальная оценка поможет определить наилучший следующий шаг. Признаки пыхтения, фырканья или мешковатости могут присутствовать, например, в виде остатков периоральной боли или дерматита.
Оценка
Диагноз обычно вычитается клинически на основании анамнеза и физического состояния.
Лечение/управление
Первоначальное лечение должно основываться на клинической картине и должно быть сосредоточено на возможной дыхательной или сердечной недостаточности. Медицинские работники должны быть готовы при необходимости защитить дыхательные пути, используя неинвазивные или инвазивные методы. Бета-агонисты могут быть использованы при хрипах, но могут быть бесполезны. Если обнаружена тяжелая легочная токсичность, переходите к интубации, так как у пациентов может быстро наступить декомпенсация. Высокое положительное давление в конце выдоха обычно показано для поддержания альвеол.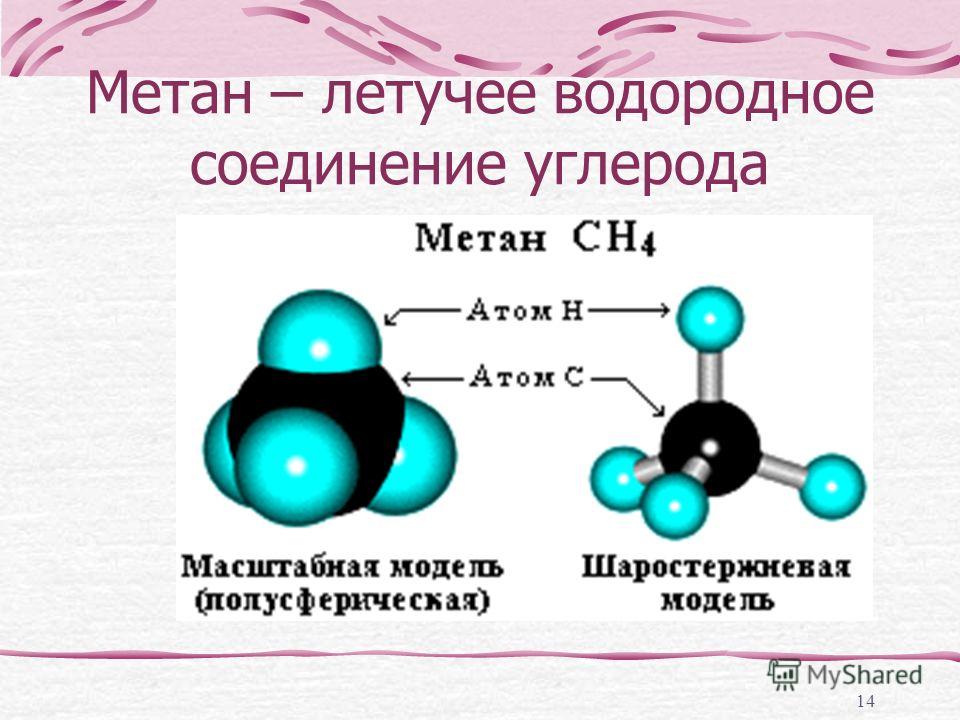 Антибиотики могут быть оправданы при подозрении на сопутствующую инфекцию. Тем, у кого проявляются сердечно-сосудистые симптомы, в случаях гипотонии потребуется агрессивная внутривенная гидратация жидкости. Желудочковые аритмии следует лечить бета-блокаторами, чтобы предотвратить выбросы катехоламинов. Катехоламинов, таких как адреналин, следует избегать, учитывая повышенную чувствительность проводящей системы, связанную с углеводородами.
Антибиотики могут быть оправданы при подозрении на сопутствующую инфекцию. Тем, у кого проявляются сердечно-сосудистые симптомы, в случаях гипотонии потребуется агрессивная внутривенная гидратация жидкости. Желудочковые аритмии следует лечить бета-блокаторами, чтобы предотвратить выбросы катехоламинов. Катехоламинов, таких как адреналин, следует избегать, учитывая повышенную чувствительность проводящей системы, связанную с углеводородами.
Пациентам с воздействием на кожу необходимо снять одежду и провести обеззараживание с мылом и теплой водой. Для безопасности персонала и поставщиков медицинских услуг следует использовать меры предосторожности при контакте. Пациенты проявляют возбуждение или судороги должны быть назначены бензодиазепинами. Пациентам может потребоваться фиксация для их собственной защиты безопасности персонала или медицинских работников. Симптомы желудочно-кишечного тракта обычно не требуют лечения или обеззараживания. Перед началом обеззараживания желудочно-кишечного тракта следует проконсультироваться с местным токсикологическим центром. Легочный CHAMP полезен для определения серьезных/опасных для жизни случаев проглатывания.
Легочный CHAMP полезен для определения серьезных/опасных для жизни случаев проглатывания.
C — Camphor
H — Halogenated hydrocarbons
A — Aromatic hydrocarbons
M — Metals
P — Pesticides
Halogenated hydrocarbons may cause dysrhythmias and hepatotoxicity, where ароматические углеводороды могут вызвать угнетение костного мозга и рак.
Первоначальные заказы должны включать рентгенограмму грудной клетки, чтобы помочь в определении степени повреждения легких. Лабораторные исследования, как правило, бесполезны при оценке острого воздействия, но могут определить влияние на другие системы органов. Полезные лабораторные тесты могут включать общий анализ крови, насыщение крови кислородом, электролиты сыворотки, функциональные пробы печени, креатинин, глюкозу и анализ мочи. Также может быть полезен электрокардиограф. Удлиненный интервал QT, подъем сегмента ST, брадикардия, SVT, AV-блокады, фибрилляция предсердий, преждевременные сокращения желудочков и фибрилляция желудочков — все это возможные изменения ЭКГ при воздействии углеводородов. Пациента следует поместить на кардиомонитор для возможных аритмий и пульсоксиметрию для выявления гипоксии. Заменяйте электролиты по мере необходимости, так как при воздействии углеводородов часто встречается гипокалиемия. Основным методом лечения токсичности углеводородов является поддерживающая терапия, и большинство симптомов исчезают в течение короткого времени наблюдения. Если после периода наблюдения от 4 до 6 часов отсутствуют признаки легочной или системной токсичности, включая четкую рентгенограмму грудной клетки, пациент может быть выписан домой с последующим амбулаторным наблюдением и строгими мерами предосторожности при возвращении. Если после наблюдения сохраняются системные или легочные симптомы, может потребоваться госпитализация и длительное наблюдение. N-ацетилцистеин можно рассматривать в случаях токсичности печени, связанной с определенными токсинами, такими как четыреххлористый углерод. Другие соображения включают рассмотрение токсичности добавок, которые могут сосуществовать с углеводородами.
Пациента следует поместить на кардиомонитор для возможных аритмий и пульсоксиметрию для выявления гипоксии. Заменяйте электролиты по мере необходимости, так как при воздействии углеводородов часто встречается гипокалиемия. Основным методом лечения токсичности углеводородов является поддерживающая терапия, и большинство симптомов исчезают в течение короткого времени наблюдения. Если после периода наблюдения от 4 до 6 часов отсутствуют признаки легочной или системной токсичности, включая четкую рентгенограмму грудной клетки, пациент может быть выписан домой с последующим амбулаторным наблюдением и строгими мерами предосторожности при возвращении. Если после наблюдения сохраняются системные или легочные симптомы, может потребоваться госпитализация и длительное наблюдение. N-ацетилцистеин можно рассматривать в случаях токсичности печени, связанной с определенными токсинами, такими как четыреххлористый углерод. Другие соображения включают рассмотрение токсичности добавок, которые могут сосуществовать с углеводородами.
Дифференциальный диагноз
Анамнез и физическое определение токсичности углеводородов. Однако, если диагноз неясен, рассмотрите другие признаки, присутствующие у измененного пациента, включая нарушения сна, глубокую депрессию/тревогу, злоупотребление психоактивными веществами, нейродегенеративное заболевание, новообразования, метаболические причины, травму и токсическую энцефалопатию.
Улучшение результатов бригады здравоохранения
С токсичностью углеводородов лучше всего справляется межпрофессиональная бригада, в которую входят врачи скорой помощи, специалисты по токсикологии и медицинскому персоналу. Медицинский персонал должен защитить себя от вторичного облучения, надев соответствующие СИЗ. Первоначальное лечение является поддерживающим и удаляет пациента из окружающей среды, чтобы предотвратить дальнейшее воздействие. Обеззараживание одежды жизненно важно, поскольку эти химические вещества могут впитываться через кожу. Пациенты нуждаются в длительном наблюдении, поскольку есть доказательства того, что эти химические вещества могут вызывать подавление костного мозга и рак.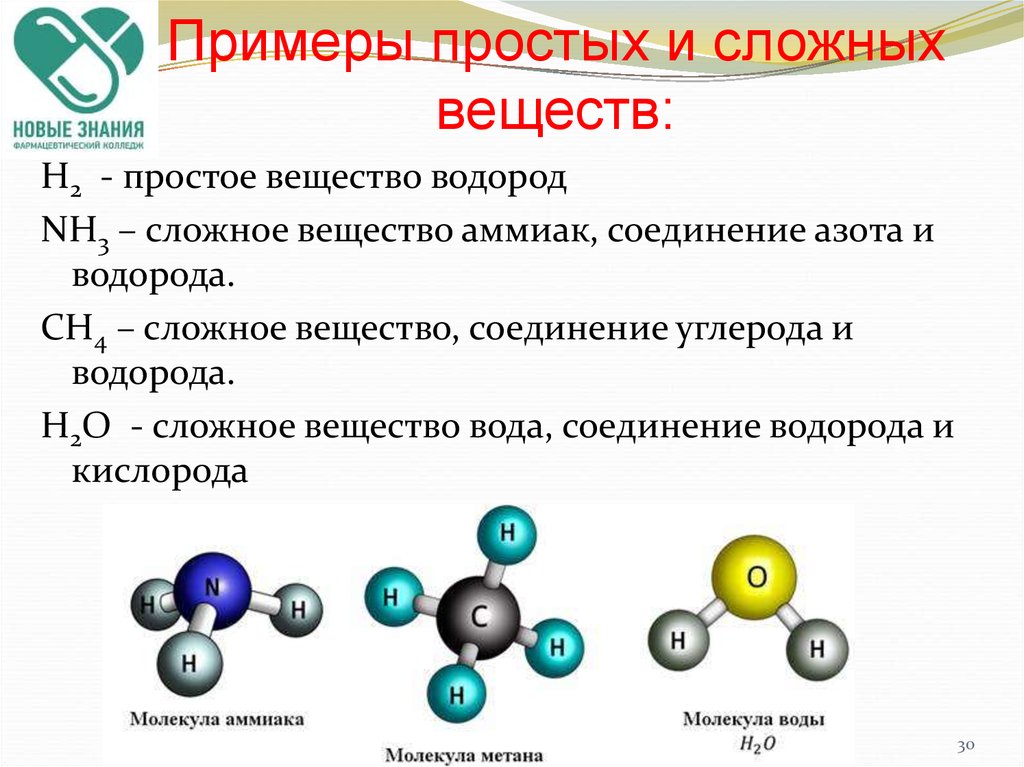
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Aggarwal S, Jilling T, Doran S, Ahmad I, Eagen JE, Gu S, Gillespie M, Albert CJ, Ford D, Oh JY, Patel RP, Matalon S. Phosgene вдыхание вызывает гемолиз и острое повреждение легких. Токсикол Летт. 2019 15 сентября; 312: 204-213. [Бесплатная статья PMC: PMC6653688] [PubMed: 31047999]
- 2.
Билал М, Икбал ХМН. Взгляд на токсичность и неблагоприятные последствия космецевтики для здоровья человека — обзор. Научная общая среда. 2019 20 июня; 670: 555-568. [PubMed: 30909033]
- 3.
Songbo M, Lang H, Xinyong C, Bin X, Ping Z, Liang S. Окислительное стрессовое повреждение при кардиотоксичности, вызванной доксорубицином. Токсикол Летт. 2019 01 июня; 307: 41-48. [PubMed: 30817977]
- 4.
Бок КВ.
 Арилуглеводородный рецептор (AHR) функционирует в NAD + метаболизм, миелопоэз и ожирение. Биохим Фармакол. 2019 Май; 163: 128-132. [PubMed: 30779909]
Арилуглеводородный рецептор (AHR) функционирует в NAD + метаболизм, миелопоэз и ожирение. Биохим Фармакол. 2019 Май; 163: 128-132. [PubMed: 30779909]- 5.
Друвал Э., Рак А., Грегоращук Э.Л. Обзор: Полициклические ароматические углеводороды (ПАУ) — действие на функцию плаценты и риски для здоровья новорожденных в будущем. Токсикология. 2019 01 января; 411: 133-142. [PubMed: 30321648]
- 6.
Циаусис Дж., Антониу М.Н., Колиаракис И., Меснаге Р., Вардавас С.И., Изотов Б.Н., Псарулаки А., Цацакис А. Влияние одиночного и комбинированного токсического воздействия на микробиом кишечника: текущие данные знания и будущие направления. Токсикол Летт. 201915 сент.; 312:72-97. [PubMed: 31034867]
- 7.
Демиртепе Х., Мелимук Л., Даймонд М.Л., Баярд Л., Войта Ш., Прокеш Р., Санка О., Кланова Дж., Палковичова Муринова В., Рихтерова Д., Раштерова Д. Связь прошлого использования устаревших SVOC с сегодняшними уровнями внутри помещений и воздействием на человека.


 И. Менделеева.
И. Менделеева.

 Арилуглеводородный рецептор (AHR) функционирует в NAD + метаболизм, миелопоэз и ожирение. Биохим Фармакол. 2019 Май; 163: 128-132. [PubMed: 30779909]
Арилуглеводородный рецептор (AHR) функционирует в NAD + метаболизм, миелопоэз и ожирение. Биохим Фармакол. 2019 Май; 163: 128-132. [PubMed: 30779909]
Leave A Comment