Кто является промежуточным хозяином печеночного сосальщика? Жизненный цикл печеночного сосальщика
- 1 Марта, 2020
- Первая помощь
- Ксения Кульшина
Паразитарные болезни человека — это проблема, которая так или иначе затрагивает все сферы жизни и людей любого социального достатка. Заразиться гельминтозом возможно даже после соблюдения всех мер предосторожности, недостаточно тщательно промыв яблоко или съев недостаточно прожаренное мясо.
Печеночный сосальщик — плоский червь из семейства паразитов, который проникает в организм животных и человека извне и обитает в желчевыводящих путях печени, а также в самом органе. Чаще всего заболевают люди в странах с жарким климатом, например, в Центральной Африке или Южной Америке. Болезнь может поразить не только жителей государств с низким уровнем жизни, но и граждан вполне благополучных европейских стран. Это связано с высокой приспособляемостью червя и его редкой устойчивостью к различным факторам внешней среды.
Болезнь может поразить не только жителей государств с низким уровнем жизни, но и граждан вполне благополучных европейских стран. Это связано с высокой приспособляемостью червя и его редкой устойчивостью к различным факторам внешней среды.
Необычное название связано с наличием на поверхности червя нескольких присосок, благодаря которым он передвигается по протокам гепатобилиарной системы (в нее входят печень, желчный пузырь и поджелудочная железа). Его очень сложно обнаружить в организме, и врачи часто лечат эти органы от какой-либо другой патологии, не догадываясь, что причиной недомогания является гельминт. Многие люди интересуются, кто является хозяином печеночного сосальщика? Являются им, в основном, такие травоядные животные, как коровы, лошади и козы.
Виды печеночных сосальщиков
Печеночный сосальщик — это не один вид червей, а сразу несколько, объединенных в один класс по некоторым признакам. К ним относятся:
- кошачья двуустка;
- китайский сосальщик;
- печеночная двуустка;
- ланцетовидный сосальщик;
- гигантский сосальщик.

У человека заболевание фасциолез вызывает именно печеночная двуустка или реже гигантская двуустка.
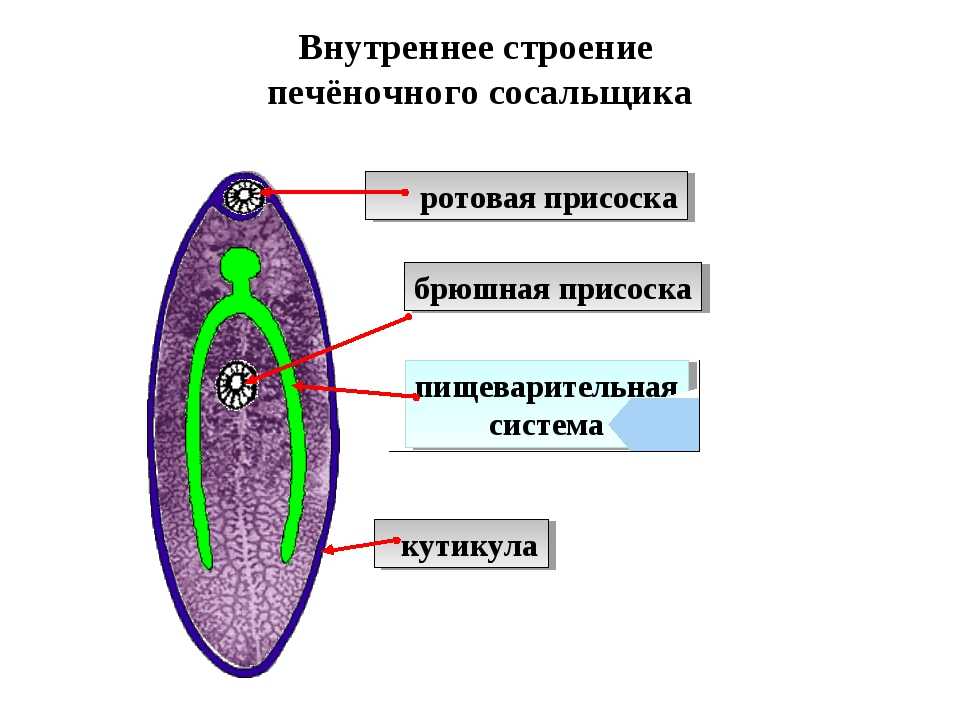
Морфология и строение
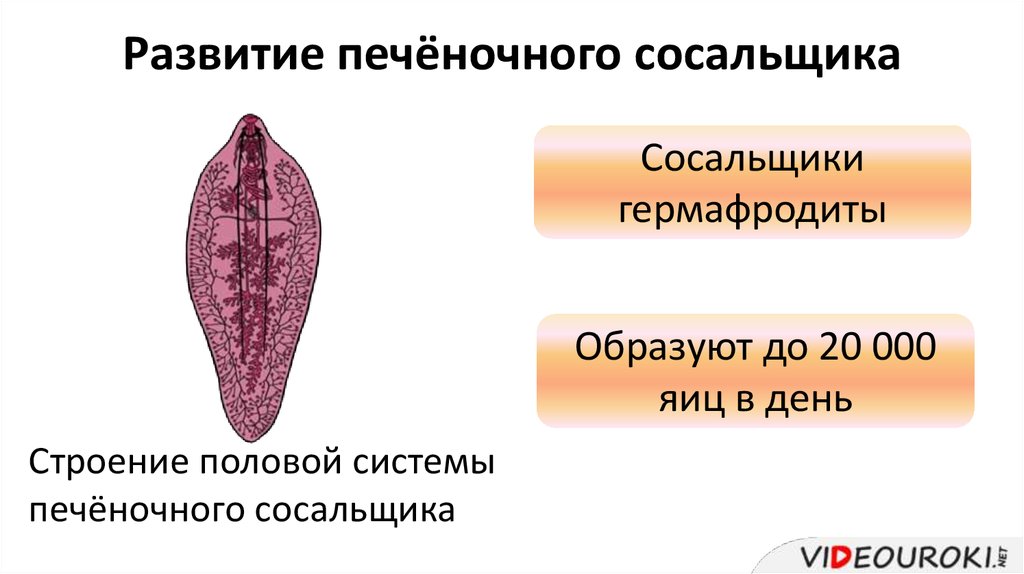
Это достаточно большой паразит, размером до 3 см в длину. В ширину достигает около 1 см. Тело вытянутое и имеет форму листа. Хозяин печеночного сосальщика — позвоночное животное, в организме которого он передвигается с помощью головной и брюшной присосок. Червь является гермафродитом, поэтому в средней части имеются разветвленные яичники. У паразита хорошо развита пищеварительная система, в которой есть зачатки кишечника.
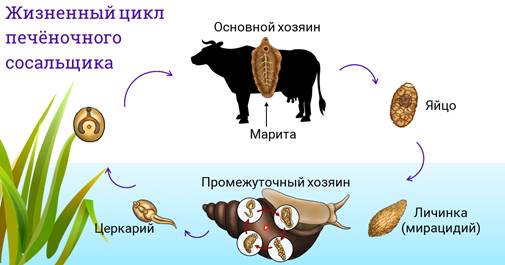
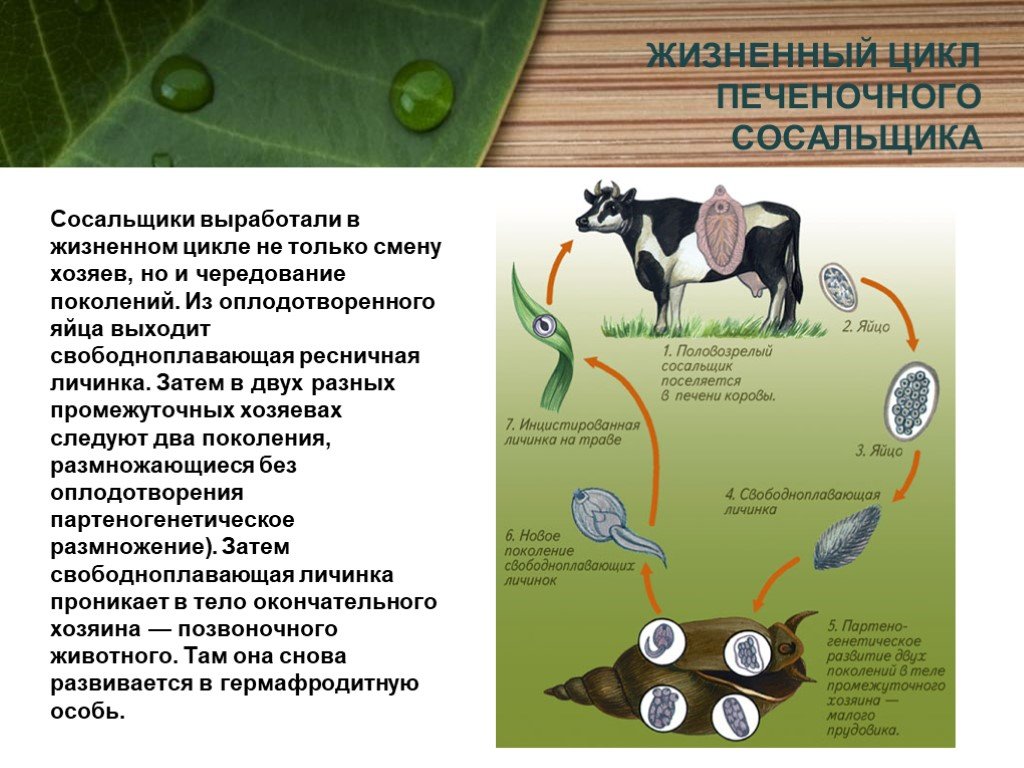
Жизненный цикл печеночного сосальщика
У данного червя довольно сложный жизненный цикл. В процессе жизни печеночный сосальщик меняет двух хозяев: основного и промежуточного. Врачи много лет задавались вопросом, какое животное является основным хозяином печеночного сосальщика? Довольно долго вопрос оставался без ответа. Относительно недавно, около 50 лет назад, было, наконец, установлено, что основной хозяин печеночного сосальщика — это позвоночные травоядные животные, например, коровы или козы, а также собственно человек.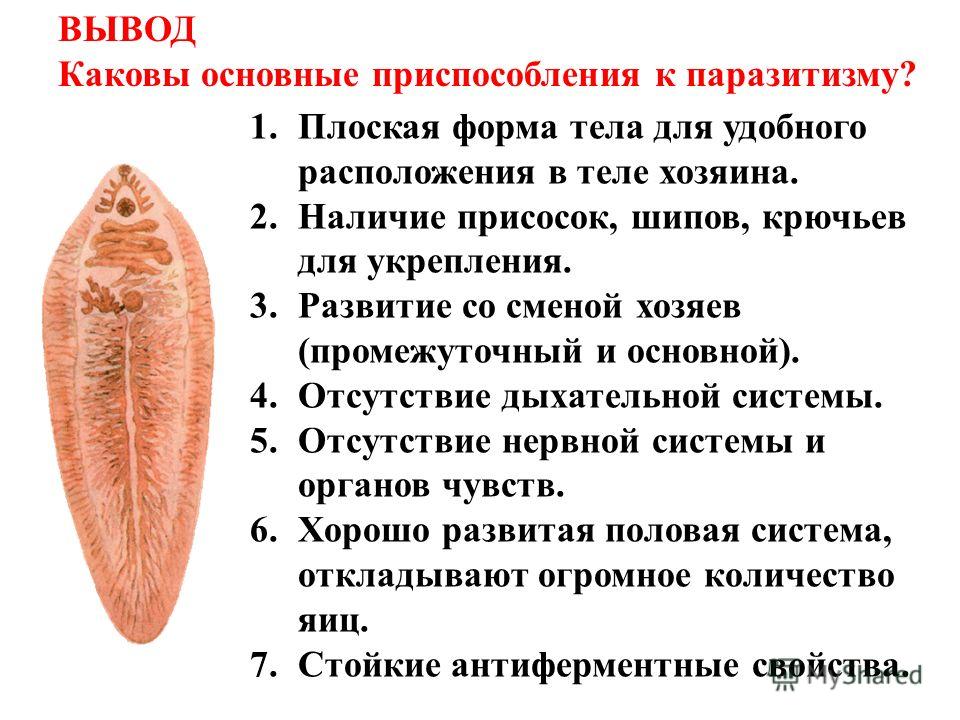
Развитие личинок до попадания в организм промежуточного хозяина
Часто паразиты имеют сложную систему развития. Так, печеночный сосальщик имеет промежуточного хозяина. Чаще всего им становится пресноводный моллюск — прудовик. Промежуточный хозяин печеночного сосальщика обитает практически повсеместно, в любых сырых, влажных местах.
Сосальщик — паразит, который имеет сложную систему развития. Экскременты от зараженных животных попадают в воду, а содержащиеся в них мельчайшие яйца глиста — фасциолы, развиваются постепенно на дне, чтобы выйти в виде личинок — мирацидий. Личинки в состоянии передвигаться благодаря наличию ресничек на поверхности мерцательного эпителия, которым они покрыты. В свободном виде, в воде, они могут просуществовать не более 2 суток. Если они не нашли за это время прудовика, мирацидии погибают.
Развитие в организме улитки-прудовика
Дальнейший этап — заражение следующего хозяина сосальщиком — промежуточного. Печеночный сосальщик проникает внутрь благодаря наличию особых желез вокруг рта личинки. Попав внутрь моллюска, личинка постепенно превращается в спороцисту, которая уже не способна к самостоятельному движению, так как потеряла реснички. Благодаря осмосу она забирает питательные вещества из организма промежуточного хозяина печеночного сосальщика (коим она, по сути, и является) и постепенно преобразовывается в следующую стадию развития паразита — редии. Редии имеют более сложное строение, и даже зачаточную пищеварительную систему, которая позволяет им заглатывать ртом ткани хозяина и таким образом получать необходимые вещества. Промежуточные хозяева печеночного сосальщика — обыкновенные улитки-прудовики.
Попав внутрь моллюска, личинка постепенно превращается в спороцисту, которая уже не способна к самостоятельному движению, так как потеряла реснички. Благодаря осмосу она забирает питательные вещества из организма промежуточного хозяина печеночного сосальщика (коим она, по сути, и является) и постепенно преобразовывается в следующую стадию развития паразита — редии. Редии имеют более сложное строение, и даже зачаточную пищеварительную систему, которая позволяет им заглатывать ртом ткани хозяина и таким образом получать необходимые вещества. Промежуточные хозяева печеночного сосальщика — обыкновенные улитки-прудовики.
Внутри редий расположены особые клетки, где вследствие многочисленных преобразований развивается второе их поколение, а уже из него — особая форма личинок под названием церкария. Церкария имеет длинное тело с присосками и хвостом. В организме промежуточного хозяина печеночные сосальщики проводят около месяца.
Как они попадают в организм к коровам или лошадям?
Такая неприятность случается, если фермеры, вопреки рекомендациям, выпасают своих животных на заболоченных, сырых местностях.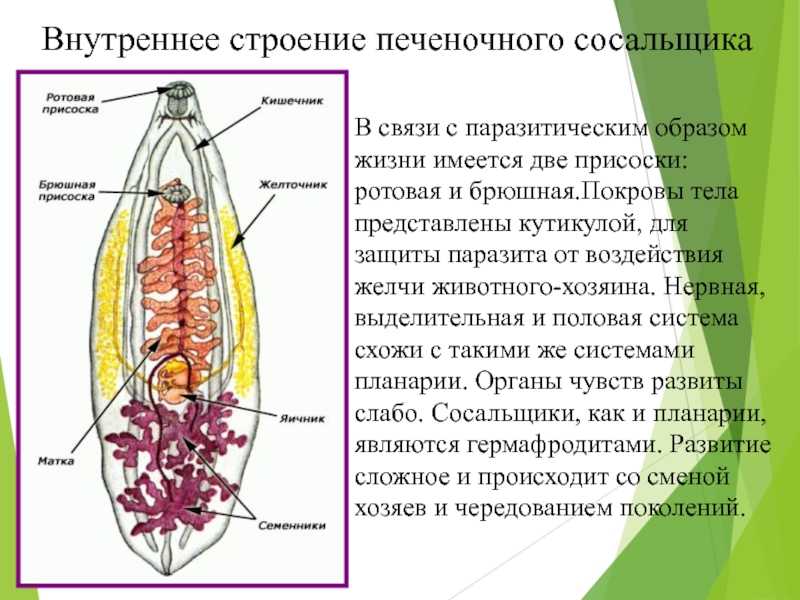 Церкария некоторое время плавает в водоеме свободно, а затем прикрепляется к какому-либо водному растению и образует цисту, в виде которой может существовать долгие годы. Животному достаточно съесть такое растение, чтобы заболеть фасциолезом, или, как говорят в быту, гниением печени.
Церкария некоторое время плавает в водоеме свободно, а затем прикрепляется к какому-либо водному растению и образует цисту, в виде которой может существовать долгие годы. Животному достаточно съесть такое растение, чтобы заболеть фасциолезом, или, как говорят в быту, гниением печени.
Наибольший вред паразит наносит основному хозяину. Хозяева печеночного сосальщика — в основном, травоядные животные. Особенно часто поражает паразит организм овец или коров. Смертность овец достигает в некоторых случаях 100 процентов.
По пищеварительному тракту хозяина сосальщик проникает в протоки печени, где находится до своего полового созревания. Полностью цикл развития завершается за 2-3 месяца. Именно поэтому по окончании пастбищного сезона важно провести дегельминтизацию скота.
Профилактика фасциолеза у животных
Включает в себя обязательную дегельминтизацию коров и овец в конце осени, когда животных переводят в зимние помещение. Перед выпасом животных нужно проверять территорию, на которой они будут пастись. Болотистые местности обязательно осушают. Проводятся расчеты, в зависимости от которых постепенно меняют животных, пасущихся на одних и тех же пастбищах. Это проводится из таких соображений — личинка развивается примерно за 90 дней, следовательно, если поменять животных за такой период трижды, адолескарии не успеют развиться в полноценных особей и заразить скот. Сельскохозяйственные животные, которые могут стать основными хозяевами печеночного сосальщика, должны обязательно проходить санитарную обработку от данных паразитов.
Болотистые местности обязательно осушают. Проводятся расчеты, в зависимости от которых постепенно меняют животных, пасущихся на одних и тех же пастбищах. Это проводится из таких соображений — личинка развивается примерно за 90 дней, следовательно, если поменять животных за такой период трижды, адолескарии не успеют развиться в полноценных особей и заразить скот. Сельскохозяйственные животные, которые могут стать основными хозяевами печеночного сосальщика, должны обязательно проходить санитарную обработку от данных паразитов.
Профилактика заболевания у человека
Основной путь заражения у человека — питье некипяченой воды из непроверенных водоемов. Воду в походах надо кипятить в течение 10 минут. Также человек может заразиться фасциолезом при поедании сырой или недожаренной рыбы или мяса от скота, который был заражен личинками. Человек в таком случае становится окончательным хозяином печеночного сосальщика. Заражение может произойти даже если употреблять фрукты или овощи, которые выросли на сырой, болотистой земле без должной обработки.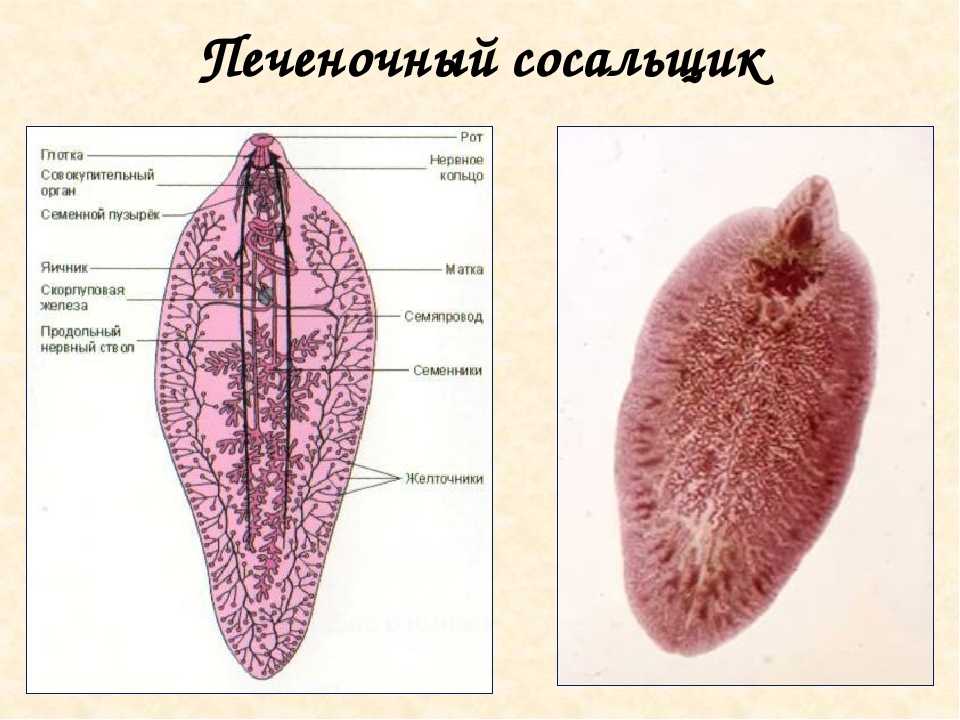
Симптомы заболевания у человека
Первые признаки заболевания у человека проявляются в течение 3 месяцев после попадания печеночного сосальщика в организм. На протяжении 2-4 недель заболевшего может мучить не проходящий кашель. Затем резко поднимается температура, появляется характерная сыпь на животе. Печень увеличивается в размерах и ее легко прощупать. Пальпация болезненная. Недомогание может сопровождаться потерей аппетита и болью в животе.
В хронической фазе боли исчезают, но печень остается постоянно увеличенной. Человек постепенно теряет в весе, болезнь может сопровождаться обмороками, головокружениями, приступами стенокардии. Значительно ухудшается питание организма и поступление в него питательных веществ, так как паразит в ходе своей жизнедеятельности поглощает витамины, а также белки и жиры, предназначенные для самого организма. Может уменьшатся количество эритроцитов и лейкоцитов, так как червь заглатывает их, путешествуя по кровеносным сосудам.
Паразиты губительно действуют своей жизнедеятельностью на печень, что приводит к воспалению ее функциональной ткани (гепатиту). Вследствие этого орган не может справиться с нагрузкой, и обмен веществ нарушается. Это может привести даже к интоксикации. Резко изменяются как биохимические, так и общие анализы крови, которые показывают увеличение эозинофилов и высокое СОЭ.
Вследствие этого орган не может справиться с нагрузкой, и обмен веществ нарушается. Это может привести даже к интоксикации. Резко изменяются как биохимические, так и общие анализы крови, которые показывают увеличение эозинофилов и высокое СОЭ.
Для диагностики заболевания врачи обычно советуют сдать анализ на антитела к данному паразиту, а также берут для микроскопического исследования кал и мочу. Во время острой стадии заболевания нередко обнаруживают характерные уплотнения в печени и почках. Это можно выявить с помощью УЗИ. Антитела к данному паразиту выделяются даже после излечения на протяжении целых 12 месяцев.
Лечение у человека
Основная цель лечения — стабилизировать состояние больного. С этой целью назначают «Триклабендазол» и «Нитазоксанид». Назначают диету № 5, которая призвана облегчить состояние организма и уменьшить нагрузку на печень. До полного излечения не рекомендуется пользоваться общей посудой. Также не заразить окружающих поможет соблюдение личной гигиены и влажная уборка.
Осложнения заболевания
Если пренебрежительно относиться к заболеванию и не слишком сильно задумываться над лечением либо несвоевременно прийти к врачу с жалобами на боль в области печени, паразит может добраться до остальных органов и капитально ухудшить состояние пациента. Может начаться гнойное воспаление таких органов как печень, желчный пузырь, поджелудочная железа. Вследствие воспаления желчного пузыря нередко возникает перитонит, то есть воспаление брюшной полости.
Поджелудочная железа особенно остро реагирует на данного паразита. Так как дисфункция этого органа может привести к нарушению выработки гормона инсулина, часто заражение фасциолами приводит к диабету либо обострению состояния у диабетиков. Нередко из-за переполнения кровеносных сосудов червями образуются кисты поджелудочной железы. Из-за недостаточного питания клетки печени перерождаются, и образуются опухоли, чаще всего злокачественные.
Таким образом, данный паразит имеет сложный жизненный цикл, в ходе которого два раза меняет своих хозяев.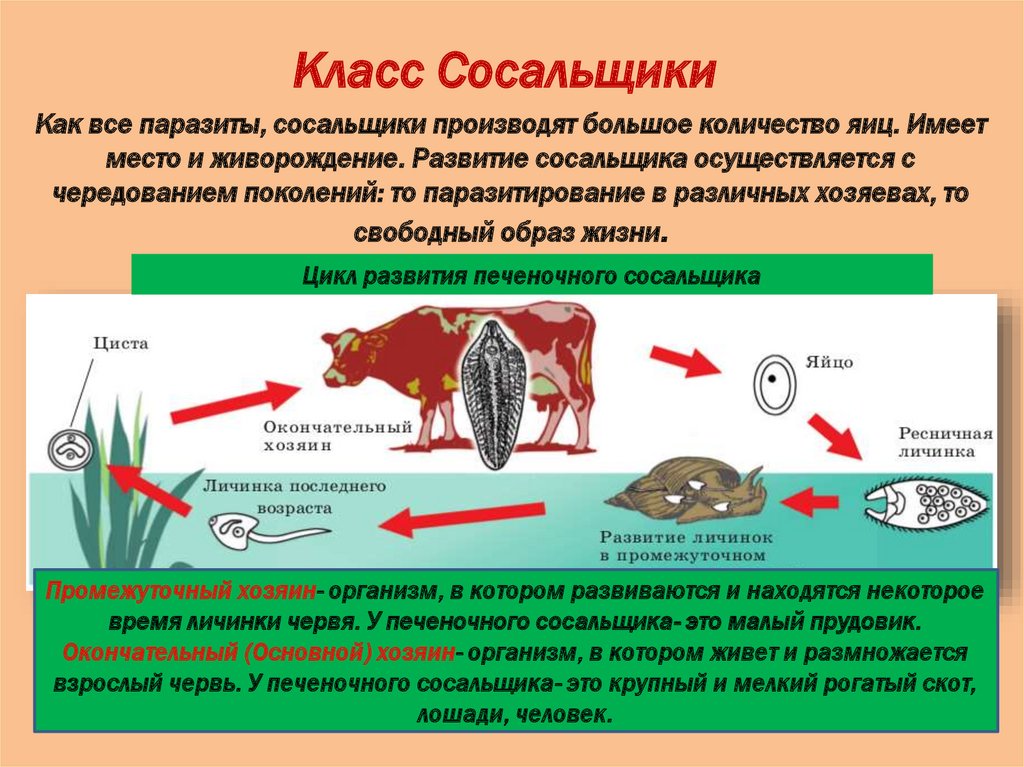 Промежуточный хозяин сосальщика — обыкновенный прудовик, а основными хозяевами могут стать как животные, так и человек. Простые меры предосторожности помогут защитить себя и своих питомцев от данного заболевания.
Промежуточный хозяин сосальщика — обыкновенный прудовик, а основными хозяевами могут стать как животные, так и человек. Простые меры предосторожности помогут защитить себя и своих питомцев от данного заболевания.
Похожие статьи
Болезнь Альцгеймера: профилактика, симптомы и лечение
Дерматология
Удаление бородавок жидким азотом: особенности, принцип лечения, отзывы, фото и последствия
Дерматология
Уксус от бородавок: причины появления, методы лечения, эффективные рецепты, отзывы
Cтоматология
Таблетки от зубной боли: обзор препаратов, применение, отзывы
Дерматология
Как вылечить витилиго: домашние методы лечения, аптечные препараты и рекомендации врачей
Другие состояния
Отекли ноги: как снять отек в домашних условиях
Найдите ошибки в приведённом тексте.
 Укажите номера предложений, в которыхсделаны ошибки, исправьте их. ( 1)Ленточные черви и Сосальщики ведут паразитический образ жизни. (2)Яйцо печёночного сосальщика начинает развиваться, только попав в воду. (3)Малый прудовик является основным хозяином печёночного сосальщика. (4)Окончательным хозяином бычьего цепня является крупный рогатый скот. (5)Взрослый червь — печёночный сосальщик размножается в организме малого прудовика. (6)Печеночный сосальщик и бычий цепень Найдите ошибки в приведённом тексте. Укажите номера предложений, в которыхсделаны ошибки, исправьте их. ( 1)Ленточные черви и Сосальщики ведут паразитический образ жизни. (2)Яйцо печёночного сосальщика начинает развиваться, только попав в воду. (3)Малый прудовик является основным хозяином печёночного сосальщика. (4)Окончательным хозяином бычьего цепня является крупный рогатый скот. (5)Взрослый червь — печёночный сосальщик размножается в организме малого прудовика. (6)Печеночный сосальщик и бычий цепень — это плоские черви.
Укажите номера предложений, в которыхсделаны ошибки, исправьте их. ( 1)Ленточные черви и Сосальщики ведут паразитический образ жизни. (2)Яйцо печёночного сосальщика начинает развиваться, только попав в воду. (3)Малый прудовик является основным хозяином печёночного сосальщика. (4)Окончательным хозяином бычьего цепня является крупный рогатый скот. (5)Взрослый червь — печёночный сосальщик размножается в организме малого прудовика. (6)Печеночный сосальщик и бычий цепень Найдите ошибки в приведённом тексте. Укажите номера предложений, в которыхсделаны ошибки, исправьте их. ( 1)Ленточные черви и Сосальщики ведут паразитический образ жизни. (2)Яйцо печёночного сосальщика начинает развиваться, только попав в воду. (3)Малый прудовик является основным хозяином печёночного сосальщика. (4)Окончательным хозяином бычьего цепня является крупный рогатый скот. (5)Взрослый червь — печёночный сосальщик размножается в организме малого прудовика. (6)Печеночный сосальщик и бычий цепень — это плоские черви.
Учебник Курсы Книги Тесты Вопросы Личный кабинет
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Задание ЕГЭ по биологии
Линия заданий — 24
Наслаждайтесь
интересным учебником
и решайте
десятки тестов
на Studarium,
мы всегда рады вам! =)
 Найдите ошибки в приведённом тексте. Укажите номера предложений, в которых
сделаны ошибки, исправьте их.
Найдите ошибки в приведённом тексте. Укажите номера предложений, в которых
сделаны ошибки, исправьте их.(1)Ленточные черви и Сосальщики ведут паразитический образ жизни. (2)Яйцо печёночного сосальщика начинает развиваться, только попав в воду. (3)Малый прудовик является основным хозяином печёночного сосальщика. (4)Окончательным хозяином бычьего цепня является крупный рогатый скот. (5)Взрослый червь — печёночный сосальщик размножается в организме малого прудовика. (6)Печеночный сосальщик и бычий цепень — это плоские черви. (7)К плоским червям относят свободноживущих планарий.
Ошибки допущены в предложениях 3, 4, 5:
3) Малый прудовик является промежуточным хозяином печеночного сосальщика
4) Окончательным (основным) хозяином бычьего цепня служит человек
5) Взрослая особь печеночного сосальщика размножается в организме человека, крупного рогатого скота (живет в желчных ходах печени)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 4295.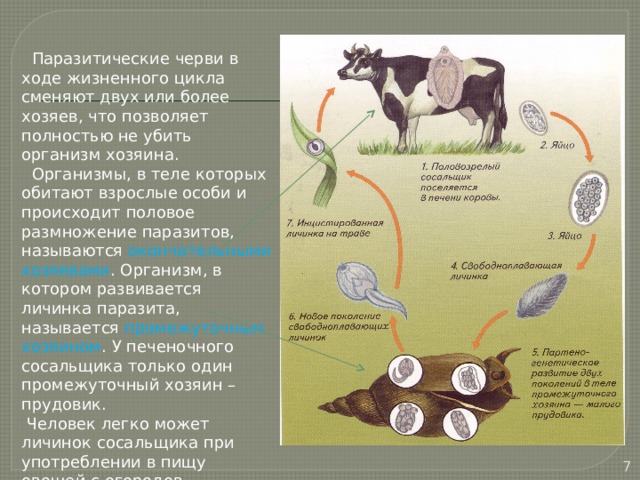
P.S.S. Для вас готово следующее случайное задание. Мы сами не знаем, но вас ждет что-то интересное!
Печеночные сосальщики · Вклад Министерства сельского хозяйства США в ветеринарную паразитологию ·
Дорогостоящая проблема
«Печеночная двуустка, или печеночная гниль овец, веками признавалась в Европе причиной огромных потерь овец в сезон дождей». Доктор Роберт Дилл, Рено, Невада, без даты.
Fasciola hepatica в печени овец
Печеночные двуустки ( Fasciola hepatica ) представляют собой плоские листовидные черви, встречающиеся у овец, крупного рогатого скота, коз, а иногда у оленей, лосей и других млекопитающих, которые пасутся во влажных или болотистые пастбища. В начале 19В 2000-х годах быстрое распространение печеночных трематод в США с западного побережья и штатов Скалистых гор на восток и север вызвало заболевание домашнего скота и значительный ущерб для американских владельцев ранчо крупного рогатого скота и овец.
В начале 19В 2000-х годах быстрое распространение печеночных трематод в США с западного побережья и штатов Скалистых гор на восток и север вызвало заболевание домашнего скота и значительный ущерб для американских владельцев ранчо крупного рогатого скота и овец.
Каждый год некоторые овцы и крупный рогатый скот падали от печеночной двуустки. Однако смерть была не самой распространенной потерей. Зараженные животные часто жили с хроническими заболеваниями, были слабыми и нерентабельными.
Печеночная двуустка вызывает снижение рождаемости, неэффективную конверсию корма и замедление роста, плохое качество молока и мяса, а также грубую и ломкую шерсть или шерсть. Печень животных, используемых в пищу, забраковывали, если на ней обнаруживались признаки заражения трематодами, и производители были вынуждены брать на себя убойные сборы за нездоровое поголовье.
Каждый череп представляет собой 13 голов овец, погибших между зимой 1923 г. и весной 1924 г., Овандо, Монтана
Улитка ( Linnaeus truncatulus )
00002 Как эти паразитические черви начинают свою жизнь 904 цикла в виде яиц, отложенных во влажных местах, таких как медленно текущие ручьи, каналы и канавы с травой или растительностью на их берегах. Вылупившиеся эмбрионы должны немедленно найти и внедриться в тела некоторых видов пресноводных улиток. Улитки, как промежуточные хозяева, необходимы для развития личинок двуустки. Когда они готовы покинуть улиток, личинки двуустки превращаются в цисты, которые прикрепляются к растениям или плавают в воде, пока их не съест пасущееся животное. Незрелые сосальщики выходят из кист внутри животного-хозяина, а затем мигрируют в печень, где разрушают ткань органа на пути к желчным протокам. Зрелые сосальщики, живущие в желчных протоках, откладывают яйца. Яйца выходят из животного с фекалиями, и жизненный цикл двуустки начинается снова.
Вылупившиеся эмбрионы должны немедленно найти и внедриться в тела некоторых видов пресноводных улиток. Улитки, как промежуточные хозяева, необходимы для развития личинок двуустки. Когда они готовы покинуть улиток, личинки двуустки превращаются в цисты, которые прикрепляются к растениям или плавают в воде, пока их не съест пасущееся животное. Незрелые сосальщики выходят из кист внутри животного-хозяина, а затем мигрируют в печень, где разрушают ткань органа на пути к желчным протокам. Зрелые сосальщики, живущие в желчных протоках, откладывают яйца. Яйца выходят из животного с фекалиями, и жизненный цикл двуустки начинается снова.Пастбище, на котором летом 1923 года овцы заразились трематодой, Овандо, Монтана
Основные результаты исследований
Чтобы сократить потери скота, вызванные печеночными трематодами, Бюро животноводства Министерства сельского хозяйства США провело исследования по лечению и профилактике трематод. .
1887: Исследования сосальщиков в печени и легких крупного рогатого скота показали их причинную связь с поражениями внутренних органов инфицированных животных.
1929: Роберт Джей, помощник ветеринара Зоологического отдела Бюро животноводческой промышленности, начал исследование борьбы с печеночной двуусткой в Калифорнии. Он обнаружил, что обработка стад овец на открытом воздухе четыреххлористым углеродом показала хорошие результаты в борьбе с сосальщиками. Овцы, находящиеся на откормочной площадке или пастбище, должны были содержаться на том корме, к которому они привыкли на протяжении всего лечения. Некоторые овцы умерли после обработки четыреххлористым углеродом, но позже ученые определили, что их смерть была вызвана метаболическими изменениями, происходящими, когда овцам давали другой корм одновременно с лечением.
Встреча доктора Роберта Джея по борьбе с печеночным сосальщиком в H.C. Ранчо Шеффер, долина Поэ, графство Напа, 28 марта 1929 г. проверить влияние температуры на яйца печеночной двуустки. Они продемонстрировали, что яйца двуустки в печени мясных животных погибают при воздействии высоких (от 116 до 121 градусов по Фаренгейту) и низких (от 0 до 38 градусов по Фаренгейту) температур.
1936: Выделение чрезвычайных средств позволило Зоологическому отделу начать крупномасштабную кампанию по борьбе с печеночным двуустным трематодом в четырех западных штатах: Вашингтоне, Орегоне, Айдахо и Юте. Работа заключалась в осушении заболоченных земель и очистке ручьев для уничтожения улиток, служивших промежуточными хозяевами печеночной двуустки Fasciola hepatica . Преобразование окружающей среды таким образом предотвратило размножение улиток. Участки, которые нельзя было осушить, обрабатывали медным купоросом, чтобы отравить улиток.
1938: Леонард Эрвин Суонсон из Бюро животноводства показал, что яйцам печеночной двуустки требуется много кислорода для развития до заразной стадии. В илистых условиях развитие яиц замедлялось.
1942-1943: Гексахлорэтан, суспендированный в бентонитовой смеси, разработанной Бюро животноводства, успешно использовался для удаления взрослых печеночных трематод крупного рогатого скота.
Ресурсы:
Эндрюс, Джон С.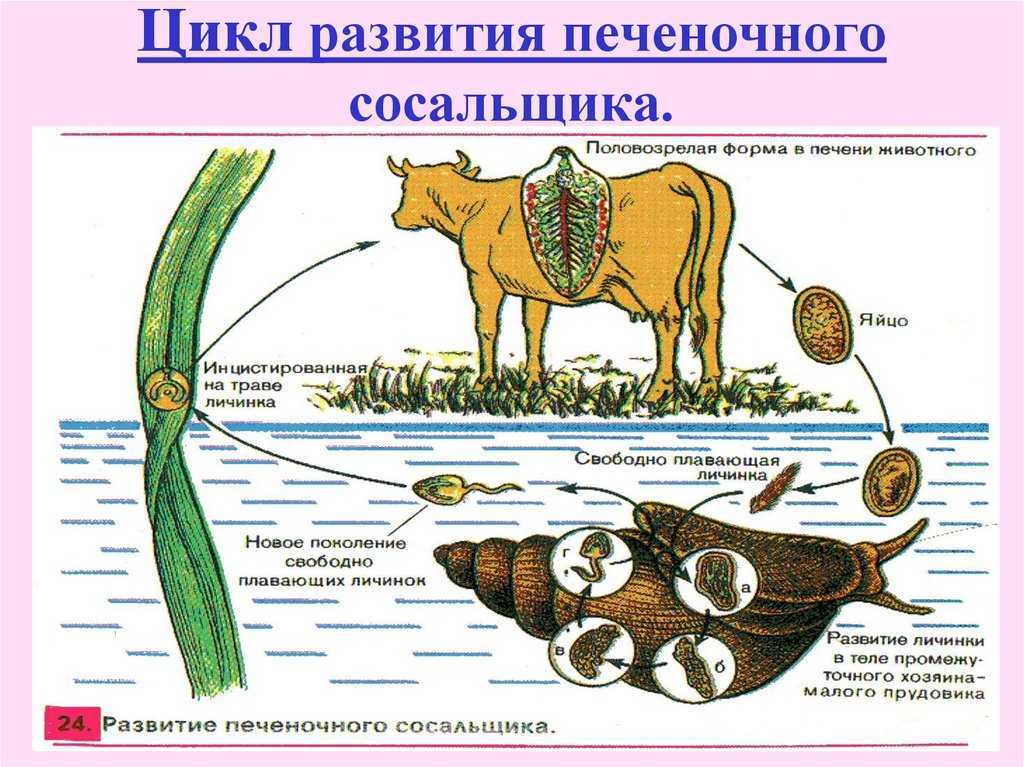 1987. «Паразитология животных в Министерстве сельского хозяйства США, 1886-1919 гг.84». В 100 Years of Animal Health 1884–1984 , под редакцией Вивиан Д. Уизер, Ларри Марка, Х. Грэма Пёрча и партнеров Национальной сельскохозяйственной библиотеки, 113–65. Белтсвилль, Мэриленд: Партнеры Национальной сельскохозяйственной библиотеки, Inc.
1987. «Паразитология животных в Министерстве сельского хозяйства США, 1886-1919 гг.84». В 100 Years of Animal Health 1884–1984 , под редакцией Вивиан Д. Уизер, Ларри Марка, Х. Грэма Пёрча и партнеров Национальной сельскохозяйственной библиотеки, 113–65. Белтсвилль, Мэриленд: Партнеры Национальной сельскохозяйственной библиотеки, Inc.
Отдел исследований болезней животных и паразитов, Служба сельскохозяйственных исследований. 1961. Печеночные двуустки крупного рогатого скота . Листовка 493. Вашингтон, округ Колумбия: Министерство сельского хозяйства США. https://archive.org/details/liverflukesincat493unit.
———. 1969. Обыкновенная двуустка у овец . Листовка 492. Вашингтон, округ Колумбия: Министерство сельского хозяйства США. https://archive.org/details/commonliverfluke492unit_0.
«Концептуальные достижения в гельминтологических исследованиях». 1961. Отчеты Национальной коллекции паразитов животных США. Ящик 98, папка 3. Специальные коллекции, Национальная сельскохозяйственная библиотека.
Дилл, Роберт. нд «Печеночный сосальщик овец». Записи Национальной коллекции паразитов животных США. Ящик 140, папка 1. Специальные коллекции, Национальная сельскохозяйственная библиотека.
Смит, Джаред Г. и Д. Л. Ван Дайн. 1905. Обыкновенная двуустка на Гавайях (Distoma hepaticum) . Бюллетень Гавайской сельскохозяйственной экспериментальной станции 11. Гонолулу, Гавайи: Министерство сельского хозяйства США. https://archive.org/details/commonliverfluke11smit.
Суонсон, Леонард Э., Эдвард Г. Бэтт и Уолтер Р. Деннис. 1952. Печеночная двуустка и борьба с ней . Бюллетень 502. Гейнсвилл, Флорида: Сельскохозяйственная экспериментальная станция Университета Флориды.
← Санитарная обработка свиней
Указатель-каталог ветеринарной и медицинской зоологии →
Паразиты, болезни и меры борьбы
Печеночные двуустки
Недавний прогресс в разработке вакцин против печеночной двуустки и кровяной двуустки
1. Jones M. K., Keizer J., McManus D.P. Трематоды. В: Кэрролл К.С., Пфаллер М.А., Лэндри М.Л., МакАдам А.Дж., Патель Р., Рихтер С.С., Уорнок Д.В., редакторы. Руководство по клинической микробиологии. АСМ Пресс; Вашингтон, округ Колумбия, США: 2019. стр. 2590–2605. [Перекрестная ссылка] [Академия Google]
K., Keizer J., McManus D.P. Трематоды. В: Кэрролл К.С., Пфаллер М.А., Лэндри М.Л., МакАдам А.Дж., Патель Р., Рихтер С.С., Уорнок Д.В., редакторы. Руководство по клинической микробиологии. АСМ Пресс; Вашингтон, округ Колумбия, США: 2019. стр. 2590–2605. [Перекрестная ссылка] [Академия Google]
2. Мас-Кома С., Валеро М.А., Барг М.Д. Фасциолез. Доп. Эксп. Мед. биол. 2019;1154:71–103. doi: 10.1007/978-3-030-18616-6_4. [PubMed] [CrossRef] [Google Scholar]
3. Торгерсон П.Р., Девлисшаувер Б., Прает Н., Спейбрук Н., Уиллингем А.Л., Касуга Ф., Рокни М.Б., Чжоу С.Н., Февр Э.М., Шрипа Б. и др. др. Оценки Всемирной организации здравоохранения глобального и регионального бремени 11 паразитарных болезней пищевого происхождения, 2010 г.: обобщение данных. ПЛОС Мед. 2015;12:e1001920. doi: 10.1371/journal.pmed.1001920. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Cwiklinski K., O’Neill S.M., Donnelly S., Dalton J.P. Перспективный взгляд на фасциолез животных и человека.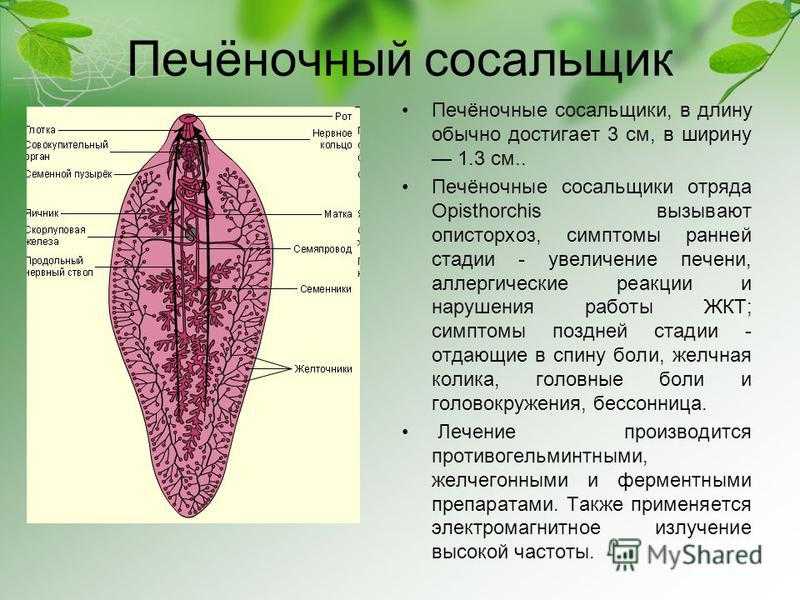
5. Молина-Эрнандес В., Малкахи Г., Перес Дж., Мартинес-Морено А., Доннелли С., О’Нил С.М., Далтон Дж.П. , Cwiklinski K. Вакцина Fasciola hepatica : Возможно, мы еще не достигли этого, но мы на правильном пути. Вет. Паразитол. 2015; 208:101–111. doi: 10.1016/j.vetpar.2015.01.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Флинн Р.Дж., Мусах-Эройе М. Уклонение от иммунитета хозяина во время инфекции
7. Cwiklinski K., Jewhurst H., McVeigh P., Barbour T., Maule A.G., Tort J., O’Neill S.M., Robinson M.W., Donnelly S., Dalton J.P. Заражение паразитом-гельминтом Fasciola hepatica требует быстрой регуляции метаболических, вирулентных и инвазивных факторов, чтобы приспособиться к своему хозяину-млекопитающему.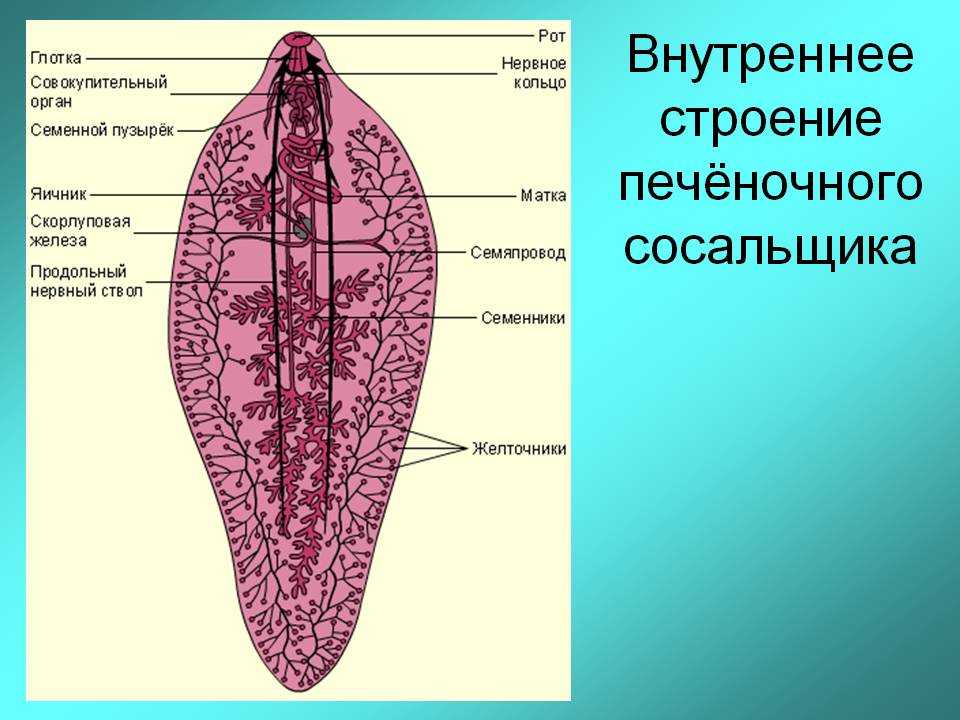 Мол. Клетка. протеом. 2018;17:792–809. doi: 10.1074/mcp.RA117.000445. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мол. Клетка. протеом. 2018;17:792–809. doi: 10.1074/mcp.RA117.000445. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Dalton J.P., Robinson M.W., Mulcahy G., O’Neill S.M., Donnelly S. Иммуномодулирующие молекулы
9. Rodríguez E., Noya V., Cervi L., Chiribao M.L., Brossard N., Chiale C., Carmona C., Giacomini C., Freire T. Glycans from Fasciola hepatica модулируют иммунный ответ хозяина и индуцированное TLR созревание дендритных клеток. PLoS Негл. Троп. Дис. 2015;9:e0004234. doi: 10.1371/journal.pntd.0004234. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Сулейман А.А., Золнерчик К., Джапа О., Оуэн Дж.П., Мэддисон Б.К., Эмес Р.Д., Ходжкинсон Дж.Е., Гоф К.С., Флинн Р.Дж. Фактор роста, полученный из трематодных паразитов, связывается и оказывает влияние на иммунные функции хозяина через рецепторные комплексы цитокинов хозяина.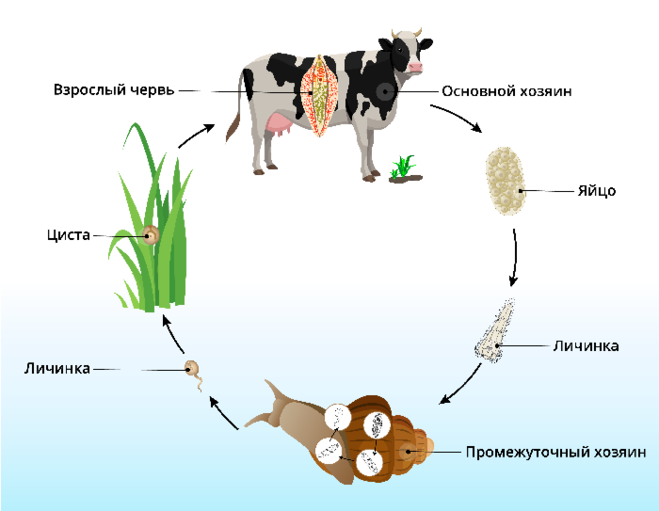
11. Liu Q., Huang S.Y., Yue DM, Wang J.L., Wang Y., Li X., Zhu X.Q. Протеомный анализ экскреторных и секреторных продуктов Fasciola hepatica (FhESP), участвующих во взаимодействии с РВМС и цитокинами хозяина, методом дробовой ЖХ-МС/МС. Паразитол. Рез. 2017; 116: 627–635. doi: 10.1007/s00436-016-5327-4. [PubMed] [CrossRef] [Google Scholar]
12. Musah-Eroje M., Flynn R.J. Fasciola hepatica, TGF-β и мимикрия хозяина: враг внутри. Курс. мнение микробиол. 2018;46:80–85. doi: 10.1016/j.mib.2018.09.002. [PubMed] [CrossRef] [Google Scholar]
13. Piedrafita D., Raadsma H.W., Prowse R., Spithill T.W. Иммунология взаимоотношений паразит-хозяин при фасциолезе ( Fasciola hepatica и Fasciola gigantica ) Can. Дж. Зул. 2004; 82: 233–250. doi: 10.1139/z03-216. [CrossRef] [Google Scholar]
14. Toet H., Piedrafita D.M., Spithill T. W. Вакцины против печеночной двуустки у жвачных животных: стратегии, прогресс и будущие возможности. Междунар. Дж. Паразитол. 2014;44:915–927. doi: 10.1016/j.ijpara.2014.07.011. [PubMed] [CrossRef] [Академия Google]
W. Вакцины против печеночной двуустки у жвачных животных: стратегии, прогресс и будущие возможности. Междунар. Дж. Паразитол. 2014;44:915–927. doi: 10.1016/j.ijpara.2014.07.011. [PubMed] [CrossRef] [Академия Google]
15. Dominquez M.F., Gonzalez-Miguel J., Carmona C., Dalton J., Cwiklinski K., Tort J.F., Siles-Lucas M. Низкое аллельное разнообразие в генах-кандидатах вакцин из разных мест дает надежду на Fasciola hepatica иммунизация. Вет. Паразитол. 2018; 258:46–52. doi: 10.1016/j.vetpar.2018.06.011. [PubMed] [CrossRef] [Google Scholar]
16. Cwiklinski K., Dalton J.P., Dufresne P.J., La Course J., Williams D.J., Hodgkinson J., Paterson S. The Fasciola hepatica 9Геном 0007: дупликация и полиморфизм генов свидетельствуют об адаптации к среде хозяина и способности к быстрой эволюции. Геном биол. 2015;16:71. doi: 10.1186/s13059-015-0632-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Choi YJ, Fontenla S., Fischer P.U., Le T.H., Costábile A.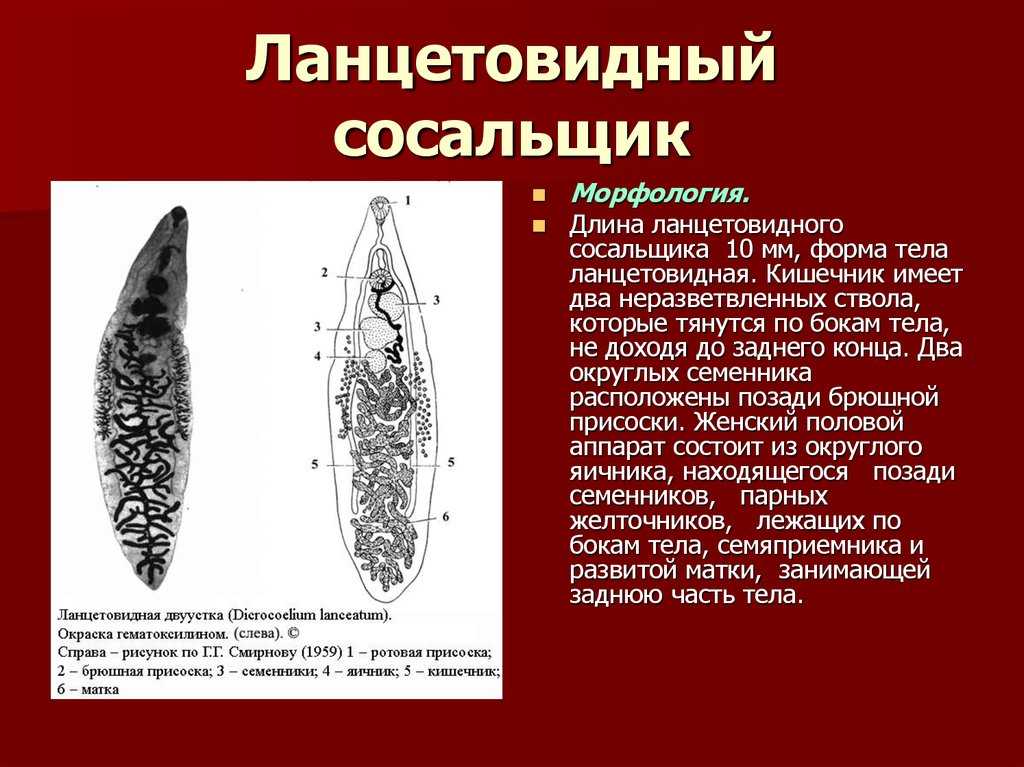 , Blair D., Brindley P.J., Tort J.F., Cabada M.M., Mitreva M. Адаптивная радиация сосальщиков семейства Fasciolidae, полученная на основе полногеномных сравнений ключевых видов. Мол. биол. Эвол. 2020; 37: 84–99. doi: 10.1093/molbev/msz204. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Blair D., Brindley P.J., Tort J.F., Cabada M.M., Mitreva M. Адаптивная радиация сосальщиков семейства Fasciolidae, полученная на основе полногеномных сравнений ключевых видов. Мол. биол. Эвол. 2020; 37: 84–99. doi: 10.1093/molbev/msz204. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Пандей Т., Гош А., Тодур В.Н., Раджендран В., Калита П., Калита Дж., Шукла Р., Четри П.Б., Шукла Х., Сонкар А. и др. Проект генома печеночной двуустки Fasciola gigantica . АСУ Омега. 2020;5:11084–11091. doi: 10.1021/acsomega.0c00980. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Майзелс Р.М., Курниаван-Атмаджа А. Изменчивость и полиморфизм паразитов-гельминтов. Паразитология. 2002; 125:S25–S37. дои: 10.1017/S0031182002001890. [PubMed] [CrossRef] [Google Scholar]
20. Cwiklinski K., Dalton J.P. Прогресс в исследованиях Fasciola hepatica с использованием технологий «omics». Междунар. Дж. Паразитол. 2018;48:321–331. doi: 10.1016/j.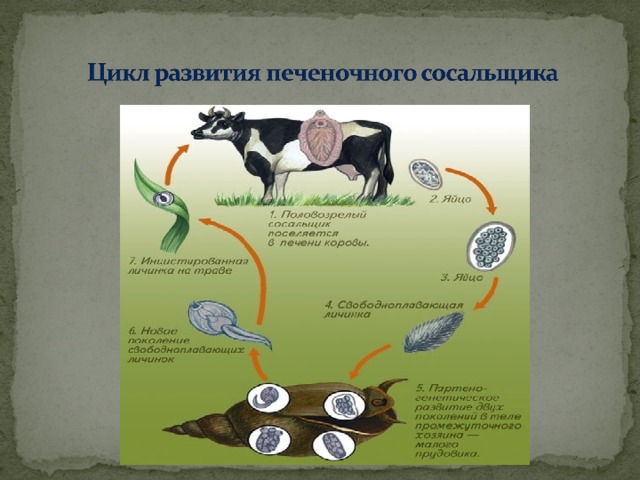 ijpara.2017.12.001. [PubMed] [CrossRef] [Google Scholar]
ijpara.2017.12.001. [PubMed] [CrossRef] [Google Scholar]
21. Де ла Торре-Эскудеро Э., Герлах Дж. К., Беннет А., Цвиклински К., Джухерст Х. Л., Хьюсон К. М., Джоши Л., Килкойн М., О’Нил С., Далтон Дж.П. и др. Поверхностные молекулы внеклеточных везикул, секретируемых возбудителем гельминта Fasciola hepatica направляют их интернализацию клетками-хозяевами. PLoS Негл. Троп. Дис. 2019;13:e0007087. doi: 10.1371/journal.pntd.0007087. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Cameron T.C., Cooke I., Faou P., Toet H., Piedrafita D., Young N., Rathinasamy V., Beddoe T., Андерсон Г., Демпстер Р. и др. Новый иммунопротеомный подход ex vivo, характеризующий тегументальные антигены Fasciola hepatica , идентифицированные с использованием иммунных антител резистентных овец. Междунар. Дж. Паразитол. 2017; 47: 555–567. doi: 10.1016/j.ijpara.2017.02.004. [PubMed] [CrossRef] [Академия Google]
23. Янг Н.Д., Холл Р.С., Джекс А.Дж., Кантасесси С. , Гассер Р.Б. Выяснение транскриптома Fasciola hepatica — ключ к фундаментальным и биотехнологическим открытиям для забытого паразита. Биотехнолог. Доп. 2010; 28: 222–231. doi: 10.1016/j.biotechadv.2009.12.003. [PubMed] [CrossRef] [Google Scholar]
, Гассер Р.Б. Выяснение транскриптома Fasciola hepatica — ключ к фундаментальным и биотехнологическим открытиям для забытого паразита. Биотехнолог. Доп. 2010; 28: 222–231. doi: 10.1016/j.biotechadv.2009.12.003. [PubMed] [CrossRef] [Google Scholar]
24. Янг Н.Д., Кэмпбелл Б.Е., Холл Р.С., Джекс А.Р., Кантацесси С., Лаха Т., Сон В.М., Шрипа Б., Лукас А., Бриндли П.Дж. и др. . Раскрытие транскриптомов двух канцерогенных паразитов, Clonorchis sinensis и Opisthorchis viverrini . PLoS Негл. Троп. Дис. 2010;4:e719. doi: 10.1371/journal.pntd.0000719. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Robinson M.W., Menon R., Donnelly S.M., Dalton J.P., Ranganathan S. Комплексный анализ транскриптомики и протеомики секретома возбудителя гельминта Fasciola hepatica : белки, связанные с инвазией и инфекцией млекопитающего-хозяина. Мол. Клетка. протеом. 2009 г.;8:1891–1907. doi: 10.1074/mcp.M
5-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Young N.D., Jex A.R., Cantacess C., Hall R.S., Campbell B.E., Spithill T.W., Tangkawattana S., Tangkawattana P., Laha T., Гассер Р. Б. Портрет транскриптома забытой трематоды, Fasciola gigantica — Биологическое и биотехнологическое значение. PLoS Негл. Троп. Дис. 2011;5:e1004. doi: 10.1371/journal.pntd.0001004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Young N.D., Jex A.R., Cantacess C., Hall R.S., Campbell B.E., Spithill T.W., Tangkawattana S., Tangkawattana P., Laha T., Гассер Р. Б. Портрет транскриптома забытой трематоды, Fasciola gigantica — Биологическое и биотехнологическое значение. PLoS Негл. Троп. Дис. 2011;5:e1004. doi: 10.1371/journal.pntd.0001004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Чжан X.X., Цун В., Эльшейха Х.М., Лю Г.Х., Ма Дж.Г., Хуанг В.Ю., Чжао К., Чжу С.К. Секвенирование транскриптома de novo и анализ ювенильной и взрослой стадии Fasciola gigantica . Заразить. Жене. Эвол. 2017;51:33–40. doi: 10.1016/j.meegid.2017.03.007. [PubMed] [CrossRef] [Google Scholar]
28. Turner J., Howell A., McCann C., Caminade C., Bowers R.G., Williams D., Baylis M. Модель для оценки эффективности вакцин для контроля заражения печеночным сосальщиком. науч. Отчет 2016; 6: 23345. doi: 10.1038/srep23345. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Sithithaworn P., Andrews R.H., Nguyen V.D., Wongsaroj T., Sinuon M., Odermatt P., Nawa Y., Liang S., Brindley P.J., Sripa B. Современное состояние описторхоза и клонорхоза в Меконге Бассейн. Паразитол. Междунар. 2012;61:10–16. doi: 10.1016/j.parint.2011.08.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Sithithaworn P., Andrews R.H., Nguyen V.D., Wongsaroj T., Sinuon M., Odermatt P., Nawa Y., Liang S., Brindley P.J., Sripa B. Современное состояние описторхоза и клонорхоза в Меконге Бассейн. Паразитол. Междунар. 2012;61:10–16. doi: 10.1016/j.parint.2011.08.014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Suwannatrai A., Saichua P., Haswell M. Эпидемиология инфекции Opisthorchis viverrini . Доп. Паразитол. 2018; 101:41–67. doi: 10.1016/bs.apar.2018.05.002. [PubMed] [CrossRef] [Академия Google]
31. Аунг В., Хтун Т.Т., Тин Х.Х., Тонн К.К., Санпул О., Джонгтавин Дж., Садаоу Л., Фосук И., Родпай Р., Интапан П.М. и др. Первое сообщение и молекулярная идентификация инфекции Opisthorchis viverrini в человеческих сообществах из Нижней Мьянмы. ПЛОС ОДИН. 2017;12:e0177130. doi: 10.1371/journal.pone.0177130. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Пахарукова М.Ю., Мордвинов В.А. Печеночная двуустка Opisthorchis felineus: Биология, эпидемиология и канцерогенный потенциал. Транс. Рой. соц. Троп. Мед. Гиг. 2016;110:28–36. дои: 10.1093/trstmh/trv085. [PubMed] [CrossRef] [Google Scholar]
Транс. Рой. соц. Троп. Мед. Гиг. 2016;110:28–36. дои: 10.1093/trstmh/trv085. [PubMed] [CrossRef] [Google Scholar]
33. Шриампорн С., Писани П., Пипитгул В., Суванрунгруанг К., Камса-ард С., Паркин Д.М. Распространенность инфекции Opisthorchis viverrini и заболеваемость холангиокарциномой в Кхонкэне, Северо-Восточный Таиланд. Троп. Мед. Междунар. Здоровье. 2004; 9: 588–594. doi: 10.1111/j.1365-3156.2004.01234.x. [PubMed] [CrossRef] [Google Scholar]
34. Хунтикео Н., Титапун А., Лойломе В., Йонгванит П., Тинхэмроп Б., Чамадол Н., Бунмарс Т., Нетханомсак Т., Эндрюс Р.Х., Петни Т.Н. и др. Современные перспективы борьбы с описторхозом и выявления холангиокарциномы в Юго-Восточной Азии. Передний. Мед. 2018;5:117. дои: 10.3389/фмед.2018.00117. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Soukhathammavong P., Odermatt P., Sayasone S., Vonghachack Y., Vounatsou P., Hatz C., Akkhavong K., Keizer J. Эффективность и безопасность мефлохина, артесуната, мефлохина-артесуната, трибендимидина и празиквантела у пациентов с Opisthorchis viverrini : рандомизированное исследовательское открытое исследование фазы 2. Ланцет Инфекция. Дис. 2011; 11:110–118. doi: 10.1016/S1473-3099(10)70250-4. [PubMed] [CrossRef] [Академия Google]
Ланцет Инфекция. Дис. 2011; 11:110–118. doi: 10.1016/S1473-3099(10)70250-4. [PubMed] [CrossRef] [Академия Google]
36. Songserm N., Charoenbut P., Bureelerd O., Pintakham K., Woradet S., Vanhnivongkham P., Cua L.N., Uyen N.T.T., Cuu N.C., Sripa B. Поведенческие факторы риска холангиокарциномы, связанной с описторхозом среди сельских жителей, проживающих вдоль реки Меконг в пяти странах субрегиона Большого Меконга. Acta Trop. 2020;201:105221. doi: 10.1016/j.actatropica.2019.105221. [PubMed] [CrossRef] [Google Scholar]
37. Sripa B., Jumnainsong A., Tangkawattana S., Haswell M.R. Иммунный ответ на 9Инфекция 0006 Opisthorchis viverrini и ее роль в патологии. Доп. Паразитол. 2018;102:73–95. doi: 10.1016/bs.apar.2018.08.003. [PubMed] [CrossRef] [Google Scholar]
38. Янг Н.Д., Гассер Р.Б. Opisthorchis viverrini проект геномно-биомедицинских последствий и будущих направлений. Доп. Паразитол. 2018;101:125–148. doi: 10.1016/bs.apar.2018.05.005. [PubMed] [CrossRef] [Google Scholar]
39. Young N.D., Nagarajan N., Lin S.J., Korhonen P.K., Jex A.R., Hall R.S., Safavi-Hemami H., Kaewkong W., Bertrand D., Gao S. , и другие. 9Геном 0006 Opisthorchis viverrini дает представление о жизни в желчных протоках. Нац. коммун. 2014;5:4378. doi: 10.1038/ncomms5378. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Young N.D., Nagarajan N., Lin S.J., Korhonen P.K., Jex A.R., Hall R.S., Safavi-Hemami H., Kaewkong W., Bertrand D., Gao S. , и другие. 9Геном 0006 Opisthorchis viverrini дает представление о жизни в желчных протоках. Нац. коммун. 2014;5:4378. doi: 10.1038/ncomms5378. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Ершов Н.И., Мордвинов В.А., Прохорчук Е.Б., Пахарукова М.Ю., Гунбин К.В., Устьянцев К., Генаев М.А., Блинов А.Г., Мазур А., Булыгина Е. ., и другие. Новое понимание генома Opisthorchis felineus : обновленная информация о геномике эпидемиологически важных печеночных трематод. БМС Геном. 2019;20:399. doi: 10.1186/s12864-019-5752-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
41. Львова М.Н., Дужак Т.Г., Центалович И.П., Катохин А.В., Мордвинов В.А. Секретом взрослой печеночной двуустки Opisthorchis felineus . Паразитология. 2014;48:169–184. [PubMed] [Google Scholar]
42. Малвенна Дж., Шрипа Б., Бриндли П. Дж., Горман Дж., Джонс М.К., Колгрейв М.Л., Джонс А., Наваратна С., Лаха Т., Суттипрапа С. и др. . Секретируемый и поверхностный протеом взрослой стадии канцерогенного печеночного сосальщика человека Opisthorchis viverrini . Протеомика. 2010;10:1063–1078. doi: 10.1002/pmic.2003. [PubMed] [CrossRef] [Google Scholar]
Дж., Горман Дж., Джонс М.К., Колгрейв М.Л., Джонс А., Наваратна С., Лаха Т., Суттипрапа С. и др. . Секретируемый и поверхностный протеом взрослой стадии канцерогенного печеночного сосальщика человека Opisthorchis viverrini . Протеомика. 2010;10:1063–1078. doi: 10.1002/pmic.2003. [PubMed] [CrossRef] [Google Scholar]
43. Помазной М., Татков С., Катохин А., Афонников Д., Бабенко В., Фурман Д., Брусенцов И., Белавин П. , Наякшин А., Гусельников С. и др. Взрослые особи Opisthorchis felineus Основные белковые фракции, полученные из транскриптов: сравнение с печеночными двуустами Opisthorchis viverrini и Clonorchis sinensis . Эксп. Паразитол. 2013;135:297–306. doi: 10.1016/j.exppara.2013.07.011. [PubMed] [CrossRef] [Google Scholar]
44. Suttirapa S., Sotillo J., Smout M., Suyapoh W., Chaiyadet S., Tripathi T., Laha T., Loukas A. Opisthorchis viverrini протеом и взаимодействие паразит-хозяин. Доп. Паразитол. 2018;102:45–72.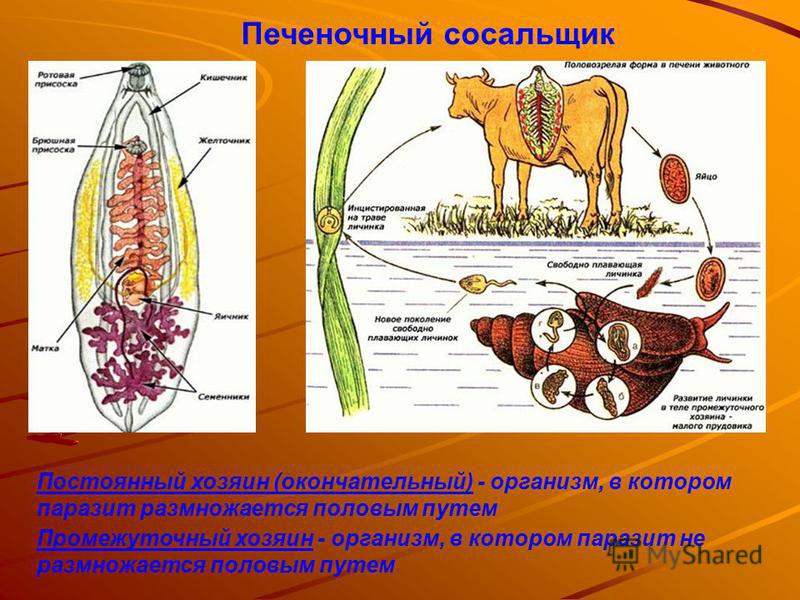 doi: 10.1016/bs.apar.2018.06.002. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/bs.apar.2018.06.002. [PubMed] [CrossRef] [Google Scholar]
45. Prasopdee S., Thitapakorn V., Sathavornmanee T., Tesana S. Всесторонний обзор омиков и исследований взаимодействий хозяев и паразитов в целях борьбы с 9Инфекция 0006 Opisthorchis viverrini для профилактики холангиокарциномы. Acta Trop. 2019;196:76–82. doi: 10.1016/j.actatropica.2019.05.011. [PubMed] [CrossRef] [Google Scholar]
46. Помазной М.Ю., Логачева М.Д., Янг Н.Д., Пенин А.А., Ершов Н.И., Катохин А.В., Мордвинов В.А. Полное профилирование транскриптома взрослых и инфекционных стадий трематоды Opisthorchis felineus. Паразитол. Междунар. 2016;65:12–19. doi: 10.1016/j.parint.2015.09.002. [PubMed] [CrossRef] [Академия Google]
47. Jex A.R., Young N.D., Sripa J., Hall R.S., Scheerlinck J.P., Laha T., Sripa B., Gasser R.B. Молекулярные изменения в Opisthorchis viverrini (печеночная двуустка Юго-Восточной Азии) при переходе от ювенильной к взрослый этап. PLoS Негл. Троп. Дис.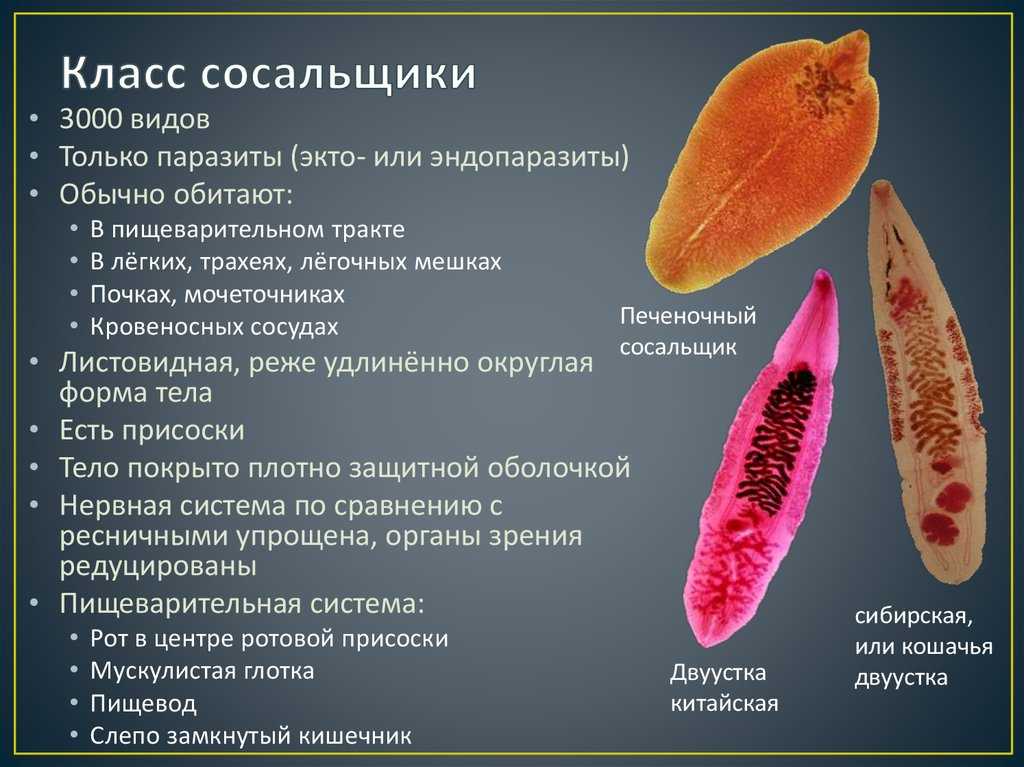 2012;6:e1916. doi: 10.1371/journal.pntd.0001916. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2012;6:e1916. doi: 10.1371/journal.pntd.0001916. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Chaibangyang W., Geadkaew-Krenc A., Smooker PM, Tesana S., Grams R. Оценка Opisthorchis viverrini кальретикулин для модуляции потенциального хозяина. Acta Trop. 2018;187:175–181. doi: 10.1016/j.actatropica.2018.08.009. [PubMed] [CrossRef] [Google Scholar]
49. Chaiyadet S., Sotillo J., Krueajampa W., Thongsen S., Brindley P.J., Sripa B., Loukas A., Laha T. Вакцинация хомяков Opisthorchis viverrini внеклеточные везикулы и рекомбинантные тетраспанины, полученные из везикул, индуцируют антитела, которые блокируют поглощение везикул холангиоцитами и снижают паразитарную нагрузку после заражения. PLoS Негл. Троп. Дис. 2019;13:e0007450. doi: 10.1371/journal.pntd.0007450. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
50. Phung L.T., Chaiyadet S., Hongsrichan N., Sotillo J., Dieu HDT, Tran CQ, Brindley P.J., Loukas A., Laha T.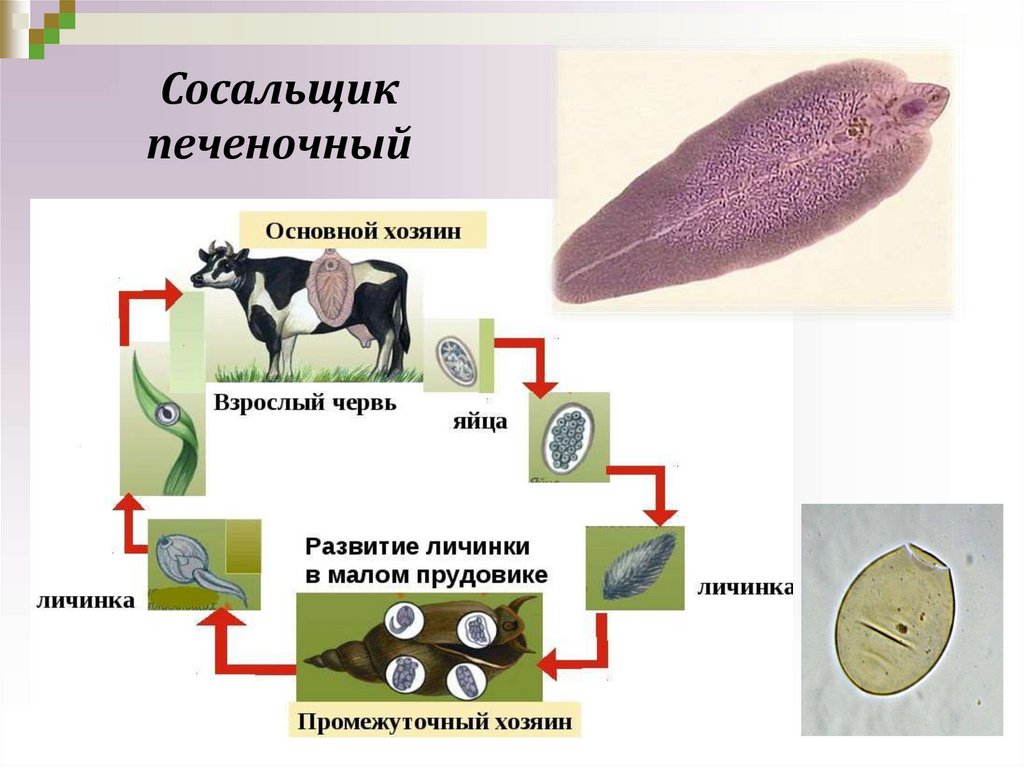 Рекомбинантный тетраспанин Opisthorchis viverrini , экспрессированный в Pichia pastoris , в качестве потенциального кандидата на вакцину против описторхоза. Паразитол. Рез. 2019;118:3419–3427. doi: 10.1007/s00436-019-06488-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Рекомбинантный тетраспанин Opisthorchis viverrini , экспрессированный в Pichia pastoris , в качестве потенциального кандидата на вакцину против описторхоза. Паразитол. Рез. 2019;118:3419–3427. doi: 10.1007/s00436-019-06488-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Phung L.T., Chaiyadet S., Hongsrichan N., Sotillo J., Dieu HDT, Tran C.Q., Brindley P.J., Loukas A., Laha T. Частичная защита химерной тетраспанин-лейцинаминопептидазной субъединичной вакциной против Opisthorchis viverrini инфекция у хомяков. Acta Trop. 2020;204:105355. doi: 10.1016/j.actatropica.2020.105355. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Tang Z.L., Huang Y., Yu X.B. Текущее состояние и перспективы Clonorchis sinensis и клонорхоз: эпидемиология, патогенез, омика, профилактика и контроль. Заразить. Дис. Бедность. 2016;5:71. doi: 10.1186/s40249-016-0166-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Qian M.B., Utzinger J., Keizer J., Zhou X.N. Клонорхоз. Ланцет. 2016; 387:800–810. doi: 10.1016/S0140-6736(15)60313-0. [PubMed] [CrossRef] [Google Scholar]
Qian M.B., Utzinger J., Keizer J., Zhou X.N. Клонорхоз. Ланцет. 2016; 387:800–810. doi: 10.1016/S0140-6736(15)60313-0. [PubMed] [CrossRef] [Google Scholar]
Печеночные двуустки: Clonorchis и Описторх . Доп. Эксп. Мед. биол. 2019;1154:139–180. doi: 10.1007/978-3-030-18616-6_6. [PubMed] [CrossRef] [Google Scholar]
55. Na B.K., Pak J.H., Hong S.J. Clonorchis sinensis и клонорхоз. Acta Trop. 2020;203:105309. doi: 10.1016/j.actatropica.2019.105309. [PubMed] [CrossRef] [Google Scholar]
56. Куан Ф.С., Ли Дж.Б., Бэ Дж.С., Оватари Н., Мин Ю.К., Ян Х.М. Устойчивость к реинфекции у крыс, индуцированной облученными метацеркариями Клонорхис китайский . Памяти Института Освальдо Круза. 2005; 100: 549–554. doi: 10.1590/S0074-02762005000500016. [PubMed] [CrossRef] [Google Scholar]
57. Wang X., Chen W., Huang Y., Sun J., Men J., Liu H., Luo F., Guo L., Lv X., Дэн С. и др. Проект генома канцерогенной двуустки печени человека Clonorchis sinensis . Геном биол. 2011;12:R107. doi: 10.1186/gb-2011-12-10-r107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Геном биол. 2011;12:R107. doi: 10.1186/gb-2011-12-10-r107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Huang Y., Chen W., Wang X., Liu H., Chen Y., Guo L., Luo F., Sun J. , Мао К., Лян П. и др. Канцерогенная печеночная двуустка, Clonorchis sinensis : Новая сборка, реаннотация и анализ генома и характеристика тканевых транскриптомов. ПЛОС ОДИН. 2013;8:e54732. doi: 10.1371/journal.pone.0054732. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Ван Д., Янг Н.Д., Корхонен П.К., Гассер Р.Б. Clonorchis sinensis и клонорхоз: актуальность изучения генетической изменчивости. Доп. Паразитол. 2018;100:155–208. doi: 10.1016/bs.apar.2018.03.006. [PubMed] [CrossRef] [Академия Google]
60. Ван Д., Корхонен П.К., Гассер Р.Б., Янг Н.Д. Улучшенные геномные ресурсы и новый биоинформационный рабочий процесс для канцерогенного паразита Clonorchis sinensis : Биотехнологические последствия. Биотехнолог. Доп. 2018; 36: 894–904. doi: 10.1016/j.biotechadv.2018.02.008. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.biotechadv.2018.02.008. [PubMed] [CrossRef] [Google Scholar]
61. Sun H., Shang M., Tang Z., Jiang H., Dong H., Zhou X., Lin Z., Shi C., Ren P., Чжао Л. и др. Пероральная доставка спор Bacillus subtilis , экспрессирующих Clonorchis sinensis парамиозин защищает белого амура от заражения церкариями. заявл. микробиол. Биотехнолог. 2020;104:1633–1646. doi: 10.1007/s00253-019-10316-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. McManus D.P., Dunne D.W., Sacko M., Utzinger J., Vennervald B.J., Zhou X.N. шистосомоз. Нац. Преподобный Дис. Прим. 2018;4:13. doi: 10.1038/s41572-018-0013-8. [PubMed] [CrossRef] [Google Scholar]
63. McManus D.P., Bergquist R., Cai P., Ranasinghe S., Tebeje B.M., You H. Шистосомоз — от иммунопатологии к вакцинам. Семин. Иммунопатол. 2020; 42: 355–371. doi: 10.1007/s00281-020-00789-Икс. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
М.Т., ван Лисхаут Л., Смитс Х.Х. и соавт. Организация производства самцов церкарий Schistosoma mansoni для модели контролируемой инфекции человека. Дж. Заразить. Дис. 2018; 218:1142–1146. doi: 10.1093/infdis/jiy275. [PubMed] [CrossRef] [Google Scholar]
и соавт. Организация производства самцов церкарий Schistosoma mansoni для модели контролируемой инфекции человека. Дж. Заразить. Дис. 2018; 218:1142–1146. doi: 10.1093/infdis/jiy275. [PubMed] [CrossRef] [Google Scholar]
65. Тебеже Б.М., Харви М., Ю Х., Лукас А., Макманус Д.П. Вакцины против шистосомоза: где мы находимся? Паразит. Векторы. 2016;9:528. doi: 10.1186/s13071-016-1799-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Hassan A.S., Zelt N.H., Perera D.J., Ndao M., Ward B.J. Вакцинация против пищеварительного фермента катепсина B с использованием вектора YS1646 Salmonella enterica Typhimurium обеспечивает почти полную защиту от заражения Schistosoma mansoni в мышиной модели. PLoS Негл. Троп. Дис. 2019;13:e0007490. doi: 10.1371/journal.pntd.0007490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Li X.H., Vance G.M., Cartwright J., Cao J.P., Wilson R.A., Castro-Borges W. Картирование эпитопов белков пищеводной железы Schistosoma japonicum для включения в вакцинные конструкции.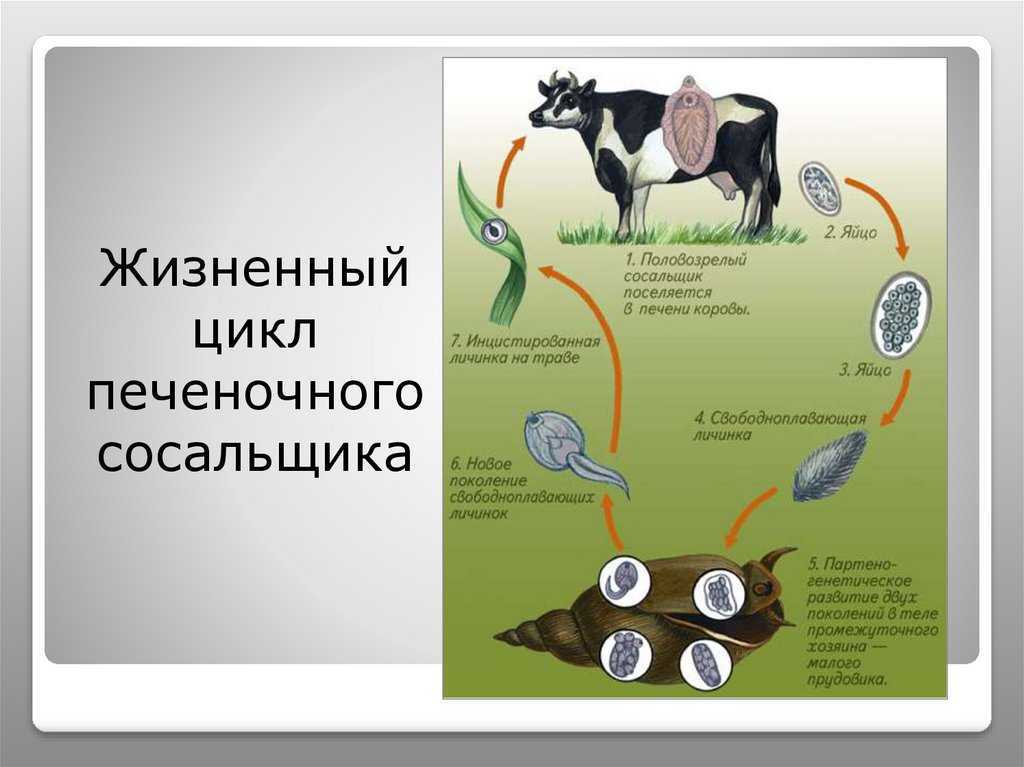 ПЛОС ОДИН. 2020;15:e0229542. doi: 10.1371/journal.pone.0229542. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2020;15:e0229542. doi: 10.1371/journal.pone.0229542. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Kifle D.W., Pearson M.S., Becker L., Pickering D., Loukas A., Sotillo J. Протеомный анализ двух популяций Schistosoma mansoni — производные внеклеточных везикул: 15 тыс. гранул и 120 тыс. гранул везикул. Мол. Биохим. Паразитол. 2020;236:111264. doi: 10.1016/j.molbiopara.2020.111264. [PubMed] [CrossRef] [Академия Google]
69. Ю Х., Цай П., Тебедже Б.М., Ли Ю., Макманус Д.П. Шистосомные вакцины для домашних животных. Троп. Мед. Заразить. Дис. 2018;3:68. doi: 10.3390/tropicalmed3020068. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Hotez P.J., Bottazzi M.E., Bethony J., Diemert D.D. Продвижение разработки вакцины против шистосомоза человека. Тенденции Паразитол. 2019;35:104–108. doi: 10.1016/j.pt.2018.10.005. [PubMed] [CrossRef] [Google Scholar]
71. Чжан В., Молехин А., Патель П., Ким Э., Пенья А., Сиддики А.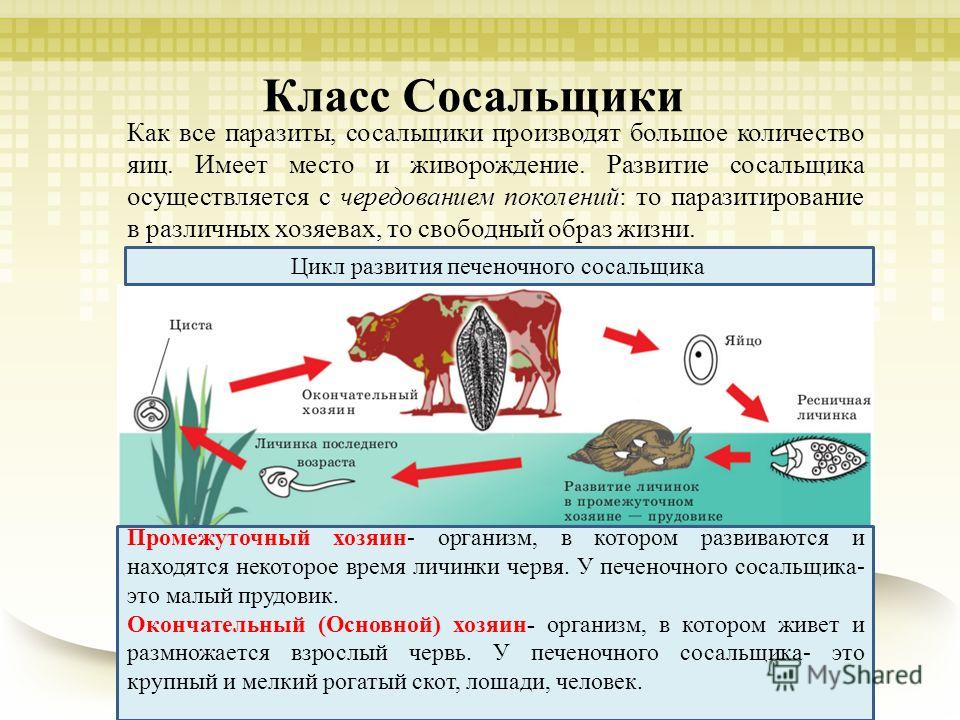 А. Тестирование 9Цели вакцины 0006 Schistosoma mansoni . Методы Мол. биол. 2020;2151:229–262. doi: 10.1007/978-1-0716-0635-3_19. [PubMed] [CrossRef] [Google Scholar]
А. Тестирование 9Цели вакцины 0006 Schistosoma mansoni . Методы Мол. биол. 2020;2151:229–262. doi: 10.1007/978-1-0716-0635-3_19. [PubMed] [CrossRef] [Google Scholar]
72. Молехин А.Ю. Разработка вакцины против шистосомоза: обновленная информация о клинических испытаниях на людях. Дж. Биомед. науч. 2020;27:28. doi: 10.1186/s12929-020-0621-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Riveau G., Deplanque D., Remoué F., Schacht A.M., Vodougnon H., Capron M., Thiry M., Martial J., Либерса С., Капрон А. Безопасность и иммуногенность антигена rSh38GST у людей: рандомизированное клиническое исследование фазы 1 вакцины-кандидата против мочевого шистосомоза. PLoS Негл. Троп. Дис. 2012;6:e1704. doi: 10.1371/journal.pntd.0001704. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Riveau G., Schacht A.M., Dompnier J.P., Deplanque D., Seck M., Waucquier N., Senghor S., Delcroix-Genete D., Hermann E., Idris-Khodja N., et al. Безопасность и эффективность вакцины против мочевого шистосомоза rSh38GST: рандомизированное контролируемое исследование фазы 3 у сенегальских детей. PLoS Негл. Троп. Дис. 2018;12:e0006968. doi: 10.1371/journal.pntd.0006968. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Негл. Троп. Дис. 2018;12:e0006968. doi: 10.1371/journal.pntd.0006968. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
75. Тендлер М., Алмейда М., Симпсон А. Разработка бразильской вакцины против шистосомоза на основе рекомбинантного связывающего жирные кислоты белка Sm14 плюс GLA-SE адъювант. Передний. Иммунол. 2015;6:218. дои: 10.3389/fimmu.2015.00218. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Сантини-Оливейра М., Колер Р.Н., Парра Дж., Велозу В., Джаяшанкар Л., Пинто П.М., Сиол М.А., Бергквист Р., Рид С.Г., Тендлер М. Кандидат на вакцину против шистосомоза Sm14/GLA-SE: фаза 1 клинического испытания безопасности и иммуногенности на здоровых взрослых мужчинах. вакцина. 2016; 34: 586–594. doi: 10.1016/j.vaccine.2015.10.027. [PubMed] [CrossRef] [Google Scholar]
77. Тендлер М., Алмейда М.С., Вилар М.М., Пинто П.М., Лимаверде-Соуза Г. Текущее состояние вакцины против шистосомоза Sm14/GLA-SE: преодоление барьеров и парадигм на пути к первая противопаразитарная человеческая (итарная) вакцина.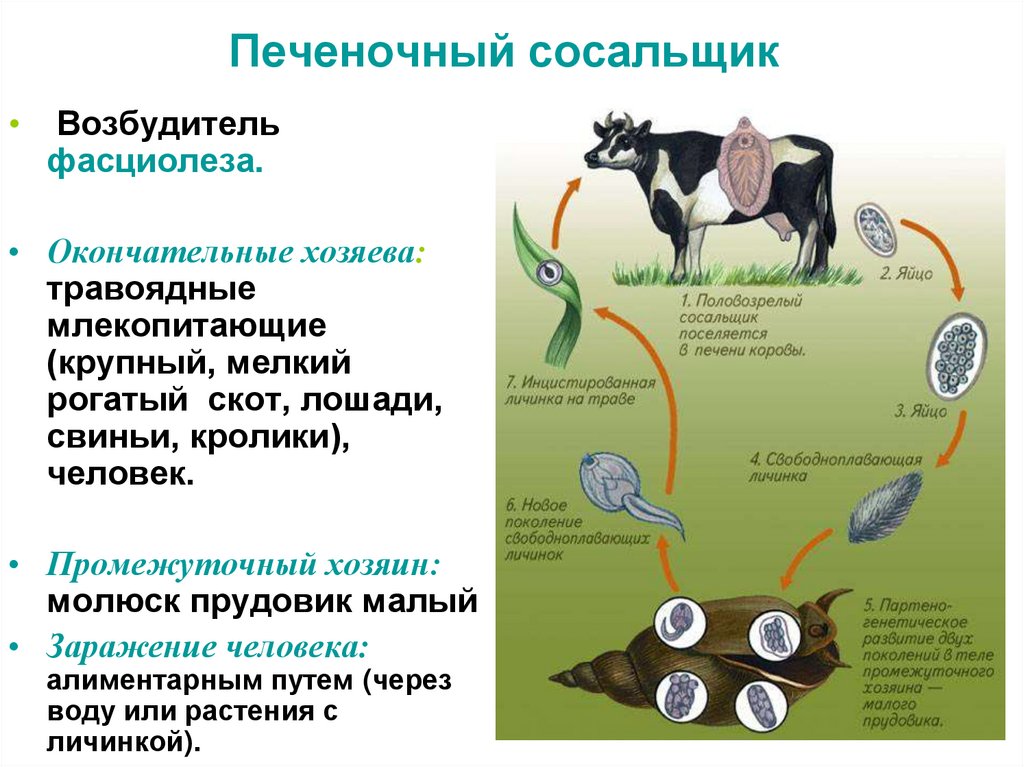 Троп. Мед. Заразить. Дис. 2018;3:121. дои: 10.3390/тропикалмед3040121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Троп. Мед. Заразить. Дис. 2018;3:121. дои: 10.3390/тропикалмед3040121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Тран М.Х., Пирсон М.С., Бетони Дж.М., Смит Д.Дж., Джонс М.К., Дюк М., Дон Т.А., Макманус Д.П., Корреа-Оливейра Р., Лукас А. Тетраспанины на поверхности Schistosoma mansoni являются защитными антигенами против шистосомоза. Нац. Мед. 2006; 12: 835–840. doi: 10.1038/nm1430. [PubMed] [CrossRef] [Google Scholar]
79. Кейтель В.А., Поттер Г.Е., Димерт Д., Бетони Дж., Эль Сахли Х.М., Кеннеди Дж.К., Патель С.М., Плискатт Дж.Л., Джонс В., Дей Г. и др. др. Фаза 1 исследования безопасности, реактогенности и иммуногенности Вакцина Schistosoma mansoni с глюкопиранозиллипидным водным составом или без него (GLA-AF) у здоровых взрослых из неэндемичных районов. вакцина. 2019;37:6500–6509. doi: 10.1016/j.vaccine.2019.08.075. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Меконнен Г.Г., Тедла Б.А., Пикеринг Д.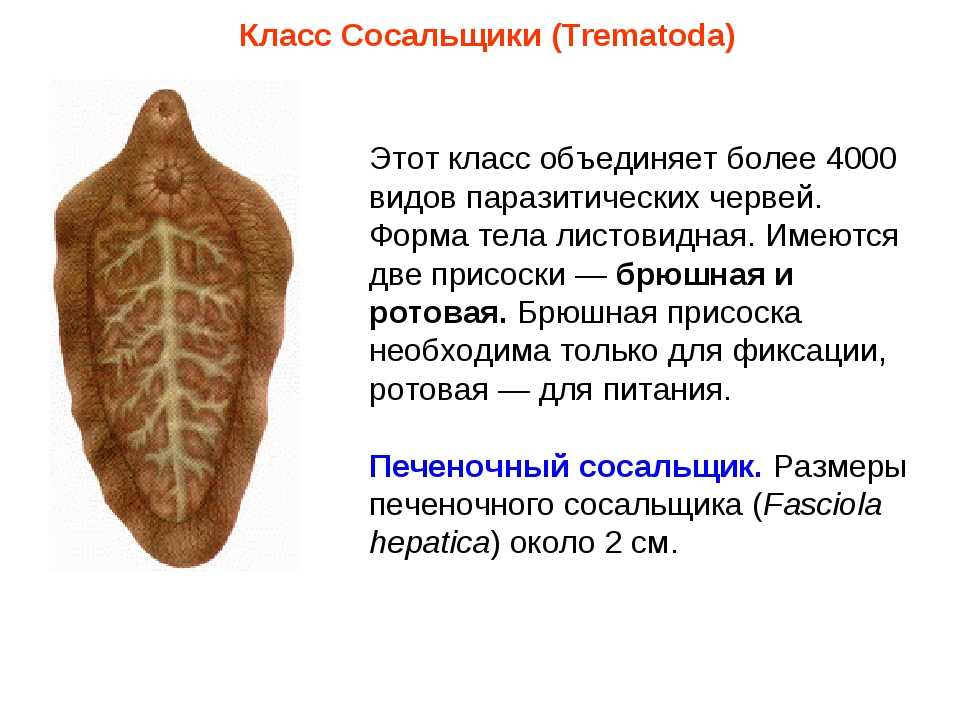 , Беккер Л., Ван Л., Чжан Б., Боттацци М.Е., Лукас А., Сотилло Дж. ., Пирсон М.С. Schistosoma haematobium белки внеклеточных везикул обеспечивают защиту в гетерологичной модели шистосомоза. Вакцины (Базель) 2020; 8:416. дои: 10.3390/вакцин8030416. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Беккер Л., Ван Л., Чжан Б., Боттацци М.Е., Лукас А., Сотилло Дж. ., Пирсон М.С. Schistosoma haematobium белки внеклеточных везикул обеспечивают защиту в гетерологичной модели шистосомоза. Вакцины (Базель) 2020; 8:416. дои: 10.3390/вакцин8030416. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81. Siddiqui A.A., Siddiqui B.A., Ganley-Leal L. Вакцины против шистосомоза. Гум. Вакцина. 2011;7:1192–1197. doi: 10.4161/hv.7.11.17017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Zhang W., Molehin A.J., Rojo J.U., Sudduth J., Ganapathy P.K., Kim E., Siddiqui A.J., Freeborn J., Sennoune S.R., Мэй Дж. и др. Вакцина против шистосомоза на основе Sm-p80: двойное слепое доклиническое испытание на бабуинах демонстрирует комплексную профилактическую эффективность и эффективность блокирования передачи паразитов. Анна. Н. Я. акад. науч. 2018;1425:38–51. doi: 10.1111/nyas.13942. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Roestenberg M., Mo A., Kremsner P.G., Yazdanbakhsh M. Контролируемые инфекции человека: отчет с семинара по моделированию контролируемых инфекций человека, Лейден Университетский медицинский центр 4–6 мая 2016 г. Вакцина. 2017; 35:7070–7076. doi: 10.1016/j.vaccine.2017.10.092. [PubMed] [CrossRef] [Google Scholar]
Roestenberg M., Mo A., Kremsner P.G., Yazdanbakhsh M. Контролируемые инфекции человека: отчет с семинара по моделированию контролируемых инфекций человека, Лейден Университетский медицинский центр 4–6 мая 2016 г. Вакцина. 2017; 35:7070–7076. doi: 10.1016/j.vaccine.2017.10.092. [PubMed] [CrossRef] [Google Scholar]
84. Langenberg M.C.C., Hoogerwerf M.A., Koopman J.P.R., Janse J.J., Kos-van Oosterhoud J., Feijt C., Jochems S.P., de Dood CJ, van Schuijlenburg R., Ozir -Фазалалихан А. и др. Контролируемый человек 9Модель инфекции 0006 Schistosoma mansoni для разработки новых лекарств, вакцин и средств диагностики. Нац. Мед. 2020; 26: 326–332. doi: 10.1038/s41591-020-0759-x. [PubMed] [CrossRef] [Google Scholar]
85. Росс А.Г., Викерс Д., Олдс Г.Р., Шах С.М., Макманус Д.П. Синдром Катаямы. Ланцет Инфекция. Дис. 2007; 7: 218–224. doi: 10.1016/S1473-3099(07)70053-1. [PubMed] [CrossRef] [Google Scholar]
86. Бергквист Р., Макманус Д.П. Разработка вакцины против шистосомоза: недостающее звено.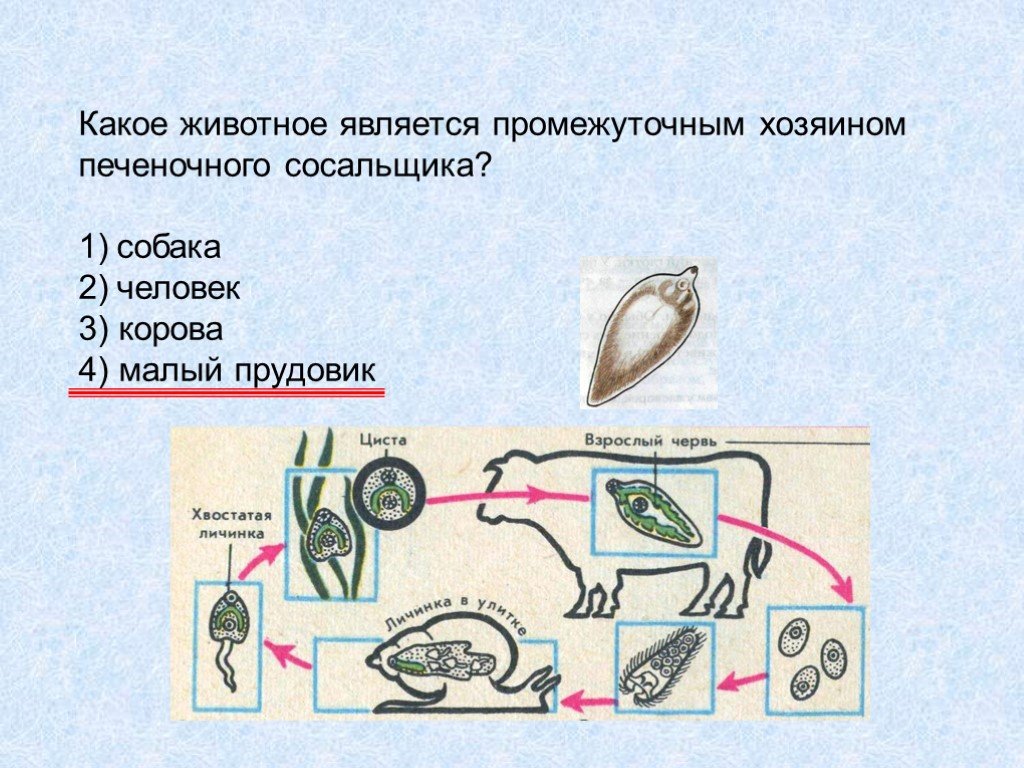


Leave A Comment