NO, Nh4, F2, MgF2, Fe, Kl.
1) Na2O + 2HCL = 2NaCl + h3O
Например, кислотные свойства: реагирует с щелочными металлами.2C2H5OH+2Na—>2C2H5ONa+h3
С образованием этилатов.
Проявляет восстановительные свойства, окисляясь до этаналя.
C2H5OH+CuO—>Ch4CHO+Cu+h3O
C2H6+Cl2=c2h5cl+hcl
c2h5cl+cl2=c2h5cl+hcl
c2h5cl2+cl2=c2h4cl+hcl
c2h4cl3+cl2=c2h3cl4+hcl
c2h3cl4+cl2+c2hcl5+hcl
c2hcl5+ck2=ccl6+hcl
:))P.S.твоя училка по химии
Найти:
n(Fe2O3), m(Fe2O3), n(Fe2(SO4)3), m(Fe2(SO4)3) — ?
Решение:
Можно писать или уравнение реакции, или стехиометрическую схему. Я отдаю предпочтение второму, но напишу и то, и другое 🙂
1*) 2Fe(OH)3→ Fe2O3 или 2Fe(OH)3 → Fe2O3 + 3h3O
1) n(Fe(OH)3) = 214г : 107г/моль = 2моль
2) n(Fe2O3) = 2моль : 2 = 1моль
3) m(Fe2O3) = 1моль * 160г/моль = 160г
2*) Fe2O3 → Fe2(SO4)3 (или 2Fe(OH)3 → Fe2(SO4)3) или Fe2O3 + 3h3SO4 → Fe2(SO4)3 + 3h3O
Из прошлого решения задачи мы выяснили, что n(Fe(OH)3) = 2моль, а n(Fe2O3) = 1моль, поэтому:
1) n(Fe2(SO4)3) = n(Fe2O3) = 1моль
2) m(Fe2(SO4)3) = 1моль * 400г/моль = 400г
Денатурация белка — разрушение его структуры. Если разрушается первичная структура, то это необратимая денатурация и вернуть белок невозможно. Денатурацию вызываюют: радиация, воздействие тяжелых металлов, высокая температура и так далее
Если разрушается первичная структура, то это необратимая денатурация и вернуть белок невозможно. Денатурацию вызываюют: радиация, воздействие тяжелых металлов, высокая температура и так далее
Основные типы химической связи. Химическая связь. Типы химических связей Тест 3 виды химической связи
Ход урока: (Cлайд 3)
- Объяснение темы “Основные типы химической связи”.
- Закрепление (Тест)
- Работа в графическом редакторе “Paint” – составление графических формул веществ.
- Домашнее задание.
Ход урока
I. Химический диктант. (Cлайд 4)II. Проверка домашнего задания
(Cлайд 5)- Что такое электроотрицательность?
- Зависимость электроотрицательности от расположения элемента в таблице Менделеева?
- Как определить принадлежность элемента к металлам или неметаллам по электроотрицательности?
III. Объяснение темы “Основные типы химической связи”. (
Cлайд 6)- Связь между элементами с одинаковой или близкой электроотрицательностью называется ковалентной. (Cлайд 7)
- Связь между металлами называется металлической.
- Связь между элементами со значительно отличающейся электроотрицательностью называется ионной.
- Связь между электроотрицательными элементами
разных молекул при помощи водорода называется
водородной
IV. Закрепление (Тест)
(Cлайд 19)“Закрепление 3” – для тех, кто не совсем уверен в своих знаниях,
“Закрепление 4” – для тех, кто уверен в своих знаниях,
“Закрепление 5” – для тех, кто абсолютно уверен в своих знаниях.
- Отвечаете на вопросы.
- Получаете оценку и ждете пока учитель не разрешит закрыть программу.
V. Работа в графическом редакторе “Paint” – составление графических формул веществ.
(Cлайд 9)1.Открываете программу “Paint”.
2. При помощи “наборов инструментов”
составляете графические формулы веществ: воды,
фторида натрия, хлороводорода, метана.
H 2 O, NaF, HCl, CH 4 .
Тест «Типы связей и кристаллических решеток»
Вариант №1
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9. Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В1. Установите соответствие между соединением и типом связи в соединении.
Установите соответствие между соединением и типом связи в соединении.
В2. Установите соответствие между соединением и типом кристаллической решетки
В3. Установите соответствие между соединением и типом связи в соединении.
Типы химических свиязей.
Часть А
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
1)1 2)2 3)3 4)4
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
А)железо 1)ионная
Д)азот
Типы химических свиязей.
Часть А
1.Химическая связь в молекуле фтороводорода
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
2. ионная связь образуется между атомами
1) натрия и фтора 2)серы и водорода 3) серы и кислорода 4)хлора и водорода
3. Ионная связь образуется между ионами
1) Li + и I — 2) Br — и H + 3) H + и B 3+ 4) S 2- и O 2-
4. Химическая связь между атомами химических элементов с порядковыми номерами 3 и 35
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
5. Химическая связь между атомами, электроотрицательности которых не отличаются друг от друга, называется
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
6. Химическая связь атома химического элемента, имеющего шесть электронов на внешнем электронном слое с водородом
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
7. Ковалентная полярная связь в каждом из двух веществ:
1)NaCl, KOH 2) HI, H 2 O 3)CO 2 , Br 2 4)CH 4 , F 2
8. Две общие электронные пары имеются в молекуле
Две общие электронные пары имеются в молекуле
1)водорода 2)бромоводорода 3)сероводорода 4) аммиака
9. Одну ковалентную связь имеет молекула
1)иодоводорода 2)азота 3)метана 4)кислорода
10. Число общих электронных пар в соединениях состава ЭО 2
1)1 2)2 3)3 4)4
11. Укажите формулу лишнего соединения
1) KCl 2) CO 3) H 2 O 4) HCl
Часть В.
12. Установите соответствие между названием соединения и типом химической связи в этом соединении.
Название соединения Тип химической связи
А)железо 1)ионная
Б)кислород 2)ковалентная полярная
В)вода 3)ковалентная неполярная
Г)бромид литии 4)металлическая
Д)азот
13. Ковалентная полярная связь имеет место в соединениях:
1)сероводород 2)угарный газ 3)фтор 4)цинк 5)фторид калия 3)фтор
14.Три ковалентные полярные связи имеют молекулы
1)азота 2)фосфина 3) углекислого газа 4)аммиака 5)метана
Часть С
15. Приведите примеры четырех соединений калия, имеющих одновременно и ионную и ковалентную связь.
16. Назовите соединение, имеющее одну ковалентную неполярную связь атомов, электроны которых расположены на трех энергетических слоях.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
(HCl, H 2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2, где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+Cl 0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).![]() Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2O, H 2F 2, NH 3. За счет водородных связей вода характеризуется столь высокими по сравнению с H 2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 311 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
1. Связь между ионами металла и блуждающими электронами называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
2. Химическая связь, возникающая между атомами неметаллов одного вида называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
3. Химическая связь, возникающая между атомами неметаллов обладающих разной электроотрицательностью называется ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
4. Химическая связь, возникающая между атомами типичного металла и типичного неметалла называется: ИОННОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ МЕТАЛЛИЧЕСКОЙ КОВАЛЕНТНОЙ ПОЛЯРНОЙ
5. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N 2 , NH 3, CO 2, NH 3, H 2, KF H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
6. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N 2 , NH 3, CO 2, Na, NH 3, H 2, KF H 2 O, НCl F 2, HF, C Ca. CO 3
7. Выберите группу веществ, в состав которой входят только вещества с металлической связью: Na, CO 2, K, Al, NH 3, Fe H 2 O, Na. Cl N 2, H 2, F 2, C Na, H 2, HF, Ca. CO 3
8. Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na. Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
Выберите группу веществ, в состав которой входят только вещества с ионной связью: Nа, К, Аl, Fe CO 2, Na. Сl, NH 3, H 2, H 2 O, НCl F 2, C KF, Mg. I 2, Ca. Cl 2
9. Определите вид химической связи и тип кристаллической решетки, если вещество обладает высокой температурой плавления и кипения, твердое, тугоплавкое, хорошо растворимо в воде. Раствор проводит электрический ток. Ковалентная полярная связь и атомная кристаллическая решетка Ионная связь и ионная кристаллическая решетка Ковалентная полярная связь и молекулярная кристаллическая решетка. Металлическая связь и металлическая кристаллическая решетка. Ковалентная неполярная связь и молекулярная кристаллическая решетка
Тест «Типы связей и кристаллических решеток»
Тест «Типы связей и кристаллических решеток»
Вариант №1
При выполнении заданий А1-А14 из предложенных вариантов ответов выберите тот, который вы считаете правильным.
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
В1. Установите соответствие между соединением и типом связи в соединении.
Соединение
Тип связи
А) KF
1) Ионная
Б) O2
2) Ковалентная
В) Na2O
Г) СаCl2
Д) N2
В2. Установите соответствие между соединением и типом кристаллической решетки
Установите соответствие между соединением и типом кристаллической решетки
Соединение
Тип кристаллической решетки
А) KF
1) Ионная
Б) O2
2) Молекулярная
В) Na
3) Атомная
Г) СаCl2
4) Молекулярная
Д) SiO2
В3. Установите соответствие между соединением и типом связи в соединении.
Соединение
Тип связи
А) N2
1) Ковалентная неполярная
Б) h3S
2) Ковалентная полярная
В) Ph4
3) Ионная
Г) Na
4) металлическая
Д) LiCl
Тест «Типы связей и кристаллических решеток»
Вариант №2
При выполнении заданий А1-А14 из предложенных вариантов ответов выберите тот, который вы считаете правильным.
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5. В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7.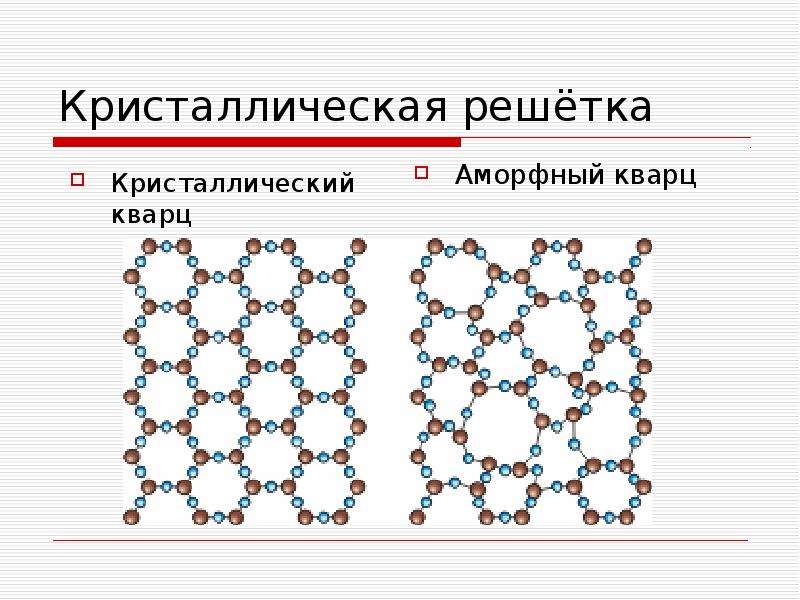 При соединении атомов одного и того же химического элемента образуется связь
При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9. Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
1) металлическая 2) молекулярная 3) ионная 4) атомная
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр.
В1. Установите соответствие между соединением и типом связи в соединении.
Соединение
Тип связи
А) BaF2
1) Ионная
Б) Cl2
2) Ковалентная полярная
В) h3O
3) Ионная
Г) NаBr
Д) Nh4
В2. Установите соответствие между соединением и типом кристаллической решетки
Соединение
Тип кристаллической решетки
А) CO2
1) Ионная
Б) Si
2) Молекулярная
В) NaOH
3) Атомная
Г) Са
4) Молекулярная
Д) Графит (С)
В3. Установите соответствие между соединением и типом связи в соединении.
Установите соответствие между соединением и типом связи в соединении.
Соединение
Тип связи
А) Zn
1) Ковалентная неполярная
Б) SO2
2) Ковалентная полярная
В) h3
3) Ионная
Г) N2
4) металлическая
Д) BaCl2
Просмотр содержимого документа
«Тест «Типы связей и кристаллических решеток» »
Тест «Типы связей и кристаллических решеток»
Вариант №1
При выполнении заданий А1-А14 из предложенных вариантов ответов выберите тот, который вы считаете правильным. |
А1 В молекуле сероуглерода CS2 химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А2 Атомную кристаллическую решетку имеет
1) СН4 2) Н2 3) О2 4) Si
А3. В аммиаке (Nh4) и хлориде бария (BaCl2) химическая связь соответственно:
1) ионная и ковалентная полярная 3) ковалентная неполярная и металлическая
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А4. Ионную кристаллическую решетку имеет
1) SiO2 2) Na2O 3) CO 4) P4
А5. Какие из предложенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления
Б. Вещества с атомной решеткой пластичны и обладают высокой электрической проводимостью.
1) Верно только А 2) Верно только Б 3) Верны оба суждения 4) Оба суждения неверны
А6.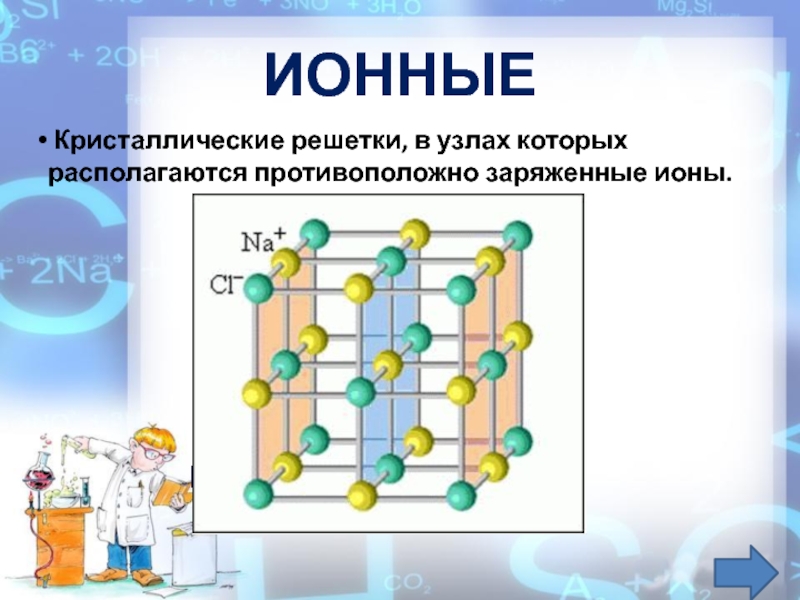 Ионный характер связи наиболее выражен в соединении
Ионный характер связи наиболее выражен в соединении
1) CCl4 2) SiO2 3) CaF2 4) Nh4
А7. В каком ряду все вещества имеют ковалентную полярную связь
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
А8. Кристаллическая решетка углекислого газа (CO2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А9. водородная связь образуется между молекулами
1) C2H6 2) C2H5OH 3) C6H5Ch4 4) NaCl
А10. Частично положительный заряд в молекуле OF2
1) у атома О 2) у атома F 3) у атомов О и F 4) Все атомы заряжены отрицательно
А11. Молекулярную кристаллическую решётку имеет
1) Nh4 2) Na2O 3) ZnCl2 4) CaF2
А12. Атомную кристаллическую решётку имеет
1) Ba(OH)2 2) алмаз 3) I2 4) Al2(SO4)2
А13. Ионную кристаллическую решётку имеет
1) лёд 2) графит 3) HF 4) KNO3
А 14. Металлическую кристаллическую решётку имеет
1) графит 2) Cl2 3) Na 4) NaCl
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр. |
В1. Установите соответствие между соединением и типом связи в соединении.
Соединение | Тип связи |
А) KF | 1) Ионная |
Б) O2 | 2) Ковалентная |
В) Na2O | |
Г) СаCl2 | |
Д) N2 |
В2. Установите соответствие между соединением и типом кристаллической решетки
Установите соответствие между соединением и типом кристаллической решетки
Соединение | Тип кристаллической решетки |
А) KF | 1) Ионная |
Б) O2 | 2) Молекулярная |
В) Na | 3) Атомная |
Г) СаCl2 | 4) Молекулярная |
Д) SiO2 |
В3. Установите соответствие между соединением и типом связи в соединении.
Соединение | Тип связи |
А) N2 | 1) Ковалентная неполярная |
Б) h3S | 2) Ковалентная полярная |
В) Ph4 | 3) Ионная |
Г) Na | 4) металлическая |
Д) LiCl |
Тест «Типы связей и кристаллических решеток»
Вариант №2
При выполнении заданий А1-А14 из предложенных вариантов ответов выберите тот, который вы считаете правильным. |
А1. Вещества только с ионной связью приведены в ряду
1) F2, CCl4, KCl 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2,K2S
А2. Кристаллическая решетка графита
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А3. Молекулярную решетку имеет
1) Na2O 2) SiO2 3) CaF2 4) Nh4
А4. Кристаллическая решетка хлорида кальция (СaCl2)
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А5.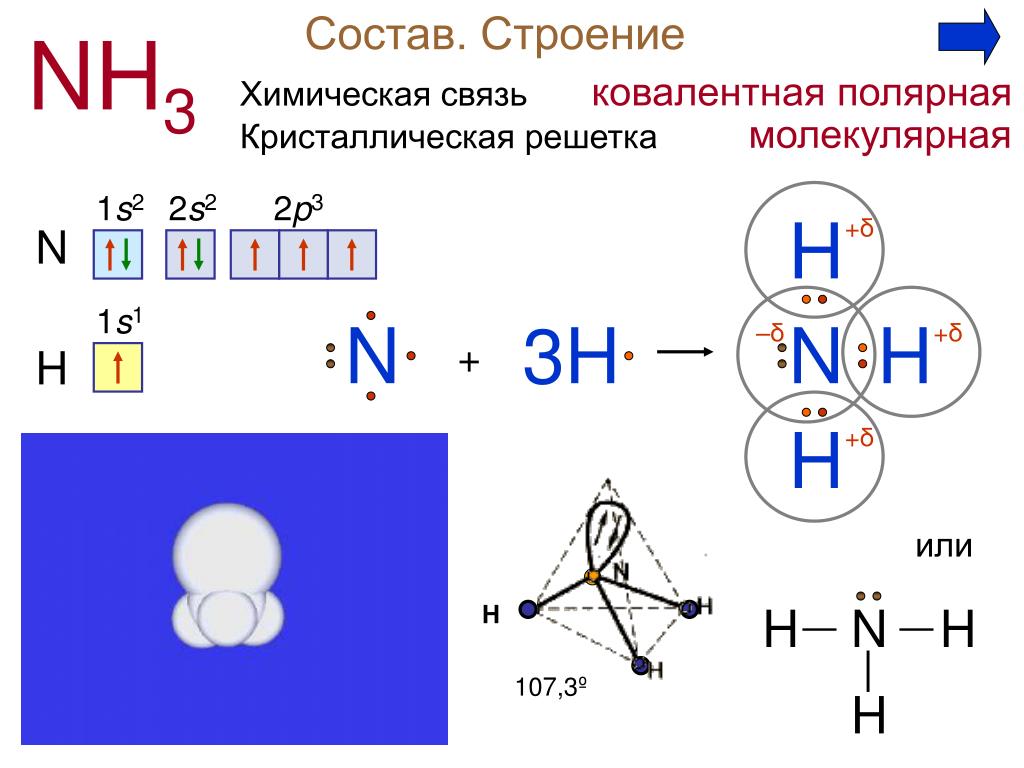 В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
1) CCl4 2) SiO2 3) CaF2 4) Nh5Cl
А6. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку
1) Ионная 2) Молекулярная 3) Атомная 4) Металлическая
А7. При соединении атомов одного и того же химического элемента образуется связь
1) Ионная 2) Ковалентная полярная 3) Ковалентная неполярная 4) Металлическая
А8. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 3) проводят электрический ток в растворах
2) хрупкие и легкоплавкие 4) проводят электрический ток в расплавах
А9. Электронная пара в молекуле HBr
1) не существует 2) находится посередине 3) смещена к атому Н 4) смещена к атому Br
А10. Вещество молекулярного строения
1) O3 2) BaO 3) C 4) K2S
А11. Кристаллическая решётка алмаза
1) металлическая 2) молекулярная 3) ионная 4) атомная
А12. Кристаллическая решётка гидроксида калия (KOH)
1) атомная 2) металлическая 3) ионная 4) молекулярная
А13. Кристаллическая решётка хлороводородной кислоты (НCl)
1) ионная 2) молекулярная 3) атомная 4) ионная
А14. Кристаллическая решётка железа
1) металлическая 2) молекулярная 3) ионная 4) атомная
В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр. |
В1. Установите соответствие между соединением и типом связи в соединении.
Соединение | Тип связи |
А) BaF2 | 1) Ионная |
Б) Cl2 | 2) Ковалентная полярная |
В) h3O | 3) Ионная |
Г) NаBr | |
Д) Nh4 |
В2. Установите соответствие между соединением и типом кристаллической решетки
Соединение | Тип кристаллической решетки |
А) CO2 | 1) Ионная |
Б) Si | 2) Молекулярная |
В) NaOH | 3) Атомная |
Г) Са | 4) Молекулярная |
Д) Графит (С) |
В3. Установите соответствие между соединением и типом связи в соединении.
Соединение | Тип связи |
А) Zn | 1) Ковалентная неполярная |
Б) SO2 | 2) Ковалентная полярная |
В) h3 | 3) Ионная |
Г) N2 | 4) металлическая |
Д) BaCl2 |
Строение молекул. Химическая связь
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов.
Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорвана.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, h3S, Nh4 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (Nh5+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая кристаллическая решеткаМеталлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Обобщение материала
Типы химической связи
Полезные ссылки
Источник материала
Ионная связь и её характеристики (видео)
Ковалентная связь и её характеристики (видео)
Металлическая связь и её характеристики (видео)
Схемы образования веществ с различным типом связи (видео)
Разбор видов связи
Ионная химическая связь (видео)
Ковалентная неполярная химическая связь (видео)
Ковалентная полярная химическая связь (видео)
Металлическая химическая связь (видео)
Дополнительные материалы
Ковалентная и ионная химическая связь (видео)
Металлическая и водородная химические связи (видео)
Ионная связь (видео)
Ковалентная связь (видео)
Ковалентная полярная связь (видео)
Кристаллические решетки — Персональный сайт учителя химии Куликовой Надежды Владимировны
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.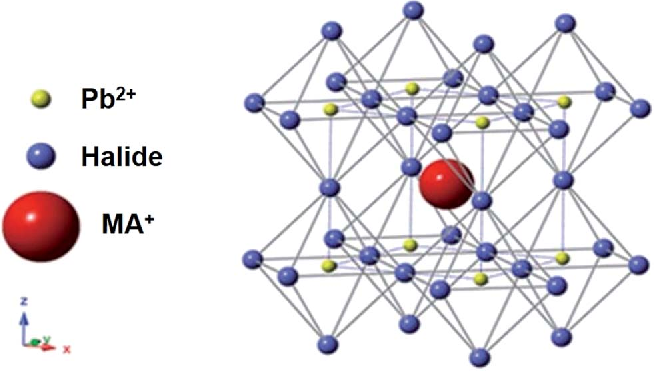
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» — пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
Таблица: Свойства веществ с различной кристаллической решёткой
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.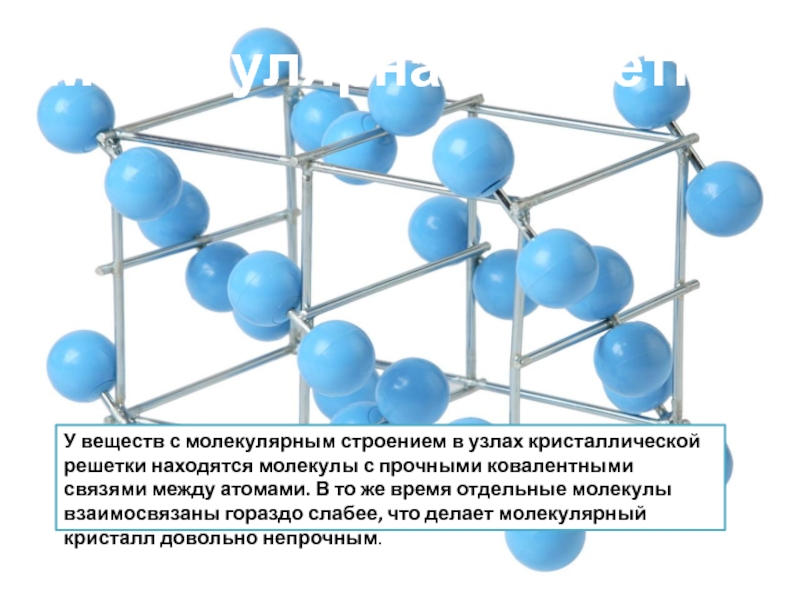
Атомная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся отдельные атомы. Атомы в таких решётках соединены между собой прочными ковалентными связями.
Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами.
Ионная кристаллическая решётка образована ионами, связанными друг с другом электростатическим взаимодействием.
Такая кристаллическая решётка характерна, например, для поваренной соли — хлорида натрия.
Молекулярная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся молекулы какого–либо вещества.
IV. Закрепление
Задание №1. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4COOH), сахар (C12h32O11), калийное удобрение (KCl), речной песок (SiO2) – температура плавления 1710 0C, аммиак (Nh4), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
Задание №2. По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
V. Тренажеры
Тренажёр №1. «Кристаллические решётки»
Тренажёр №2. «Тестовые задания»
VI. Выполните тест
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a) тугоплавки и хорошо растворимы в воде
б) легкоплавки и летучи
в) тверды и электропроводны
г) теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
a) вода
б) кислород
в) алмаз
г) озон
3) Атомная кристаллическая решётка характерна для:
a) алюминия и графита
б) серы и йода
в) оксида кремния и хлорида натрия
г) алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а) молекулярная
б) атомная
в) ионная
г) металлическая
Аммиак, строение, получение и свойства
Цели урока.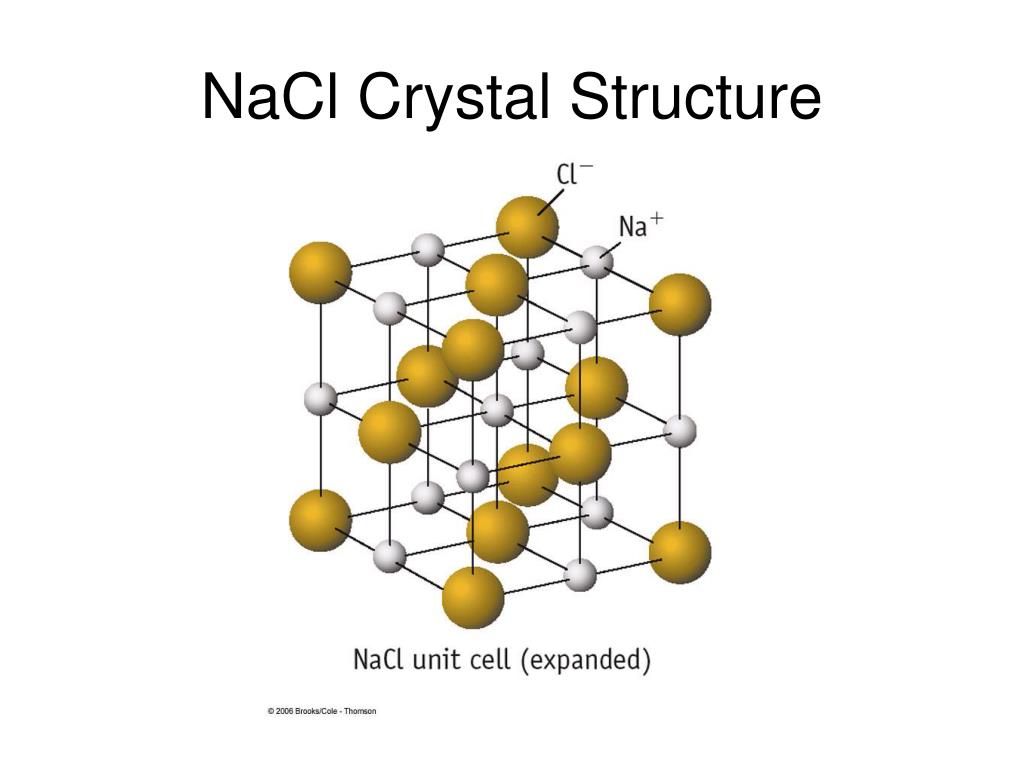
- Образовательная — в ходе урока обеспечить формирование новых знаний учащихся об аммиаке, его строении, свойствах, получении и применении.
- Рассмотреть строение молекулы аммиака. Познакомить учащихся с водородной связью. Изучить свойства аммиака. Рассмотреть донорно-акцепторный механизм образования химической связи
- Развивающая — умение сравнивать, обобщать, развивать мышление, интерес к предмету.
- Воспитательная — поведение в кабинете химии, наблюдательность при просмотре видеосюжета, формировать информационную и коммуникативную культуру.
Оборудование. Аммиачная вода, кристаллические Nh5Cl и Ca(OH)2, фенолфталеин, прибор для получения газов, HCl (конц), KMnO4 (для получения О2), KI, крахмал, лакмусовая бумажка, кристаллизатор, цилиндр, стеклянные палочки, лабораторный штатив.
ХОД УРОКА
I. Актуализация опорных знаний.
Проводим химическую разминку.
а) назовите возможные степени окисления азота,
б) в каких случаях азот будет проявлять окислительные свойства, и в каких - восстановительные?
в) перечислите физические свойства азота.
г) в чем причина химической инертности азота?
д) при каких условиях азот вступает в реакции с другими веществами?
е) в каком виде азот встречается в природе?
з) какова роль азота в жизни природы?
II. Изучение нового материала.
1. Строение молекулы.
Открывая дверцу холодильника, вы ощущаете холод. Так какое же вещество является причиной этому явлению?
Работа в парах.
Инструкция №1.
1. Напишите уравнения реакции водородных соединений азота.
2. Изобразите электронную и структурную формулу
этого соединения.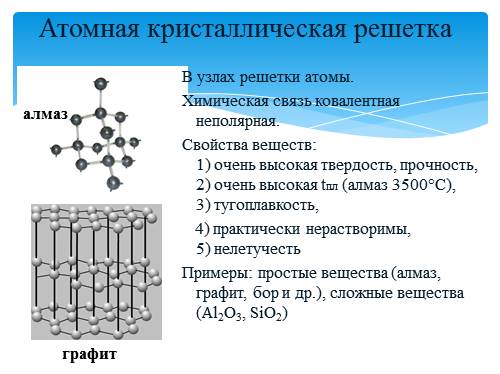
3. Определите химическую связь в этой молекуле.
4. Какую особенность электронного строения вы видите у атома азота?
Учащиеся работают самостоятельно в парах с учебником с.47-48
Затем, проверяем правильность выполненного задания через мультимедиa (слайд №1, 2, 3 и 4) Презентация.
2. Определить физические свойства аммиака.
Проблемный вопрос. В чем причина хорошей растворимости аммиака в воде?
Беседа:
Кристаллическая решетка аммиака- молекулярная; молекула легкая, но в отличие от молекулы азота - полярная.
Отсюда, какие температуры кипения и плавления должен иметь аммиак?
Учащиеся: можно предположить, что — низкие.
Почему?
Потому, что полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам.
Строение молекулы позволяет прогнозировать и хорошую растворимость в воде.
Это связано с возникновением между его молекулами особой химической связи- водородной. (слайд №5). У атома азота имеется свободная электронная пара в молекуле аммиака, наличие частичного (+) заряда на атоме водорода и наличие частичного (-) заряда на атоме азота.
Водородной называется связь между атомами водорода одной молекулы и атомами электроотрицательных элементов другой молекулы (F, O, N). (слайд№5)
Вывод: аммиак при повышении давления переходит в жидкое состояние. Испарение жидкого аммиака при понижении давления сопровождается сильным охлаждением окружающих предметов. Используется это свойство в холодильных установках.
- Аммиак- бесцветный газ.
- От него во рту першит.
- Щиплет нос и щиплет глаз.
- Аммиак — он ядовит!
- Аммиак — он растворитель.
- С газа в жидкость переходит
- Аммиак — диамагнит.

- Так же ток он не проводит.
- Сухой аммиак
- На воздухе взрывается.
- В воде растворяется.
- Взрывчатые вещества, удобрения
Вот не полный список его применения.
3. Получение аммиака в лаборатории.
Демонстрируем опыт. Нагреваем смеси хлорида аммония с гидроксидом кальция.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + H2O
Полученный аммиак растворяем в воде, в которую добавляем фенолфталеина. Раствор аммиака окрашивается в малиновый цвет.
Почему раствор аммиака окрасился в малиновый цвет?
Учащиеся: в растворе присутствует ион гидроксида, среда щелочная.
Учитель. В аммиачной воде большая часть аммиака содержится в виде молекул Nh4, равновесие смещено влево, (т.к. Nh4 — слабый электролит)и такая вода содержит много молекул Nh4, поэтому она пахнет аммиаком. Показываю, как правильно обращаться с растворами сильно пахнущих веществ.
Демонстрируем обесцвечивание окрашенной фенолфталеином аммиачной воды при нагревании. Почему это произошло?
Учащиеся: непрочное соединение.
При нагревании растворимость газов (Nh4-газ) уменьшается, аммиак улетучивается, равновесие реакции еще больше смещается влево, гидроксид-ион (ОН ) практически не остается в растворе. Водный раствор становится нейтральным.
Проблемный вопрос: из какого сырья и какими способами можно производить азотные удобрения?
Учащиеся предполагают, что из азота воздуха.
Задача эта была выдвинута перед отечественной
наукой Д.И.Менделеевым, который писал : «Одну из
задач прикладной химии составляет отыскание
технически выгодного способа получения из азота
воздуха его соединений, заключающих
ассимилируемый азот. Будущность сельского
хозяйства много зависит от открытия подобного
способа».
Будущность сельского
хозяйства много зависит от открытия подобного
способа».
Экономически наиболее выгодный способ промышленного связывания атмосферного азота - синтез аммиака из азота и водорода:
Учитель: Дайте характеристику данной реакции.
Учащиеся:
- экзотермическая
- обратимая
- каталитическая
- гетерогенная
- с уменьшением объема
Учитель: какие условия смещения равновесия необходимо для увеличения выхода аммиака?
Учащиеся: уменьшение температуры, увеличение давления.
Выход аммиака невелик, и вести промышленный синтез с такими показателями нерентабельно.
Обсуждаем с учащимися вопрос о возможностях повышения практического выхода аммиака. Важным критерием эффективности производства является производительность реактора. Анализ количественных данных о росте концентрации аммиака в азото — водородной смеси по мере протекания реакции позволяет прийти к в ы в о д у: производительность реактора можно увеличить путем уменьшения времени реакции. При этом снижается выход аммиака за один проход газовой смеси через реактор, а непрореагировавший газ можно снова вернуть в производство. Таким образом, идея циркуляции — важный технологический принцип, экономически целесообразный, повышающий производительность реактора. Необходимы требования к качеству сырья, в нем должно содержаться возможно меньше таких примесей, как аргон, метан. Сырье должно быть тщательно очищено от ядовитых для катализатора веществ(например, от соединений серы). Катализатором для синтеза аммиака является железо, активированное добавками(оксидами алюминия и калия) для придания высокой стабильной активности.
4. Образование катиона аммония идет по
донорно-акцепторному механизму.
Атом азота имеет свободную электронную пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул воды или кислот. (слайд № 6)
К молекуле аммиака по этому механизму присоединяется катион водорода +Н из молекулы воды и образуется ион +Nh5, в котором три ковалентные связи образуются по обменному механизму, а четвертая — по донорно- акцепторному механизму. Тем не менее все связи равноценны.
5. Химические свойства.
а) растворимость аммиака в воде.
Демонстрируем опыт: наполненную аммиаком пробирку опускаем в кристаллизатор с водой, в которую добавили немного фенолфталеина. Вода быстро заполняет пробирку, а раствор аммиака окрашивается в малиновый цвет.
Растворимость аммиака в воде очень велика- в 1 объеме воды растворяется 700 объемов аммиака. Почему аммиак хорошо растворяется в воде?
Учащиеся. Причина — образование водородных связей.
Учитель: какую среду имеет водный раствор аммиака?
Учащиеся: щелочную.
Учитель: так какими же свойствами должен обладать водный раствор аммиака?
Учащиеся: основными.
Какой вывод из этого мы можем с вами заключить?
Вывод: водный раствор аммиак является основанием.
Учитель: если водный раствор аммиака основание, то с какими веществами он будет взаимодействовать?
Учащиеся: с кислотами.
Демонстрируем опыт: «дым без огня», подносим друг к другу две стеклянные палочки, смоченные концентрированными растворами аммиака и соляной кислоты. Между этими палочками появляется обильный дым.
Напишите в полном и кратком ионном видах
уравнения реакцию водного раствора аммиака с
соляной кислотой.
Один ученик записывает уравнение реакций у доски, затем проверяем записи в своих тетрадях.
NH3 +HCl = NH4Cl
Учитель: какая соль образовалась и дать ей название?
Учащиеся дают название этой соли.
Образование катиона аммония при взаимодействии с кислотами идет по донорно- акцепторному механизму.
Обращаем внимание учащихся, что донором является азот, а акцептором- водород, т.к. у азота имеется свободная электронная пара, а у водорода свободная орбиталь.
В аммиаке азот имеет низшую с.о. (-3).
Так, чем же будет являться аммиак в окислительно-восстановительных реакциях?
Смотрим видеосюжет взаимодействие аммиака с кислородом (с катализатором и без него).
После просмотра видеосюжета прошу ребят написать уравнения реакций с кислородом, проставить с.о. и коэффициенты методом электронного баланса.
Правильность написание уравнений проверяем (слайд№ 7, 8)
Вывод: азот в аммиаке имеет низшую с.о. (-3), поэтому азот может только отдавать электроны, повышая свою с.о., отсюда — аммиак проявляет только восстановительные свойства. Химические свойства аммиака идут с изменением с.о. азота и с образованием ковалентной связи по донорно- акцепторному механизму.
III. Закрепление:
а) по какими признаками можно распознать аммиак? (по запаху; по окрашиванию влажной индикаторной бумаги — синеет; по появлению дыма при поднесении стеклянной палочки, смоченной концентрированной соляной кислотой).
б) какой тип реакции при взаимодействии аммиака с кислотами? (соединения)
в) написать уравнения реакции аммиака с ортофосфорной кислотой и дать названия полученных солей.
IV. Домашнее задание $17 c.52 упр.6,7,9-
1уровень; 6-11- 2 уровень. Подготовить сообщение о
применении и значение аммиака.
Подготовить сообщение о
применении и значение аммиака.
Типы кристаллических решёток; таблица, показывающая отличия кристаллических решёток графита, йода и натрия
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц. Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионными называют решётки, в узлах которых находятся ионы.Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов. Ионы могут быть простые или сложные.
Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.Связи между ионами в таких кристаллах прочные.
Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.
Кристаллическая решётка хлорида натрия
Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от (–37) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.
Металлическая кристаллическая решётка
Металлические изделия
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния((IV)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом. У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — (1728) °С, а у графита она выше — (4000) °С. Атомные кристаллы практически нерастворимы.
Кристаллическая решётка алмаза
Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения.
Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения. Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы. Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода((IV)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (h3,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).
Кристаллическая решётка углекислого газа
«Сухой лёд»
Кристаллики иода
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки.
Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные.
Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно (995) °С, (–83) °С, (–220) °С.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
Источник: https://www.yaklass.ru/p/himija/89-klass/stroenie-veshchestva-18844/kristallicheskie-reshetki-61860/re-a6ccb0b0-4b1a-4645-897f-e8a126bdc853
Типы кристаллических решеток и структур веществ (Таблица)
Справочная таблица по химии содержит информацию по важнейшим типам кристаллических решеток и структур центральных атомов. Таблица предназначена для школьников, изучающих углубленный курс неорганической химии, абитуриентов, поступающих в вузы химического профиля, а также студентов.
Таблица типы кристаллических структур
| Формула | Тип кристалической решетки | Координационное число и многогранник центрального атома | |
| Простые вещества | Cu | Кубическая пл. упак. упак. | 12, кубооктаэдр |
| α-Fe | Кубическая объемно-центрированная | 8, куб | |
| Mg | Гексагональная пл. упак. | 12, гексаг. аналог кубооктаэдра | |
| В12 | Тетрагональная | 5 (= 8 — 3), пентаг. пирамида | |
| Сx — (алмаз) | Кубическая | 4 (= 8 — 4), тетраэдр | |
| Сx — (графит) | Гексагональная | 3, (тр-к) + 1 | |
| Рx — черн. | Ромбическая | 3 (= 8 — 5), триг. пирамида | |
| S8 | Ромбическая | 2(= 8 — 6), / SSS 108 | |
| I2 | Ромбическая | 1 (= 8 — 7) | |
| Соединения типа АХ | NaCl | Кубическая | 6, октаэдр |
| CsCl | Кубическая | 8, куб | |
| ZnS (сфалерит) | Кубическая | 4, тетраэдр | |
| ZnS (вюртцит) | Гексагональная | 4, тетраэдр | |
| NiAs | Гексагональная | 6, октаэдр | |
| Соединения типа АХ2 | CaC2 | Тетрагональная | 10 и 2, тетраг. пирамиды, сближенные основаниями |
| FeS2(пирит) | Кубическая | 6, октаэдр | |
| CaF2 (флюорит) | Кубическая | 8, куб | |
| ТiO2 (рутил) | Тетрагональная | 6, октаэдр | |
| CdI2 | Гексагональная | 6, октаэдр | |
| SiO2 (кристобалит) | Кубическая | 4, тетраэдр |
Таблица типы кристаллических решеток
Примеры кристаллических решеток
Источник: https://infotables.ru/khimiya/326-kristallicheskie-struktury-i-reshetki-vazhnejshie-tipy-tablitsa
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: Nh4, h3O, Cl2, CO2, N2, Br2, h3, I2. Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, Nh5Br, KNO3, Li2O, Na3PO4.
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.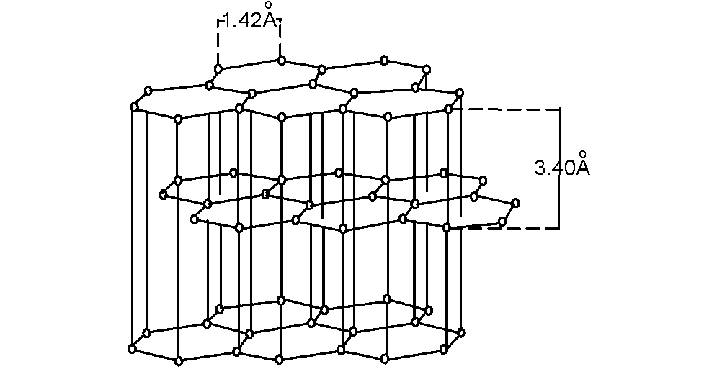
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).
Источник: https://studarium.ru/article/154
Типы кристаллических решеток. Видеоурок. Химия 11 Класс
В зависимости от давления и температуры, все вещества могут существовать в различных агрегатных состояниях: твердом, жидком, газообразном или в виде плазмы. При низких температурах и высоком давлении все вещества существуют в твёрдом агрегатном состоянии. Твердое и жидкое состояние вещества называют конденсированным.
В твердых телах частицы располагаются компактно, в определенном порядке. В зависимости от степени упорядоченности частиц в твердых телах определяют 2 фазовых состояния: кристаллическое и аморфное.
Если частицы располагаются таким образом, что между соседними частицами есть некоторая упорядоченность в расположении, а именно: постоянное расстояние и углы между ними, такое явление называют наличие ближнего порядка в расположении. Рис. а.
a b
Рис. 1. Наличие ближнего и дальнего порядка в расположении частиц
Если же частицы расположены таким образом, что упорядоченность наблюдается и между ближайшими соседями, и на гораздо больших расстояниях, это называют наличие дальнего порядка. Рис. б.
Аморфное тело (от греч А – не, morfe – форма) – бесформенные вещества. В них существует только ближний порядок и нет дальнего порядка.
Примеры аморфных тел приведены на рис. 2.
Рис. 2. Аморфные тела
Это воск, стекло, пластилин, смола, шоколад.
Свойства аморфных веществ
- Имеют только ближний порядок (как в жидкостях).

- Твердое агрегатное состояние при нормальных условиях.
- Нет четкой температуры плавления. Плавятся в интервале температур.
В кристаллическом теле существует и ближний, и дальний порядок. Если мысленно соединить точки, обозначающие линии, получится пространственный каркас, который называется кристаллической решеткой.
Точки, в которых размещены частицы – ионы, атомы или молекулы – называют узлами кристаллической решетки (рис. 3). Частицы не жестко фиксированы в узлах, они могут немного колебаться, не убегая из этих точек.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, выделяют её типы (табл. 1).
Рис. 3. Кристаллическая решетка
Физические свойства веществ с различными типами кристаллических решеток
Табл.1. Физические свойства веществ
Существует несколько подтипов кристаллических решеток, различающихся расположением атомов в пространстве.
В веществах с атомной, ионной, металлической кристаллической решетками нет молекул – это немолекулярные вещества.Молекулярные вещества – с молекулярной кристаллической решеткой.
Полиморфизм — это явление, при котором сложные вещества одинакового состава имеют разные кристаллические решетки.
Например, пирит и марказит. Их формула – FeS2.Но они и выглядят по-разному, и обладают различными физическими свойствами. Аналогично, различными физическими свойствами обладают минералы состава CaCO3: арагонит, мрамор, исландский шпат, мел.
Явление существования химических элементов в виде нескольких простых веществ называется аллотропией, а вещества – аллотропными модификациями. Это объясняется различным составом вещества или различием в их кристаллической решетке.
Кислород и озон – аллотропные модификации химического элемента кислорода. Углерод образует графит, алмаз, фуллерен, карбин.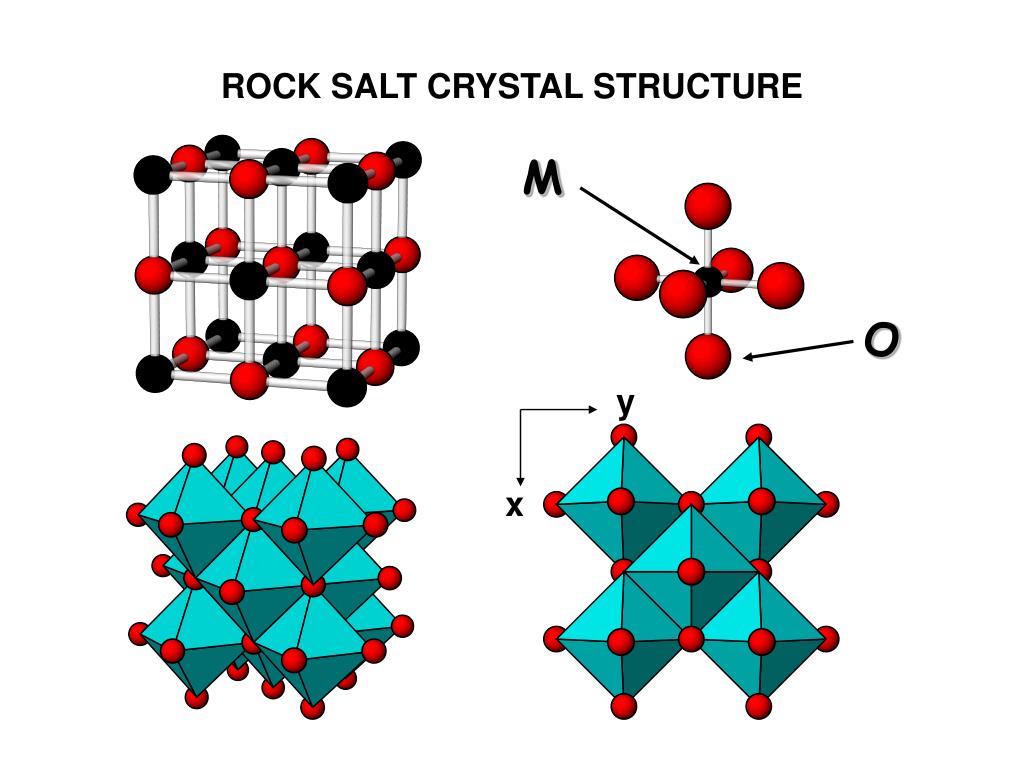 Расположение атомов в их кристаллических решетках разное, и поэтому они проявляют разные свойства. У фосфора аллотропные вещества – красный, белый и черный фосфор. Аллотропия характерна и для металлов.
Расположение атомов в их кристаллических решетках разное, и поэтому они проявляют разные свойства. У фосфора аллотропные вещества – красный, белый и черный фосфор. Аллотропия характерна и для металлов.
Например, железо может существовать в виде α, β, δ, γ.
Текучесть аморфных веществ
Одним из свойств, по которым отличаются аморфные тела от жидких, является их текучесть. Если положить кусочек смолы на нагретую поверхность, то он постепенно растечется по этой поверхности.
Вязкость – это способность сопротивляться перемещению одних частей тела относительно других для жидкостей и газов: чем она выше, тем сложнее изменить форму тела. Оконные стекла – это типичные аморфные вещества.
Теоретически они должны постепенно стекать вниз. Но вязкость стекла высокая, и его деформацией можно пренебречь. Вязкость стекла примерно в 1000 раз выше вязкости смолы. За год деформация стекла составляет 0,001%.
За 1000 лет деформация стекла составляет 1%.
Подведение итога урока
На уроке рассмотрены типы кристаллических решеток, типы агрегатных состояний вещества, твердые тела с кристаллической структурой. Введено понятие полиморфизма и аллотропии. Объяснялась зависимость физических и химических свойств от разных типов кристаллических решеток в веществе.
Список литературы
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Попель П.П. Химия: 11 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О.С.Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- №№ 7, 8, 9 (с.
 41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012. - Приведите примеры веществ молекулярного строения.
- Что такое полиморфизм?
Источник: https://interneturok.ru/lesson/chemistry/11-klass/btipy-himicheskih-svyazejb/tipy-kristallicheskih-reshetok
Кристаллические решетки в химии
Содержание:
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме.
Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку.
Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов.
Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления.
Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки.
В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия.
Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки.
Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом.
Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
- И в завершение подробное видео пояснения о свойствах кристаллических решеток.
- Эта статья доступна на английском – Crystal Lattice in Chemistry.
Источник: https://www.poznavayka.org/himiya/kristallicheskie-reshetki-v-himii/
Урок №53. Кристаллические решётки — ХиМуЛя.com
Строение вещества
В химические взаимодействия
вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со
строением вещества.
При низких температурах для
веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём
всех самоцветов и драгоценных камней. Да и само его название означает
по-гречески «несокрушимый».
На алмазы с давних пор смотрели как на
чудодейственные камни.
Считалось, что человек, носящий алмазы, не знает
болезней желудка, на него не действует яд, он сохраняет до глубокой старости
память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют
бриллиантом.
При плавлении в результате
тепловых колебаний порядок частиц нарушается, они становятся подвижными, при
этом характер химической связи не нарушается. Таким образом, между твёрдым и
жидким состояниями принципиальных различий нет.
У жидкости появляется
текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы
Жидкие кристаллы открыты в
конце XIX века, но изучены в последние
20-25 лет. Многие показывающие устройства современной техники, например
некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие
кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и
лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд
водяной лёд
плавится при температуре выше 2000 С. Необычность сочетания
«жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность
структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из
многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное
строение, то при его плавлении эти молекулы ориентируются определённым образом
друг относительно друга (их длинные оси располагаются параллельно).
При этом
молекулы могут свободно перемещаться параллельно самим себе, т.е. система
приобретает свойство текучести, характерное для жидкости. В то же время система
сохраняет упорядоченную структуру, обусловливающую свойства, характерное для
кристаллов.
Высокая подвижность такой
структуры даёт возможность управлять ею путём очень слабых воздействий
(тепловых, электрических и др.), т.е. целенаправленно изменять свойства
вещества, в том числе оптические, с очень малыми затратами энергии, что и
используется в современной технике.
Типы кристаллических решёток
- Любое химическое вещество
образованно большим числом одинаковых частиц, которые связаны между собою. - При низких температурах,
когда тепловое движение затруднено, частицы строго ориентируются в пространстве
и образуют кристаллическую решётку. - Кристаллическая решетка – это структура с геометрически правильным
расположением частиц в пространстве. - В самой кристаллической
решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных
кристаллических формах (т.е. имеют разные кристаллические решетки) –
аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре
модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало
кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его
Он обнаружен в метеоритах и получен искусственно, а строение его
ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода.
Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали
«зеркальным углеродом». Зеркальный углерод химически инертен, термостоек,
непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью
с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» — пишу, рисую.
Графит представляет собой тёмно – серые кристаллы со слабым металлическим
блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита,
связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
| ионная | атомная | молекулярная | металлическая | |
| Что в узлах кристаллической решётки, структурная единица | ионы | атомы | молекулы | атомы и катионы |
| Тип химической связи между частицами узла | ионная | ковалентная: полярная и неполярная | ковалентная: полярная и неполярная | металлическая |
| Силы взаимодействия между частицами кристалла | электростати- ческие | ковалентные | межмолекуляр- ные | электростати- ческие |
| Физические свойства, обусловленные кристаллической решёткой |
|
|
|
|
| Агрегатное состояние вещества при обычных условиях | твёрдое | твёрдое |
| твёрдое, жидкое(Нg) |
| Примеры | большинство солей, щелочей, оксиды типичных металлов | С (алмаз, графит), Si, Ge, B, SiO2, CaC2, SiC (карборунд), BN, Fe3C, TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. | все газы, жидкости, большинство неметаллов: инертные газы, галогены, h3, N2, O2, O3, P4 (белый), S8. Водородные соединения неметаллов, оксиды неметаллов: h3O, CO2 «сухой лёд». Большинство органических соединений. | Металлы, сплавы |
Свойства веществ с различной кристаллической решёткой (таблица)
Если скорость
роста кристаллов мала при охлаждении – образуется стеклообразное состояние
(аморфное).
- Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в
периодической системе и кристаллической решёткой его соответствующего простого
вещества существует тесная взаимосвязь.
| г р у п п а | ||||||||
| I | II | III | IV | V | VI | VII | VIII | |
| I | h3 | He | ||||||
| II | Li | Be | B | C | N2 | O2 | F2 | Ne |
| III | Na | Mg | Al | Si | P4 | S8 | Cl2 | Ar |
| IV | K | Ca | Ga | Ge | As | Se | Br2 | Kr |
| V | Rb | Sr | In | Sn | Sb | Te | I2 | Xe |
| Тип кристаллической решётки | металлическая | атомная | молекулярная |
- Простые вещества остальных элементов имеют
металлическую кристаллическую решётку. - ЗАКРЕПЛЕНИЕ
- Изучите материал лекции, ответьте на следующие
вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в
быту веществ: вода, уксусная кислота (Ch4COOH),
сахар (C12h32O11), калийное удобрение (KCl),
речной песок (SiO2) – температура плавления 1710 0C, аммиак (Nh4), поваренная соль? Сделайте
обобщённый вывод: по каким свойствам вещества можно определить тип его
кристаллической решётки? - По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 — определите тип кристаллической решётки
(ионная, молекулярная) каждого соединения и на основе этого опишите физические
свойства каждого из четырёх веществ. - Тренажёр №1. «Кристаллические решётки»
- Тренажёр №2. «Тестовые задания»
- Тест (самоконтроль):
1) Вещества, имеющие
молекулярную кристаллическую решётку, как правило:
a).
тугоплавки и хорошо растворимы в воде б). легкоплавки и летучи
в). Тверды и
электропроводны
г).
Теплопроводны и пластичны
- 2) Понятия «молекула» не
применимо по отношению к структурной единице вещества: - a).
вода - б). кислород
- в).
алмаз - г). озон
- 3) Атомная кристаллическая решётка
характерна для: - a).
алюминия и графита - б). серы и йода
- в).
оксида кремния и хлорида натрия - г). алмаза и
бора - 4) Если вещество хорошо
растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая
решётка: - а).
молекулярная - б). атомная
- в).
ионная
- г).
металлическая
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/lekcia-kristalliceskie-reseetki
ХИМИЯ. как определить тип кристаллической решетки?
Екатерина ***** Мудрец (17790) 7 лет назад В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка.
Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы.
Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь.
Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность.
Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы.
молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) .
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
- Комментарий удален
- Комментарий удален
- Комментарий удален
Vika Ученик (149) 7 лет назад ИОННЫЕ Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. АТОМНЫЕ Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал. МОЛЕКУЛЯРНЫЕ Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии МЕТАЛЛИЧЕСКИЕ Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Taneshige Мудрец (10906) 7 лет назад молекулярная кристаллическая решетка, в узлах которой распологаются молекулы, например Cl2,I2,h3, Br2 и т. д атомная кристаллическая решетка, в узлах которой находятся отдельные атомы, которые соединены очень прочными ковалентными связями, например алмаз металлическая кристаллическая решетка, в узлах которой распологаются атомы и ионы металла, ну это все металлы Na, K, Mg, Ca и другие
ионная кристаллическая решетка в узлах которой находятся ионы, их образуют вещества с ионной связью. это соли, некоторые оксиды и гидроксиды металлов, самый простой пример NaCl, KI
Исаак Таненбаум Ученик (125) 3 года назад Ольга Куртеева Знаток (253) 3 года назад Илья Новичков Ученик (185) 3 года назад Dana Takenova Ученик (241) 3 года назад В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы.
Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь.
Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность.
Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы.
молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) .
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
миша пупков Ученик (208) 3 года назад В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы.
Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь.
Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность.
Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы.
молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) .
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействияв узлах атомных кристаллических решеток находятся отдельные атомы
Никита Кравченко Ученик (233) 2 года назад В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. Ионные кристаллические решетки Виды частиц в узлах решетки: ионы Для веществ с ионной химической связью будет характерна ионная решетка. Ионы-это частицы, имеющие положительный или отрицательный заряд. Напрмер NaCl, Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов. Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток Атомные кристаллические решетки В узлах атомной кристаллической решетки находятся отдельные атомы.
Ковалентная химическая связь. В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С) , прочны и тверды, нелетучи, практически нерастворимы в жидкостях. Металлические кристаллические решетки Металлическая связь.
Связь в металлах между положительными ионами посредством обобществленных электронов. общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность.
Вещества с металлической связью имеют металлические кристаллические решетки В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки Эти вещества являются неметаллами. Простые по составу. Химическая связь внутри молекул ковалентная неполярная. Летучие, легкоплавкие, малорастворимые в воде. в узлах решетки нах. молекулы.
молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, h3,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар) .
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
Радомир Пиглицин Мастер (2492) 1 год назад Ионные кристаллические решеткиДанные типы кристаллических решеток присутствуют в соединениях с ионным типом связи. В этом случае узлы решетки содержат ионы, обладающие противоположным электрическим зарядом. Благодаря электромагнитному полю, силы межионного взаимодействия оказываются достаточно сильными, и это обуславливает физические свойства вещества. Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие. физические типы кристаллических решеток Атомные кристаллические решеткиЭтот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.ЧТО ДЕЛАТЬ В СЛУЧАЕ ОХРИПЛОСТИ ИЛИ ПОТЕРИ ГОЛОСА?Голос человека – настоящее сокровище, которое многие не берегут. Важнейшим фактором, который влияет на голос, является состояние ЛОР-органов. Поэтому ларингит сопровождается охриплостью и даже полной потерей голоса. В случае потери голоса следует…Читать далее… SlickJump® Есть противопоказания. Посоветуйтесь с врачом. Молекулярные кристаллические решеткиВещества, имеющие молекулярный тип кристаллической решетки, представляют собой систему устойчивых, взаимодействующих, плотноупакованных между собой молекул, которые расположены в узлах кристаллической решетки. В подобных соединениях молекулы сохраняют свое пространственное положение в газообразной, жидкой и твердой фазе. В узлах кристалла молекулы удерживаются слабыми ван-дер-ваальсовыми силами, которые в десятки раз слабее сил ионного взаимодействия. молекулярный тип кристаллической решетки Образующие кристалл молекулы могут быть как полярными, так и неполярными. Из-за спонтанного движения электронов и колебания ядер в молекулах электрическое равновесие может смещаться – так возникает мгновенный электрический момент диполя. Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой.Женская грудь требует особого внимания и заботы…Не секрет, что мастопатия — это широко распространенное заболевание, от которого страдают многие женщины. Но не все знают, что его развитие может быть фоном для возникновения более серьезных…Читать далее… SlickJump®Металлические кристаллические решеткиМеталлическая связь гибче и пластичней ионной, хотя может показаться, что обе они базируются на одном и том же принципе. Типы кристаллических решеток металлов объясняют их типичные свойства – такие, например, как механическая прочность, тепло- и электропроводность, плавкость.
Отличительной особенностью металлической кристаллической решетки является наличие положительно заряженных ионов металла (катионов) в узлах этой решетки. Между узлами находятся электроны, которые непосредственно участвуют в создании электрического поля вокруг решетки. Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом. типы кри
Источник: https://otvet.mail.ru/question/73059881
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Кристаллическая структура проницаемого для аммиака аквапорина
Abstract
Было высказано предположение, что аквапорины подсемейства TIP (внутренние белки тонопласта) способствуют проникновению воды и аммиака через вакуолярную мембрану растений, позволяя вакуоли эффективно связывать ионы аммония и противодействовать цитозольным колебаниям аммиака. Здесь мы сообщаем о структуре, определенной с разрешением 1,18 Å из двойниковых кристаллов Arabidopsis thaliana аквапорина At TIP2; 1, и подтверждаем проницаемость для воды и аммиака очищенного белка, восстановленного в протеолипосомах, что дополнительно подтверждается моделированием молекулярной динамики.Структура At TIP2; 1 демонстрирует фильтр с расширенной селективностью с консервативным аргинином фильтра, занимающим уникальное непредсказуемое положение. Относительно широкие поры и полярный характер фильтра селективности уточняют проницаемость для аммиака. Путем мутационных исследований мы показываем, что идентифицированные детерминанты в области расширенного фильтра селективности достаточны для превращения строго водоспецифичного человеческого аквапорина в At TIP2; 1-подобный аммиачный канал. Предполагается, что гибкий гистидин и новая заполненная водой боковая пора депротонируют ионы аммония, тем самым, возможно, увеличивая проникновение аммиака.Молекулярное понимание того, как аквапорины способствуют потоку аммиака через мембраны, потенциально может быть использовано для регулирования потерь аммиака через плазматическую мембрану в атмосферу, например, во время фотодыхания, и тем самым для изменения эффективности использования азота растениями.
Сведения об авторе
Аммиак — центральная молекула в метаболизме азота. Аквапорины — это интегральные мембранные белки, которые образуют каналы, которые ускоряют пассивное проникновение небольших полярных незаряженных молекул, таких как вода и аммиак, через липидные мембраны клетки.Информация о структуре проницаемых для аммиака аквапоринов отсутствует. Здесь мы сообщаем о структуре проницаемого для аммиака аквапорина At TIP2; 1 с высоким разрешением и исследуем ее с помощью функциональных анализов мутантов и моделирования молекулярной динамики. Наши данные раскрывают неожиданные особенности фильтра селективности субстрата, включая консервативный аргинин в новой ориентации, который стабилизируется взаимодействиями с гистидином, который связан со специфичностью аммиака. Дополнительный гистидин в другой части At TIP2; 1 усиливает положение аргинина и непосредственно взаимодействует с субстратом в канале.Таким образом, этот гистидин включен в фильтр с расширенной селективностью, что должно побудить к переосмыслению детерминант специфичности всех типов аквапоринов. Мы предполагаем, что интересная заполненная водой боковая пора, расположенная рядом со связывающим субстрат гистидином, участвует в депротонировании ионов аммония, что может увеличить чистое проникновение аммиака. Понимание принципов проницаемости для аммиака может в будущем позволить нам регулировать прохождение аммиака и создавать культуры с более высокой эффективностью использования азота.
Образец цитирования: Kirscht A, Kaptan SS, Bienert GP, Chaumont F, Nissen P, de Groot BL, et al. (2016) Кристаллическая структура аммиакопроницаемого аквапорина. PLoS Biol 14 (3): e1002411. https://doi.org/10.1371/journal.pbio.1002411
Академический редактор: Раймунд Дутцлер, Цюрихский университет, ШВЕЙЦАРИЯ
Поступила: 17 ноября 2015 г .; Одобрена: 19 февраля 2016 г .; Опубликован: 30 марта 2016 г.
Авторские права: © 2016 Kirscht et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Уточненная структура и амплитуды структурных факторов депонированы в банке данных белков, www.pdb.org, с кодом доступа 5I32. Все остальные соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Финансовая поддержка Шведского исследовательского совета (VR) UJ, PK; Formas, Исследовательская школа фармацевтических наук (FLÄK) PK; Бельгийский национальный фонд научных исследований (FNRS), Межвузовская программа по полюсам притяжения — научная политика Бельгии и Французское сообщество Бельгии — Action de Recherches Concertées признаны FC; GPB был научным сотрудником FNRS и в настоящее время поддерживается грантом Эмми Нётер 1668 / 1-1 от Deutsche Forschungsgemeinschaft.PN был поддержан грантом на перспективные исследования (Biomemos) Европейского исследовательского совета. Доступ к синхротронным источникам был поддержан программой Danscatt Датского совета независимых исследований и контрактом 860 с BioStruct-X. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Сокращения: AQP, аквапорин; Доктор медицины, молекулярная динамика; NPA, Асн-Про-Ала; OG, н-октил-β-D-глюкозид; PIP, собственный белок плазматической мембраны; PMF, потенциальная средняя сила; POPC, 1-пальмитоил-2-олеоилфосфатидилхолин; СОВЕТ, Внутренний белок Tonoplast
Введение
Азот — это макроэлемент, который часто ограничивает рост растений.Следовательно, эффективное отведение и хранение аммиака, центральной молекулы в метаболизме азота, имеет фундаментальное значение. Внутренние белки тонопластов (TIP), принадлежащие к семейству основных внутренних белков, также известному как суперсемейство аквапоринов (AQP), как было показано, проводят как воду [1], так и аммиак [2–4]. TIPs присутствуют во всех наземных растениях, но в то время как примитивные растения, такие как мхи, имеют только один тип TIP (TIP6), пять специализированных подгрупп (TIP1-5) развились у высших растений [5].ТИПы могут составлять до 40% белка в вакуолярной мембране, то есть в тонопласте [6], и было предложено повысить эффективность поглощения азота и детоксикацию путем улавливания кислотой ионов аммония в вакуолях [3]. Кроме того, было высказано предположение, что TIP-опосредованное увеличение проницаемости для аммиака играет роль в ремобилизации вакуолярного аммиака во время азотного голодания [2] и в перераспределении азота при старении [7]. Недавно TIP были включены в пересмотренную модель бесполезного цикла в условиях высокого содержания аммиака [8].Сходство последовательностей с TIPs наблюдается у AQP8s млекопитающих [9], которые также проницаемы для аммиака [10] и участвуют в патологических состояниях, таких как гипераммонемия и печеночная энцефалопатия [11].
Кристаллические структуры установили, что AQP являются гомотетрамерами, где каждый из мономеров содержит функциональную пору, созданную шестью спиралями, соединяющими мембрану (спираль 1 ‒ спираль 6), пятью соединительными петлями (петля A ‒ петля E) и двумя более короткими спиралями спираль B и спираль E; рис. 1), обе демонстрируют мотив сигнатуры AQP Asn-Pro-Ala (NPA) [12–16].Спирали B и E соединяются в мотивах NPA в середине мембраны, образуя таким образом двудольный трансмембранный сегмент. Различные изоформы AQP способствуют проникновению множества небольших незаряженных полярных молекул, в то время как протоны эффективно выводятся из поры частично за счет положительного заряда, который фокусируется в область NPA макродиполями коротких спиралей [17]. Считается, что субстратная специфичность достигается с помощью фильтра селективности ароматический / аргинин [18], который был определен как четыре остатка, расположенные на нецитозольном конце поры [19].Из этих остатков аргинин консервативен в короткой спирали E большинства AQP и способствует исключению протонов [20], тогда как гистидин в спирали 5 связан со специфичностью воды [13]. AQP, проницаемые для аммиака и воды, называемые аквааммониапоринами, включая человеческий Hs AQP8, обычно не имеют гистидина в спирали 5, но вместо этого имеют гистидин в спирали 2 [2–4]. Однако все ранее опубликованные структуры AQP представляют собой либо водоспецифические каналы (истинные AQP), либо водо- и глицерин-проводящие акваглицеропорины, поэтому дальнейшее понимание структурных особенностей, которые придают селективность по аммиаку, отсутствует.Чтобы восполнить этот пробел в знаниях, мы решили кристаллизовать аквааммониапорин At TIP2; 1 из A . Талиана . Здесь мы представляем кристаллическую структуру At TIP2; 1, определенную при атомном разрешении (1,18 Å с частичным двойникованием). В сочетании с моделированием молекулярной динамики (МД) и функциональными исследованиями мутантов, структура дает новое понимание молекулярных основ селективности субстрата в суперсемействе AQP.
Рис 1. Топология и структура на TIP2; 1.
(A) График топологии, показывающий спирали, охватывающие мембрану (h2 – H6) и промежуточные петли (A – E). Гомологичные области внутреннего повтора обозначены цветом. Пять позиций фильтра с расширенной селективностью отмечены в соответствии с позицией на рисунке. Глицин (Gly 1), соответствующий инициатору метионину в At TIP2; 1, заштрихован темно-голубым цветом рядом с пунктирной линией, представляющей сайт расщепления TEV, а N-концевой дека-His-тег заштрихован фиолетовым. (B) Две короткие спирали (HB и HE) в петле B и E, соединенные консервативными мотивами NPA, образуют седьмой трансмембранный сегмент.Все трансмембранные сегменты наклонены в мембране, но это наиболее выражено в спиралях h4, H6, HB и HE, обращенных к липидному бислою. (C) Восемь молекул воды образуют единый массив в основной поре мономера, соединяя цитозольные и вакуолярные преддверия. Вверху справа пять дополнительных молекул воды видны в боковой поре под петлей C. (D) At TIP2; 1 тетрамер, если смотреть со стороны вакуоля. Мономеры показаны в виде поверхности и в карикатурном изображении, используемом в (B) и (C).
https://doi.org/10.1371/journal.pbio.1002411.g001
Результаты
Общая структура
на TIP2; 1Гетерологически экспрессируется At TIP2; 1 дает до 1,1 мг очищенного и концентрированного белка на 1 г влажных клеток Pichia pastoris . Очищенный At TIP2; 1 был подтвержден как функциональный водный канал, ингибируемый ртутью, а также проницаемый для аммиака (рис. 2). At TIP2; 1, солюбилизированный н-октил-β-D-глюкозидом, кристаллизовался при pH 5.0 и структура, определенная с разрешением 1,18 Å (табл. 1). В указанной структуре разрешены 238 аминокислотных остатков, и только N-концевой тег и 12 нативных остатков на C-конце не включены в модель. В отличие от других AQP (например, So, PIP2; 1 [14], Hs AQP5 [15]), ни петли, ни разрешенные части концевых областей не перекрываются с соседними мономерами в тетрамере. Петля A и петля D загибаются назад на своей собственной субъединице, а N- и C-концевые области встречаются на внешнем крае цитоплазматического преддверия, не ограничивая поры (Рис. 1C и 1D).Соответственно, структура At TIP2; 1 представляет собой открытый канал, в котором цитозольные и вакуолярные преддверия соединены порой, выстилающей восемь молекул воды в одном файле.
Рис. 2. Функциональные анализы.
(A) Водопроницаемость липосом со вставкой и без нее При TIP2; 1 измерено при различных значениях pH. Эксперименты с остановленным потоком с гиперосмолярным сдвигом 100 мМ демонстрируют высокую проводимость, обеспечиваемую белком, при цитозольном и вакуолярном pH.Относительные одноэкспоненциальные константы скорости прибл. 110 с -1 при LPR 30 демонстрируют способность выдерживать высокопроницаемую для воды вакуоль. (B) Водопроницаемость очищенного At TIP2; 1 (LPR 50) ингибируется ртутью, как ранее было показано в ооцитах [21]. (C) Поглощение аммиака отслеживается по повышенной внутренней флуоресценции после замены 20 мМ NaCl на 20 мМ NH 4 Cl, что соответствует начальному градиенту NH 3 в 4,5 мкМ. Протеолипосомы с At TIP2; 1 (зеленый) демонстрируют более высокую проницаемость, чем контрольные липосомы такого же размера (серые).Также показаны подогнанные кривые, дающие одно экспоненциальные скорости. (D) Сводка скоростей при различных градиентах аммиака. Уравнения и коэффициенты корреляции приведены для линейной аппроксимации усредненных одноэкспоненциальных скоростей как функции общего начального градиента концентрации NH 3 / NH 4 + . Планки погрешностей представляют собой стандартное отклонение скорости в пределах набора из приблизительно десяти записей остановленного потока на образец липосомы. Основные данные панелей A – D можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.g002
Фильтр с расширенной избирательностью
Интересно, что диаметр поры At TIP2; 1 в области NPA меньше, чем у других AQP, и остается постоянным на уровне около 3 Å по всей поре (рис. 3A и 3B). Это необычно, поскольку в других структурах открытых AQP фильтр селективности ароматический / аргинин составляет самую узкую часть поры. Как упоминалось ранее, аминокислотные остатки в четырех положениях фильтра селективности пор в спирали 2, спирали 5, петле E и спирали E (конкретно обозначены h3 P , H5 P , LE P и HE P ), как полагают, определяют субстратную специфичность (рис. 1A и 3C).В соответствии с этим, TIP2 отклоняются от других AQP (Рис. 3D), и, как ожидается на основе мутационных исследований и моделирования [2,22], более широкий фильтр селективности в основном обусловлен изолейцином (Ile 185) в положении H5 P в спираль 5, заменяя гистидин, который сохраняется в водоспецифичных AQP. Однако наиболее яркая особенность фильтра селективности At TIP2; 1 возникает из-за непредсказуемого позиционирования аргинина на HE P в спирали E (Arg 200), консервативном остатке почти во всех AQP.В At TIP2; 1 боковая цепь аргинина выталкивается в сторону поры гистидином, расположенным в петле C (His 131), который теперь появляется как пятый остаток (LC P ) фильтра расширенной селективности. . Новое положение аргинина дополнительно стабилизируется водородной связью с гистидином (His 63) в положении h3 P спирали 2, которая занимает по существу то же пространство, что и соответствующие ароматические остатки воды и глицериновых каналов (например, Phe 81 в So PIP2; 1 [14], Trp 48 в Ec GlpF [12]) без прямого воздействия на апертуру поры.Тесное взаимодействие с Arg 200 в положении HE P в спирали E предполагает сдвиг в p K a His 63 в положении h3 P , который, вероятно, останется непротонированным также в кислой среде. вакуоли. В отличие от His 63, дополнительный His 131 в положении LC P в петле C указывает на центр поры и образует водородную связь с водой поры (Wat 2; фиг. 3B). Следовательно, At TIP2; 1 представляет первую структуру AQP, где остаток в петле C (His 131) непосредственно участвует во взаимодействиях с субстратом в области селективности, определяя фильтр расширенной селективности с пятью положениями.Остаток гистидина в положении h3 P в спирали 2 сохраняется во всех TIP, тогда как гистидин в положении LC P в петле C сохраняется только в некоторых типах TIP, включая изоформы TIP2, и, по-видимому, был заменен фенилаланином у общего предка TIP1 и TIP3 (Рис. 3D) [5]. Фенилаланин в положении LC P в петле C также способен стерически направлять аргинин в положении HE P в спирали E в сторону поры, но обеспечивает более гидрофобную среду на фильтре селективности.Стоит отметить, что подобно TIP3, AQP8 млекопитающих [9,10] также содержат гистидин в положении h3 P спирали 2, не имеют консервативного гистидина в петле C и могут быть выровнены с фенилаланином в положении LC P . в петле C (Рис. 3D). Таким образом, гистидин в положении h3 P в спирали 2 и ароматический остаток в положении LC P в петле C, по-видимому, являются общей чертой среди проницаемых для аммиака AQP как у растений, так и у животных. Это предполагает, что производное фенилаланина в LC P в петле C некоторых растительных TIP, которое поддерживает проницаемость для аммиака без способности образовывать водородные связи с субстратом, отражает адаптацию к другой среде, например.g. относительно pH или альтернативно измененных требований к скорости проникновения и селективности.
Рис. 3. Диаметр пор и фильтр с расширенной селективностью.
(A) Индивидуальные профили At TIP2; 1 (зеленый), проницаемый для глицерина Ec GlpF (синий), специфичный для воды So PIP2; 1 (закрытая форма; фиолетовый) и Hs AQP4 (оранжевый), а также средний диаметр пяти других структур AQP, характерных для открытой воды (пунктирная линия). Идентификаторы банка данных белков приведены в таблице S1.Область NPA и фильтр селективности (SF) обозначены затенением. В отличие от ранее описанных структур AQP, где область SF составляет наиболее узкую часть канала, диаметр пор At TIP2; 1 более однороден по всему каналу. (B) Графическое изображение сбоку At TIP2; 1 пора совмещена с (A). Фильтр селективности выделен стержневым изображением остатков в позициях h3 P , HE P и LC P (слева направо).Неотображаемые остатки в позициях H5 P и LE P расположены перед визуальной плоскостью. Крупным планом показана электронная плотность при 4σ. Высокое разрешение структуры позволяет точно определять атомы азота в имидазольных кольцах гистидинов. Nε LC P -His 131 образует водородную связь (желтая пунктирная линия) с молекулой воды (Wat2) в поре. (C) Вакуолярный (вид сверху At TIP2; 1) и соответствующий внеклеточный вид ( So, PIP2; 1 и Ec GlpF) аминокислотных остатков в пяти положениях (h3 P , LC P , H5 P , LE P и HE P ), содержащий фильтр расширенной селективности поры. At TIP2; 1 (зеленый) сравнивается с водоотталкивающим So PIP2; 1 (фиолетовый) и проницаемым для глицерина Ec GlpF (синий). В At TIP2; 1 гистидины на h3 P и LC P стабилизируют аргинин (Arg 200) на HE P в новой ориентации, которая явно отличается от его расположения в структурах водоспецифичных и глицерин-проницаемые AQP. Пространственная ориентация карбонилов основной цепи в позиции LE P аналогична в At TIP2; 1 и Ec GlpF, тогда как она отклоняется в специфичном для воды So PIP2; 1.Ile 185 при H5 P из At TIP2; 1 приводит к более широкой области SF по сравнению с водоспецифичными AQP, которые имеют гистидин в этом положении. (D) Сохранение остатков в фильтре с расширенной селективностью, показанном на (C). Позиция LC P , которая расширяет фильтр селективности, обведена красным. Растительные TIP и AQP8 млекопитающих сходны и заметно отличаются от водоспецифичных AQP у животных и растений (PIP, внутренние белки плазматической мембраны), а также от глицеринового канала GlpF.Паттерны консервации предполагают аналогичную ориентацию консервативного аргинина в положении HE P фильтра селективности всех TIP и AQP8, и, кроме того, отдельные подгруппы TIP и водоспецифичных AQP могли развить специализированные профили субстратов (подробности в таблице S2) . Звездочка обозначает идентичность TIP2, а цвета выделяют фильтры селективности, показанные на (C).
https://doi.org/10.1371/journal.pbio.1002411.g003
Общая важность петли C в AQP
Измерения абсолютной водопроницаемости [23] и относительной проницаемости для других субстратов [24] выявляют большие различия среди специфичных для воды AQP.Например, AQP4 млекопитающих имеет в 4 раза более высокую проницаемость для воды в одном канале по сравнению с AQP1, хотя они имеют одинаковые или похожие остатки в четырех канонических положениях фильтра селективности. Наша структура привела нас к повторному исследованию аминокислотного остатка в положении LE P в петле E, который вносит свой карбонил в область селективности. Сравнение At TIP2; 1 с другими структурами AQP идентифицирует две пространственные группы (I и II) карбонилов из остатков в позиции LE P в петле E, как показано в вспомогательной информации (S1 Fig; вид сверху на Fig 3C) . At TIP2; 1 группируется вместе с акваглицеропоринами и водопроницаемым человеческим AQP4 (группа I), тогда как большинство водоспецифичных AQP составляют группу II из-за аспарагина в положении LC P в петле C (рис. 3D). , который может образовывать водородную связь с карбонилом основной цепи аминокислотного остатка в положении LE P . Это специфическое для группы II взаимодействие направляет карбонил LE P к центру поры и квазипараллельно мембране. В этой конформации пептидные связи этого и двух предшествующих остатков искажены.Напротив, AQP, лишенные аспарагина в положении LC P , помещают карбонил основной цепи аминокислотного остатка в положение LE P (Gly 194 в At TIP2; 1) — и предшествующие остатки петли E — в более расслабленная конформация, напоминающая конформацию соответствующего карбонила (Gly 80) в связанной с квазисимметрией петле B (Рис. 1A). Вариация карбонилов аминокислотных остатков в положении LE P пространственно мала и, следовательно, мало влияет на диаметр пор как таковая, но существенно влияет на водородные связи с субстратами.Таким образом, идентичность аминокислотного остатка в положении LC P в петле C, по-видимому, имеет отношение к субстратной специфичности не только для проницаемых для аммиака AQP, но также и для водоспецифичных изоформ.
Специфичность аммиака
Чтобы исследовать вклад аминокислотных остатков в фильтре с расширенной селективностью на субстратную специфичность, мы проанализировали проницаемость водоспецифичных AQP1 человека ( Hs, AQP1) и At TIP2; 1 с использованием анализов in vivo и in vitro. .Оба этих канала содержат консервативный аргинин в позиции HE P фильтра селективности, но, как установлено нашей структурой, пространственное расположение его боковой цепи относительно поры отличается. Ожидается, что замена всех четырех отклоняющихся остатков фильтра с расширенной селективностью в четырехкратном мутанте At TIP2; 1 на соответствующие остатки Hs AQP1 отменила комплементацию в тесте на рост дрожжей, исследующем проницаемость для аммиака (рис. 4). Одноточечные мутации в каждом из четырех положений указывают, что все индивидуальные замены, кроме замены гистидина на фенилаланин в h3 P , совместимы с проницаемостью для аммиака в At TIP2; 1.Несовместимость фенилаланина может быть объяснена его разной электростатикой и немного большим размером, что противоречило бы ориентации аргинина в положении HE P в фильтре селективности At TIP2; 1. Пространственная ориентация аргинина в позиции HE P в At TIP2; 1 ограничена петлей C и гистидином в позиции LC P , следовательно, введенный фенилаланин в h3 P , вероятно, займет альтернативное положение. где он закрывает поры.Совместимость трех других одиночных мутаций на первый взгляд может быть объяснена их полярной природой, позволяющей образовывать водородные связи с аммиаком. Однако, как упоминалось выше, в положении LE P водородная связь с субстратом обеспечивается карбонилом основной цепи, а не боковой цепью. Интересно, что двойная мутация в спирали 5 (положение H5 P ) и петле E (положение LE P ) фильтра селективности не смогла продемонстрировать проницаемость для аммиака в анализе роста.Это может указывать на то, что небольшой и гибкий остаток в положении LE P из At TIP2; 1 необходим, чтобы позволить его карбонилу взаимодействовать с субстратом в присутствии гистидина в положении H5 P .
Рис. 4. Комплементация роста штамма дрожжей с дефектом поглощения аммония мутантами At TIP2; 1.
Штамм дрожжей 31019b ( Δmep1–3 ) трансформировали пустым вектором pYeDP60u или несущей pYeDP60u кДНК, кодирующей положительные контроли Hs AQP8 или Hs AQP1, или At TIP2; 1 или его мутанты .Пять аминокислотных остатков фильтра расширенной селективности в каждой конструкции обозначены однобуквенным кодом слева в порядке h3 P , LC P , H5 P , LE P и HE P . , показывая замены жирным шрифтом. Дополнение и отсутствие дополнения обозначаются знаком + и — соответственно. Трансформанты помещали при OD 600 , равном 1 (правый столбец) и 0,01 (левый столбец), на чашки, содержащие 0,2% пролина или указанные концентрации аммония в качестве единственного источника азота, и рост регистрировали через 13 дней при 28 ° C.Каждая панель, показывающая рост при определенной концентрации, состоит из отдельных изображений каждого пятна, взятых из различных условий роста. Все отдельные изображения обрабатывались одинаково.
https://doi.org/10.1371/journal.pbio.1002411.g004
Идентификация детерминант субстратной специфичности на основе функциональных нокаут-мутантов осложняется возможными тривиальными объяснениями потери функции, такими как неправильная укладка белка или отказ достичь плазматической мембраны.Следовательно, вместо того, чтобы просто пытаться искоренить аммиачную специфичность At TIP2; 1 с помощью мутаций, мы решили сосредоточиться на мутантах с повышением функции специфичного для воды Hs AQP1 в попытке имитировать аммиак и воду. проницаемость При TIP2; 1. Следовательно, четыре отклоняющихся остатка в фильтре расширенной селективности Hs AQP1 были мутированы ступенчатым образом, чтобы проверить, не гистидин ли на LC P , что может заставить аргинин на LE P Hs AQP1 в В TIP2; 1-подобном положении было достаточно для достижения подходящей селективности к субстрату, или если потребовались дополнительные замены.Неожиданно только четырехкратный мутант Hs AQP1 (h3 P -F56H, LC P -N127H, H5 P -h280I, LE P -C189G) показал значительный рост по сравнению с контролем с пустым вектором в тест комплементации дрожжей на проницаемость для аммиака (рис. 5). Были проведены эксперименты с остановленным потоком для количественного определения показателей проницаемости для аммиака и воды для мутантов Hs, AQP1 и контролей. Для сравнения относительной специфичности независимо от различий в уровнях экспрессии правильно свернутого белка в плазматической мембране дрожжей были рассчитаны отношения этих скоростей (таблица 2).Хотя эти две скорости представляют собой скорости защелачивания и набухания в двух разных произвольных единицах, их отношения предлагают информативную меру относительной специфичности при сравнении мутированных белков и белков дикого типа. В то время как Hs AQP1 дикого типа проводит только воду, At TIP2; 1 показал значительную скорость проникновения аммиака, соответствующую примерно 3% скорости проникновения воды в этом штамме. Интересно, что такое же соотношение было получено только для четверного мутанта Hs AQP1, показывая, что этих четырех замен достаточно для воспроизведения At TIP2; 1-подобной специфичности в Hs AQP1.Две другие мутантные формы Hs AQP1, а именно одиночный мутант H5 P -h280I и тройной мутант (h3 P -F56H, LC P -N127H, H5 P -h280I), показали более высокую специфичность для аммиака, чем At TIP2; 1 и аналогичные абсолютные уровни аммиака, как у четверного мутанта, но неожиданно не смогли дополнить штамм с делецией транспорта аммиака в анализе роста. Недостаточная водопроницаемость этих мутантов может объяснить эти наблюдения, подразумевая, что двойная проницаемость может быть необходима для эффективного поглощения аммиака in vivo.Нарушение водопроницаемости, вероятно, является результатом более высокой гидрофобности изолейцина, замещающего гистидин в положении H5 P из Hs AQP1. По-видимому, водопроницаемость у квадрупольного мутанта восстанавливается мутацией LE P -C189G. Это согласуется с сохранением небольшого аминокислотного остатка (аланина или глицина) на уровне LE P TIP. Небольшой остаток может позволить карбонильному кислороду в LE P — не связанному водородом с аминокислотой в положении LC P — занять расслабленное положение и более эффективно взаимодействовать с водой в фильтре селективности.В отличие от более ранних мутационных исследований [4], наше новое понимание структуры позволило нам рационально спроектировать и имплантировать TIP2-подобный профиль субстрата в водоспецифичный AQP.
Рис. 5. Комплементация роста штамма дрожжей с дефектом поглощения аммония мутантами Hs AQP1.
Штамм дрожжей 31019b ( Δmep1–3 ) трансформировали пустым вектором pYeDP60u или pYeDP60u, несущим кДНК, кодирующую положительные контроли Hs AQP8 или At TIP2; 1, или Hs AQP1 или его мутанты.Пять аминокислотных остатков фильтра расширенной селективности в каждой конструкции обозначены однобуквенным кодом слева в порядке h3 P , LC P , H5 P , LE P и HE P . , показывая замены жирным шрифтом. Дополнение и отсутствие дополнения обозначаются знаком + и — соответственно. Трансформанты помещали при OD 600 , равном 1 (правый столбец) и 0,0001 (левый столбец), на чашки, содержащие 0,2% пролина или указанные концентрации аммония в качестве единственного источника азота, и рост регистрировали через 13 дней при 28 ° C.Каждая панель, показывающая рост при определенной концентрации, состоит из отдельных изображений каждого пятна, взятых из различных условий роста. Все отдельные изображения обрабатывались одинаково.
https://doi.org/10.1371/journal.pbio.1002411.g005
Хотя структура с высоким разрешением At TIP2; 1 позволила нам различать атомы азота и углерода в боковых цепях гистидинов (рис. 3B), было бы невозможно отличить азот аммиака от кислорода воды в порах At TIP2; 1 из-за их одинаковой электронной плотности и ожидаемого низкого содержания аммиака.Чтобы получить более подробное представление о специфичности субстрата в At TIP2; 1, мы поэтому использовали моделирование MD. Водопроницаемость наблюдалась с высокой частотой ( p f ± SD), соответствующей приблизительно 25 ± 4 × 10 −14 см 3 с −1 (S2 рис.), Что примерно в четыре раза выше по оценке AQP1 человека. Высокая проницаемость для воды в At TIP2; 1 соответствует его низкой свободной энергии для воды (S3, рис.). Примечательно, что события спонтанного проникновения аммиака наблюдались в несмещенном моделировании длительностью 400 нс (S1 Movie) и подтверждались моделированием зонтичного отбора проб, что давало барьер свободной энергии приблизительно 15 кДж / моль (рис. 6A) в соответствии с высокой проницаемостью для аммиака.Дальнейший анализ показывает, что эффекты десольватации компенсируются несколькими остатками водородных связей на фильтре селективности (рис. 6A – 6C), что существенно снижает энергетический барьер в этой области, где он достигает пика для специфичного для воды Hs AQP1 [25]. В отличие от простой модельной мембраны (S3 Рис.), Тонопласт содержит стерины [26], которые увеличивают непроницаемость для полярных молекул. Таким образом, проницаемость для аммиака At TIP2; 1 сравнивается с холестеринсодержащей модельной мембраной с барьером свободной энергии для аммиака 20 кДж / моль (рис. 6A).Из-за этих различий в энергетических барьерах проницаемость At TIP2; 1 на порядок выше.
Рис. 6. МД моделирование на TIP2; 1.
(A) Профили средней потенциальной силы (PMF) для аммиака через At TIP2; 1 (красный) и через модельную мембрану, содержащую 20% холестерина (зеленый). В нижней части панели показано количество водородных связей между аммиаком и At TIP2; 1 как функция положения вдоль оси поры.Взаимодействия с остатками в фильтре расширенной селективности, изображенном на (C), имеют цветовую кодировку для определения их вклада (h3 P -His 63 (синий), LC P -His 131 (красный), LE P -Gly 194 (зеленый) и HE P -Arg 200 (коричневый)) и демонстрируют водородную связь с каждым из четырех полярных остатков фильтра расширенной селективности. (B) Снимки проникновения аммиака. Поперечное сечение На TIP2; 1 показано серой поверхностью и зеленым рисунком магистрали.Боковые цепи выбранных аминокислотных остатков в фильтре селективности отображаются в виде полосок и имеют цветовую маркировку, как на (C). (C) Крупный план молекулы аммиака в центре, образующей водородные связи с четырьмя остатками (h3 P -His 63, LC P -His 131, LE P -Gly 194 и HE P -Arg 200) фильтра селективности. Водородные связи обозначены оранжевыми штрихами, а расстояния указаны в Å. Иль 185 в позиции H5 P фильтра селективности, расположенного перед визуальной плоскостью, не показан.Базовые данные панели A можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.g006
Накопление аммония на поверхности
Спорный вопрос о том, проникают ли аквааммониапорины ионами аммония или нет [27]. Это имеет физиологическое значение, поскольку необходимо эффективное исключение ионов аммония для захвата кислоты в вакуоли. Моделирование методом МД, содержащего ионы аммония, не показало явлений спонтанного проникновения, как и ожидалось, из-за эффектов электростатического отталкивания и десольватации в поре.Это напоминает переносчик аммиака AmtB, который, как обычно считается, имеет сходную аммиачную / аммиачную селективность, но где проникновение аммиака было предложено стимулировать за счет рекрутирования аммония в нецитозольный вестибюль [28]. Поэтому мы исследовали, накапливаются ли ионы аммония на вакуолярной поверхности At TIP2; 1. Сравнение электростатики показывает, что вакуолярная поверхность At TIP2; 1 явно более отрицательна, чем соответствующая поверхность другого растения AQP, внеклеточная поверхность плазматической мембраны, расположенная специфично для воды So PIP2; 1, которую мы установили. структура на 2.Разрешение 1 Å [14] (S4 рис.). Отрицательная вакуолярная поверхность At TIP2; 1 преобладает на открытых кислотных остатках (Asp 48, Asp 52, Asp 210). Действительно, наши модели МД показывают локальное обогащение ионами аммония этими кислотными остатками (рис. 7А). Хотя точные положения кислотных остатков различаются, отрицательная вакуолярная поверхность представляет собой консервативный признак среди TIP, что подразумевает общность этого открытия.
Рис. 7. Накопление аммония и возможный путь протонов.
(A) МД моделирования, показывающие накопление аммония (синяя сетка) на остатках аспартата (желтые палочки) на вакуолярной (вверху) и цитозольной (внизу) стороне At TIP2; 1.Плотность воды (фиолетовая сетка) очерчивает вертикальную основную пору мономера и подтверждает наличие заполненной водой боковой поры под петлей C. Остатки фильтра с расширенной селективностью изображены в виде палочек (h3 P -His 63 (синий), LC P -His 131 (красный), LE P -Gly 194 (зеленый) и HE P -Arg 200 (коричневый)). (B) и (C) МД-моделирование, демонстрирующее гибкость His 131 в положении LC P , являющегося нейтральным (B) и положительно заряженным (C). Цветовой код как на (A).(D) Поверхностное представление кристаллической структуры, изображающей заполненную водой боковую пору под петлей C. Водородные связи воды 10 (Wat10), а также между Arg 200 в позиции HE P в спирали E и His 63 в позиции h3 P в спирали 2 обозначены оранжевыми пунктирными линиями. (E) Предварительная рабочая модель аммиакопроницаемого At TIP2; 1. Аммоний может способствовать проникновению аммиака, накапливая его на поверхности вакуолярного белка и, возможно, перемещая его протоны обратно в кислую вакуоль с помощью His 131 (красный) в положении LC P в петле C через заполненную водой боковую пору.
https://doi.org/10.1371/journal.pbio.1002411.g007
Возможная функция боковой поры
Учитывая низкий pH в некоторых вакуолях и накопление аммония на вакуолярной поверхности At TIP2; 1, эффективность проницаемости явно повысится, если аммоний будет способствовать канализации аммиака. Как же тогда депротонируется аммоний? Дистальное положение второй вакуолярной петли (петли C) относительно Arg 200 в позиции HE P в спирали E намекает на объяснение.Фактически, моделирование структуры и МД сходятся в том, что петля C оставляет достаточно места для непрерывной боковой поры, идущей от селективного фильтра до вакуолярной поверхности (рис. 7A – 7D). Во всех ранее описанных структурах AQP HE P -аргинин непосредственно связан водородными связями с кислородом карбонила основной цепи остатка, соответствующего Pro 129 петли C. В At TIP2; 1 этот контакт вместо этого опосредуется через воду. молекула (Wat 10; рис. 7D), занимающая такое же положение, как аргинин-связывающий карбонильный кислород в других структурах AQP.Интересно, что пептидная связь, предшествующая TIP2-специфическому гистидину (His 131) в положении LC P в петле C, сохраняет необычно большой двугранный угол (19 °) [29], и это искривление будет еще больше при более глубоком положении петля C. Чтобы выяснить, может ли His 131 в положении LC P и боковая пора играть роль в облегчении депротонирования аммония, мы провели дальнейшее моделирование с помощью МД. Депротонирование аммония через LC P -His 131 через боковую пору, скорее всего, требует позиционного смещения этого остатка от аммиака к молекуле воды в боковой поре (Wat 11), чтобы достичь расстояния водородной связи.Моделирование показывает, что угол боковой цепи His 131 (chi 1) остается таким же, как и в кристаллической структуре, когда нейтрален (Рис. 7B и S5 Рис.), Тогда как в протонированном, т.е. положительно заряженном состоянии, альтернативная ориентация к Wat 11 действительно наблюдается (рис. 7C, рис. S5 и рис. S6). Кроме того, поскольку моделирование подтверждают, что боковая пора постоянно сольватируется от His 131 до выхода из вакуоля, она предлагает протонный провод для возврата протонов в вакуолярную среду, поскольку аммоний переносится в пору в виде аммиака.Эти результаты заставляют нас размышлять о возможном TIP2-специфическом механизме (рис. 7E), где гистидин (His 131) в положении LC P в петле C перемещает протоны от основной поры к поверхности вакуоля через боковую пору, используя Grotthuss. механизм, предположительно увеличивающий скорость проникновения аммиака из вакуоли в условиях неравновесного потока.
Обсуждение
Атомная структура проницаемой для воды и аммиака At TIP2; 1 позволяет по-новому взглянуть на селективность субстрата AQP.В структуре обнаружен фильтр с расширенной селективностью, включающий пятый аминокислотный остаток в положении LC P в петле C, который также может играть роль в определении профилей субстратов для всего суперсемейства AQP. Важность расширенного фильтра селективности продемонстрирована мутационными исследованиями in vivo и in vitro, показавшими усиление функции At TIP2; 1, селективность субстрата в водоспецифическом AQP1 человека. Моделирование методом МД поддерживает аммиачную проводимость и отсутствие аммиачной проницаемости.Как и ожидалось из структуры, аммиак взаимодействует с LC P -His 131 и ведет себя подобно воде в порах AQP [18], переориентируясь в области NPA на N-концах спирали B и спирали E из-за их макроэлементов. диполи (фильм S1). На основе структурного анализа и моделирования мы описываем селективный фильтр, который обладает высокой проницаемостью для аммиака благодаря своей ширине и множеству потенциальных полярных контактов с субстратом, и размышляем о механизме, в котором проницаемость аммиака может быть дополнительно увеличена за счет накопления аммония в вакуолярном белке. поверхность, депротонирование через TIP2-специфичный LC P -His 131 и перенос протона через ранее не идентифицированную заполненную водой боковую пору.Следует подчеркнуть, что моделирование имеет лишь ограниченную поддержку этого предположения, и без подтверждающих структур трудно специфически воздействовать на боковую пору с помощью мутаций или предсказать, является ли это консервативной особенностью других TIPs и AQP8s. Однако мы считаем наиболее вероятным, что консервативный аргинин в положении HE P в спирали E других TIP и AQP8 принимает ту же конформацию, как показано здесь для At TIP2; 1, из-за ароматических остатков в положении LC P в петле C и остатки водородных связей в позиции h3 P в спирали 2.Паттерны сохранения в фильтре селективности AQP8 и отдельных подгруппах TIP указывают на то, что среди аквааммониапоринов возникла функциональная дифференциация. TIP2 и TIP4 высших растений сходны с TIP6, обнаруженными у примитивных растений, таких как мхи, и, следовательно, вероятно, представляют оригинальные функции и механистические особенности TIP. Напротив, TIP1 и TIP3, которые появляются с появлением семенных растений, а также AQP8 у животных, лишены гистидина в положении LC P , который, как предлагается здесь, усиливает депротонирование аммония.Такие вариации среди аквааммониапоринов могут быть связаны со свойствами, зависящими от pH, которые, однако, еще предстоит изучить. В этом контексте следует упомянуть, что как AQP8, так и мутант AtTIP2; 1, лишенный гистидина в положении LC P , дополняли проницаемость аммиака в анализе роста одинаково хорошо или лучше, чем AtTIP2; 1 дикого типа, демонстрируя, что гистидин на это положение не является существенным для эффективного поглощения аммиака в этих условиях. Структура At TIP2; 1 будет способствовать моделированию других AQP, включая человеческий AQP8, и, следовательно, может также помочь выяснить молекулярные основы проникновения аммиака у человека.
Из наших результатов ясно, что At TIP2; 1 может увеличивать проницаемость мембран для аммиака, но условия, связывающие фенотип, связанный с аммиаком, с TIPs до сих пор не описаны у растений [30]. Растения выделяют значительное количество аммиака своими листьями, а аммиак, образующийся при фотодыхании, еще больше усугубляет потери, подразумевая ограниченную способность ферментов реассимиляции аммиака [31]. Мы ожидаем, что высокая проницаемость тонопласта для аммиака и быстрое улавливание кислоты аммонием в вакуоли особенно важны в переходные периоды фотодыхания, когда он противодействует высоким уровням аммиака в цитозоле и, таким образом, снижает потери через плазматическую мембрану, обеспечивая время реассимиляционных путей. для включения большего количества образующегося аммиака.Следовательно, мы предполагаем, что экспрессия проницаемых для аммиака мутантных изоформ AQP в плазматической мембране, таких как мутанты PIP2, имеющие TIP2-подобный фильтр расширенной селективности, в сочетании с регуляцией экспрессии TIP может использоваться для изменения относительной проницаемости для аммиака плазматической мембраны. и тонопласт для изучения влияния на выброс аммиака в этих условиях. Контроль выбросов аммиака путем регулирования проницаемости для аммиака в мембранах потенциально может открыть новый способ повышения эффективности использования азота на заводах.
Материалы и методы
Для получения дополнительной информации см. Текст вспомогательной информации S1.
At TIP2; 1 с N-концевой дека-His-меткой был экспрессирован в Pichia pastoris и очищен, как описано ранее [32]. Вкратце, мембраны промывали мочевиной и солюбилизировали 10% н-октил-β-D-глюкозидом (OG). Белок очищали аффинной хроматографией на никеле с использованием промывки имидазолом 100 мМ с последующей эксклюзионной хроматографией с использованием колонки S200.Функциональность была подтверждена анализом протеолипосом с остановленным потоком.
Кристаллизацию методом диффузии пара в виде висячей капли проводили при комнатной температуре с использованием резервуарного раствора, состоящего из 50 мМ магния / ацетата натрия, pH 5,0 и 28% (об. / Об.) ПЭГ 400, и кристаллы охлаждали мгновенно в жидком азоте. Данные были собраны при длине волны 1 Å на канале луча X06SA (PXI) в швейцарском источнике света, Виллиген, Швейцария. Структура была решена путем молекулярного замещения, и модель построена вручную.При рафинировании исключено 3% отражений, включая двойные пары, и в результате фракция двойников составила 40,7%, достигнув значений R рабочий и R свободный — 10,2% и 11,2%, соответственно. Выбросы Рамачандрана и остатки в неблагоприятных регионах были проверены вручную.
Исследования мутантов At TIP2; 1 и Hs AQP1 были выполнены с использованием протопластов и интактных клеток из Saccharomyces cerevisiae , как описано ранее [33].
Моделирование проводилось с помощью GROMACS 4.5 [34] с использованием силового поля CHARMM36 [35]. Для изучения свойств At TIP2; 1 белок был встроен в бислой 1-пальмитоил-2-олеоилфосфатидилхолина (POPC). Было проведено три несмещенных 500 нс моделирования для изучения равновесного поведения At TIP2; 1 в присутствии воды, аммиака или ионов аммония. Зонтичный отбор проб был использован для расчета PMF для проникновения воды и аммиака [36,37].
Дополнительная информация
S1 Рис.Селективность фильтрует карбонилы в петле E в двух различных пространственных группах.
(A) HE P -аргинин (R200) из At TIP2; 1 показан для ориентации. Карбонилы на LE P водоспецифичных AQP образуют группу II (фиолетовая заливка), и большинство из них находятся в пределах расстояния водородных связей с двумя молекулами воды в своих структурах, как показано So PIP2; 1 (PDB ID 1Z98; Виолетта). Карбонилы каналов, не относящихся к воде, собираются в другом месте (группа I; зеленая заливка).Среди них At TIP2; 1 (зеленый), облегчение транспорта глицерина и неохарактеризованные белки ( Af AqpM, Pf AQP, Ec GlpF, Mm AqpM), но специфичные для воды Hs AQP4 также принадлежит к этой группе. Как и все другие члены этой группы, в Hs AQP4 отсутствует LC P -спарагин (N153 в So PIP2; 1, рис. 3D), который сохраняется среди других водоспецифичных белков (синий цвет, только аспарагины). показаны остатки).Каждый карбонил в группе II может образовывать водородную связь с карбоксамидом этого аспарагина, если карбоксамид ориентирован правильно. Определенная гибкость предполагает особый случай Hs AQP0, где доступны различные структуры (показаны 1YMG и 2B6O), а карбонил виден в обеих ориентациях. Помимо глицериновых фасилитаторов, кажется, что в группе I требуются небольшие остатки, такие как глицин и аланин, в LE P (рис. 3D), тогда как в группе II могут быть размещены несколько более крупные остатки, такие как цистеин или треонин.В LE P показана только магистраль. (B) Крупный план At TIP2; 1 (зеленый) и So PIP2; 1 (фиолетовый), показывая водородную связь карбонилов на LE P и воду, взаимодействующую с LC P -His 131. Боковая цепь LE P -Thr 219 не показан. Основная пора At TIP2; 1 проанализирована HOLE [38].
https://doi.org/10.1371/journal.pbio.1002411.s002
(TIF)
S2 Рис. Значения осмотической проницаемости (
p f ), рассчитанные на основе моделирования методом МД.p f значения были рассчитаны отдельно для каждого мономера в семи временных окнах по 50 нс. Вклад отдельных мономеров в значения тетрамера p f обозначен разными цветами, а средние значения на мономер и стандартное отклонение в каждом временном окне обозначены черной линией и полосами ошибок. Базовые данные можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.s003
(TIF)
S3 Фиг.PMF для воды через
At TIP2; 1 канал рассчитан по траектории равновесия (черный).Планки погрешностей представляют собой стандартное отклонение PMF по четырем мономерам белка. Профиль PMF для аммиака через модельную мембрану без холестерина показан синим цветом. Базовые данные можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.s004
(TIF)
S4 Рис. Соответствующие вакуумные электростатические карты двух заводских AQP.
Нецитозольная поверхность тетрамера So PIP2; 1 (слева, обращена к апопласту) и At TIP2; 1 (справа, обращена внутрь вакуоли). Положительные и отрицательные электростатические потенциалы, рассчитанные PyMol [39], отмечены градиентами синего и красного цвета соответственно.
https://doi.org/10.1371/journal.pbio.1002411.s005
(TIF)
S5 Рис. Диэдральные популяции LC
P -His 131 в трех различных протонированных состояниях.Углы Chi1 в МД-моделировании с дважды протонированным (положительно заряженным; синий), протонированным Nδ (нейтральный; желтый) и протонированным Nε (нейтральный; красный) His 131.Базовые данные можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.s006
(TIF)
S6 Рис. Двугранный угол хи1 остатка LC
P -His 131 в моделировании дважды протонированного His 131, обобщенный на S5 Рис.Данные показаны для последних ~ 350 нс траектории 500 нс после первого наблюдаемого перехода . Остаток His 131 спонтанно обменивается между своими возможными конфигурациями во всех четырех мономерах белка.Базовые данные можно найти в S1 Data.
https://doi.org/10.1371/journal.pbio.1002411.s007
(TIF)
S1 Фильм. МД моделирование демонстрирует спонтанное проникновение аммиака.
На TIP2; 1 мономер отображается на виде сбоку с LC P -His 131 фильтра селективности, а также Asn 83 и Asn 197 в области NPA, показанной в виде палочек. Молекула аммиака (сферическое представление) входит в основную пору с цитозольной стороны белка.Во время проникновения через поры аммиак переориентируется так, что его пара свободных электронов указывает на аспарагины в центре белка. В ходе видео, которое соответствует 2,94 нс, можно наблюдать, как имидазольная группа LC P -His 131 поворачивается на 180 ° и обратно.
https://doi.org/10.1371/journal.pbio.1002411.s008
(MP4)
Благодарности
Мы благодарим Адин Карлссон за техническую помощь и установку кристаллизации белка в лаборатории Max IV за первоначальную помощь.Мы благодарны за помощь в проверке кристаллов в Maxlab, Лунд, Швеция, в линиях луча 911-2 / 3 и в сборе данных в Swiss Light Source, Институте Пауля Шеррера, Виллиген, Швейцария, в линии луча X06SA.
Вклад авторов
Задумал и спроектировал эксперименты: AK PK UJ PG SSK BLdG GPB FC. Проведены эксперименты: АК ГПБ ССК. Проанализированы данные: АК ПГ UJ ПН ГПБ FC SSK BLdG. Написал статью: AK PG UJ PK PN GPB FC SSK BLdG. Составление рукописи: AK PG UJ.
Ссылки
- 1. Maurel C, Reizer J, Schroeder JI, Chrispeels MJ. Белок вакуолярной мембраны гамма-TIP создает специфичные для воды каналы в ооцитах Xenopus. Embo J 1993; 12: 2241–2247. pmid: 8508761
- 2. Ян Т.П., Моллер А.Л., Цойтен Т., Холм Л.М., Клаерке Д.А., Мохсин Б. и др. Гомологи аквапоринов у растений и млекопитающих переносят аммиак. Письма FEBS 2004 г .; 574: 31–36. pmid: 15358535
- 3. Лок Д., Людвиг Ю., Юань Л., фон Вирен Н.Внутренние белки тонопласта AtTIP2; 1 и AtTIP2; 3 способствуют транспорту Nh4 в вакуоль. Plant Physiol 2005; 137: 671–680. pmid: 15665250
- 4. Диновски М., Майер М., Моран О., Людвиг У. Молекулярные детерминанты проводимости аммиака и мочевины в гомологах аквапоринов растений. Письма FEBS 2008 г .; 582: 2458–2462. pmid: 18565332
- 5. Андерберг HI, Kjellbom P, Johanson U. Аннотация основных внутренних белков Selaginella moellendorffii и эволюция семейства белков у наземных растений.Границы растениеводства 2012; 3: 33. pmid: 22639644
- 6. Маэшима М. ТРАНСПОРТЕРЫ ТОНОПЛАСТ: организация и функции. Ежегодный обзор физиологии растений и молекулярной биологии растений 2001 г .; 52: 469–497. pmid: 11337406
- 7. Wudick MM, Luu DT, Maurel C. Взгляд внутрь: модели локализации и функции внутриклеточных аквапоринов растений. Новый фитолог 2009; 184: 289–302. pmid: 19674338
- 8. Coskun D, Britto DT, Li M, Becker A, Kronzucker HJ.Быстрый перенос аммиачного газа учитывает бесполезный трансмембранный цикл при токсичности Nh4 / Nh5 + в корнях растений. Физиология растений 2013; 163: 1859–1867. pmid: 24134887
- 9. Agemark M, Kowal J, Kukulski W, Norden K, Gustavsson N, Johanson U и др. Восстановление функции водных каналов и 2D-кристаллизация человеческого аквапорина 8. Biochimica et biophysica acta 2012; 1818: 839–850. pmid: 22192778
- 10. Сапаров С.М., Лю К., Агре П., Поль П. Быстрый и селективный транспорт аммиака аквапорином-8.Журнал биологической химии 2007; 282: 5296–5301. pmid: 17189259
- 11. Сория Л. Р., Маррон Дж., Каламита Дж., Маринелли Р. А.. Детоксикация аммиака посредством уреагенеза в гепатоцитах крысы включает митохондриальные каналы аквапорина-8. Гепатология 2013; 57: 2061–2071. pmid: 23299935
- 12. Fu D, Libson A, Miercke LJ, Weitzman C, Nollert P, Krucinski J, et al. Структура глицеринпроводящего канала и основы его селективности. Science 2000; 290: 481–486.pmid: 11039922
- 13. Суи Х, Хан Б.Г., Ли Дж.К., Валиан П., Яп Б.К. Структурные основы водного транспорта по водному каналу AQP1. Nature 2001; 414: 872–878. pmid: 11780053
- 14. Торнрот-Хорсфилд С., Ван И, Хедфальк К., Йохансон Ю., Карлссон М., Тайхоршид Э. и др. Структурный механизм аквапоринации растений. Природа 2006; 439: 688–694. pmid: 16340961
- 15. Horsefield R, Norden K, Fellert M, Backmark A, Tornroth-Horsefield S, Terwisscha van Scheltinga AC и др.Рентгеновская структура человеческого аквапорина с высоким разрешением 5. Труды Национальной академии наук Соединенных Штатов Америки, 2008 г .; 105: 13327–13332. pmid: 18768791
- 16. Косинска Эрикссон У., Фишер Г., Фриманн Р., Энкави Г., Тайхоршид Э., Нейтце Р. Разрешение Субангстрема Рентгеновская структура детализирует взаимодействия аквапорин-вода. Наука 2013; 340: 1346–1349. pmid: 23766328
- 17. Мурата К., Мицуока К., Хираи Т., Вальц Т., Агре П., Хейманн Дж. Б. и др. Структурные детерминанты проникновения воды через аквапорин-1.Nature 2000; 407: 599–605. pmid: 11034202
- 18. де Гроот Б.Л., Грубмюллер Х. Проникновение воды через биологические мембраны: механизм и динамика аквапорина-1 и GlpF. Science 2001; 294: 2353–2357. pmid: 11743202
- 19. Жу Ф.К., Тайхоршид Э., Шультен К. Модель коллективной диффузии для проникновения воды через микроскопические каналы. Письма с физическим обзором 2004 г .; 93: Artn 224501.
- 20. Wu B, Steinbronn C, Alsterfjord M, Zeuthen T., Beitz E.Согласованное действие двух катионных фильтров в водном канале аквапоринов. Журнал EMBO 2009; 28: 2188–2194. pmid: 19574955
- 21. Дэниелс М.Дж., Шомон Ф., Мирков Т.Е., Криспелс М.Дж. Характеристика нового аквапорина вакуолярной мембраны, чувствительного к ртути, в уникальном месте. Растительная клетка 1996; 8: 587–599. pmid: 8624437
- 22. Beitz E, Wu B, Holm LM, Schultz JE, Zeuthen T. Точечные мутации в области ароматических / аргининовых соединений в аквапорине 1 позволяют прохождение мочевины, глицерина, аммиака и протонов.Труды Национальной академии наук Соединенных Штатов Америки, 2006 г .; 103: 269–274. pmid: 16407156
- 23. Ян Б., Веркман А.С. Проницаемость аквапоринов 1–5 и MIP для воды и глицерина определяется количественно по экспрессии меченных эпитопом конструкций в ооцитах Xenopus. Журнал биологической химии 1997; 272: 16140–16146. pmid: 9195910
- 24. Гейер Р.Р., Муса-Азиз Р., Цинь X, Борон В.Ф. Относительная селективность аквапоринов млекопитающих по CO2 / Nh4 0–9.Американский журнал физиологии Клеточная физиология 2013; 304: C985–994. pmid: 23485707
- 25. Hub JS, de Groot BL. Механизм селективности по аквапоринам и акваглицеропоринам. Труды Национальной академии наук Соединенных Штатов Америки, 2008 г .; 105: 1198–1203. pmid: 18202181
- 26. Йошида С., Уэмура М. Липидный состав плазматических мембран и тонопластов, выделенных из этиолированных проростков бобов маш (Vigna radiata L.). Физиология растений 1986; 82: 807–812.pmid: 16665114
- 27. Литман Т., Согаард Р., Зойтен Т. Проницаемость аквапоринов млекопитающих для аммиака и мочевины. Справочник по экспериментальной фармакологии 2009: 327–358. pmid: 186
- 28. Акгун У., Хадеми С. Периплазматический вестибюль играет важную роль для рекрутирования растворенных веществ, селективности и стробирования в суперсемействе Rh / Amt / MEP. Труды Национальной академии наук Соединенных Штатов Америки, 2011 г .; 108: 3970–3975. pmid: 21368153
- 29.Беркхольц Д.С., Дриггер С.М., Шаповалов М.В., Данбрак Р.Л., Карплюс П.А. Непланарные пептидные связи в белках обычны и консервативны, но не смещены в сторону активных сайтов. Труды Национальной академии наук 2012; 109: 449–453.
- 30. Ли Г., Сантони В., Маурел С. Аквапорины растений: роль в физиологии растений. Biochimica et biophysica acta 2014; 1840: 1574–1582. pmid: 24246957
- 31. Кумагай Э., Араки Т., Хамаока Н., Уэно О. Эмиссия аммиака из листьев риса в связи с фотодыханием и генотипическими различиями в активности глутаминсинтетазы.Летопись ботаники 2011; 108: 1381–1386. pmid: 21937483
- 32. Карлссон М., Фотиадис Д., Шовалл С., Йоханссон И., Хедфальк К., Энгель А. и др. Восстановление функции водного канала сверхэкспрессированного и очищенного аквапорина из Pichia pastoris. Письма FEBS 2003 г .; 537: 68–72. pmid: 12606033
- 33. Бертл А., Калденхофф Р. Функция отдельной поры Nh4 в аквапорине TIP2; 2 из пшеницы. Письма FEBS 2007; 581: 5413–5417. pmid: 17967420
- 34. Пронк С., Палл С., Шульц Р., Ларссон П., Бьелкмар П., Апостолов Р. и др.GROMACS 4.5: высокопроизводительный и высокопараллельный набор инструментов молекулярного моделирования с открытым исходным кодом. Биоинформатика 2013; 29: 845–854. pmid: 23407358
- 35. Клауда Дж. Б., Венейбл Р. М., Фрейтес Дж. А., О’Коннор Дж. В., Тобиас Д. Д., Мондрагон-Рамирес С. и др. Обновление силового поля всеатомных добавок CHARMM для липидов: проверка шести типов липидов. Журнал физической химии B 2010; 114: 7830–7843.
- 36. Hub JS, de Groot BL, van der Spoel D. g_wham-A Реализация свободного взвешенного гистограммного анализа, включая оценки робастных ошибок и автокорреляции.Журнал химической теории и вычислений 2010; 6: 3713–3720.
- 37. Hub JS, Винклер Ф.К., Меррик М., Де Гроот Б.Л. Потенциалы средней силы и проницаемости для углекислого газа, аммиака и потока воды через канал резус-белка и липидные мембраны. Журнал Американского химического общества 2010; 132: 13251–13263. pmid: 20815391
- 38. Умная ОС, Гудфеллоу Дж. М., Уоллес Б. А.. Размеры пор грамицидина А. Биофизический журнал 1993; 65: 2455–2460.pmid: 7508762
- 39. Schrodinger, LLC, Система молекулярной графики PyMOL, версия 1.5.0.4 (2010).
Поведение при сжатии и электронные свойства аммиачного льда: исследование из первых принципов
Понимание сжимающего поведения аммиачного льда — непреходящая тема из-за его значительного значения для планетологии и происхождения жизни, а также ее применения в сельском хозяйстве и промышленности. В настоящее время наиболее стабильными кристаллическими структурами аммиачного льда при повышении давления являются P 2 1 3, P 2 1 2 1 2 1 , Pma 2, Pca 2 1 , P 2 1 / m и Pnma соответственно.Принимая во внимание эти шесть кристаллических структур, структурное и электронное поведение аммиачного льда под давлением было систематически исследовано с использованием расчетов по теории функционала плотности. Согласно нашим расчетам, переход из молекулярной фазы P 2 1 2 1 2 1 в ионную фазу Pma 2 можно отнести к связям между атомами H и атомами N. на соседних молекулах NH 3 .Анализ населенности Малликена и плотности состояний электронов предполагает уменьшение переноса заряда между атомами N и H и усиление связей с увеличением давления. Кроме того, при высоком давлении в молекулярных фазах аммиачного льда было обнаружено перекрытие зарядов между молекулами NH 3 , что также наблюдается между NH 2 — и NH 4 + группы в ионных фазах. С увеличением давления ширина запрещенной зоны аммиачного льда быстро увеличивается, а затем постепенно уменьшается, что является следствием тонкой конкуренции между сильной связью в состояниях H 1s и N 2p и перекрытием зарядов.Это моделирование помогает нам понять характеристики аммиачного льда под высоким давлением и дает ценную информацию об эволюции планет.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?Кристаллическая структура трихлорамминбис (трифенилфосфин) осмия (III), OsCl3 (Nh4) (P (C6H5) 3) 2 — Northwestern Scholars
Желто-оранжевый продукт, полученный реакцией оксотрихлорбис (трифенилфосфин) осмия (V) с На основе дифракционного исследования показано, что дигидрохлорид гидразина в кипящих с обратным холодильником растворах этанол-вода и перекристаллизованный из ацетонитрила представляет собой трихлорамминбис (трифенилфосфин) осмий (III), OsCl 3 (NH 3 ) (P (C 5) H 5 ) 3 ) 2 .Кристаллическая структура была определена из трехмерных рентгеновских данных, собранных счетными методами, и была уточнена с использованием методов наименьших квадратов до окончательного R-фактора на F, равного 3,2% для 1554 независимых отражений над фоном. Материал кристаллизуется в моноклинной пространственной группе C 2h 6 -I2 / a в ячейке с размерами a = 22,429 (8), b = 9,519 (3), c = 15,852 (5) Å и β = 102,80. (2) °. Плотность 1,69 г / см 3 , рассчитанная для четырех формульных единиц в ячейке, хорошо согласуется с наблюдаемой плотностью 1.68 ± 0,01 г / см 3 . Требуется, чтобы хорошо разделенные отдельные молекулы кристаллографически обладали симметрией C 2 . Для наложения симметрии C 2 необходимо, чтобы атомы водорода аммина были разупорядочены, и группа NH 3 , свободно вращающаяся вокруг связи Os-N, использовалась в качестве приближения к этому беспорядку. Конфигурация вокруг атома осмия является искаженной октаэдрической, причем атомы P переходят друг в друга, а атомы Cl переходят друг к другу в базисной плоскости, а третий атом Cl находится в одной вершине, а группа аммиака — в другой.Единственное большое отклонение от идеальной октаэдрической конфигурации — это движение цис-атомов Cl к N по направлению к атому азота. Расстояние Os-N составляет 2,136 (9) Å, а расстояние Os-P составляет 2,411 (2) Å. Расстояние Os-Cl cis до атома N существенно не отличается от расстояния Os-Cl транс до атома N, и среднее значение этих расстояний составляет 2,362 (1) Å. Геометрические детали этой молекулы сравниваются с предыдущими результатами по арил- и алкилиминокомплексам Re и обнаруживаются, что их можно объяснить с точки зрения внутримолекулярных несвязанных взаимодействий.
Влияние щелочной обработки или обработки жидким аммиаком на кристаллическую целлюлозу: изменения кристаллической структуры и влияние на ферментативную усвояемость | Биотехнология для биотоплива
Материалы
В данном исследовании обработка водным раствором NaOH и жидким аммиаком проводилась на четырех целлюлозах: Avicel PH-101 (Sigma-Aldrich, Сент-Луис, Миссури, каталожный номер 11365), α-целлюлозе ( Sigma-Aldrich, каталожный номер C8002), хлопковый линт (International Fiber Corporation, North Tonawanda, NY; каталожный номер.C10CL) и целлюлозу, экстрагированную из кукурузной соломы (полученной способом, описанным в разделе о получении целлюлозы из кукурузной соломы). Эти образцы целлюлозы были выбраны из-за их различных структурных свойств, таких как DP и CI. DP и CI целлюлоз, использованных в этом исследовании, приведены в таблице 5. Более низкий CI α-целлюлозы и целлюлозы из кукурузной соломы, по крайней мере, частично связан с более низким содержанием целлюлозы в этих образцах из-за их загрязнения ксиланом и лигнин (таблица 2).Жидкий аммиак был приобретен у General Air, Денвер, Колорадо. Аморфная целлюлоза, использованная в этой работе для измерения ХИ с использованием XRD, была приготовлена из измельченной фильтровальной бумаги Wiley (Whatman № 1) с использованием небольшой модификации процедуры, разработанной Шредером и сотрудниками [ 43], описанный в [44]. Вкратце, целлюлозу нагревали (125 ° C) с параформальдегидом в диметилсульфоксиде (ДМСО), так что гидроксильные группы в целлюлозе реагировали с формальдегидом и становились метилолированными, вызывая растворение целлюлозы в ДМСО.Метилольные группы удаляли и целлюлозу регенерировали путем медленного добавления раствора ДМСО к 0,2 М раствору метоксида натрия в метаноле и 2-пропаноле (1: 1 по объему). Аморфная целлюлоза выпала в осадок, и затем ее тщательно промыли сначала раствором алкоксида в метаноле, затем 0,1 М хлористым водородом, а затем деионизированной водой.
Получение целлюлозы из кукурузной соломы
Целлюлозу экстрагировали из кукурузной соломы, собранной в Кирни, штат Северная Каролина. Сырье было сделано из междоузлий кукурузной соломы, которые разрезали на куски длиной приблизительно 2 см, а затем разрезали пополам.Целлюлозу из кукурузной соломы получали путем предварительной обработки органозольв в условиях, аналогичных описанным ранее [45]. Междоузлия кукурузной соломы предварительно обрабатывали при 130 ° C в течение 56 минут, используя 0,57% по массе серной кислоты. Предварительная обработка привела к гидролизу большей части ксилана и солюбилизации большей части лигнина. Выход твердого вещества после предварительной обработки составил 53 мас.%. После предварительной обработки твердый остаток тщательно промывали водой и затем прессовали до содержания твердого вещества примерно 25%.
Дальнейшая делигнификация была достигнута обработкой твердого остатка кислым хлоритом в соответствии с методом Saarnio et al. . [46]. Хлорит натрия (0,67 г на грамм биомассы) смешивали с предварительно обработанной биомассой в большом пластиковом пакете с застежкой-молнией при концентрации воды 10%. После тщательного смачивания биомассы добавляли уксусную кислоту в концентрации 1 мл ледяной уксусной кислоты на грамм биомассы. Мешок, содержащий отбеливающую смесь, герметично закрывали и помещали в водяную баню с температурой 60 ° C на 2 часа при регулярном перемешивании.После образования газообразного диоксида хлора его периодически выпускали из мешка.
После делигнификации кислого хлорита смесь фильтровали на воронке Бюхнера и промывали деионизированной водой до удаления всех следов отбеливающей смеси. Воду отжимали из осадка на фильтре до содержания твердого вещества примерно 25%.
Обработка жидким аммиаком
Был использован традиционный метод получения целлюлозы III из целлюлозы I, основанный на методах, описанных Barry et al. .[21] и Исогай и др. . [47]. Примерно от 3 до 5 г целлюлозы (сухой эквивалентный вес в печи) помещали в реакционный сосуд из нержавеющей стали (модель 4714, Parr Instrument Co., Молин, Иллинойс). Реакционный сосуд закрывали, взвешивали и затем охлаждали на бане сухой лед / ацетон (-75 ° C) для облегчения переноса жидкого аммиака в реактор при атмосферном давлении. Безводный жидкий аммиак медленно добавляли в реакционный сосуд в соотношении 2 г к 3 г на грамм целлюлозы, используя передающую трубку из нержавеющей стали из цилиндра с жидким аммиаком, снабженного эдукторной трубкой.После добавления аммиака сосуд немедленно взвешивали и затем охлаждали на бане сухой лед / ацетон в течение 15 минут. Для обработки при -33 ° C сосуд открывали после 90 мин обработки при -75 ° C и позволяли вентилироваться в вытяжном шкафу в течение ночи, пока весь аммиак не испарился. Для конечной температуры обработки 25 ° C целлюлозу сначала обрабатывали при -75 ° C в течение 15 минут, а затем сосуд погружали в водяную баню, поддерживаемую при 25 ° C, на время реакции либо 5 минут, либо 90 минут. . После завершения желаемого периода реакции и до его удаления из водяной бани обработку прекращали немедленным сбросом давления в сосуде в вентилируемом кожухе.Целлюлозу, обработанную аммиаком, удаляли из сосуда и оставляли в вытяжном шкафу на ночь до полного испарения аммиака. Температурный профиль обработки жидким аммиаком, проводимой при 25 ° C, показан на рисунке 9. Для обработки при повышенных температурах, другими словами от 75 ° C до 140 ° C, целлюлозу сначала обрабатывали при -75 ° C в течение 15 минут, затем сосуд выдерживали при 25 ° C в течение 30 минут перед тем, как подвергнуть сосуд окончательной термообработке в течение 1 часа в предварительно нагретой псевдоожиженной песчаной бане (Techne Inc., Берлингтон, штат Нью-Джерси) поддерживали при желаемой температуре реакции (75 ° C, 105 ° C, 130 ° C или 140 ° C). После завершения окончательной термообработки и перед удалением из песчаной бани в реакционном сосуде сбросили давление, позволив аммиаку вытечь через вентилируемый колпак. После выпуска аммиака сосуд охлаждали на водяной бане, поддерживаемой при 25 ° C. Целлюлозу, обработанную аммиаком, удаляли из сосуда и оставляли в вытяжном шкафу на ночь, пока весь аммиак не испарился.
Рис. 9Температурный профиль обработки жидким аммиаком, проводимой при 25 ° C в течение 5 минут .
Обработка водным раствором NaOH
Обработка образцов целлюлозы водным раствором NaOH проводилась в соответствии с методом, описанным Fengel et al. . [29]. Образцы порошкообразной целлюлозы вымачивали и перемешивали в растворе NaOH с концентрацией 16,5 мас.% (2,142 г целлюлозы плюс 250 мл NaOH) при 25 ° C в течение 2 ч с вытеснением воздуха азотом. Раствор NaOH отфильтровывали от образца, а затем осадок на фильтре тщательно промывали дистиллированной водой до тех пор, пока промывка не стала нейтральной.Затем промытое твердое вещество сушили вымораживанием. Обработка всех четырех образцов целлюлозы водным раствором NaOH проводилась с использованием 16,5 мас.% Водного раствора NaOH, поскольку, как сообщалось, обработка при этой концентрации вызывала полное превращение целлюлозы I в целлюлозу II [29].
Измерения степени полимеризации
Распределение молекулярной массы (или DP) образцов целлюлозы охарактеризовали с помощью эксклюзионной хроматографии (SEC). Процедура была изменена по сравнению с ранее опубликованными методами [48–50].Для измерения молекулярно-массового распределения целлюлозы необходимо было растворить целлюлозу в элюенте SEC, тетрагидрофуране (ТГФ), что было достигнуто путем образования трикарбанилатного производного целлюлозы.
Карбанилирование целлюлозы осуществляли с помощью следующей процедуры. Образцы целлюлозы (10 мг), которые были высушены в течение ночи при 40 ° C в вакуумной печи, помещали в 5 мл реактивов (Pierce, Rockford, IL) и добавляли сухой пиридин (2 мл) плюс фенилизоцианат (0,4 мл).Фенилизоцианат присутствует в 20-кратном молярном избытке по сравнению с доступными гидроксильными группами в целлюлозах. Реакционные сосуды нагревали до 70 ° C и интенсивно перемешивали в модуле нагрева / перемешивания Pierce Reacti-Therm в течение 24 часов. Реакции гасят, добавляя к смеси 0,4 мл метанола для взаимодействия с избытком фенилизоцианата. Производные осаждали в 26 мл метанола и воды (7: 3, об. / Об.), А затем дважды промывали смесью метанола и воды. Затем карбанилаты целлюлозы растворяли в ТГФ (20 мл).Растворы фильтровали через фильтры Nylaflo с пористостью 0,45 мкм (PALL, Порт Вашингтон, Нью-Йорк) перед анализом. SEC выполняли при комнатной температуре с использованием пяти колонок (PLgel 10 мкм 10 3 , 10 4 , 10 5 и 10 6 Å, плюс колонка Shodex большего размера 10 7 Å) для покрытия широкой диапазон молекулярных масс карбанилированных целлюлоз. Стандарты полистирола использовали для калибровки времени удерживания по молекулярной массе. В качестве элюента использовали ТГФ степени чистоты для ВЭЖХ при скорости потока 1.0 мл / мин. Хроматограммы были получены путем мониторинга сигнала от диодно-матричного детектора на длине волны 235 нм с полосой пропускания 10 нм. Для расчета DP целлюлозы молекулярные массы были разделены на 519 — молекулярную массу повторяющейся единицы карбанилированной целлюлозы со степенью замещения 3,0.
Ферментативное расщепление
Ферментативное расщепление проводили на необработанных образцах целлюлозы, обработанных водным NaOH и жидким аммиаком, в двух экземплярах. Ферментативное расщепление проводили во встряхиваемых колбах Эрленмейера объемом 125 мл при загрузке 1% твердых веществ при 40 ° C и 130 об / мин в течение 120 ч в соответствии с процедурой NREL / TP-510-42629 Национальной лаборатории возобновляемой энергии (NREL) [51].Добавляли препарат фермента целлюлазы Genencor GC220 (лот 49448; 121 FPU / мл, 202 мг белка / мл) на уровне 20 мг белка на грамм целлюлозы (что соответствует примерно 12 единицам фильтровальной бумаги / г целлюлозы). Никакой дополнительной -глюкозидазы или мультифектной ксиланазы не добавляли. Общий объем суспензий осахаривания после добавления фермента и 50 мМ цитратного буфера (pH 4,8) составлял 50 мл. Чтобы определить прогресс превращения целлюлозы, аликвоту хорошо перемешанных суспензий по 2 мл отбирали в заранее определенные моменты времени, начиная с 4 ч, 16 ч и 24 ч.После этого образцы удаляли каждые 24 часа до 120 часов. Отобранные образцы немедленно фильтровали через шприцевые фильтры PALL Acrodisc Nylon (PALL) 0,2 мкм и затем охлаждали до анализа на глюкозу. Выходы глюкозы и целлобиозы измеряли с помощью ВЭЖХ (Agilent 1100 series) с использованием колонки Shodex Sugar SP0810, поддерживаемой при 85 ° C в соответствии с процедурой NREL NREL / TP-510-42623 [52]. Подвижная фаза представляла собой наночистую воду, профильтрованную через 0,2 мкм, при скорости потока 0,6 мл / мин. Объем вводимой пробы составлял 10 мкл, а время анализа — 23 мин.Конверсию целлюлозы рассчитывали путем добавления общих выходов глюкозы и целлобиозы (и глюкоза, и целлобиоза были преобразованы в эквивалент глюкана) для каждой точки времени гидролиза.
Дифракция рентгеновских лучей
XRD выполняли на четырехкружном гониометре Scintag PTS (Scintag Inc., Купертино, Калифорния) с использованием излучения CuKα (0,15406 нм), генерируемого при 45 кВ и 36 мА. Прорези источников составляли 2,0 мм и 4,0 мм при радиусе гониометра 290 мм, а прорези детектора составляли 1,0 мм и 0,5 мм при том же радиусе.Высушенные образцы целлюлозы закрепляли на кварцевой подложке с помощью нескольких капель разбавленного клея. Этот разбавленный клей в высыхании аморфен и почти не добавляет фонового сигнала. Сканирование было получено от 8 до 42 градусов двутета с шагом 0,05 градуса. CI целлюлозы рассчитывали из спектров XRD в соответствии с методом аморфного вычитания, описанным в другом месте [44]. Вкратце, дифрактограмма аморфной целлюлозы вычиталась из дифрактограмм исследуемых образцов, чтобы исключить влияние аморфного компонента на дифрактограммах.Затем было вычислено отношение интегрированных площадей вычтенной дифрактограммы к исходной дифрактограмме, чтобы получить CI образца. Для оценки размера кристаллитов использовалось уравнение Шеррера [31, 32]:
, где λ — длина волны падающего рентгеновского излучения (1,5418 Å), θ угол Брэгга, соответствующий плоскости (002), β — полная ширина на полувысоте (FWHM) рентгеновского пика, соответствующего плоскости (002), τ — размер рентгеновских кристаллитов, а k — постоянная со значением 0.89 [25, 53].
13 C CPMAS ЯМР-анализСпектры ЯМР 13 C CPMAS высокого разрешения регистрировали на спектрометре Bruker Avance 200 МГц (Bruker BioSpin Corporation, Биллерика, Массачусетс) с зондом 7 мм, работая при 50,13 МГц для 13 ° C, при комнатной температуре. Скорость вращения составляла 7000 Гц, контактный импульс 2 мс, время сбора данных 51,3 мс и задержка между импульсами 4 с при 20000 сканирований. Пик адамантана использовался в качестве внешнего эталона (δ C 38.3 промилле). Перед записью спектров образцы гидратировали деионизированной водой (около 43%). Химические сдвиги 13 C были даны в значениях δ (ppm), и каждый пик в спектрах целлюлозы I, II и III I был назначен в соответствии с литературными значениями [35, 36, 54, 55]. Целлюлоза I: C6-аморфная (от 61,3 до 62,1 ppm), C6-кристаллическая (от 65,2 до 65,8 ppm), C2, C3 и C5 (от 71,2 до 75,6 ppm), C4-аморфная (от 83,5 до 84,4 ppm), C4-кристаллическая (88,2 до 89,6 частей на миллион), C1 (от 104,2 до 107,8 частей на миллион).Целлюлоза II: C6 (61,4, 62,2, 62,7 частей на миллион), C2, C3 и C5 (72,6, 72,9, 73,7, 74,4, 74,6, 75,9, 76,2, 76,5 частей на миллион), C4 (84,2, 84,4, 86,1, 87,4, 88,3, 88,6 частей на миллион), C1 (104,8, 106,9 частей на миллион). Целлюлоза III I : C6 (62,4 частей на миллион), C5 (72,9 частей на миллион), C2 (73,5 частей на миллион), C3 (75,9 частей на миллион), C4 (87,9 частей на миллион), C1 (104,9 частей на миллион). КИ определяли методом аморфного вычитания спектров ЯМР [44].
Факторный анализ
Анализ главных факторов проводился на данных конверсии целлюлозы, полученных через 16, 24, 48 и 72 часа переваривания, в сочетании с данными аморфного содержания и категориальными переменными типа целлюлозы и типа алломорфа.Категориальный переменный тип целлюлозы был закодирован (-2 = авицел; -1 = α-целлюлоза; 1 = хлопковый линт; 2 = кукурузная солома), как и переменная алломорфа (-1 = целлюлоза I; 0 = целлюлоза II; 1 = целлюлоза. III). Факторный анализ был выполнен с корреляцией Пирсона и вращением Varimax с использованием XLSTAT (Addinsoft USA, New York, NY), дополнительной программы к Microsoft Excel 2007 (Microsoft Corporation, Redmond, WA).
Заполнение пустот в синтезе аммиака: роль вакансий азота в катализаторах
ИЗОБРАЖЕНИЕ: Частицы никеля диссоциируют h3, обеспечивая атомы H либо атомами N из самой кристаллической решетки CeN, либо выступающими атомами N из молекул N2, заполняя вакансию азота.В… посмотреть еще
Кредит: 2020 Американское химическое общество
Ученые из Токийского технологического института (Tokyo Tech) исследуют, как вакансии азота в катализаторах участвуют в синтезе аммиака, ключевого химического вещества в промышленности удобрений. Они разработали общее правило разумной конструкции катализаторов на основе нитридов, основанное на их энергии образования вакансий азота, и создали высокопроизводительный катализатор для синтеза аммиака с использованием церия, переходного металла в большом количестве.
Аммиак (Nh4) — это химическое вещество, встречающееся в природе, но его широкое использование в качестве важного ингредиента в различных производственных процессах сделало его одним из наиболее производимых химических веществ. Он играет ключевую роль в производстве удобрений и помогает повысить урожайность различных культур. Из-за высокого спроса ежегодно производится более 150 миллионов тонн Nh4. Неудивительно, что химики активно искали экологически чистые и энергоэффективные способы синтеза Nh4.
Обычным способом производства Nh4 является непосредственное использование газов азота (N2) и водорода (h3). Но разорвать прочную связь между атомами N сложно. Именно здесь вступают в игру катализаторы (материалы, облегчающие необходимые реакции). К сожалению, для получения лучшего на сегодняшний день катализатора синтеза Nh4 требуется рутений, редкий и дорогой металл. Пытаясь найти альтернативы, ученые из Tokyo Tech, включая доктора Тиан-Нан Йе, профессора Масааки Китано и профессора Хидео Хосоно, недавно попытались выяснить, что именно является хорошим катализатором для разрушения N2 и создания Nh4.
В предыдущей статье, опубликованной в журнале Nature , Хосоно и его коллеги представили новую стратегию производства Nh4, которая включает использование нитрида лантана (LaN) в сочетании с наночастицами никеля (Ni). Ключевым вкладом этого исследования было осознание того, что вакансии азота играют важную роль в каталитическом процессе, что позволило им разработать катализатор на основе La с характеристиками, сопоставимыми с характеристиками катализаторов на основе рутения. В недавнем исследовании, опубликованном в журнале Американского химического общества , исследовательская группа пошла дальше своих выводов и выяснила, является ли энергия, необходимая для образования этих азотных вакансий, в конечном итоге определяющими характеристиками катализаторов во время производства Nh4.
Вакансии азота на поверхности катализатора могут легко захватить N2 и ослабить его связь N-N, после чего атомы, диссоциированные от h3 на наночастицах Ni, прыгают на выступающий атом N, образуя Nh4. Кроме того, диссоциированные атомы H могут также образовывать Nh4 непосредственно с использованием атомов N из самой кристаллической решетки катализатора, создавая, таким образом, новые вакансии азота в процессе. Следуя успеху своего предыдущего катализатора Ni / LaN, в этом исследовании они создали и сравнили аналогичные катализаторы с разной энергией образования вакансий азота (ENV).
Среди испытанных катализаторов нитрид церия с добавлением никеля (CeN) показал лучшие каталитические характеристики благодаря относительно низкому ENV. Характеристики других протестированных материалов также были напрямую связаны с их соответствующими ENV. Взволнованный результатами, профессор Хосоно отмечает: «Теперь мы можем предложить общее правило для разработки катализаторов на основе нитридов для синтеза Nh4, в которых их ENV доминирует над их каталитическими характеристиками». В частности, каталитическая активность Ni / CeN была сопоставима с каталитической активностью катализаторов на основе рутения, что представляло собой потенциальную экологически чистую альтернативу, состоящую из более распространенных материалов.
Более того, команда также отметила, что загрузка Ni на CeN даже не требовалась; вакансии азота в CeN также могут запускать диссоциацию молекул h3. «Было продемонстрировано, что CeN сам по себе и с загрузкой Ni дает наиболее эффективные и стабильные катализаторы синтеза аммиака среди различных нитридных катализаторов, которые мы исследовали», — объясняет Е. Команда надеется, что выводы, полученные в результате этого исследования, могут быть полезны не только для синтеза аммиака, но и для других целей. Китано заключает: «Понимание роли нитридов может пролить свет на дизайн и разработку эффективных катализаторов на основе переходных металлов для других химических процессов.«
###
Работает на пустом месте: новый доступный катализатор использует азотные вакансии для производства аммиака: Tokyo Tech News
https: /
Работает на пустом месте: новый доступный катализатор использует азотные вакансии для производства аммиака: Tokyo Tech News
https: /
Разработка высокоактивного и стабильного катализатора синтеза аммиака при низких температурах: Tokyo Tech News
https: /
Дух создания новых материалов: Tokyo Tech Research Stories
https: /
О Токийском технологическом институте
Tokyo Tech стоит на переднем крае исследований и высшего образования как ведущий университет науки и технологий в Японии. Исследователи Tokyo Tech преуспели в различных областях, от материаловедения до биологии, информатики и физики. Основанный в 1881 году, Tokyo Tech принимает более 10 000 студентов и аспирантов в год, которые становятся научными лидерами и одними из самых востребованных инженеров в отрасли.Воплощая японскую философию «моноцукури», что означает «техническая изобретательность и инновации», технологическое сообщество Токио стремится внести свой вклад в общество посредством высокоэффективных исследований.
https: /
Заявление об ограничении ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
.

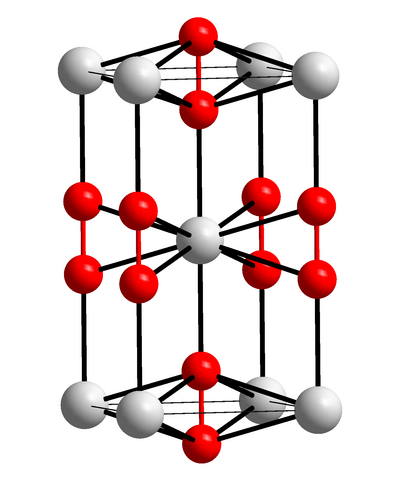

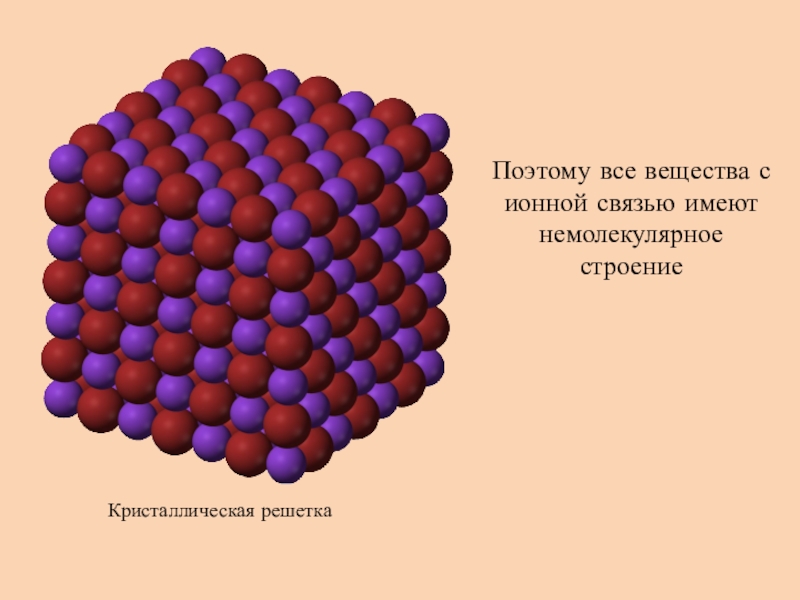
 41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012. и Tкип очень↑,
и Tкип очень↑,
Leave A Comment